Les centres germinatifs des organes lymphoïdes secondaires, tels que la rate, les ganglions lymphatiques et les plaques de Peyer 1 , sont des structures lymphoïdes transitoires, dans lesquelles les lymphocytes B subissent des cycles itératifs de prolifération clonale et de mutation somatique. Les lymphocytes B ayant survécu à cette sélection darwinienne possèdent les récepteurs les plus spécifiques pour l’épitope d’intérêt, et sont à même de produire des anticorps protecteurs de haute affinité. Les lymphocytes B défectueux, quant à eux, sont éliminés, ce qui conduit à l’accumulation de lymphocytes B apoptotiques au sein des centres germinatifs [ 1 , 2 ]. Ces débris cellulaires sont alors pris en charge par des macrophages « à corps tingibles » (tingible body macrophages) [ 3 , 4 ], des cellules phagocytaires découvertes au xixe siècle par Walther Flemming, et qui contiennent des restes de lymphocytes colorables, d’où leur nom. Lorsque l’activité d’efférocytose 2 de ces macrophages est défectueuse, les lymphocytes B apoptotiques s’accumulent dans les centres germinatifs, ce qui entraîne la production d’anticorps auto-réactifs et le développement de maladies auto-immunes [ 5 ]. Les macrophages à corps tingibles peuvent ainsi être comparés à des éboueurs professionnels, dont la fonction apparemment anodine est essentielle au bon déroulement de la réponse immunitaire humorale.
Les mécanismes moléculaires et cellulaires des réponses impliquant les lymphocytes B dans les centres germinatifs ont fait l’objet de nombreuses études qui, étonnamment, avaient peu exploré l’origine et le comportement des macrophages à corps tingibles. Récemment, un groupe de chercheurs dirigé par Ziv Shulman [ 6 ] a étudié la dynamique de ces macrophages lors d’une réponse immunitaire en utilisant des techniques d’imagerie biphotonique intravitale. Cette approche leur a permis de suivre en temps réel les mouvements des cellules immunitaires dans les ganglions lymphatiques de souris vivantes sous sédation. Une semaine après l’induction des centres germinatifs par immunisation, les auteurs ont montré que chaque centre germinatif contenait environ 25 macrophages à corps tingibles qui, contrairement aux lymphocytes B, demeuraient immobiles, surveillant en permanence leur environnement grâce à des protrusions cellulaires dynamiques. Ces macrophages pouvaient contenir jusqu’à 12 lymphocytes B apoptotiques à un instant donné, et leur taux de capture moyen était d’un lymphocyte B toutes les 10 minutes. Ces résultats ont incité les chercheurs à approfondir leur exploration de la spécificité de l’efférocytose des macrophages à corps tingibles : en effet, les centres germinatifs contiennent des lymphocytes B en cours de prolifération/sélection, mais également des lymphocytes B naïfs ou des lymphocytes T CD4+ dits « auxiliaires ». Les chercheurs se sont donc demandé si les macrophages à corps tingibles pouvaient également phagocyter ces cellules. Après avoir effectué des transferts adoptifs de lymphocytes B naïfs et de lymphocytes T CD4+, ils ont recherché, par microscopie, l’existence d’une capture de ces cellules par les macrophages au sein des centres germinatifs, mais en vain. Ils ont ainsi mis en évidence la spécificité des macrophages à corps tingibles envers les lymphocytes B apoptotiques des centres germinatifs, et suggéré que ces cellules émettent, en mourant, des signaux uniques, encore inconnus, qui sont reconnus par les macrophages.
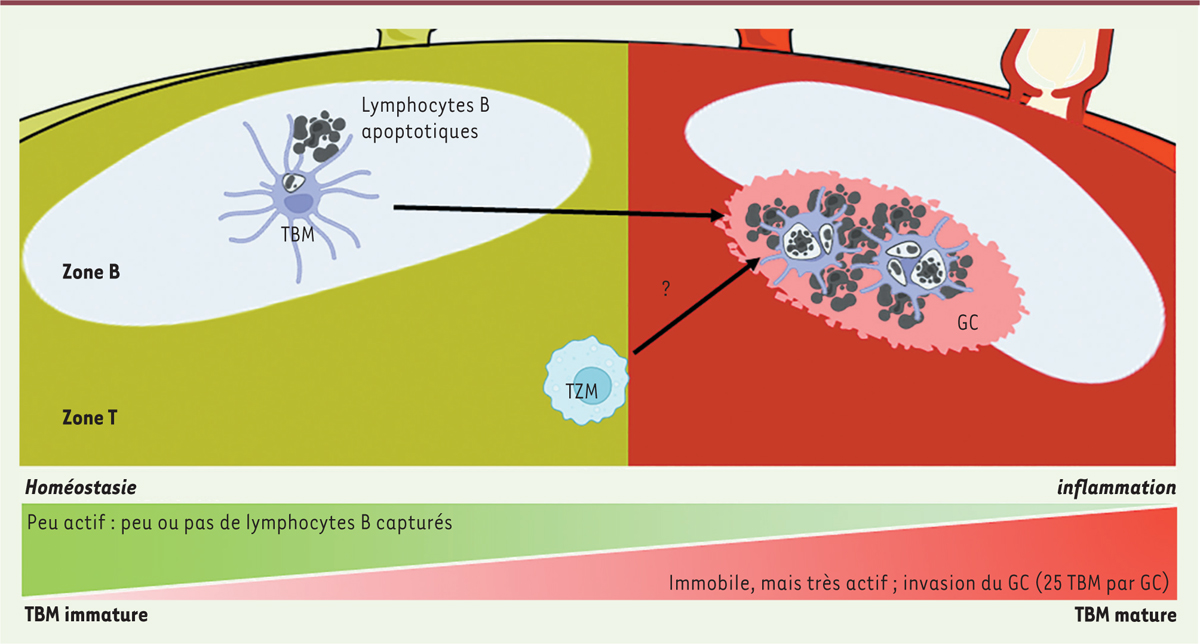
Les chercheurs ont ensuite étudié l’origine et le renouvellement des macrophages à corps tingibles. De nombreux macrophages tissulaires ont une origine embryonnaire, une longue durée de vie et un taux de renouvellement faible [ 7 ]. En particulier, les résultats d’études récentes montrent que certains macrophages des ganglions lymphatiques, tels que les macrophages de la zone des lymphocytes T ( T cell zone resident macrophages ) et les macrophages du sinus sous-capsulaire ( subcapsular sinus macrophages ), s’y implantent pendant la vie intra-utérine et subissent ensuite une dilution progressive par l’adjonction de monocytes sanguins après la naissance [ 8 , 9 ]. En utilisant différents modèles animaux, les chercheurs ont montré que bien que les macrophages à corps tingibles dérivent d’une population de macrophages résidant dans les ganglions lymphatiques avant immunisation, leur production ne dépendait pas des macrophages du sinus sous-capsulaire. Ils ont alors émis l’hypothèse qu’ils pourraient dériver des macrophages de la zone T. Cette hypothèse a tout d’abord été étayée par les similitudes fonctionnelles, phénotypiques et transcriptionnelles entre ces macrophages et ceux à corps tingibles. En effet, ces deux types de macrophages sont impliqués dans l’élimination des lymphocytes apoptotiques dans les ganglions lymphatiques et ils partagent l’expression de gènes impliqués dans l’efférocytose, tels que Merkt, Cx3cr1 et Cd68 . Par ailleurs, on sait que pendant la réponse immunitaire, les follicules de lymphocytes B envahissent la zone T adjacente, dans laquelle résident les macrophages de cette zone [ 10 ] ( Figure 1 ). Étant donné que les centres germinatifs se développent généralement à la frontière qui séparent la zone T des follicules B, il est possible que les macrophages de la zone T annexés par l’expansion du follicule exercent leur fonction d’efférocytose dans le nouveau centre germinatif formé. Dans ce scénario, les macrophages à corps tingibles et les macrophages de la zone T représenteraient des formes transitoires et polyvalentes d’une même entité cellulaire.
| Figure 1.
Maturation et fonction des macrophages à corps tingibles au cours d’une réponse immunitaire.
Les macrophages à corps tingibles (TBM) jouent un rôle crucial dans la réponse immunitaire en phagocytant les lymphocytes B apoptotiques dans les centres germinatifs (GC) des ganglions lymphatiques. Alors que les TBM immatures sont responsables de l’ingestion des lymphocytes B naïfs apoptotiques, l’activité phagocytaire des TBM matures, qui proviennent des macrophages résidents, est spécifiquement dirigée contre les lymphocytes B activés apoptotiques après immunisation. Malgré leur nombre limité (environ 25 macrophages à corps tingibles par centre germinatif) et leur immobilité, ces macrophages, grâce à leurs protrusions cellulaires dynamiques, sont efficaces pour éliminer les débris des lymphocytes B très mobiles. TZM : macrophage de la zone T.
|
L’exclusivité de la présence des macrophages à corps tingibles dans le centre germinatif a incité les chercheurs à explorer si cette structure transitoire, qui émerge après l’immunisation, était une condition préalable indispensable à la présence des macrophages à corps tingibles dans les ganglions lymphatiques. Pour élucider le rôle des centres germinatifs dans l’apparition des macrophages à corps tingibles après une immunisation, les chercheurs ont utilisé des souris génétiquement modifiées qui sont incapables de former des centres germinatifs. Après immunisation de ces souris, le constat d’une absence de macrophages infiltrés dans les follicules de lymphocytes B semblait indiquer que le développement des macrophages à corps tingibles nécessite la présence des centres germinatifs. Cependant, une autre équipe de chercheurs vient de montrer que l’apoptose massive des lymphocytes B suffisait à induire la maturation de ces macrophages, en l’absence de tout centre germinatif [ 11 ]. Cette découverte leur a permis de conclure que les macrophages à corps tingibles étaient déjà présents, à un stade immature, dans les follicules naïfs, où leur activité basale d’efférocytose était peu visible par imagerie.
Les résultats de ces études récentes permettent de mieux comprendre la dynamique des macrophages à corps tingibles dans la réponse des centres germinatifs des ganglions lymphatiques à l’immunisation. Cependant, ils soulèvent également des questions quant aux étonnantes capacités de phagocytose de ces macrophages. En effet, le taux de mortalité élevé des lymphocytes B dans les centres germinatifs, couplé au petit nombre de macrophages à corps tingibles responsables de leur élimination, indique que ces macrophages sont des phagocytes très efficaces, capables de reconnaître et d’engloutir une grande quantité d’organelles et de débris cellulaires. Étant donné la microarchitecture fermée des centres germinatifs, il conviendrait de déterminer si le contenu des vacuoles efférocytaires des macrophages à corps tingibles peut être réutilisé pour répondre à la forte exigence métabolique de la réaction du centre germinatif à l’immunisation. En d’autres termes, les macrophages à corps tingibles représentent-ils une usine de recyclage des métabolites des lymphocytes apoptotiques du centre germinatif permettant de maintenir le métabolisme très actif de cette structure, et contribuant en même temps à préserver la tolérance immunitaire ? La nature transitoire des centres germinatifs soulève également la question du devenir de ces macrophages à corps tingibles à la fin de la réaction. Meurent-ils, retrouvent-ils un phénotype immature, ou regagnent-ils la zone T lorsque les follicules B se rétractent dans leur territoire d’origine après immunisation ? Enfin, le caractère statique de ces macrophages au sein d’un centre germinatif peuplé de lymphocytes B en mouvement implique qu’ils soient ancrés à un élément structural du centre germinatif (stroma) qui reste à identifier.