Les cellules sont constamment confrontées à des stress génotoxiques qui compromettent l’intégrité du patrimoine génétique. Les sources de ces atteintes à la stabilité génétique peuvent être d’origine exogène, telles que les radiations (ionisantes ou rayonnement ultraviolet) ou les agents chimiques (pollution, tabac, etc.), mais aussi endogène, telles que les espèces réactives de l’oxygène ( reactive oxygen species, ROS) ou des accidents lors de la réplication du génome. Au cours de leur vie, les cellules sont exposées de façon chronique et journalière aux stress endogènes (contrairement aux stress exogènes aigus).
Les stress génotoxiques peuvent induire la mort cellulaire, la sénescence, l’inflammation, la mutagenèse, et le développement de cancers. De fait, l’instabilité génétique est une caractéristique des cellules vieillissantes et des cellules cancéreuses. Pour contrecarrer les effets de ces stress, la réponse aux dommages de l’ADN ( DNA damage response, DDR) coordonne un réseau de voies métaboliques assurant une transmission fidèle du patrimoine génétique lors de la division cellulaire. L’activation de la DDR conduit à l’arrêt de la synthèse d’ADN et de la progression dans le cycle cellulaire, pour réparer l’ADN et rétablir la réplication du génome sur des matrices restaurées [ 1 ]. En particulier, la DDR est activée au moment des premières étapes de la sénescence et de la tumorigenèse [ 2 – 4 ]. Un défaut de la DDR conduit à une sensibilité accrue aux agents génotoxiques, à l’instabilité génétique, et est fréquemment associé à une prédisposition au cancer et à un vieillissement prématuré [ 1 – 5 ].
En l’absence de stress exogène, les cellules maintiennent leur progression dans le cycle cellulaire et répliquent leur génome, malgré l’exposition chronique au stress endogène. Cela suggère que la DDR n’est pas activée dans ces conditions, et qu’un seuil d’intensité de stress serait donc nécessaire pour une activation complète de la DDR. Cela pose la question de l’existence même d’une réponse des cellules aux stress de faible intensité, et implique, si une réponse alternative à la DDR « canonique » existe, d’en déterminer la nature.
Nous avons exposé des cellules primaires (fibroblastes de peau ou cellules épithéliales mammaires) à des doses croissantes de différentes substances chimiques qui induisent un stress réplicatif 1 : l’hydroxyurée, un inhibiteur de la ribonucléotide réductase, qui provoque un déséquilibre des réservoirs de nucléotides ; l’aphidicholine, un inhibiteur des polymérases réplicatives de l’ADN ; la camptothécine, un inhibiteur de la topoisomérase de type I. En étudiant la réponse de cellules primaires humaines à ces stress réplicatifs, nous avons montré que la nature de la réponse dépend de l’intensité du stress, et qu’il existe un seuil d’intensité délimitant deux types de réponses distinctes [ 6 ] : la DDR canonique, qui conduit à l’arrêt de la synthèse du génome et du cycle cellulaire, n’est activée que lorsqu’un certain seuil d’intensité du stress est atteint ; en deçà de ce seuil, les cellules continuent à répliquer leur ADN en vue de leur division, et une réponse différente de la DDR canonique est mise en place. Cette réponse spécifique à des stress de plus faible intensité, qui ne bloquent pas la progression de la réplication de l’ADN, est désignée en anglais par low-level stress DDR (LoL-DDR).
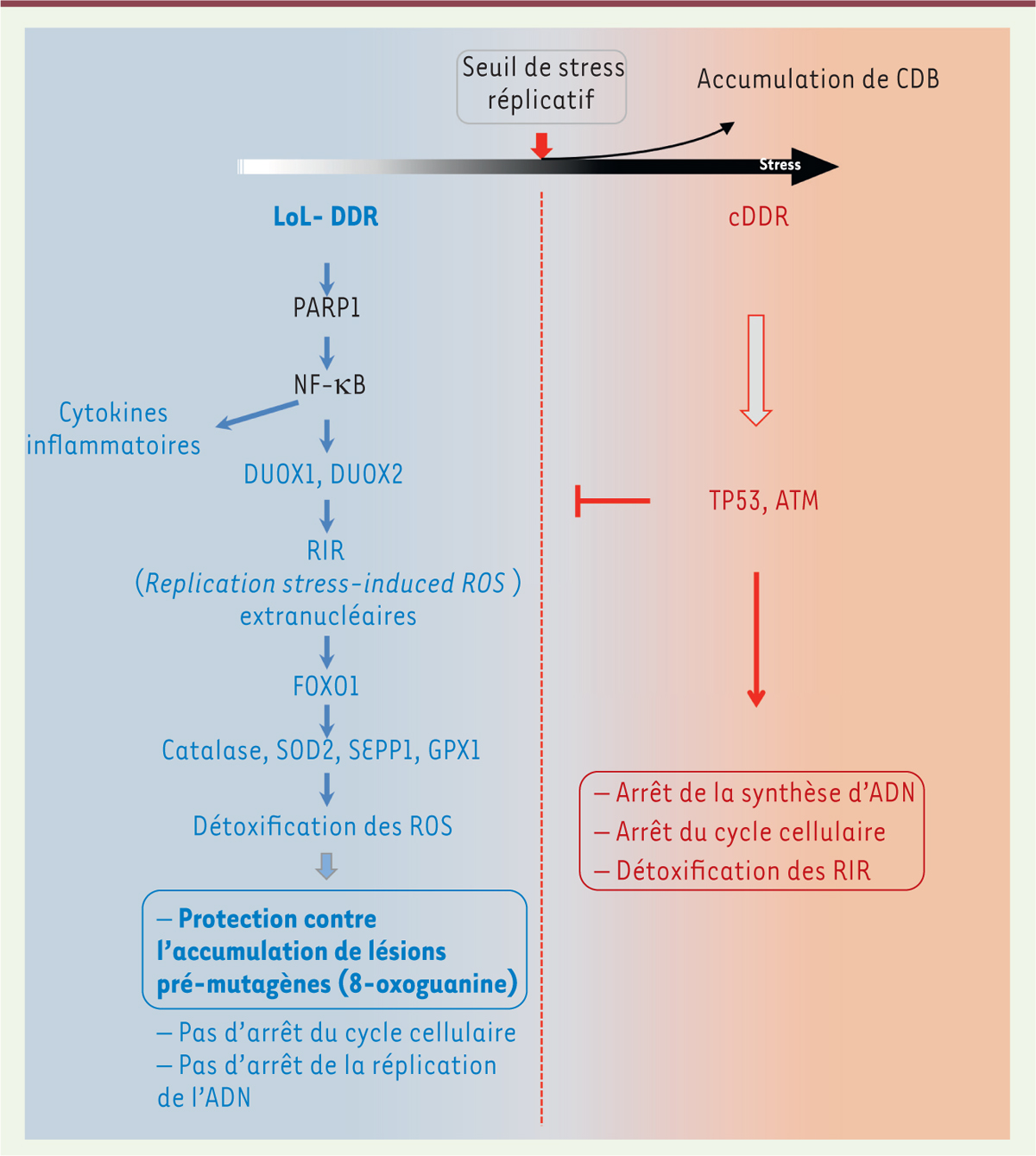
En réponse aux stress réplicatifs non-bloquants, la LoL-DDR se déroule selon les cinq étapes suivantes : 1) PARP1 (poly ( ADP-ribose) polymérase 1), un senseur de l’intégrité de l’ADN, active le facteur de transcription NF-kB ( nuclear factor-kappa B ), indépendamment de son activité enzymatique ; 2) NF-kB active l’expression des NADPH oxydases DUOX1 ( dual oxidase 1 ) et DUOX2 ( dual oxidase 2 ), et induit par ailleurs l’expression de cytokines pro-inflammatoires ; 3) DUOX1 et DUOX2 synthétisent des « ROS induites par le stress réplicatif » ( replication stress-induced ROS, RIR) cytoplasmiques. Il convient de noter que la production de ces RIR est indépendante des protéines TP53 et ATM ( ataxia telangiectasia mutated ) [ 6 ], ce qui montre que cette réponse est différente de la DDR canonique, qui est contrôlée par ces deux protéines ; 4) les RIR activent la voie FOXO1 ( forkhead box O1 ), qui induit l’expression des gènes de détoxification des ROS codant la catalase, la superoxyde dismutase 2 (SOD2), la sélénoprotéine P (SEPP1), et la glutathion peroxydase 1 (GPX1). Incidemment, la quantité de ROS produite par une exposition exogène de cellules au peroxyde d’hydrogène (H 2 O 2 ) est réduite si on traite préalablement ces cellules à l’hydroxyurée aux doses qui induisent les RIR : la LoL-DDR, en produisant des RIR, peut donc également, par un mécanisme adaptatif, détoxifier des ROS issus d’un stress exogène ; 5) l’induction par les RIR de cette voie de détoxification des ROS réduit l’accumulation de bases oxydées pré-mutagènes (telles que la 8-oxoguanine) dans l’ADN, protégeant ainsi l’intégrité du génome ( Figure 1 ).
| Figure 1.
Le modèle de réponse « biphasique » aux lésions de l’ADN.
Les cellules primaires répondent au stress de réplication en fonction de son intensité, de deux manières distinctes : une réponse au stress de bas niveau/endogène (en bleu) et une réponse au stress de haut niveau (en rose). En dessous d’un certain seuil d’intensité du stress (flèche rouge), les cellules engagent la réponse de bas niveau (low level
DNA damage response
, LoL-DDR), qui ne réprime pas la synthèse de l’ADN et la progression du cycle cellulaire. La réponse LoL-DDR régule la production d’espèces réactives de l’oxygène (ROS) extranucléaires (
replication-induced ROS
, RIR)
via
une cascade de signalisation impliquant PARP1, NF-κB, DUOX1 et DUOX2. Parallèlement, NF-κB induit l’expression de gènes de cytokines pro-inflammatoires. Les RIR induisent le programme de détoxification FOXO1, protecteur contre l’accumulation de lésions pré-mutagènes de l’ADN, telles que la présence de 8-oxoguanine (8-oxoG), dans une réponse de type adaptatif. Lorsque l’intensité du stress réplicatif dépasse un seuil d’intensité (flèche rouge), les cellules accumulent les cassures double brin (CDB) de l’ADN et déclenchent la DDR canonique (cDDR), qui détoxifie les RIR, réprime la synthèse de l’ADN, et bloque la progression du cycle cellulaire (figure adaptée de [
6
]).
|
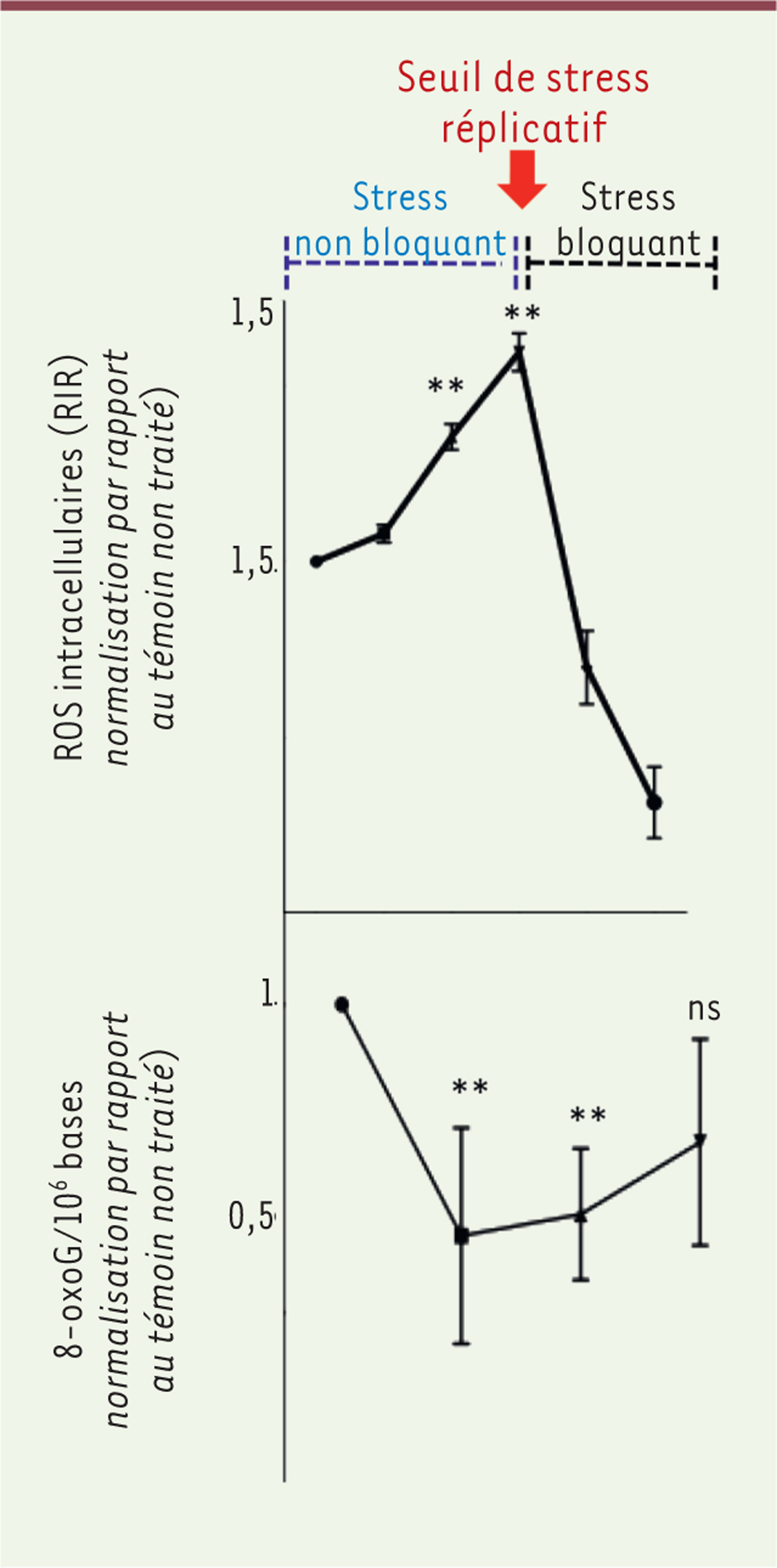
L’augmentation de l’intensité du stress réplicatif conduit à l’induction de la DDR canonique et à la suppression de la production de RIR, une conséquence de l’activation des protéines TP53 et ATM ( Figure 1 ). Ainsi, la courbe « dose-réponse » de la production des RIR en fonction de l’intensité du stress réplicatif comporte un « pic », qui indique le seuil d’intensité du stress à partir duquel la DDR canonique est activée, tandis que la courbe d’accumulation de 8-oxoguanine dans l’ADN a un profil en miroir de la précédente, avec un « creux » correspondant au pic de RIR ( Figure 2 ). Il convient de noter que la phosphorylation du variant d’histone H2AX (gH2AX), qui signale les cassures double brin de l’ADN, est détectable à partir de ce seuil de stress : il se pourrait donc que la détection de ces cassures soit le signal déclenchant la transition de la LoL-DDR vers la DDR canonique.
| Figure 2.
Conséquences du stress réplicatif sur la production d’espèces réactives de l’oxygène et l’accumulation de la 8-oxoguanine dans l’ADN.
Des stress réplicatifs de différentes intensités ont été induits expérimentalement dans des cellules primaires (fibroblastes de peau ou cellules épithéliales mammaires) en utilisant une substance génotoxique à des concentrations croissantes. En deçà d’un certain seuil d’intensité du stress réplicatif (flèche rouge), les cellules ne sont pas bloquées dans leur cycle (stress « non bloquant »), et les ROS induites par le stress réplicatif (RIR) s’accumulent ; le taux de 8-oxoguanine (8-oxoG) dans l’ADN décroît concomitamment. Au-delà de ce seuil d’intensité, la production de RIR diminue et le taux de 8-oxoG dans l’ADN rejoint son niveau basal. Les données présentées correspondent à la moyenne ± SEM (erreur standard de la moyenne) des différents échantillons pour chaque condition de stress réplicatif, après normalisation des valeurs par rapport au témoin non traité (= 1). ** et ns désignent respectivement une différence statistiquement significative et non significative par rapport à ce témoin (figure adaptée de [
6
]).
|
L’hydroxyurée est souvent utilisée dans le traitement de la leucémie myélomonocytaire chronique afin de réduire le nombre des cellules myéloïdes circulantes en diminuant la prolifération des cellules précurseurs, sans toutefois l’inhiber complètement [ 7 ]. Or, les concentrations d’hydroxyurée qui induisent les RIR dans les fibroblastes primaires en culture sont du même ordre de grandeur que celles mesurées dans le sérum des patients sous traitement. Des échantillons de sang périphérique ont été prélevés avant et après le début du traitement par l’hydroxyurée, et l’expression des gènes a été analysée dans les lymphocytes T CD3 + prolifératifs et comparée à celle des monocytes CD14 + non prolifératifs. Les gènes cibles de FOXO1 ( SEPP1, SOD2, GPX, catalase ) sont régulés à la hausse dans les lymphocytes T CD3 + , mais pas dans les monocytes CD14 + . Ce résultat confirme que l’hydroxyurée, qui cible les cellules en train de proliférer, active la voie FOXO1 également in vivo, dans un contexte pathologique.
L’expression de la plupart des NADPH oxydases est souvent accrue dans les cancers. En revanche, seuls DUOX1 et DUOX2 (qui jouent un rôle central dans la LoL-DDR) sont inactivées dans différents types de tumeurs [ 8 ], ce qui constitue un argument en faveur d’un effet protecteur anti-tumoral des ROS contrôlés par DUOX1 et DUOX2. En outre, l’administration d’antioxydants, qui a été proposée pour protéger contre la carcinogenèse, favorise en fait la survenue d’adénocarcinomes pulmonaires et de métastases de mélanome chez la souris [ 9 , 10 ]. Cela plaide en faveur d’un rôle bénéfique des ROS dans l’homéostasie des cellules humaines. Plus généralement, les défauts de chacun des acteurs de la LoL-DDR (NF-κB, PARP1, FOXO1, DUOX1 et DUOX2) partagent certaines conséquences pathologiques, telles que des défauts dans l’homéostasie et le métabolisme cellulaires, le vieillissement et la prédisposition au cancer. Enfin, il convient de noter que si le stress réplicatif conduit à la production de RIR dans les lignées cellulaires transformées, ces RIR ne sont pas contrôlées par la LoL-DDR ; notamment, elles ne sont pas détoxifiées en cas de stress de forte intensité, et des RIR sont produites dans le noyau, entraînant une accumulation de la base pré-mutagène 8-oxoguanine dans l’ADN, ce qui peut mettre en péril l’intégrité du génome.
En plus de la production des RIR, l’activation de NF-κB par des stress réplicatifs non bloquants active l’expression de gènes codant des cytokines pro-inflammatoires activatrices de l’immunité innée, ce qui pourrait constituer une protection supplémentaire contre les effets des dommages à l’ADN. En effet, en éliminant les cellules endommagées, l’immunité innée participerait au maintien de l’intégrité du génome. Le stress réplicatif entraîne la synthèse de cytokines pro-inflammatoires par la production de fragments d’ADN cytosoliques qui induisent la voie cGAS ( cyclic GMP-AMP synthase ) – STING ( stimulator of interferon genes ) [ 11 ]. La découverte de la LoL-DDR a révélé que la production de cytokines pro-inflammatoires pourrait être directement activée par l’axe PARP1/NF-κB, sans nécessiter la présence d’ADN dans le cytosol.
Les cellules adaptent donc leur réponse au stress réplicatif en fonction de son intensité. Une réponse non canonique spécifique aux dommages de l’ADN est ainsi dédiée à des niveaux de stress faibles, qui n’affectent que faiblement la distribution du cycle cellulaire et la synthèse de l’ADN. Comme toutes les cellules sont soumises à des stress endogènes de faible intensité tout au long de leur vie, cette réponse joue vraisemblablement un rôle primordial dans le maintien de l’intégrité de leur génome.