La question de savoir jusqu’à quel point les cellules somatiques de mammifères peuvent se répliquer a longtemps été débattue. Selon la « limite de Hayflick », du nom du scientifique ayant décrit en 1961 ce phénomène, les cellules somatiques ne seraient pas immortelles, et les cellules humaines ne pourraient se diviser que 50 à 60 fois avant d’atteindre un état de sénescence réplicative caractérisé par un arrêt irréversible de la prolifération [ 1 ]. Cette limite à une prolifération cellulaire infinie semble imposée par des contraintes biologiques, telles que l’accumulation de lésions de l’ADN, la perte de la protéostase ou des modifications dans l’homéostasie métabolique.
Au sein de l’organisme, les cellules du système immunitaire, et particulièrement les cellules lymphocytaires, ont un destin particulier. Par exemple, les lymphocytes T CD8 + , impliqués dans les réponses anti-tumorale et anti-infectieuse, peuvent rester dans un état de quiescence pendant des années, puis se réactiver en quelques minutes et se multiplier très rapidement dès qu’ils ont rencontré l’antigène dont ils sont spécifiques. Au contraire, il est établi qu’en cas d’infection chronique ou de tumeur cancéreuse, les lymphocytes T spécifiques acquièrent progressivement un état d’épuisement, caractérisé par une capacité de prolifération altérée et une incapacité à éliminer leurs cibles cellulaires [ 2 ]. Cependant, en dehors de ces conditions pathologiques, il n’a jamais été démontré que le potentiel de division des cellules du système immunitaire était intrinsèquement limité, et que la sénescence des lymphocytes T était un phénomène inévitable. C’est la question à laquelle a souhaité répondre une équipe de chercheurs à l’université du Minnesota (États-Unis) [ 3 ].
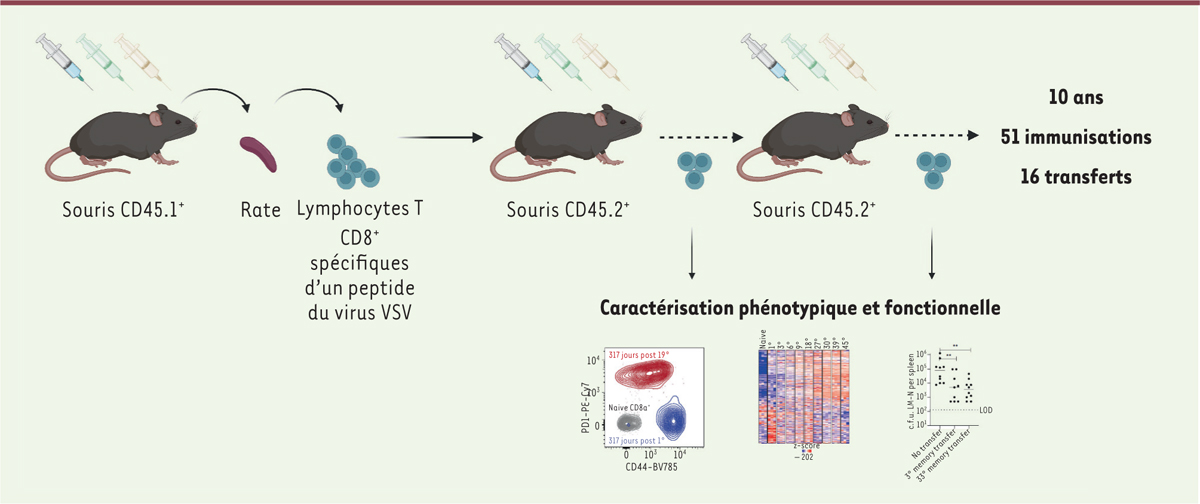
Dans ce travail de recherche de longue haleine (plus de dix ans), les chercheurs ont mis en œuvre des protocoles de vaccinations hétérologues itératifs chez la souris. Ils ont d’abord vacciné des souris de souche C57BL/6 CD45.1 + selon un protocole dit de prime-boost-boost (amorce suivie de deux rappels), comprenant trois injections vaccinales hétérologues, à environ deux mois d’intervalle, permettant l’induction d’une réponse lymphocytaire T CD8 + spécifique d’un peptide du virus responsable de la stomatite vésiculaire (VSV). Puis ils ont récupéré, dans la rate et les ganglions lymphatiques, cette population lymphocytaire spécifique, qu’ils ont transférée à des souris congéniques CD45.2 + , qui ont ensuite elles-mêmes reçu trois injections de vaccin. Ce processus a été répété de manière itérative, sur une période de 10 ans, totalisant ainsi 16 transferts de cellules et 51 immunisations. Les cellules lymphocytaires T CD45.1 + CD8 + « descendantes », issues de l’immunisation initiale, ont ainsi pu être itérativement stimulées, puis récoltées et transférées à de nouvelles souris pendant plus de 10 ans, soit environ quatre fois la durée de vie moyenne d’une souris ( Figure 1 ). Or, cette population de lymphocytes n’a jamais perdu sa capacité d’expansion après les immunisations répétées.
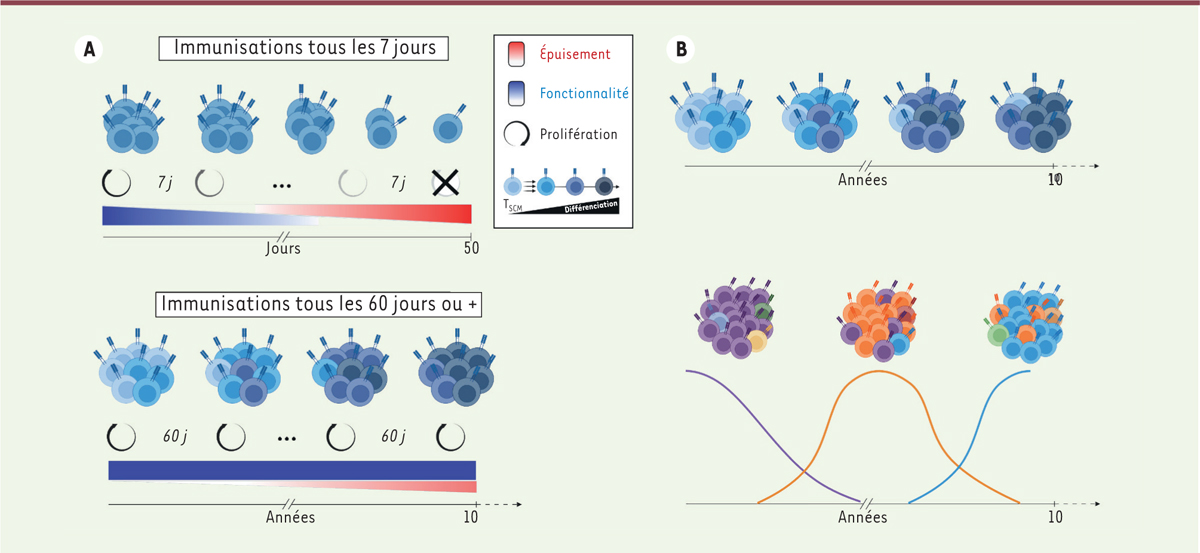
Il convient de préciser qu’une période minimale de repos entre les immunisations (d’environ 30 jours semble-t-il) s’est avérée nécessaire pour conserver le potentiel de prolifération de ces lymphocytes T CD8 + spécifiques du peptide viral : la capacité proliférative s’est rapidement détériorée lorsque les rappels vaccinaux ont été réalisés à 7 jours d’intervalle ( Figure 2A ). En revanche, malgré les nombreux cycles espacés de stimulation et d’expansion associée à une différenciation des cellules, les chercheurs ont montré que la population lymphocytaire d’intérêt restait fonctionnellement compétente (production de cytokines, contrôle d’une nouvelle infection) et qu’elle ne présentait pas de raccourcissement significatif des télomères chromosomiques, un marqueur de la sénescence réplicative. Par ailleurs, malgré l’expression des molécules PD-1 ( programmed cell death protein 1 ), TIM-3 ( T cell immunoglobulin and mucin domain-containing protein 3 ) et TOX ( thymocyte selection-associated high mobility group box ), considérées comme des marqueurs d’épuisement cellulaire, les lymphocytes T CD8 + spécifiques du peptide viral n’ont montré aucun signe d’épuisement progressif ou d’anergie ( Figure 2A ). Ce constat, sans être novateur, rappelle opportunément que l’expression de ces marqueurs n’est pas nécessairement un signe d’épuisement ou de dysfonctionnement cellulaire, et qu’elle peut être associée à l’état de différenciation et d’activation des lymphocytes T [ 4 , 5 ].
| Figure 2.
Représentation schématique des résultats expérimentaux et hypothèses. A. Résultats expérimentaux.
En haut : un intervalle rapproché entre chaque immunisation (7 jours) conduit progressivement à l’épuisement des lymphocytes T CD8
+
, une détérioration de leur fonctionnalité et de leur capacité à proliférer, jusqu’à leur perte 50 jours après le début des immunisations. En bas : en revanche, en augmentant l’intervalle entre chaque immunisation (60 jours ou plus), il est possible de maintenir la capacité à proliférer ainsi que la fonctionnalité des lymphocytes T CD8
+
, qui restent alors détectables même après 10 années d’immunisations successives. Cependant, même en suivant ce protocole, les lymphocytes T CD8
+
montrent une expression modérée de certains marqueurs couramment associés à l’épuisement et un profil de différenciation plus tardif.
B. Hypothèses.
En haut : le maintien d’une réponse fonctionnelle pourrait impliquer la persistance de quelques cellules T
SCM
(en bleu clair), capables d’auto-renouvellement tout en produisant simultanément un grand nombre de cellules plus différenciées (en bleu foncé). En bas : une autre hypothèse implique un renouvellement clonal où les clones plus anciens et différenciés approchant de la sénescence (cellules violettes) sont continuellement remplacés par des « nouveaux clones » (cellules oranges, puis cellules bleues) avec une fonctionnalité préservée.
|
Si la démonstration de la survie des lymphocytes et de la mémoire immunitaire à long terme n’est pas nouvelle, ces résultats apportent néanmoins un regard neuf sur les phénomènes de prolifération et de sénescence des cellules du système immunitaire, et plus particulièrement des lymphocytes T. Grâce à sa ténacité, cette équipe de recherche a montré pour la première fois que les lymphocytes T ont un potentiel d’expansion et de longévité exceptionnel, bien au-delà de la durée de vie de l’organisme dont ils sont issus : un lymphocyte T murin peut ainsi théoriquement se répliquer 1 040 fois sans s’épuiser fonctionnellement. Ces résultats conduisent par ailleurs à s’interroger sur l’importance, dans le vieillissement du système immunitaire, du délai entre des stimulations antigéniques répétées et de l’environnement dans lequel résident les lymphocytes T. Ils peuvent avoir des implications médicales pour les thérapies cellulaires en oncologie, pour la prise en charge du vieillissement, ainsi que pour l’élaboration des stratégies vaccinales.
Cependant, en dépit de son originalité, cette étude chez la souris présente certaines limitations. Certes, elle décrit un phénomène singulier, mais sans élucider le mécanisme biologique. Plusieurs questions demeurent sans réponse. La capacité de ces lymphocytes T à se renouveler et à proliférer de manière quasi-illimitée pourrait-elle être due à la préservation au cours du temps d’une petite sous-population de lymphocytes T scm ( stem cell-like memory ) au potentiel prolifératif et de production des cellules plus différenciées très supérieur à celui des autres lymphocytes T [ 6 , 7 ] ( Figure 2B ) ? Cette capacité à maintenir une réponse fonctionnelle à très long terme implique-t-elle un renouvellement clonal, avec le remplacement de vieux clones épuisés ou sénescents par des nouveaux ( Figure 2B ) ? Des analyses du transcriptome et du répertoire clonotypique à l’échelle de la cellule unique auraient vraisemblablement permis de répondre à ces questions, mais la difficulté d’exploiter rétrospectivement des échantillons de cellules murines congelées représente sans doute une limitation technique dans ce type d’expérimentation ayant débuté il y a plus de 10 ans.
Par ailleurs, la mesure de la longueur des télomères des chromosomes, marqueur clef de la sénescence cellulaire, n’est présentée par les auteurs de l’article que sur deux réplicats, et est exprimée en valeur relative et non en valeur réelle, ce qui peut compliquer son interprétation. Le maintien de la longueur des télomères dans des lymphocytes T différenciés peut d’ailleurs surprendre : dans l’espèce humaine, un raccourcissement des télomères est une caractéristique des lymphocytes T qui se différencient [ 8 ]. Surtout, il convient de rappeler que les télomères sont beaucoup plus longs dans les lymphocytes murins que dans les lymphocytes humains, ce qui implique un rapport à la sénescence cellulaire différent entre les deux espèces [ 9 ]. Il sera donc nécessaire de confirmer et compléter ces résultats par des études longitudinales plus détaillées dans l’espèce humaine, avant de pouvoir conclure sur le potentiel réplicatif des lymphocytes et le mécanisme du maintien de la mémoire immunitaire à long terme dans notre espèce, point de départ d’éventuelles applications thérapeutiques.