| |
| Med Sci (Paris). 39(8-9): 602–605. doi: 10.1051/medsci/2023098.Transfert du VIH-1 entre les lymphocytes T infectés et les macrophages Fusionner pour mieux disséminer Rémi Mascarau,1,2* Brigitte Raynaud-Messina,1,2 and Christel Vérollet1,2 1Institut de pharmacologie et biologie structurale (IPBS), université de Toulouse Paul Sabatier, CNRS, UPS
,
Toulouse
,
France 2International research project (IRP) CNRS « MAC-TB/HIV », Toulouse (France), et Buenos Aires (Argentine) MeSH keywords: Humains, VIH-1 (Virus de l'Immunodéficience Humaine de type 1), Macrophages, Lymphocytes T CD4+, Infections à VIH, complications |
Bien que les thérapies antirétrovirales actuelles soient efficaces pour réduire la charge virale chez les patients infectés par le virus de l’immunodéficience humaine (VIH-1), l’un des principaux défis à relever pour éradiquer complètement le virus est l’élimination des réservoirs viraux persistants. En effet, dans les cellules réservoirs, le virus est maintenu dans un état latent. Lors de l’arrêt du traitement, le VIH-1 peut être réactivé dans ces cellules et induire un rebond de la charge virale chez les patients, et la progression vers le syndrome d’immunodéficience acquise (SIDA). Parmi ces réservoirs, on compte certaines catégories de lymphocytes T CD4
+
, considérées comme les cibles principales du virus, mais également d’autres cellules immunitaires comme les macrophages. Les macrophages sont également impliqués dans d’autres étapes de l’infection, puisqu’ils participent à l’infection initiale en capturant le virus dans les muqueuses [
1
], à sa propagation dans l’organisme [
2
], mais aussi à de nombreuses complications plus tardives liées à l’infection, notamment à cause de leur longue durée de vie et de leur large distribution tissulaire [
3
]. Nous nous sommes intéressés aux mécanismes impliqués dans l’infection des macrophages par le VIH-1, puisque ces cellules constituent des réservoirs viraux et représentent des cibles thérapeutiques prometteuses.
|
Le transfert intercellulaire, principal mode de dissémination du VIH-1 vers les macrophages
D’une manière générale, les cellules cibles du VIH-1 peuvent être infectées par des particules virales libres, ou par transmission du virus d’une cellule donneuse déjà infectée vers une cellule receveuse. Plusieurs mécanismes de transfert intercellulaire ont été mis en évidence, tels que l’établissement de synapses virologiques et infectieuses ou la formation de ponts membranaires (
tunneling nanotubes
). Cependant, les mécanismes moléculaires qui contrôlent le transfert du virus de cellule à cellule pour l’infection des macrophages restent mal connus [
4
]. L’étude de ces mécanismes est d’autant plus pertinente que les macrophages sont peu permissifs à l’infection par des particules virales libres, notamment parce qu’ils expriment de faibles quantités des molécules CD4 (
cluster of differentiation 4
) et CCR5 (
C-C chemokine receptor type 5
), les récepteurs indispensables à l’entrée du virus dans ces cellules cibles.
In vitro
, deux principaux mécanismes de l’infection des macrophages par transfert intercellulaire du virus à partir de lymphocytes T infectés ont été décrits : soit par phagocytose de ces lymphocytes [
5
], qui sont alors capturés et dégradés, soit par fusion cellulaire [
6
].
|
La fusion entre lymphocytes T infectés et macrophages permet une infection rapide et efficace des macrophages tissulaires
Nous avons montré que la fusion cellulaire hétérotypique avec des lymphocytes infectés est un processus plus rapide et plus efficace pour infecter des macrophages humains dérivés de monocytes que l’infection par des particules virales libres [
6
], ou par phagocytose [
7
]. Cette fusion cellulaire implique une interaction spécifique entre les lymphocytes T infectés et les macrophages (
Figure 1A
), suivie, après quelques minutes, par la fusion de leurs membranes plasmiques. Ceci résulte en une cellule infectée hybride, ou hétérocaryon, contenant à la fois un noyau de lymphocyte T et un noyau de macrophage (
Figure 1B
). Ce mode de transmission du virus permet une infection efficace des macrophages humains résidents provenant de divers tissus, tels que les macrophages placentaires ou les macrophages alvéolaires du poumon, qui ont été identifiés comme réservoirs viraux (
Figure 1C
). Il pourrait expliquer pourquoi les macrophages infectés sont souvent sous la forme de cellules géantes multinucléées dans les tissus des patients infectés [
8
] et contiennent parfois du matériel de lymphocytes T [
4
].
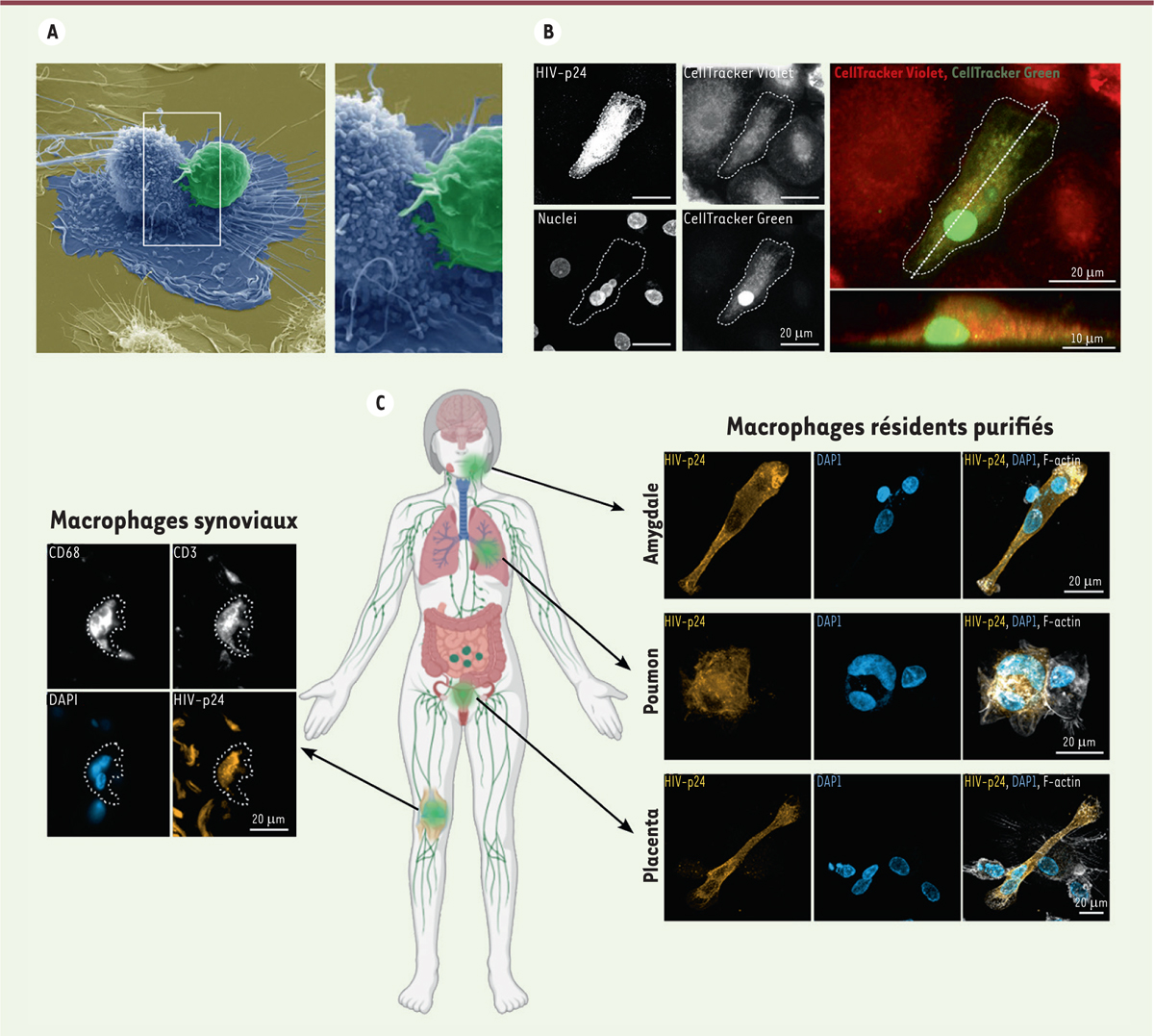
 | Figure 1.
L’interaction entre lymphocytes T infectés et macrophages promeut la fusion entre les deux cellules et la formation d’un hétérocaryon infecté. (A)
L’observation de l’interaction entre un lymphocyte T infecté par le VIH-1 (en vert) et un macrophage (en bleu) par microscopie électronique à balayage montre l’établissement d’un contact étroit entre les deux cellules, ainsi que des déformations de la membrane du lymphocyte T en direction du macrophage.
(B)
Des macrophages et des lymphocytes T infectés ont été marqués avec des sondes fluorescences différentes (respectivement,
CellTracker violet
et
green
) avant d’être mélangés. Après six heures de coculture, on observe l’apparition de cellules infectées (marquage HIV-p24), marquées par les deux sondes fluorescentes, et comportant au moins deux noyaux d’origines différentes (Nuclei).
(C)
Des macrophages issus de différents tissus ont été exposés à des lymphocytes T infectés, soit directement dans leur tissu d’origine (macrophages synoviaux, à gauche), soit après purification (amygdale, poumon et placenta, à droite). Après 24 heures, on observe des macrophages infectés (marquage HIV-p24) et multinucléés (noyaux, DAPI). Dans le cas des explants synoviaux, ces cellules expriment à la fois un marqueur de macrophage (CD68) et un marqueur de lymphocyte T (CD3).
|
Une des caractéristiques des macrophages est leur grande diversité. Selon leur localisation tissulaire et le contexte physiopathologique, ces cellules présentent des états d’activation différents, associés notamment à une modulation de leurs fonctions et de leur phénotype. Cette diversité est aussi liée à des différences dans leur susceptibilité à l’infection par des particules virales libres. En effet, des macrophages activés
in vitro
, que ce soit par des stimulus pro-inflammatoires ou anti-inflammatoires, sont moins permissifs à l’infection que des macrophages non activés [
9
]. Nous avons montré que, dans des conditions anti-inflammatoires, la fusion avec des lymphocytes T est le mécanisme majeur d’infection des macrophages. Au contraire, le profil pro-inflammatoire des macrophages favorise plutôt le transfert viral par l’établissement de synapses entre les deux cellules, induisant une infection moins productive.
|
Les tétraspanines et le cytosquelette cortical d’actomyosine des macrophages contrôlent leur infection par fusion cellulaire
Bien qu’elle soit particulièrement efficace pour infecter les macrophages par le VIH-1, la fusion cellulaire est rarement impliquée dans l’infection d’autres types cellulaires par ce virus, notamment au cours de l’interaction entre deux lymphocytes T [
4
]. Cela suggère l’existence de mécanismes moléculaires spécifiques de l’infection des macrophages. Nous avons montré que l’interaction entre les lymphocytes T infectés et les macrophages préalable à la fusion est caractérisée par le recrutement de F-actine et de molécules impliquées dans l’adhérence cellulaire (ICAM-1 [
intercellular adhesion molecule 1
], intégrine β2) à la zone de contact. Nous avons ensuite étudié le rôle du cytosquelette d’actine dans le processus d’infection des macrophages par fusion cellulaire. En exposant les macrophages à différents inhibiteurs de la dynamique du cytosquelette d’actine, puis en les mettant en contact avec des lymphocytes T infectés, nous avons constaté une diminution de la fréquence des évènements de fusion entre les deux types cellulaires (
Figure 2
). Inversement, l’inhibition de l’activité de la myosine II, impliquée dans la contraction de ce cytosquelette et la rigidité de la membrane plasmique, favorise la survenue de ces évènements. Ces résultats indiquent que la fusion entre les deux cellules est contrôlée par un équilibre entre la dynamique de l’actine et la contraction de la myosine. Nous avons ensuite recherché les molécules présentes à la membrane plasmique qui pouvaient contrôler la fusion lors de l’interaction entre les deux cellules. Nous nous sommes intéressés à une famille de protéines membranaires, les tétraspanines, qui sont recrutées au contact entre des cellules infectées et des cellules cibles et qui modulent l’efficacité du transfert viral dans d’autres contextes [
10
]. Nous avons montré que la tétraspanine CD81 favorise l’activation de la GTPase RhoA, une enzyme elle-même impliquée dans l’activité de la myosine en induisant la phosphorylation de sa chaîne légère. Ainsi, l’inhibition de cette tétraspanine dans les macrophages augmente leur infection par fusion cellulaire (
Figure 2
). L’axe tétraspanine CD81/RhoA/myosine II joue donc un rôle important dans le contrôle de la fusion hétérotypique entre un lymphocyte T infecté et un macrophage.
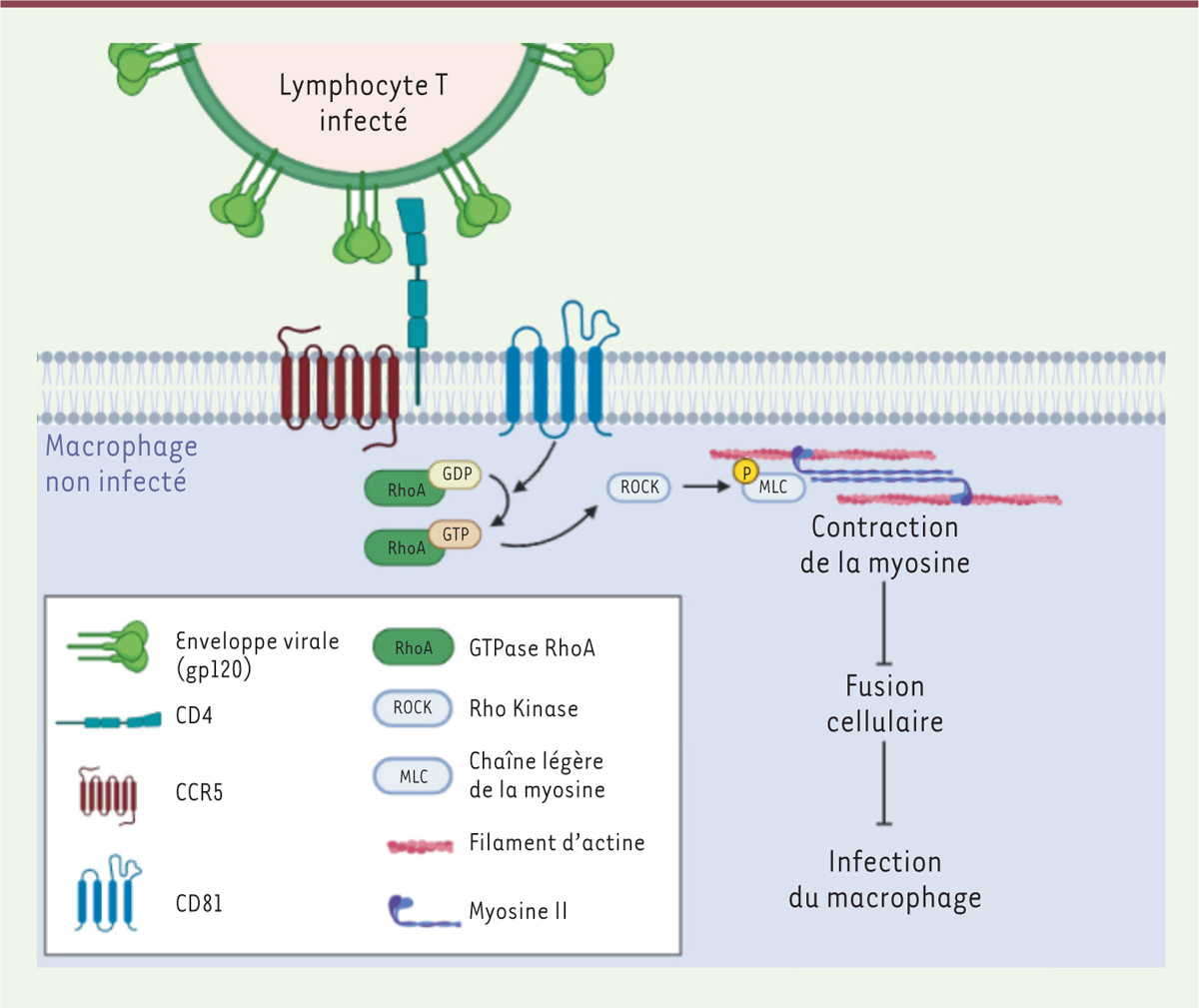
 | Figure 2.
Contrôle moléculaire de la fusion entre les lymphocytes T et les macrophages par l’axe CD81/RhoA/myosine II.
Au cours du contact entre un lymphocyte T infecté et un macrophage, la tétraspanine CD81 à la surface du macrophage favoriserait la liaison du GTP à la GTPase RhoA, donc son activation. Celle-ci induirait l’activité de la kinase ROCK, dont l’action est de phosphoryler la chaîne légère de la myosine II (MLC). Cette phosphorylation entraîne un changement de conformation de la myosine qui induit sa contraction et une augmentation de la rigidité corticale, au détriment de la fusion entre les deux cellules et de l’infection du macrophage.
|
|
La fusion cellulaire avec des lymphocytes T infectés par le VIH-1 apparaît donc comme un mécanisme majeur d’infection des macrophages par ce virus. Les macrophages sont généralement considérés comme peu permissifs à l’infection par le VIH-1
in vitro
, mais ils sont néanmoins infectés dans une grande diversité de tissus chez les patients porteurs du virus. Ce processus d’infection par fusion cellulaire s’avère capable de contourner les restrictions induites par l’activation des macrophages et de toucher une grande variété de macrophages tissulaires. À terme, une compréhension approfondie des mécanismes moléculaires de cette transmission virale devrait permettre d’élaborer de nouvelles stratégies thérapeutiques pour limiter l’infection des macrophages, et donc l’établissement de réservoirs viraux persistants et leurs conséquences néfastes sur la progression de l’infection.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Ganor
Y
,
Real
F
,
Sennepin
A
,
et al.
HIV-1 reservoirs in urethral macrophages of patients under suppressive antiretroviral therapy.
.
Nat Microbiol
.
2019;
;
4
:
:633.
–
644
.
2.
Vérollet
C
,
Souriant
S
,
Bonnaud
E
,
et al.
HIV-1 reprograms the migration of macrophages.
.
Blood
.
2015;
;
125
:
:1611.
–
1622
.
3.
Sattentau
QJ
,
Stevenson
M
.
Macrophages and HIV-1: an unhealthy constellation.
.
Cell Host Microbe
.
2016;
;
19
:
:304.
–
310
.
4.
Han
M
,
Woottum
M
,
Mascarau
R
,
et al
.
Mechanisms of HIV-1 cell-to-cell transfer to myeloid cells.
.
J Leukoc Biol
.
2022;
;
112
:
:1261.
–
71
.
5.
Baxter
AE
,
Russell
RA
,
Duncan
CJ
,
et al.
Macrophage infection via selective capture of HIV-1-infected CD4
+
T cells
.
.
Cell Host Microbe
.
2014;
;
16
:
:711.
–
721
.
6.
Bracq
L
,
Xie
M
,
Lambelé
M
,
et al.
T cell-macrophage fusion triggers multinucleated giant cell formation for HIV-1 spreading.
.
J Virol
.
2017;
;
91
:
:e01237.
–
e01217
.
7.
Mascarau
R
,
Woottum
M
,
Fromont
L
,
et al
.
Productive HIV-1 infection of tissue macrophages by fusion with infected CD4
+
T cells
.
.
J Cell Biol
.
2023;
;
222
:
:e202205103.
.
8.
Compton
AA
,
Schwartz
O
.
They might be giants: Does syncytium formation sink or spread HIV infection?
.
PLoS Pathog
.
2017;
;
13
:
:e1006099.
.
9.
Cassol
E
,
Cassetta
L
,
Rizzi
C
,
et al.
M1 and M2a polarization of human monocyte-derived macrophages inhibits HIV-1 replication by distinct mechanisms.
.
J Immunol
.
2009;
;
182
:
:6237.
–
6246
.
10.
Gordón-Alonso
M
,
Yañez-Mó
M
,
Barreiro
O
,
et al.
Tetraspanins CD9 and CD81 modulate HIV-1-induced membrane fusion.
.
J Immunol
.
2006;
;
177
:
:5129.
–
5137
.
|