La plasticité cellulaire permet une adaptation rapide des cellules aux changements physiques ou chimiques de leur environnement. Elle relève de mécanismes non génétiques et est impliquée dans de nombreux processus physiologiques ou pathologiques. Par exemple, des cellules tumorales peuvent opérer une transition épithélio-mésenchymateuse qui les fait passer d’un état hautement prolifératif à un état plus invasif, et ainsi contribuer aux métastases cancéreuses [ 1 ]. Au cours de l’inflammation, les cellules immunitaires, dont font partie les macrophages, peuvent se transformer en cellules qui exécutent la réponse inflammatoire et favorisent la réparation des tissus [ 2 ]. Cependant, une inflammation incontrôlée en réponse à une infection peut entraîner un sepsis, un syndrome clinique caractérisé par des lésions tissulaires et un dysfonctionnement des organes potentiellement mortel. Plus de 11 millions de personnes dans le monde meurent chaque année d’un choc septique, aussi le développement de nouveaux médicaments actifs contre le sepsis représente-t-il un défi qu’il importe de relever [ 3 ].
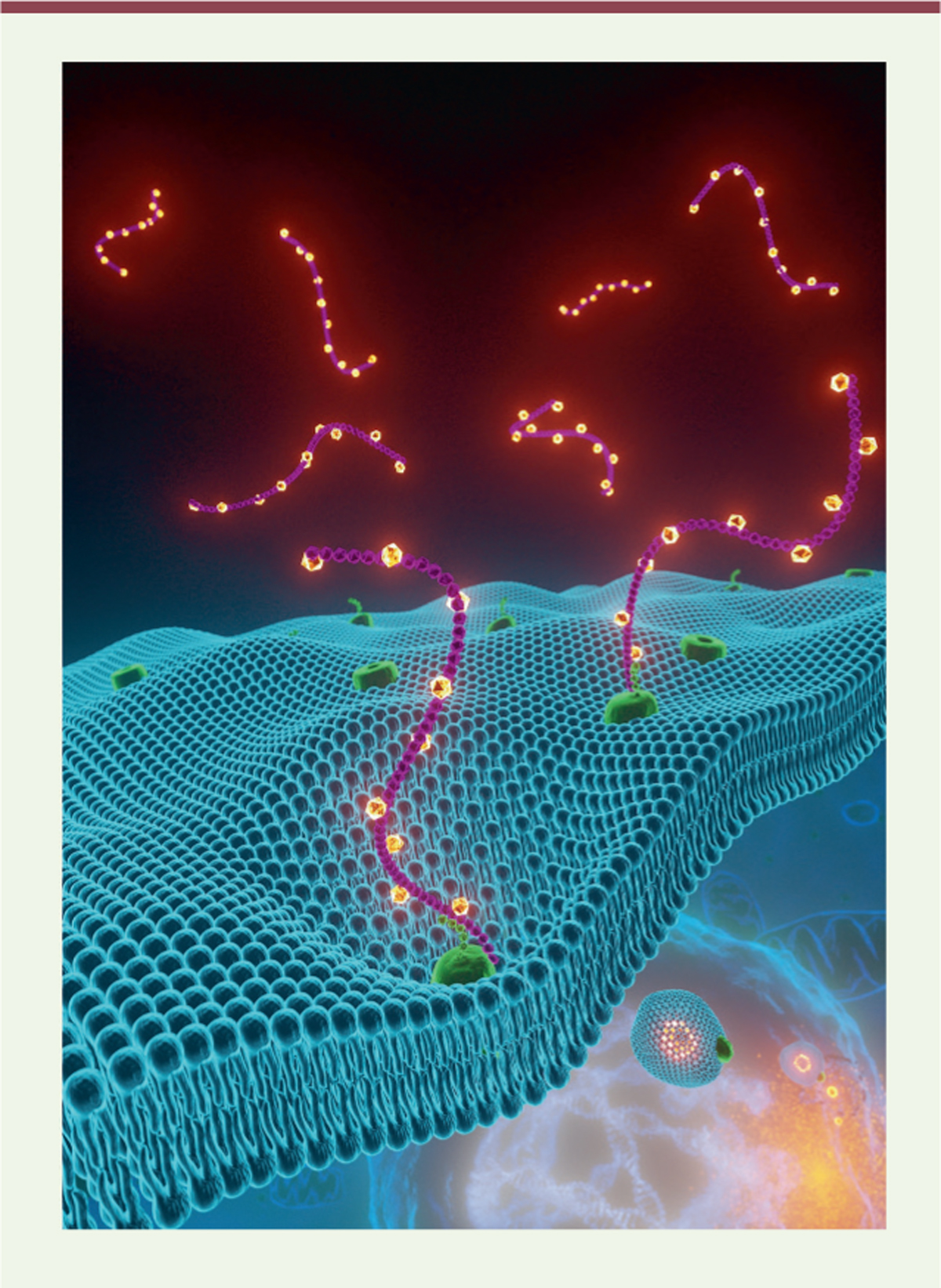
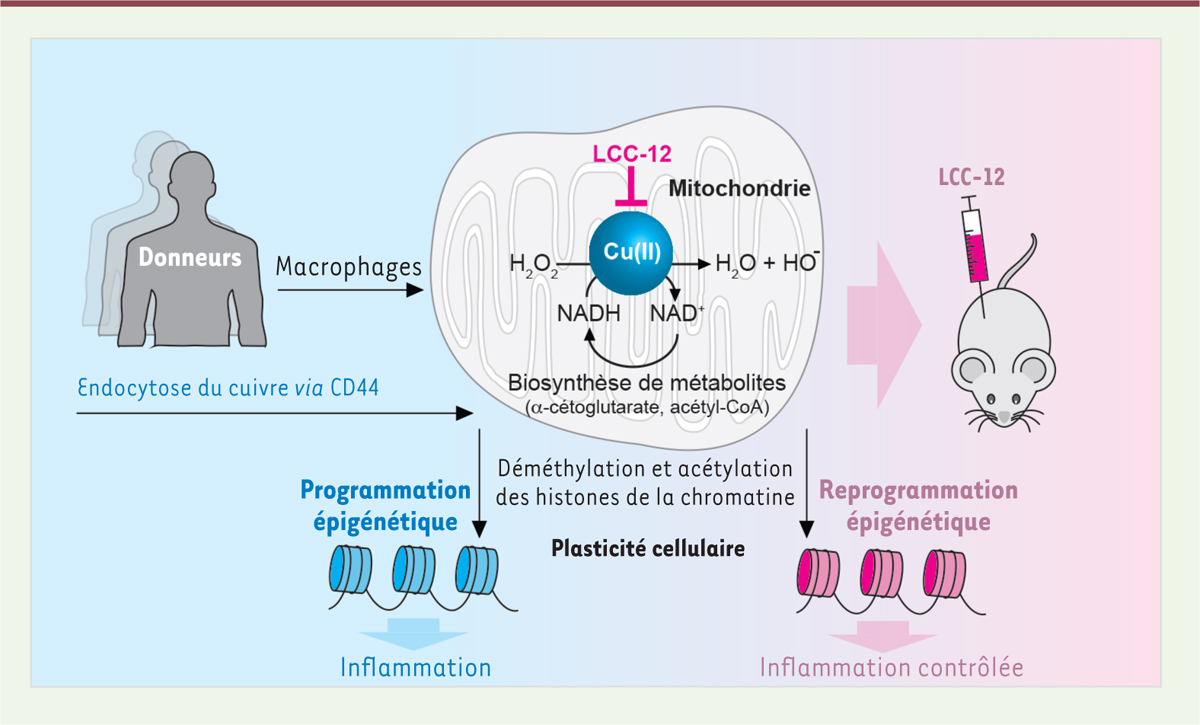
La glycoprotéine de surface CD44, qui est le récepteur principal des hyaluronates, est associée à la plasticité cellulaire dans le cancer et dans la réponse immunitaire [ 4 ]. Les macrophages inflammatoires surexpriment cette glycoprotéine [ 5 ]. On savait qu’au cours de la transition épithélio-mésenchymateuse des cellules cancéreuses, du fer lié aux hyaluronates est internalisé dans la cellule, faisant suite à l’endocytose de CD44 [ 6 ]. Nous avons tout d’abord recherché si l’activation des macrophages pouvait également s’accompagner d’une endocytose de métaux via CD44 [ 7 ]. Dans les mitochondries de macrophages inflammatoires humains, issus de monocytes triés à partir du sang de donneurs, nous avons détecté, par spectrométrie de masse, une augmentation de la quantité de cuivre. Cette augmentation a pu être empêchée par l’ajout d’un ARNi (ARN interférent) dirigé contre CD44, ou par celui d’un anticorps anti-CD44 qui bloque l’interaction avec les hyaluronates. Inversement, la supplémentation du milieu de culture cellulaire par du hyaluronate a amplifié l’augmentation de la quantité de cuivre intracellulaire. Ces résultats montrent qu’il existe une endocytose du cuivre lié aux hyaluronates, impliquant CD44, au cours de l’activation des macrophages ( Figure 1 ).
Nous avons ensuite cherché à déterminer si le cuivre jouait un rôle dans l’activation macrophagique (détectée par l’expression de deux marqueurs membranaires d’activation, CD80 et CD86). Nous avons ajouté au milieu de culture cellulaire différents chélateurs du cuivre, dont la D-pénicillamine et la trientine, qui sont utilisées pour traiter la maladie de Wilson (une maladie génétique due à l’accumulation de cuivre dans l’organisme), et la metformine, un médicament de la famille des biguanides utilisé dans le traitement du diabète de type 2. En effet, un article datant de 1929 décrivait la chélation du cuivre par la metformine [ 8 ], et nous savions que ce biguanide réduit l’activité du complexe I de la chaîne de transport d’électrons par un mécanisme encore indéterminé [ 9 ]. Nous avons constaté une diminution de l’activation des macrophages en présence de metformine, mais seulement à des doses élevées (10 mM). Nous avons alors tenté d’améliorer ce résultat en liant chimiquement deux molécules de metformine par une chaîne carbonée afin de réduire le coût entropique inhérent à la formation de complexes de chélation bimoléculaire Cu(metformine) 2 . Parmi la quarantaine de composés synthétisés, seul LCC-12 ( lipophilic copper clamp 12 )/supformine a permis de diminuer sensiblement l’activation macrophagique, à une dose 1 000 fois inférieure à celle de la metformine. LCC-12 forme un complexe stable uniquement avec le cuivre(II) (ion Cu 2+ ) ( Figure 2 ), pas avec d’autres métaux tels que le magnésium, le calcium, le manganèse, le zinc, le fer ou encore le cuivre(I) (ion Cu + ). LCC-12 bloque la plasticité des macrophages, mais nous avons constaté qu’il inhibe également l’activation des cellules dendritiques, celle des lymphocytes T CD4 + et CD8 + , ainsi que la transition épithélio-mésenchymateuse des cellules cancéreuses. La synthèse d’un dérivé isotopique de LCC-12 a permis d’établir que la molécule se localisait dans les mitochondries, et une analyse du contenu en cuivre des différents organites cellulaires au cours de l’activation macrophagique a montré qu’il augmentait dans les mitochondries, mais restait inchangé dans le noyau cellulaire ou le réticulum endoplasmique. Ainsi, le cuivre mitochondrial contrôle la plasticité des macrophages, mais également celle d’autres cellules : c’est donc un acteur central de la plasticité cellulaire.
La spectrométrie de masse a également révélé l’existence d’une augmentation du contenu mitochondrial en manganèse au cours de l’activation des macrophages, ce qui suggérait l’implication de la superoxyde dismutase mitochondriale dépendante du manganèse (SOD2), dont la quantité, ainsi que celle du peroxyde d’hydrogène (H 2 0 2 ) qu’elle produit, augmente effectivement dans les mitochondries des macrophages activés. Nous avons montré que le cuivre(II) induit la réduction de H 2 0 2 en présence de NADH, avec production de NAD + , une molécule nécessaire à la production de divers métabolites, dont l’a-cétoglutarate et l’acétyl-CoA, qui sont impliqués dans le contrôle de l’activité des déméthylases et des acétyltransférases. LCC-12, en chélatant le cuivre(II), antagonise la conversion de NADH en NAD + , pour produire à la place l’époxy-NADH, relativement instable. En présence de LCC-12, nous avons effectivement détecté une diminution des concentrations d’a-cétoglutarate et d’acétyl-CoA.
Puisque nous avions montré que LCC-12 atténue l’activation des macrophages, nous avons fait l’hypothèse qu’il provoque des altérations épigénétiques affectant l’expression des gènes pro-inflammatoires dans ces cellules. Au cours de l’activation des macrophages, nous avons détecté, par séquençage de leur contenu en ARNm, une augmentation de l’expression de gènes impliqués dans l’inflammation, le métabolisme et les modifications de la chromatine. Les macrophages inflammatoires, dérivés de monocytes traités par le lipopolysaccharide et l’interféron-g, ou macrophages de patients infectés par le virus SARS-CoV2, présentent une signature inflammatoire, caractérisée par l’expression de gènes pro-inflammatoires. Nous avons également constaté une augmentation des ARNm codant des déméthylases dépendantes du fer et des acétyltransférases, ce qui se traduit par une déméthylation et une acétylation des marques d’histones dans la chromatine de ces macrophages. Des expériences de séquençage de l’ADN après immunoprécipation de la chromatine (ChIP-seq), permettant d’étudier les interactions de l’ADN avec les protéines à l’échelle du génome, ont effectivement montré une augmentation des marques d’histones H3K27ac, H3K14ac, H3K9ac (permissives pour la transcription des gènes) et une diminution des marques d’histones H3K27me3, H3K9me2 (répressives pour la transcription) dans les macrophages activés. Ces modifications de la chromatine ont été reliées à l’augmentation de l’expression des gènes de l’inflammation mentionnée précédemment. LCC-12 a entraîné, au contraire, une diminution de l’expression de ces gènes et une altération des marques épigénétiques associées à l’inflammation.
Nous avons alors cherché à confirmer ces résultats dans des modèles murins d’inflammation aigüe : modèles de sepsis (modèle induit par le lipopolysaccharide, modèle de ligature et de ponction du cæcum) et modèle de covid-19. Nous avons mis en évidence l’existence d’une augmentation des quantités de CD44 et de cuivre dans les macrophages des souris infectées. De plus, un traitement de ces souris par LCC- 12 (par voie intra-péritonéale) a permis d’atténuer l’inflammation : diminution de l’expression des gènes pro-inflammatoires mesurée par séquençage du contenu des macrophages en ARNm, diminution de leur contenu en protéines de l’inflammation mesuré par la technique du western blot , diminution de la quantité de marqueurs de leur polarisation M1 « pro-inflammatoire », tels que CD86, CD40 et NOS2, mesurée par cytométrie en flux. Enfin, ce traitement a augmenté la survie des animaux de manière plus efficace que la dexaméthasone, qui est une molécule anti-inflammatoire de référence dans le traitement du sepsis.
Nous avons donc montré que les cellules immunitaires impliquées dans l’inflammation et le sepsis contenaient une quantité accrue de cuivre, responsable des modifications de la plasticité cellulaire ( Figure 3 ). L’accumulation du cuivre(II) dans les mitochondries agit sur le contrôle épigénétique de l’inflammation via la production de métabolites. LCC-12, la petite molécule dérivée de la metformine que nous avons synthétisée, peut bloquer ces processus en chélatant le cuivre(II). Nous avons également montré que LCC-12 bloque l’acquisition des propriétés métastatiques des cellules cancéreuses, qui ont un taux de cuivre élevé. Ces résultats ouvrent une piste thérapeutique innovante contre le sepsis ou contre la formation de métastases dans le cancer.