| |
| Med Sci (Paris). 39(8-9): 591–593. doi: 10.1051/medsci/2023087.Lymphocytes MAIT Une nouvelle cible thérapeutique dans la fibrose hépatique Morgane Mabire,1 Hélène Gilgenkrantz,1* and Sophie Lotersztajn1** 1Centre de recherche sur l’inflammation, Inserm U1149, Faculté de médecine Bichat
,
Paris
,
France MeSH keywords: Humains, Cirrhose du foie, Foie, Lymphocytes, thérapie, anatomopathologie |
La fibrose hépatique est une conséquence commune à toutes les maladies chroniques du foie quelle qu’en soit l’origine (toxique, métabolique, virale, ou auto-immune). Son stade ultime, la cirrhose, expose à diverses complications sévères responsables d’une forte morbi-mortalité, dont le carcinome hépatocellulaire. En France, 200 000 à 500 000 patients présentent une cirrhose, responsable de 15 000 décès par an. La consommation excessive régulière d’alcool (maladie alcoolique du foie) ou un régime trop riche en sucres et en graisses (stéatopathie métabolique) sont devenues les deux premières causes de cirrhose dans les pays développés [
1
]. De nombreuses études ont montré que la fibrose hépatique, voire la cirrhose, était réversible lorsque l’agression chronique était interrompue. Cependant, il n’existe à ce jour ni traitement pour faire régresser la fibrose, ni traitement curatif de la cirrhose en dehors de la transplantation hépatique.
La fibrose est un processus cicatriciel consécutif à une production excessive de matrice extracellulaire, dont la composition est, en outre, altérée par les cellules fibrogéniques activées. Elle résulte d’un déséquilibre entre les voies de synthèse et de dégradation de cette matrice, le collagène non fibreux étant peu à peu remplacé par du collagène fibrillaire. La fibrogenèse est alimentée par une inflammation chronique, dans laquelle les macrophages jouent un rôle central. Au cours de la progression de la fibrose, des macrophages pro-inflammatoires, exprimant fortement le marqueur Ly6C (
lymphocyte antigen 6 complex, locus C1
) (macrophages Ly6C
high
), sont recrutés dans le foie lésé, et y produisent des cytokines et des chimiokines qui activent les cellules pro-fibrogéniques. En revanche, ce sont d’autres macrophages, appelés « résolutifs », caractérisés notamment par leur faible expression du marqueur Ly6C (macrophages Ly6C
low
), qui participent à la régression de la fibrose en sécrétant des métalloprotéases [
2
]. Une analyse transcriptomique à l’échelle unicellulaire a permis d’identifier de nouvelles sous-populations de cellules non parenchymateuses, notamment macrophagiques, impliquées dans la cirrhose chez l’homme [
3
].
|
Les lymphocytes T invariants associés aux muqueuses (
mucosal-associated invariant T cells,
MAIT) sont des lymphocytes T non conventionnels, à l’interface de l’immunité innée et de l’immunité adaptative, qui ont été conservés au cours de l’évolution. Chez l’homme, ils peuplent le foie, le poumon et l’intestin, et plus généralement les barrières muqueuses. Ils constituent la population la plus abondante de lymphocytes T reconnaissant des ligands bactériens : ils constituent 20 à 40 % des lymphocytes intrahépatiques et jusqu’à 10 % des lymphocytes T circulants. Ils ont la particularité d’exprimer une chaîne a invariante du récepteur des lymphocytes T (
T cell receptor
, TCR), et sont restreints par la molécule d’histocompatibilité de classe Ib, MR1 (
major histocompatibility complex class I-related protein)
[
13
] (
→
).
(→) Voir la Nouvelle de H. Gilgenkrantz,
m/s
n° 4, avril 2020, page 313
La molécule MR1 est notamment présente à la surface des cellules présentatrices d’antigènes professionnelles, comme les macrophages ou les cellules dendritiques, mais également à la surface des hépatocytes, des myofibroblastes et des cellules endothéliales [
4
]. Les lymphocytes MAIT sont activés par deux voies :
via
MR1, qui active leur TCR semi-invariant par l’intermédiaire d’un ligand, la riboflavine (un métabolite de la vitamine B2), ou directement, par certaines cytokines inflammatoires, notamment les interleukines 12, 18 ou 23 [
5
].
Les lymphocytes MAIT sont impliqués dans l’homéostasie tissulaire et le maintien de l’intégrité des barrières muqueuses [
6
]. Ils jouent ainsi un rôle majeur dans la défense contre les microorganismes pathogènes, bactériens ou viraux, dans tous les tissus où ils sont abondants, en particulier dans l’intestin et dans le foie. Plus récemment, un rôle réparateur leur a été attribué dans la cicatrisation épithéliale cutanée [
7
].
Le nombre des lymphocytes MAIT est généralement diminué dans le sang des patients présentant une maladie chronique inflammatoire ; néanmoins, ils y ont le plus souvent un phénotype activé et pro-inflammatoire [
8
]. Les lymphocytes MAIT jouent ainsi un rôle physiopathologique complexe en fonction de l’organe ciblé et de l’évolution de la maladie, dans différents contextes pathologiques, comme le diabète de type 1 ou de type 2, ou l’obésité [
14
,
15
] (
→
).
(→) Voir les Nouvelles de I. Magalhaes et A. Lehuen,
m/s
n° 8-9, août-septembre 2015, page 717, et de O. Rouxel et A. Lehuen,
m/s
n° 6-7, vol. 34, juin-juillet 2018
L’ensemble de ces éléments, ainsi que la capacité des lymphocytes MAIT, lorsqu’ils sont activés, à sécréter des cytokines, telles que l’interleukine 17, connue pour être pro-fibrogène dans le foie, ont incité notre équipe de recherche à étudier leur modulation et leur rôle dans la fibrose hépatique, caractérisée par une inflammation persistante. |
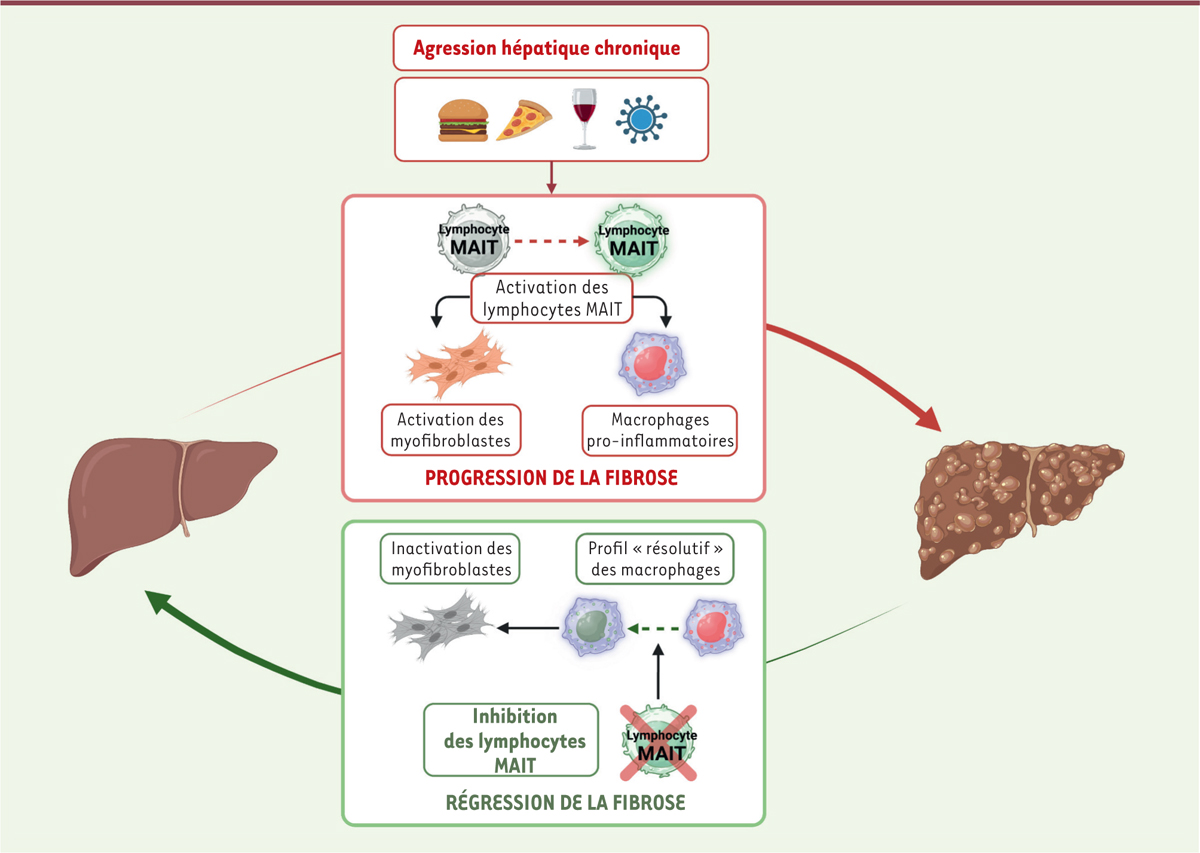
Les lymphocytes MAIT : une nouvelle population pro-fibrogène dans le foie
Nous avons mis en évidence une diminution significative du nombre des cellules MAIT dans le sang des patients présentant une cirrhose d’origine virale ou métabolique [
9
]. Si leur nombre est également plus faible dans le foie de patients cirrhotiques, les lymphocytes MAIT sont néanmoins relocalisés dans les zones de fibrose. Cette relocalisation est associée à une activation qui se traduit par une production accrue d’interleukine 17 et de TNF-α (
tumor necrosis factor
α), deux cytokines pro-inflammatoires et pro-fibrogènes dans le foie [
10
]. Ces lymphocytes accélèrent-ils pour autant la progression de la fibrose hépatique ? Pour répondre à cette question, nous avons soumis des souris enrichies en lymphocytes MAIT, ou au contraire, des souris qui en sont dépourvues (souris invalidées pour le récepteur MR1), à une agression toxique chronique (par injection répétée de tétrachlorométhane, CCl
4
) qui induit une fibrose du foie. Les souris enrichies en cellules MAIT présentaient une fibrose exacerbée, alors que les souris déficientes étaient résistantes à la fibrose. Nous avons montré, par des expériences de co-culture, que les lymphocytes MAIT activaient la prolifération et les fonctions pro-inflammatoires des myofibroblastes hépatiques (
Figure 1
). De plus, les lymphocytes MAIT activés « reprogrammaient » également les macrophages vers un profil pro-inflammatoire. Ainsi, ces lymphocytes sont des acteurs majeurs de la progression de la fibrose hépatique, ce qui en fait une cible thérapeutique potentielle contre la maladie [
9
]. Ces résultats ont depuis été confirmés chez des patients présentant une fibrose d’origine auto-immune, dans laquelle le rôle pro-fibrogène des lymphocytes MAIT a aussi été mis en évidence [
11
].
 | Figure 1.
Les lymphocytes MAIT : une cible thérapeutique contre la fibrose hépatique.
Une agression hépatique chronique entraîne l’activation des lymphocytes MAIT du foie, ce qui induit un profil inflammatoire des macrophages et stimule les propriétés fibrogéniques des myofibrobastes hépatiques. En cas de fibrose hépatique constituée, une inhibition des lymphocytes MAIT provoque un changement phénotypique des macrophages vers un profil « résolutif » et une inactivation des cellules fibrogéniques conduisant à une régression de la fibrose (figure réalisée avec le logiciel BioRender).
|
|
L’inhibition des lymphocytes MAIT : une nouvelle approche thérapeutique pour faire régresser la fibrose hépatique
L’acétyl-6-formylptérine (Ac-6-FP) est un ligand antagoniste du récepteur MR1 capable d’inhiber l’activation des lymphocytes MAIT. L’injection de cet inhibiteur à des souris au cours de la progression de la fibrose, que celle-ci soit induite par une agression chronique toxique ou par un régime gras déficient en choline (qui provoque une stéatohépatite métabolique), bloque l’activation des lymphocytes MAIT et ralentit considérablement la progression de la fibrose. Lorsque l’agression chronique (virale, toxique ou métabolique) du foie cesse, la fibrose régresse spontanément. Nous nous sommes donc demandé si l’inhibition des lymphocytes MAIT, une fois la fibrose constituée, permettrait d’accélérer sa régression. Nous avons testé l’effet de l’inhibition des lymphocytes MAIT sur un foie cirrhotique chez l’homme
ex vivo
et sur un foie fibrotique chez la souris
in vivo
[
12
]. L’incubation de tranches de foie cirrhotique de patients dans une solution d’Ac-6-FP bloque la réponse inflammatoire et diminue l’expression de gènes pro-fibrogènes (
Col1A1
,
Col1A2
,
Acta2
) et le nombre des cellules pro-fibrogènes activées.
In vivo,
l’administration d’Ac-6-FP chez la souris présentant une fibrose accélère sa régression, un effet qui disparaît lorsque le foie est préalablement déplété en macrophages, ce qui suggère que l’interruption du dialogue entre lymphocytes MAIT et macrophages joue un rôle essentiel dans cet effet bénéfique [
12
] (
Figure 1
). Une analyse transcriptomique, par RNASeq, des deux populations macrophagiques Ly6C
low
et Ly6C
high
du foie de souris présentant une fibrose hépatique, traitées ou non avec de l’Ac-6-FP, a permis d’identifier différentes voies de signalisation modifiées par ce traitement. En effet, l’inhibition des lymphocytes MAIT induit notamment la survie des macrophages « résolutifs » et l’apoptose des macrophages pro-inflammatoires [
12
]. Des expériences
in vitro
ont d’ailleurs montré l’existence d’un effet direct des lymphocytes MAIT activés sur le phénotype des macrophages, un effet qui disparaît en présence d’Ac-6-FP [
12
]. L’inhibition des lymphocytes MAIT apparaît donc comme une stratégie thérapeutique prometteuse pour ralentir la progression de la fibrose hépatique et accélérer sa régression.
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Cheemerla
S
,
Balakrishnan
M
.
Global epidemiology of chronic liver disease.
.
Clin Liver Dis
.
2021;
;
17
:
:365.
–
70
.
2.
Ramachandran
P
,
Pellicoro
A
,
Vernon
MA
,
et al.
Differential Ly-6C expression identifies the recruited macrophage phenotype, which orchestrates the regression of murine liver fibrosis.
.
Proc Natl Acad Sci USA
.
2012;
;
109
:
:E3186.
–
E3195
.
3.
Ramachandran
P
,
Dobie
R
,
Wilson-Kanamori
JR
,
et al.
Resolving the fibrotic niche of human liver cirrhosis at single-cell level.
.
Nature
.
2019;
;
575
:
:512.
–
518
.
4.
Lett
MJ
,
Mehta
H
,
Keogh
A
,
et al
.
Stimulatory MAIT cell antigens reach the circulation and are efficiently metabolised and presented by human liver cells.
.
Gut
.
2022;
;
71
:
:2526.
–
38
.
5.
Klenerman
P
,
Hinks
T SC
,
Ussher
JE
.
Biological functions of MAIT cells in tissues.
.
Mol Immunol
.
2021;
;
130
:
:154.
–
8
.
6.
Nel
I
,
Bertrand
L
,
Toubal
A
,
et al
.
MAIT cells, guardians of skin and mucosa?
Mucosal Immunol
.
2021;
;
14
:
:803.
–
14
.
7.
Du Halgouet
A
,
Darbois
A
,
Alkobtawi
M
,
et al
.
Role of MR1-driven signals and amphiregulin on the recruitment and repair function of MAIT cells during skin wound healing.
.
Immunity
.
2023;
;
56
:
:78.
–
92.e6
.
8.
Toubal
A
,
Nel
I
,
Lotersztajn
S
,
et al.
Mucosal-associated invariant T cells and disease.
.
Nat Rev Immunol
.
2019;
;
19
:
:643.
–
657
.
9.
Hegde
P
,
Weiss
E
,
Paradis
V
,
et al.
Mucosal-associated invariant T cells are a profibrogenic immune cell population in the liver.
.
Nat Commun
.
2018;
;
9
:
:2146.
.
10.
Guillot
A
,
Hamdaoui
N
,
Bizy
A
,
et al.
Cannabinoid receptor 2 counteracts interleukin-17-induced immune and fibrogenic responses in mouse liver.
.
Hepatology
.
2014;
;
59
:
:296.
–
306
.
11.
Böttcher
K
,
Rombouts
K
,
Saffioti
F
,
et al.
MAIT cells are chronically activated in patients with autoimmune liver disease and promote profibrogenic hepatic stellate cell activation.
.
Hepatology
.
2018;
;
68
:
:172.
–
186
.
12.
Mabire
M
,
Hegde
P
,
Hammoutene
A
,
et al
.
MAIT cell inhibition promotes liver fibrosis regression via macrophage phenotype reprogramming.
.
Nat Commun
.
2023;
;
14
:
:1830.
.
13.
Gilgenkrantz
H
.
Un dialogue indispensable entre cellules MAIT et microbiote.
.
Med Sci (Paris)
.
2020;
;
36
:
:313.
–
6
.
14.
Magalhaes
I
,
Lehuen
A
.
Les lymphocytes MAIT dans le diabète de type 2 et l’obésité.
.
Med Sci (Paris)
.
2015;
;
31
:
:717.
–
719
.
15.
Rouxel
O
,
Lehuen
A
.
Les cellules MAIT : un lien entre l’intestin et le diabète de type 1.
.
Med Sci (Paris)
.
2018;
;
34
:
:518.
–
522
.
|