| |
| Med Sci (Paris). 39(6-7): 558–563. doi: 10.1051/medsci/2023071.L’apport des patients dans la relecture des protocoles de recherche Flavie Mathieu,1* Marie Lanta,2,3,4** and Martine Bungener3,5*** 1Collège des relecteurs de l’Inserm, service sciences et société, département de l’information scientifique et de la communication (DISC)
,
Paris
,
France 2Comité de patients de la fondation « Vaincre Alzheimer »
,
Paris
,
France 3Groupe de réflexion avec les associations de malades de l’Inserm (Gram)
,
Paris
,
France 4Comité éthique, Ligue contre le cancer
,
Paris
,
France 5Directrice de recherche honoraire du CNRS. CERMES 3, CNRS, Inserm, EHESS, université de Paris
,
Paris
,
France |
Vignette (© Inserm). La place des patients s’est développée et renforcée dans de multiples pans de la médecine et de la recherche médicale au cours des dernières décennies, intégrant l’émergence de la société civile. Un dialogue amélioré entre sciences et société est devenu une revendication forte des citoyens dans de nombreux pays développés, obligeant les institutions de recherche à partager avec le public les avancées et résultats de la recherche scientifique, ses méthodes, ses obligations éthiques et déontologiques. |
La réglementation, les notices d’information et le consentement
Les recherches cliniques, dont les essais médicamenteux, sont fondées sur la médecine de preuve, apparue dans les années 1970 au Canada. Ces recherches impliquent la participation de patients mais aussi de volontaires sains. En France, cette procédure s’appuie sur des réglementations, juridique et éthique, rigoureuses [
1
]. Quatre principes définissent la bioéthique : l’autonomie, la bienfaisance, la non malfaisance et la justice distributive [
2
], ce qui, en recherche, conduit à l’application de règles qui sont extrêmement encadrées.
Les participants à une recherche sur la personne humaine
1,
doivent donner leur « consentement éclairé » ou faire part de leur « non opposition », selon le type de recherche envisagée. L’investigateur
2
, pour sa part, se doit d’informer les participants de façon claire et complète sur le projet de recherche qu’il envisage et pour lequel il les sollicite : son objectif, son déroulement, ses bénéfices et ses contraintes pour le participant, ses risques prévisibles, etc. Cette information n’est pas uniquement orale. Elle se fait également
via
un formulaire d’information qui sera remis au participant et qui lui permettra de prendre le temps de réfléchir à son éventuelle participation.
Bien que la loi Hurriet-Serusclat [
3
] (
→
) ait été promulguée en décembre 1988 pour structurer la recherche clinique française, d’importants progrès restaient nécessaires afin d’améliorer l’information délivrée aux futurs participants à ces recherches. En effet « le consentement éclairé » avait bien été mis en place, mais l’injonction du législateur faite aux promoteurs
3
de délivrer « une information claire et loyale » ne répondait pas, alors, à la hauteur des attentes des participants. Ainsi, lors de la promulgation de la loi Hurriet-Serusclat, la recherche clinique restait assimilée, pour les patients et le grand public, à « un monde à part », secret, très fermé, dont les règles méthodologiques leur étaient parfaitement obscures. Le monde médical craignait en effet qu’en dévoilant trop précisément ce fonctionnement (comme le tirage au sort, par exemple), les patients susceptibles de participer à une recherche soient choqués ou rebutés par une information trop exhaustive et refusent donc d’y participer. Face à ces réticences et aux informations limitées ou mal adaptées qui leur étaient délivrées, les patients se considéraient comme de simples « cobayes auxquels on cachait tout ».
(→) Voir le Forum de P. Jaillon et J.P. Demarez,
m/s
n° 3, mars 2008, page 323
Plus de trente ans après la promulgation de la loi, et bien que les mentalités aient évolué, la notice d’information et le formulaire de consentement sont encore trop souvent considérés par les promoteurs comme des documents réglementaires, nécessaires pour obtenir les avis et autorisations obligatoires pour commencer une recherche. Ces documents sont par ailleurs parfois trop longs, contiennent de nombreux termes juridiques, restent compliqués à comprendre… et sont donc peu adaptés aux personnes sollicitées qui doivent prendre une décision dite « éclairée ». Au-delà de la compréhension des documents proposés, les promoteurs ont parfois des difficultés à se mettre à la place des participants, à imaginer notamment le niveau d’acceptabilité des contraintes qui leur seront imposées dans leur vie quotidienne : nombreuses consultations, multiples examens, parfois trop invasifs, et/ou déplacements répétés, difficilement envisageables, voire irréalistes pour des personnes malades. La nature des informations à transmettre aux patients n’étant pas évidente pour le promoteur, les associations puis l’Inserm ont mis en place des comités de patients d’abord impliqués dans la relecture des projets de recherche clinique puis dans leur co-construction avec les promoteurs, considérant, à juste titre, qu’il était plus judicieux de s’appuyer sur l’expérience des personnes concernées par une maladie afin de mieux prendre en compte leur avis, à toutes les étapes d’une recherche. |
La création des comités de relecture L’idée des comités de relecture est de délivrer aux patients une information claire, loyale, éthique, qui soit à la hauteur des risques pris et des contraintes subies par les patients qui seront inclus dans une recherche clinique. La qualité de l’information transmise et la liberté d’un véritable choix sont intimement liées. Elles s’appuient sur les principes éthiques d’autonomie et de bienfaisance. En France, il existe trois comités de relecture historiques : le TRT5-CHV, le CPRC et le Collège des relecteurs de l’Inserm.
Le TRT5 (pour traitements et recherche thérapeutique, le chiffre 5 faisant référence au nombre d’associations membres à sa création) a été le premier comité impliqué dans la relecture des protocoles et la conduite des essais cliniques. Il a été créé en 1992 par des associations de personnes vivant avec le virus de l’immunodéficience humaine (VIH). Depuis, ce collectif s’est élargi à d’autres associations de lutte contre le VIH-sida et a fusionné avec le collectif hépatites virales (CHV). Ce collectif (TRT5-CHV) est un outil commun d’action et d’information sur les questions thérapeutiques et de recherche clinique. Il intervient auprès des acteurs publics et privés sur des questions liées à la recherche, à la politique du médicament ainsi qu’à la qualité de la prise en charge médicale et du parcours de santé des patients. L’action du TRT5-CHV s’est initialement déployée au sein de l’Agence nationale de recherche contre le sida (ANRS, désormais ANRS/Maladies infectieuses émergentes, créée le 1
er
janvier 2021). Ce collectif a ouvert la voie à la création de comités de relecture associatifs, puis institutionnel.
En s’inspirant de l’expérience réussie du TRT5-CHV, le comité de patients pour la recherche clinique (CPRC) a été créé en 1998 par la Ligue nationale contre le cancer et par la Fédération nationale des centres de lutte contre le cancer (FNLCC, désormais Unicancer). Il a permis, en s’appuyant sur l’expérience de patients présentant un cancer, de définir la nature de l’information nécessaire à une bonne compréhension des enjeux, objectifs, contraintes, risques et bénéfices des essais cliniques. En 2012, le CPRC a été intégré aux plans cancer et soutenu par l’Institut national du cancer, son pilotage étant assuré par la Ligue nationale contre le cancer. À la suite des premiers « États généraux des malades atteints de cancer », la Ligue avait en effet identifié des manques d’information importants, comme l’accès au dossier médical, l’opacité de la recherche clinique, etc. Le CPRC est aujourd’hui constitué d’environ 130 relecteurs (patients et quelques proches de patients). Les enjeux sont particulièrement complexes en cancérologie. Notamment parce qu’il existe de nombreuses maladies cancéreuses, avec des localisations, des pronostics et des traitements différents. Le CPRC, guichet unique pour l’ensemble des maladies cancéreuses, est un facilitateur pour les promoteurs de recherche et permet de donner une visibilité à l’ensemble des associations de malades en cancérologie mobilisées pour valoriser l’expérience du patient dans la recherche, et obtenir des avis pertinents de patients pour chacune de ces maladies.
Le Collège des relecteurs de l’Inserm, unique comité de relecture institutionnel, a été créé en 2007 pour répondre à la demande du Groupe de réflexion avec les associations de malades
4
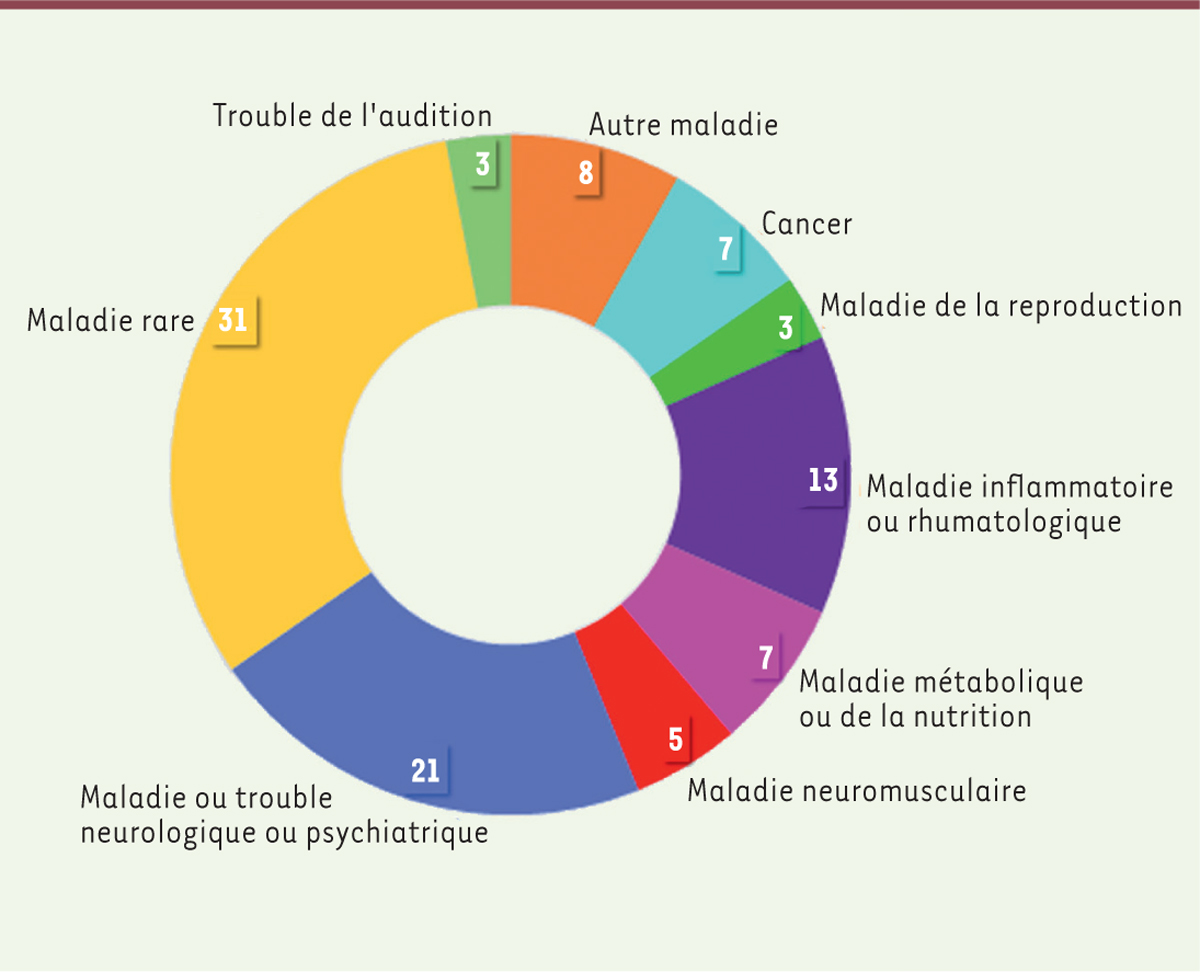
(le Gram) d’associer les associations aux projets de recherche promus par l’Inserm. Mis en place dans le cadre de la Mission associations, instaurée en 2003, devenue Service sciences et société en 2020, le Collège des relecteurs de l’Inserm est fortement inspiré du CPRC. Multithématique, il est actuellement composé d’une centaine de membres issus d’associations de malades (personnes malades ou souffrant de handicaps, proches ou aidants). La répartition des membres du Collège en fonction de la thématique de leur association est présentée dans la
Figure 1
. Les maladies cancéreuses sont peu représentées au sein du Collège des relecteurs de l’Inserm car les relectures sont adressées par la responsable du Collège au CPRC, plus spécialisé.
 | Figure 1.
Répartition des membres du Collège des relecteurs de l’Inserm en fonction de la thématique de leur association.
|
|
La formation des membres des comités de relecture Aucun prérequis n’est exigé pour intégrer les comités de relecture, à l’exception d’être concerné par une maladie, un trouble ou un handicap. Bien que ce soit leur savoir expérientiel qui est recherché, la formation des relecteurs est indispensable car l’expérience de la maladie seule n’est pas ici suffisante et doit être complétée par la connaissance de l’organisation et de la méthodologie appliquée en recherche clinique. Les relecteurs du CPRC sont formés dès leur recrutement, par les coordinatrices qui leur transmettent ensuite le guide d’aide à la relecture, un outil très concret pour les aider au fil de leurs relectures. Ces relecteurs participent à deux réunions par an qui sont destinées à les former aux évolutions de la recherche. À cette occasion, relecteurs et promoteurs se rencontrent au cours de sessions auxquelles sont invités des experts. La suite de la journée est dédiée à leur formation par petits groupes, en proposant des exercices pratiques sur les protocoles.
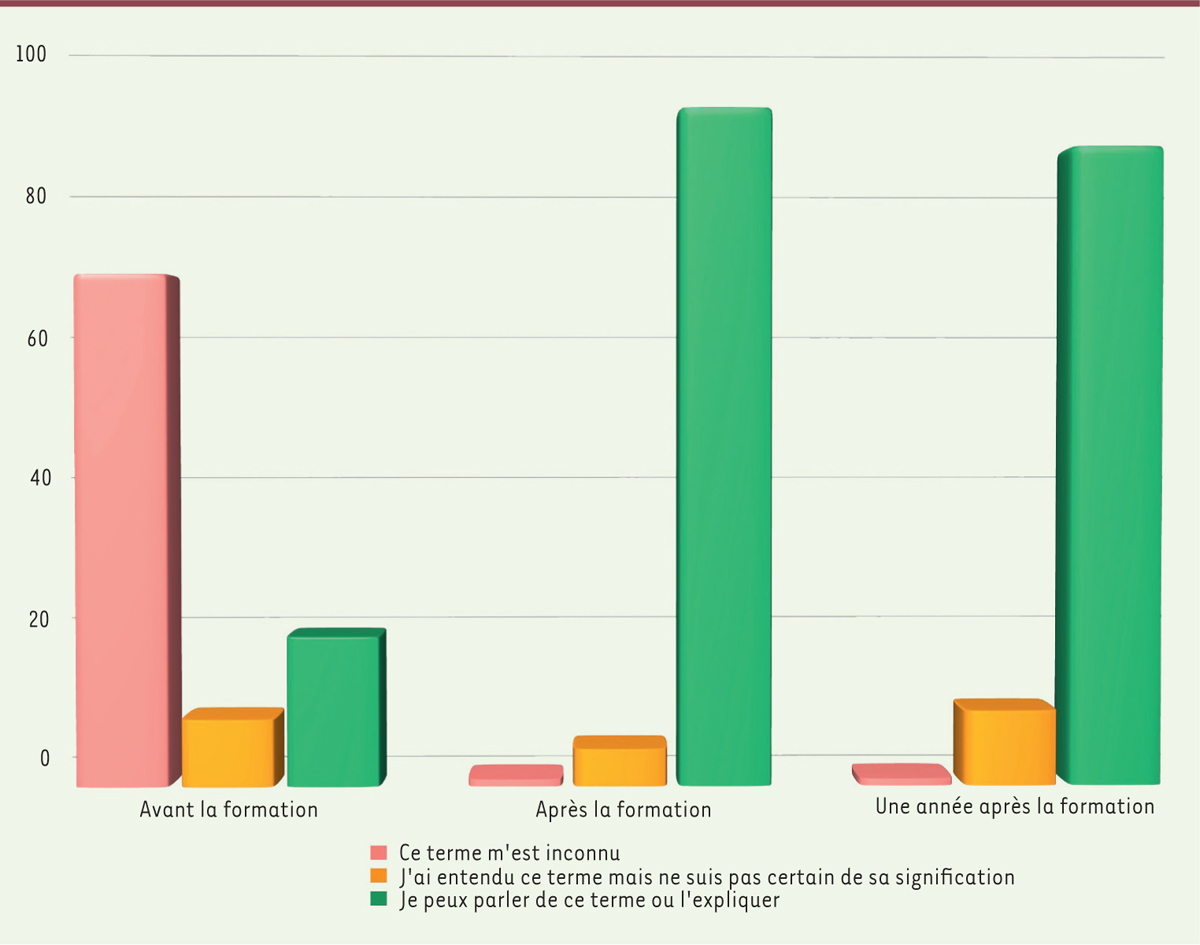
Les membres du Collège des relecteurs de l’Inserm, quant à eux, participent à un séminaire de formation qui se déroule sur deux jours. Le premier jour est dédié à la recherche clinique, et le second à la relecture critique de protocoles avec un exercice pratique. La formation est gratuite et les frais liés à la formation sont pris en charge par l’Inserm. Une évaluation des connaissances acquises lors de la formation est réalisée pour chacune des sessions de formation. En 2018, une évaluation de la formation de ces relecteurs, réalisée après une année, avait montré qu’ils avaient acquis durablement une solide maîtrise des concepts, des outils et du fonctionnement de la recherche clinique (
Figure 2
).
 | Figure 2.
Évaluation des connaissances acquises lors de la formation du Collège des relecteurs de l’Inserm.
En ordonnée, le pourcentage de réponses des participants selon les catégories de réponse, avant, juste après, ou un an après la formation.
|
Globalement, la moitié des relecteurs acceptent de relire un protocole relevant d’une autre discipline que celle dont relève leur association. Cette mutualisation des savoirs et ressentis permet un nouveau regard sur la terminologie utilisée dans les notices d’information, les personnes sollicitées pour la première fois pour participer à une recherche et à qui s’adressent ces informations, étant souvent moins au fait de leur maladie que les relecteurs spécialisés. Environ la moitié des membres du Collège des relecteurs de l’Inserm ou du CPRC acceptent de relire les protocoles rédigés en anglais, ce qui permet la relecture de projets européens ou internationaux. |
L’organisation des relectures Avant de pouvoir effectuer une relecture, chaque membre des comités de relecture doit signer un accord de confidentialité et de non conflit d’intérêt. Les membres du CPRC signent un accord qui est renouvelé tous les ans, cela pour rappeler aux relecteurs la nécessité de respecter une confidentialité absolue des recherches cliniques. Les membres du Collège des relecteurs de l’Inserm signent, quant à eux, un accord tous les quatre ans les engageant à respecter une confidentialité stricte pendant sept ans après leur dernière relecture. Au CPRC, comme au Collège des relecteurs de l’Inserm, les promoteurs transmettent leur projet de recherche (notices d’information, formulaire de consentement et protocole) aux coordinatrices des comités de relecture. Celles-ci les transmettent ensuite à trois relecteurs, sélectionnés en fonction de leur maladie et de leur disponibilité. Les relecteurs intègrent directement leurs modifications et leurs commentaires dans les documents, en les justifiant, ce qui est beaucoup plus efficace pour convaincre les promoteurs d’effectuer une correction. Les relectures réalisées par les membres du CPRC sont indemnisées (à hauteur de 75 €). Cette indemnité favorise leur sollicitation récurrente même s’ils choisissent de relire les projets à leur rythme, sans pression. Ils utilisent pour cela un guide d’aide à la relecture qui est mis à leur disposition et qui permet de s’assurer de la qualité de leurs suggestions. Les commentaires de chaque relecteur sont ensuite adressés directement aux promoteurs des projets. Les membres du Collège des relecteurs de l’Inserm sont bénévoles. Ils sont sollicités au maximum trois fois par an. Ils évaluent les notices d’information et le protocole de recherche à l’aide de grilles dédiées. Les relecteurs ont choisi que leurs relectures soient anonymes, pour limiter l’autocensure. Elles sont transmises à la coordinatrice du Collège, qui compile l’ensemble des modifications et adresse les notices modifiées au promoteur, de même que les grilles de relecture. Ces dernières permettent d’analyser les réponses des relecteurs et de prendre la mesure, non seulement des manquements qu’ils repèrent, mais aussi des améliorations qu’ils proposent. Les membres du CPRC, comme ceux du Collège des relecteurs de l’Inserm, se réunissent une à deux fois par an. Ils discutent alors du processus de relecture et des nouvelles collaborations établies avec les chercheurs. Les pratiques sont requestionnées afin de les faire évoluer. Avec l’essor du dialogue entre sciences et société, les demandes de relectures ont évoluées et sont de plus en plus importantes. Ainsi, le CPRC a eu pour tâche de relire plus de 1 700 protocoles de recherche, entre sa création, en 1998, et 2022, dont plus de 500 (soit 30 %) pour les seules années 2020-2022. Le même phénomène a été observé avec le Collège des relecteurs de l’Inserm, avec près de 250 protocoles relus depuis sa création en 2007, dont une centaine (44 %) entre 2020 et 2022. |
Les relectures, quel apport pour les acteurs de la recherche ?
La mise en place des comités de relecture est un des leviers essentiels du dialogue entre sciences et société. Les témoignages de relecteurs, recueillis en 2018, lors d’un évènement à l’Académie de médecine, à l’occasion du renouvellement du Collège des relecteurs de l’Inserm, en rendent compte :
-
«
C’est une formidable initiative à laquelle des personnes volontaires peuvent apporter une expertise… et participer à un projet d’intérêt général
»
-
«
Merci de créer ce pont entre la recherche et les malades
»
-
«
Merci ! Placer les patients au cœur des dispositifs de recherches offre clairement des perspectives nouvelles de pertinence et de démocratisation scientifique
».
Les comités de relecture ont pour but de s’assurer de la clarté des objectifs d’une recherche, de ses risques et bénéfices, et des contraintes que celle-ci peut engendrer. Ils s’assurent également de la transparence et de la lisibilité des notices d’information et des formulaires de consentement éclairé fournis lors de la demande des promoteurs de la recherche pour leur participation. Ils contribuent ainsi à ce que les participants soient mieux informés et plus aptes de décider par eux-mêmes de participer, ou non, à une recherche. La relecture par des personnes déjà concernées par la maladie permet ainsi une recherche qui sera plus éthique, prenant en compte les préoccupations et les difficultés des patients. Une telle information, claire et loyale, favorisera la participation et l’adhésion des participants aux recherches.
Une analyse des retours des relecteurs, réalisée en 2018 [
4
], montre tout l’intérêt de ces relectures. Elles apportent en effet une réelle plus-value aux projets de recherche, en identifiant les freins éventuels à la participation ou certaines contraintes difficilement acceptables par le participant. Les relecteurs peuvent également alerter les promoteurs sur d’éventuels biais de recrutement, sur la nécessité de mettre en place des dispositifs spécifiques de prise en charge ou leur proposer des améliorations.
La relecture est réalisée avant que le document final soit transmis à un Comité de protection des personnes (CPP)
5
. Notons que la plupart des projets qui ont été relus reçoivent un avis favorable, dès leur première soumission au CPP, ce qui réduit le délai, souvent important, entre soumission et démarrage de la recherche.
|
Un apport des comités qui conduit à l’extension de leur périmètre d’action L’apport du Collège des relecteurs de l’Inserm a été reconnu par l’Inserm dès sa création, en 2007, en instituant une procédure de relecture obligatoire des projets de recherche impliquant la personne humaine (RIPH) promus par l’Inserm. Depuis 2022, l’Inserm, désireux de développer une recherche éthique et responsable au sein de ses structures, demande que d’autres protocoles de recherche, portés par des investigateurs affiliés à une structure Inserm, soient également relus par le Collège des relecteurs, quel qu’en soit le promoteur. Le Collège des relecteurs de l’Inserm a également mis en place un groupe de travail dont l’objectif était de créer des outils pour aider les investigateurs à améliorer l’information qui sera délivrée aux participants aux recherches. Ce rôle du Collège sera présenté dans un prochain article. Certains membres sont également sollicités pour intégrer des comités de protection des personnes ou des comités scientifiques, leur connaissance du fonctionnement de la recherche clinique étant un levier pour apporter leur savoir expérientiel auprès des scientifiques. En 2012, l’Institut national du cancer (Inca) a reconnu et intégré l’action du CPRC dans les plans Cancer 2 et 3, et a confié son pilotage exclusif à la Ligue contre le cancer pour préserver une neutralité, indispensable face à l’ensemble des promoteurs. Depuis plusieurs années déjà, le CPRC participe à une co-construction en amont de certains essais cliniques avec des promoteurs conscients de l’intérêt de solliciter l’avis des patients sur la définition des essais réalisés et sur la qualité de vie des participants pendant l’essai. Cette démarche est intéressante : certains freins aux inclusions peuvent en effet être identifiés et les essais peuvent être adaptés aux situations des patients, en les rendant plus « vivables ». Ces nouveaux modes de collaboration entre personnes concernées et acteurs de la recherche participent à l’établissement et au maintien de la confiance collective dans la recherche et dans ses procédures scientifiques. Les comités de relecture se révèlent ainsi une puissante mécanique d’accroissement du partage et de la circulation des données scientifiques entre chercheurs et bénéficiaires. |
Le rôle des comités de relecture de projets de recherches, qu’ils soient associatifs ou institutionnel, a évolué. Ils assoient la légitimité des usagers pour comprendre et évaluer les documents fournis par la recherche afin de les impliquer. Leur reconnaissance par les promoteurs comme étant un acteur incontournable de la mise en place d’une recherche, fait suite à un important travail de co-éducation de l’ensemble des acteurs impliqués : investigateurs, attachés de recherche clinique, etc. Les promoteurs, d’abord frileux à l’idée de soumettre leurs protocoles de recherche à des « non-chercheurs », ont fini par les solliciter pour leurs nouveaux protocoles. Faire appel aux comités de relecture devient ainsi pour eux une évidence ! Les participants, mieux informés, sont davantage en confiance et peuvent ainsi discuter avec l’équipe de recherche, ce qui contribue à un dialogue équilibré. La recherche ne reste plus ce milieu clos et inaccessible. Elle s’ouvre au monde. Les relecteurs se considèrent ainsi comme des passeurs, facilitant la transmission de connaissances scientifiques devenues plus accessibles. Cette place proposée aux membres d’associations depuis plusieurs années, dorénavant acquise dans son principe, continue de se développer. Les patients ont investi ce champ avec pertinence et enthousiasme. De nouveaux comités de patients voient le jour, comme celui de la fondation « Vaincre Alzheimer » créé en 2018. Toutes les maladies peuvent être représentées et d’autres comités verront probablement le jour dans les prochaines années. Cette action, par sa place spécifique, participe à l’expression d’une démocratie en santé qui, parfois encore, peine à être entendue. Elle ouvre aussi la voie vers une co-construction plus efficace et plus équilibrée de travaux de recherche participative, aujourd’hui fortement encouragés par nos instances. Le CPRC, comme le Collège des relecteurs de l’Inserm sont aussi de plus en plus sollicités pour écrire les documents relatant les résultats des recherches cliniques. Transmettre les résultats de façon compréhensible est en effet la dernière étape d’une information fluide et loyale sur la recherche. Cela contribuera à donner plus de visibilité, de transparence et de confiance à l’ensemble de la société civile. |
Footnotes |
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Loi Huriet, 1988, articles L.1121-1 et suivants du Code de la santé publique, relatifs aux recherches impliquant la personne humaine (RIPH) hors essais médicamenteux et dispositifs médicaux. Pour les RIPH essais médicamenteux : règlement EU 536/2014 relatif aux essais cliniques de médicament à usage humain entré en vigueur le 31 janvier 2022. Pour les dispositifs médicaux : règlement EU 2017/745 relatif aux dispositifs médicaux entré en vigueur le 26 mai 2021.
2.
Rapport Belmont 1979.
.
Département de la santé, de l’éducation et des services sociaux des États-Unis.
.
3.
Jaillon
P
,
Demarez
JP
.
L’histoire de la genèse de la loi Huriet-Sérusclat de décembre.
,
1988;
.
Loi sur la protection des personnes qui se prêtent à des recherches biomédicales.
.
Med Sci (Paris).
2008
;
(24)
:
:323.
–
327
.
4.
Enquête menée en 2018 à l’occasion du renouvellement du collège des relecteurs de l’Inserm. Données personnelles présentées lors de la réunion du Gram de mars 2019 et lors de la Journée en l’honneur du renouvellement du Collège des relecteurs de l’Inserm organisée le 24 janvier 2019 à l’Académie de médecine.
|