| |
| Med Sci (Paris). 39(6-7): 551–557. doi: 10.1051/medsci/2023077.Le bien-vieillir en France et dans les pays de l’OCDE Une analyse à partir d’une nouvelle mesure d’âge physiologique Jonathan Sicsic,1,2,3* Jérôme Ronchetti,4 and Thomas Rapp1,2,3 1Université Paris Cité, LIRAES (laboratoire interdisciplinaire de recherche appliquée en économie-gestion et santé)
,
45 rue des Saints-Pères
,
F-75006Paris
,
France 2Chaire « Aging UP ! », université Paris Cité
,
Paris
,
France 3LIEPP (laboratoire interdisciplinaire d’évaluation des politiques publiques), Sciences Po
,
27 rue Saint-Guillaume
,
75337Paris
,
France 4Laboratoire de recherche Magellan (EA 3713), université Lyon 3
,
Lyon
,
France |
Vignette (© DR).
Les projets de réforme des retraites menés par les gouvernements français successifs reposent en grande partie sur l’idée selon laquelle l’augmentation de l’espérance de vie nécessite et justifie un allongement uniforme de la durée de cotisation. En effet, depuis les années 1950, l’espérance de vie à la naissance a augmenté de 15 ans, pour se stabiliser autour de 85 ans pour les femmes et 79 ans pour les hommes en 2022 [
1
]. En théorie, les individus pourraient donc travailler plus longtemps. En réalité, les débats autour de la réforme des retraites de 2023 ont fait ressortir deux enjeux majeurs.
Le premier est relatif au nombre d’années de vie en bonne santé espéré à partir de l’âge de la retraite. Si l’espérance de vie a effectivement augmenté, l’espérance de vie en bonne santé reste, quant à elle, à des niveaux bien plus faibles, et stagne depuis plusieurs années [
2
]. L’espérance de vie en bonne santé, c’est-à-dire le nombre d’années qu’une personne peut compter vivre sans souffrir d’incapacité dans les activités de la vie quotidienne, s’élevait, en 2016, à 64,1 ans pour les femmes et 62,7 ans pour les hommes, des chiffres en stagnation depuis dix ans [
2
]. À partir de 65 ans, les individus peuvent espérer vivre 10,5 années pour les femmes et 9,4 années pour les hommes sans souffrir d’incapacités ou de limitations d’activité.
La seconde préoccupation concerne l’inégale répartition de l’espérance de vie en bonne santé entre les individus. Les inégalités face au vieillissement ont été largement documentées en France [
3
–
5
] (
→
) et dans d’autres pays [
6
,
7
]. Au fondement de ce débat est le constat que l’âge calendaire constitue une mesure imprécise du vieillissement
1
. Les politiques sociales pour lesquelles l’éligibilité des individus à la retraite est fondée sur l’âge calendaire seraient dans ce cas sous-optimales et injustes. Pour être plus efficientes et moins inégalitaires, elles devraient s’appuyer sur des mesures précises du vieillissement et, en particulier, du vieillissement en bonne santé.
(→) Voir le Faits et chiffres de S. Gilgenkrantz
m/s
n° 4, avril 2008, page 415
Dans la littérature internationale, deux grands types de mesures sont utilisées pour analyser l’évolution de l’état de santé des individus [
8
,
9
]. À l’échelle de la population générale, l’espérance de vie en bonne santé fait figure de référence [
10
–
12
]. À l’échelle individuelle, des travaux, plus récents, ont proposé de mesurer un âge « biologique », à partir de biomarqueurs sélectionnés pour représenter un degré de vieillissement cellulaire plus ou moins important [
13
,
14
]. Ces deux familles de mesures comportent des limites. L’espérance de vie en bonne santé est une mesure démographique (c’est-à-dire valable à l’échelle d’une population) mais qui ne permet pas de comprendre les dynamiques et les déterminants individuels du bien-vieillir ni de les capturer entièrement [
15
] (
→
).
(→) Voir l’Éditorial de F. Jusot,
m/s
n° 3, mars 2016, page 231
Les biomarqueurs permettant le calcul d’un âge biologique sont, quant à eux, mesurés à partir de données cliniques qui sont complexes à collecter, qui plus est sur des données de taille limitée, et ne permettant pas des comparaisons inter-individuelles et encore moins des comparaisons internationales. Ces données comportent par ailleurs peu de variables socio-économiques, rendant difficile l’analyse des déterminants individuels et des trajectoires de vieillissement en bonne santé.
Dans une récente étude, parue en 2022 [
16
], nous avions pour objectif de proposer une nouvelle mesure du bien-vieillir, fondée sur le concept d’âge physiologique, qui permettrait des comparaisons individuelles et internationales (c’est-à-dire entre pays, entre systèmes de santé ou de protection sociale). L’originalité de cette approche était triple :
-
les modèles utilisés, fondés économiquement, permettaient d’étudier l’effet de différents marqueurs de vieillissement physiologique sur la santé subjective des individus [
17
,
18
] ;
-
la mesure du bien-vieillir (ou vieillissement en bonne santé) a été conceptualisée comme la différence entre l’âge physiologique et l’âge calendaire (ou chronologique) des individus. Lorsque cette différence est positive, cela signifie que l’individu vieillit plus vite que son rythme chronologique, et donc en moins bonne santé. Lorsque cette différence est négative, cela signifie que l’individu vieillit moins vite que son rythme chronologique, et est donc en meilleure santé ;
-
la mesure d’âge physiologique a été d’abord calculée au niveau individuel, ce qui permet d’en étudier les déterminants socio-économiques, puis ces mêmes déterminants ont été agrégés au niveau de chaque pays afin d’effectuer des comparaisons internationales.
Cette méthode permet ainsi de répondre aux critiques des mesures précédemment utilisées, notamment concernant leur validité externe, car soit trop individuelles, soit trop globales. La mesure de l’âge physiologique permet d’obtenir plusieurs résultats intéressants concernant les déterminants socio-économiques du vieillissement en bonne santé et le classement international des pays en termes de bien-vieillir (ce classement tenant compte de leur hétérogénéité en termes de structure d’âge, notamment). Les résultats de ce type d’analyse pourraient permettre de mieux définir les critères d’accès ou d’éligibilités aux politiques sociales et de santé, majoritairement fondées sur l’âge calendaire, une mesure imprécise du vieillissement. |
Mesure, déterminants et comparaison de l’âge physiologique Les données mobilisées
L’indicateur d’âge physiologique utilisé ici est mesuré à partir de deux sources de données issues d’enquêtes internationales : l’enquête
Health and Retirement Survey
(HRS) [
19
], une cohorte longitudinale de plus de 20 000 individus représentatifs des américains de plus de 50 ans, interrogés tous les deux ans depuis le début des années 1990 ; et l’enquête
Survey of Health, Aging and Retirement in Europe
(SHARE) qui repose également sur une cohorte longitudinale interrogeant tous les deux ans, depuis 2004, des individus européens âgés de plus de 50 ans issus de 28 pays européens [
20
,
21
]. Les analyses qui ont été réalisées dans le cadre de cette synthèse ont été restreintes à la période 2004-2017 (commune aux deux enquêtes, par souci de comparabilité), aux individus âgés entre 60 et 89 ans ayant été sujets à au moins trois observations sur la période considérée
2
. Ces deux enquêtes comprennent des questions très similaires sur des thématiques communes (santé objective et santé déclarée, recours aux soins, vieillissement, revenus et retraites). Après suppression des données manquantes, un échantillon de 39 164 individus (soit 121 705 observations au total, en tenant compte des mesures sur plusieurs périodes) issus de 11 pays européens (l’Espagne, la Grèce, la France, la Belgique, la Suède, la Suisse, les Pays-Bas, l’Italie, l’Autriche, le Danemark, l’Allemagne), d’Israël et des États-Unis, a été examiné. L’analyse a été réalisée à partir des données téléchargeables sur la plateforme
Gateway to Global Aging data
[
22
], ce qui permettait de bénéficier de données harmonisées
3
.
Le cadre conceptuel pour la mesure de l’âge physiologique
Afin de construire cette nouvelle mesure d’âge physiologique, le cadre conceptuel du modèle de Grossman
4,
a été utilisé. Dans ce modèle, la santé est modélisée comme un capital durable qui se déprécie dans le temps à un rythme plus ou moins rapide [
17
,
23
]. Ce rythme est appelé « taux de dépréciation du capital santé » et dépend de facteurs biologiques ou environnementaux ainsi que des comportements des individus (par exemple, en termes de recours aux soins ou de prévention [
24
]). Ainsi, on peut considérer qu’un individu dont le capital santé se déprécie plus vite qu’un autre sera en moins bonne santé à un âge donné : son âge physiologique sera donc plus élevé. À partir de ce modèle, un âge physiologique peut être conçu comme étant le reflet du niveau de perte en capital santé de chaque individu, perte qu’il est nécessaire de pouvoir modéliser. Pour cela, une adaptation économétrique du modèle de Grossman, qui consiste à mesurer la contribution de différentes variables à l’évolution de l’état de santé subjectif des individus, a été appliquée dans la lignée de précédents travaux [
18
,
23
,
25
]. Les pertes de capital santé se mesurent ainsi comme la contribution de ces variables, que l’on appellera « marqueurs du vieillissement physiologique », à l’évolution de l’état de santé de chaque individu. L’algorithme original de calcul de l’âge physiologique est détaillé dans l’
Encadré 1
. Ce modèle de mesure d’âge physiologique est fondé sur quatre principes et hypothèses. Premièrement, l’état de santé subjectif des individus est un indicateur de leur capital santé [
25
,
26
]. Deuxièmement, nous pouvons mesurer la vitesse de dépréciation du capital santé à partir de l’évolution de quatre indicateurs cliniques considérés comme des marqueurs du vieillissement : la fragilité, au sens de Fried [
27
,
28
], les limitations dans les activités quotidiennes (ou ADL pour
activities of daily living
, échelle de Katz [
29
]), les limitations dans les activités instrumentales de la vie quotidienne (ou IADL pour
instrumental activities of daily living
, échelle de Lawton [
30
]), et un score de comorbidités incluant neuf maladies chroniques (voir
Encadré 2
pour une présentation détaillée des différents marqueurs utilisés). Troisièmement, nous pouvons « convertir » l’effet de chacun de ces quatre indicateurs cliniques en termes de vieillissement en comparant leur effet sur la santé par rapport à l’évolution de l’âge [
18
]. Enfin, ce modèle tient compte des variations interculturelles (entre les pays notamment) et inter-individuelles dans le report des niveaux de santé subjectifs grâce à l’estimation de modèles économétriques dynamiques qui capturent l’hétérogénéité et les biais de déclaration d’état de santé [
31
].
|
1. Algorithme de calcul de l’âge physiologique au niveau individuel La méthodologie de calcul de l’âge physiologique suit un procédé en trois étapes.
Étape 1. Mesure de l’effet (« poids ») de chaque marqueur de vieillissement
La contribution de chacun des quatre indicateurs ou marqueurs de vieillissement est mesurée à partir des coefficients estimés d’un modèle de régression dynamique à effets aléatoires ayant comme variable dépendante la santé subjective individuelle auto-déclarée allant de 1 (« mauvaise ») à 5 (« excellente »). Les variables explicatives d’intérêt sont les quatre indicateurs de dépréciation du capital santé (la fragilité, les ALD, les IADL, le score de comorbidité) et l’âge (voir
Encart 2
). Le modèle est ajusté par un indicateur d’état de dépression fondé sur le score EURO-D qui permet de tenir compte des variations de santé subjective liées à la santé mentale, d’effets fixes pays et temporels et de l’état de santé passé permettant de contrôler les chocs de santé inobservés intervenus entre deux vagues d’enquête. Les modèles sont stratifiés par le sexe car nous faisons l’hypothèse que les marqueurs considérés peuvent avoir un effet différent entre les hommes et les femmes.
Étape 2. Calcul du « poids de vieillissement » associé à chaque marqueur
Nous convertissons l’effet de chacun des quatre marqueurs en termes de vieillissement en rapportant le coefficient de l’indicateur considéré au coefficient de l’âge qui résultent du modèle de régression de l’étape 1. Plus le résultat est élevé, plus l’indicateur contribue à la vitesse de dépréciation du capital santé (par rapport à sa vitesse « structurelle » liée à l’évolution de l’âge) et donc plus l’indicateur en question aura de poids dans le calcul de l’âge physiologique. Les « poids de vieillissement » qui en résultent sont reportés dans le
Tableau I.
Ces poids sont différenciés selon les hommes et les femmes.
Étape 3. Calcul de l’âge physiologique
L’âge physiologique (AP) est calculé comme la somme de l’âge calendaire (AC) et du niveau de dépréciation de capital santé. Ce niveau est calculé comme la somme pondérée de la présence
relative
du marqueur de vieillissement
k
pour l’individu
i
de sexe
g
à l’instant
t
(
x
kgit
=1 si présent, 0 sinon) par rapport à la prévalence de cet indicateur sur la population de même tranche d’âge
c
et sexe (c’est-à-dire
x̄
kgc
qui est compris entre 0 et 1). Cette présence relative est pondérée par le poids de vieillissement (par sexe) associé à l’indicateur
k
(
w
k,g
) calculé à l’étape 2. L’âge physiologique est donc calculé au niveau individuel à partir de la formule suivante :
Cette formule utilise trois niveaux d’informations. Les marqueurs du vieillissement physiologique au niveau individuel (variables
x
k
), l’écart de ces marqueurs par rapport aux individus du même âge et sexe (
x̄
kgc
) et le poids de chaque marqueur en termes de vieillissement (
w
k,g
) spécifique à chaque sexe. L’interprétation est intuitive. Un individu aura un âge physiologique prédit d’autant plus élevé (faible) qu’il cumule relativement plus (moins) de marqueurs de vieillissement que les individus de sa cohorte de naissance.
Tableau I.
|
Poids pour les hommes |
Poids pour les femmes |
|
Fragilité
|
4,25 |
3,94 |
|
Limitations des activités de la vie quotidienne (ADL)
|
2,33 |
2,49 |
|
Limitations des activités instrumentales de la vie quotidienne (IADL)
|
1,65 |
2,00 |
|
Indice de comorbidité
|
4,97 |
5,21 |
Poids de vieillissement associé à chaque marqueur.
Devenir fragile a un effet comparable en termes de perte de santé auto-déclarée au fait de vieillir 4,25 années chez les hommes et 3,94 années chez les femmes. Calcul des auteurs d’après les données de la
Gateway to Global Ageing data
(Enquêtes SHARE et HRS), 2004-2017 (d’après [
16
]).
|
|
|
2. Description des marqueurs du vieillissement physiologique Les qutre marqueurs sélectionnés sont définis et calculés à partir des informations détaillées ci-dessous, toutes présentes dans les données SHARE et HRS.
(1) La fragilité
est codée entre 0 (robuste) et 1 (fragile). Cette catégorisation est réalisée en calculant l’indice de fragilité de Fried qui agrège cinq indicateurs binaires (0 représentant l’absence et 1 la présence du critère): la fatigue, la faible force musculaire, la lenteur de marche, l’équilibre, la perte de poids. Le score de fragilité de Fried va donc de 0 à 5. Les individus sont considérés comme fragiles lorsque le score de fragilité est supérieur ou égal à 3.
(2) Les limitations dans les activités quotidiennes (ADL)
rassemblent six critères permettant de mesurer le degré d’indépendance définis par Katz (1970) : être capable de marcher, s’habiller, se laver, manger, se déplacer vers et utiliser les toilettes. Chaque item est codé 1 en cas d’incapacité. Le score ADL va donc théoriquement de 0 (aucune limitation) à 6 (limitations totales).
(3) les limitations dans les activités instrumentales de la vie quotidienne (IADL)
rassemblent cinq critères définis par Lawton et permettant de compléter (affiner) la liste des ADL : être capable d’utiliser les transports, de téléphoner, de payer ou régler ses factures, de faire ses courses et de préparer des repas. Chaque item est codé 1 en cas d’incapacité et donc le score IADL est distribué théoriquement de 0 (aucune limitation) à 5 (limitations complètes).
(4) Le score de comorbidités
est obtenu en faisant la somme pondérée de neuf maladies chroniques diagnostiquées par un médecin (auto-reportées par l’individu) : l’hypertension, le diabète, le cancer, maladie pulmonaire, maladies cardiaques, accident vasculaire cérébral, arthrite, cataracte, cholestérol. Le score pondéré fait la somme des neuf maladies avec comme poids leur effet estimé (standardisé entre 0 et 1) sur l’état de santé subjectif des individus (allant de 0,066 pour le cholestérol à 1 pour le cancer).
|
Écart entre âge calendaire et physiologiquecomme mesure du bien-vieillir
Le niveau de bien-vieillir est déterminé à partir de la différence entre l’âge physiologique et l’âge calendaire des individus. Une différence négative est interprétée comme résultant d’un vieillissement en bonne santé (
healthy aging
) alors qu’une différence positive est synonyme de vieillissement en mauvaise bonne santé (
unhealthy aging
). Quand l’écart est nul, cela signifie que la population « fait son âge ».
Validité interne et externe de la mesure de bien-vieillir
Les groupes qui vieillissent bien (
healthy aging
) et ceux qui vieillissent mal (
unhealthy aging
), définis à partir de la différence entre leur âge physiologique prédit et leur âge calendaire, ont des caractéristiques remarquablement différentes. Comparativement au groupe
unhealthy aging
, les individus qui vieillissent bien (
healthy aging
, 60 % de l’échantillon) ont deux fois plus de chance d’être en bonne santé (80 % déclarent un « bon » ou « très bon » état de santé
vs.
40 % dans le groupe
unhealthy aging
), ont un taux de prévalence de fragilité près de vingt fois plus faible (1,7 %
vs.
33,2 %), ont une prévalence de limitations d’activités de la vie quotidienne (ADL supérieure ou égale à 1) neuf fois inférieure (2,6 %
vs.
24,3 %) et un score de comorbidités trois fois plus faible (0,58
vs.
1,89), ces différences étant statistiquement très significatives. Ces différences se retrouvent également en termes de recours aux soins et plus particulièrement en termes de risque d’hospitalisation, ce taux étant inférieur à 10 % pour le groupe
healthy aging
contre 25 % pour le groupe
unhealthy aging
. Ces résultats attestent de la validité interne de la mesure du bien-vieillir telle qu’elle est utilisée. Pour étudier la validité externe, l’indicateur d’âge physiologique a été recréé à partir des données de l’étude clinique SPRINTT
5
[
32
,
33
], ce qui a permis de montrer que la mesure était très corrélée à une mesure reconstituée d’âge physiologique des personnes, calculée à partir de biomarqueurs du vieillissement utilisés dans la littérature [
14
,
34
]. Ces résultats attestent ainsi de la validité externe de cette mesure d’âge physiologique.
Comparaisons internationales du bien-vieillir
La mesure d’âge physiologique qui a ainsi été élaborée, si elle doit être interprétée avec précaution (car estimée à partir d’un modèle économétrique s’accompagnant d’erreurs de prédiction) est très utile pour les comparaisons internationales du bien-vieillir. En particulier, il est intéressant d’explorer cet écart d’âges pour les individus appartenant à la classe d’âge 70-75 ans. En effet, les données de l’OCDE (Organisation de coopération et de développement économiques) [
8
] montrent qu’en Europe, les problèmes de dépendance se manifestent généralement aux alentours de 75 ans.
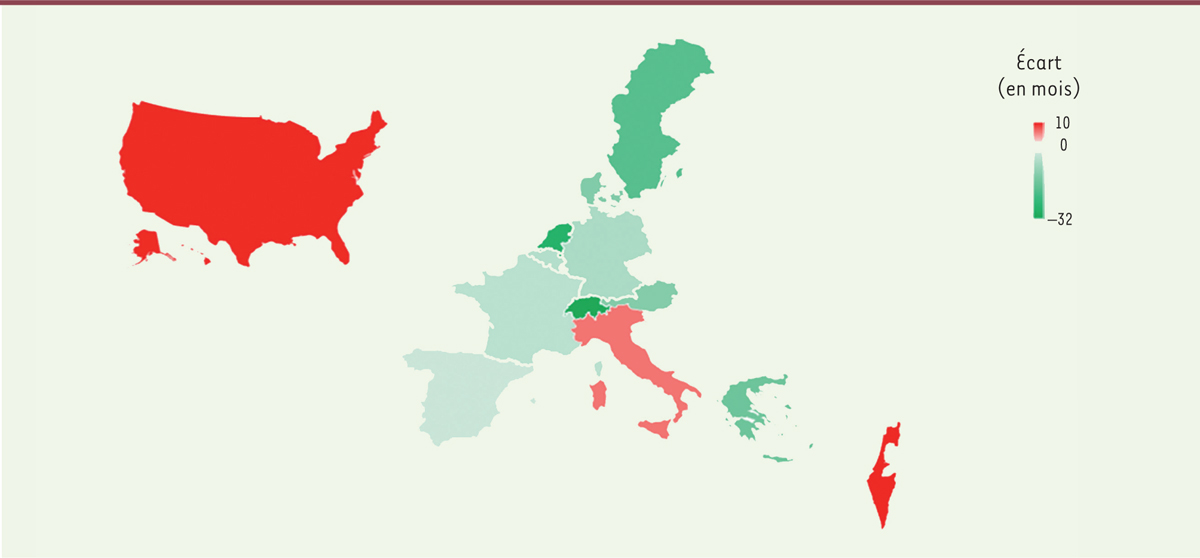
La
Figure 1
représente l’écart entre l’âge calendaire et l’âge physiologique pour les personnes appartenant à la classe d’âge 70-75 ans, dans 11 pays européens. Elle montre qu’il existe une forte hétérogénéité des situations en Europe. On peut en effet distinguer trois ensembles de pays :
-
la Suisse, les pays nordiques (Suède, Danemark), les Pays-Bas, l’Autriche et la Grèce sont des pays dans lesquels les personnes de la classe d’âge 70-75 ans vieillissent bien. Par exemple, les danois sont en moyenne plus jeunes de 16 mois que ce qu’indique leur âge calendaire (en vert foncé sur la figure).
-
les français, les espagnols et les belges « font leur âge » : l’écart entre leur âge calendaire et leur âge physiologique est proche de zéro (en vert clair sur la figure).
-
les états-uniens, les italiens et les israéliens semblent plus mal vieillir que leurs voisins européens : par exemple, les italiens sont en moyenne 10 mois plus vieux que ce qu’indique leur âge calendaire (en rouge sur la figure).
 | Figure 1.
Écart moyen entre âge calendaire et âge physiologique observé en Europe, aux États-Unis et en Israël chez les 70-75 ans.
Plus la couleur est foncée et plus l’écart (
intensity gap
) entre l’âge calendaire et l’âge physiologique est grand. Dans les pays en vert, l’écart est négatif (les aînés vieillissent bien). Dans les pays en blancs, l’écart est nul (les aînés font leur âge). Dans les pays en rouge, l’écart est positif (les aînés vieillissent mal) (selon [
16
], calcul des auteurs d’après les données harmonisées de la
Gateway to Global Aging
).
|
L’écart observé entre l’âge calendaire et l’âge physiologique pour les individus de la classe d’âge 70-75 ans s’explique notamment par l’existence d’un gradient économique fort dans les trajectoires de perte d’autonomie. Il existe en effet une corrélation positive entre l’écart d’âges calendaire/physiologique et des variables socio-économiques, comme le revenu, l’éducation et le statut marital. Ces corrélations confirment les résultats obtenus dans plusieurs travaux [
7
,
35
,
36
] qui montrent que les risques de fragilité sont plus élevés chez les individus les plus pauvres, les moins éduqués et chez les personnes isolées.
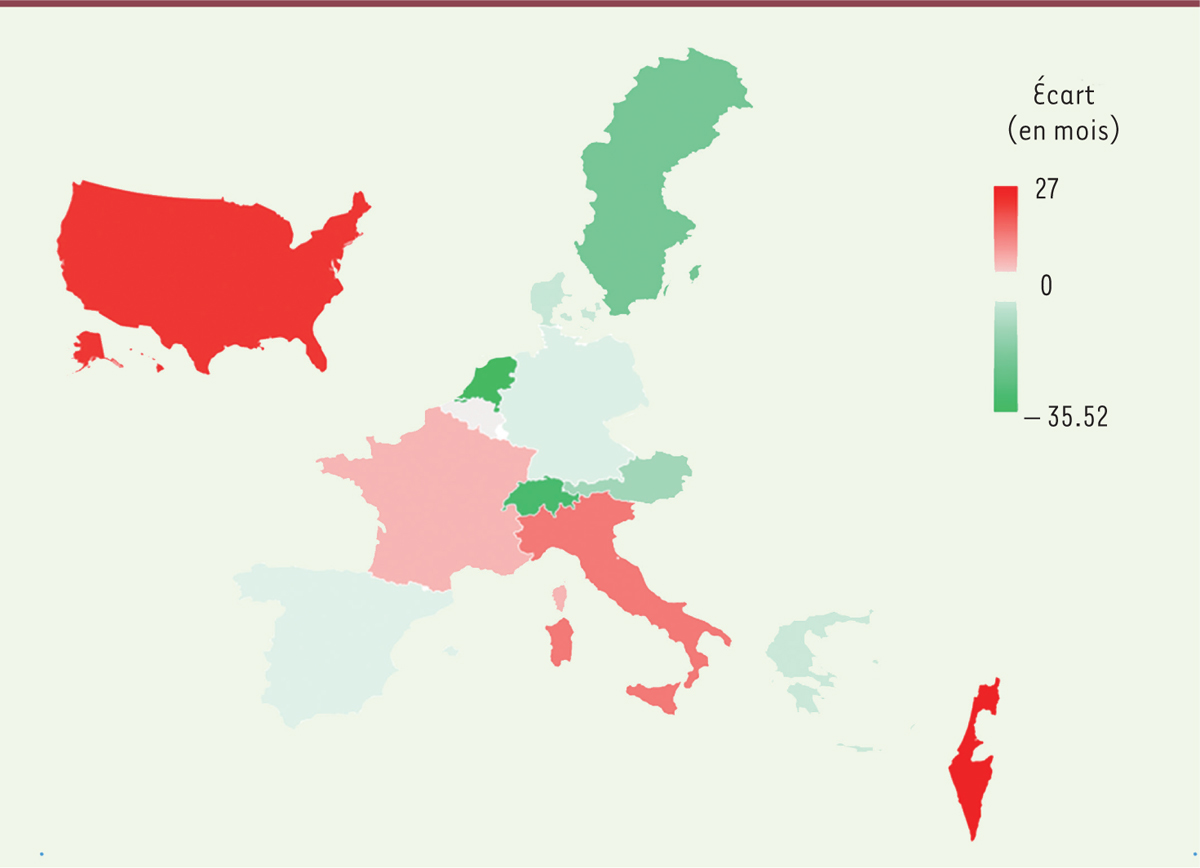
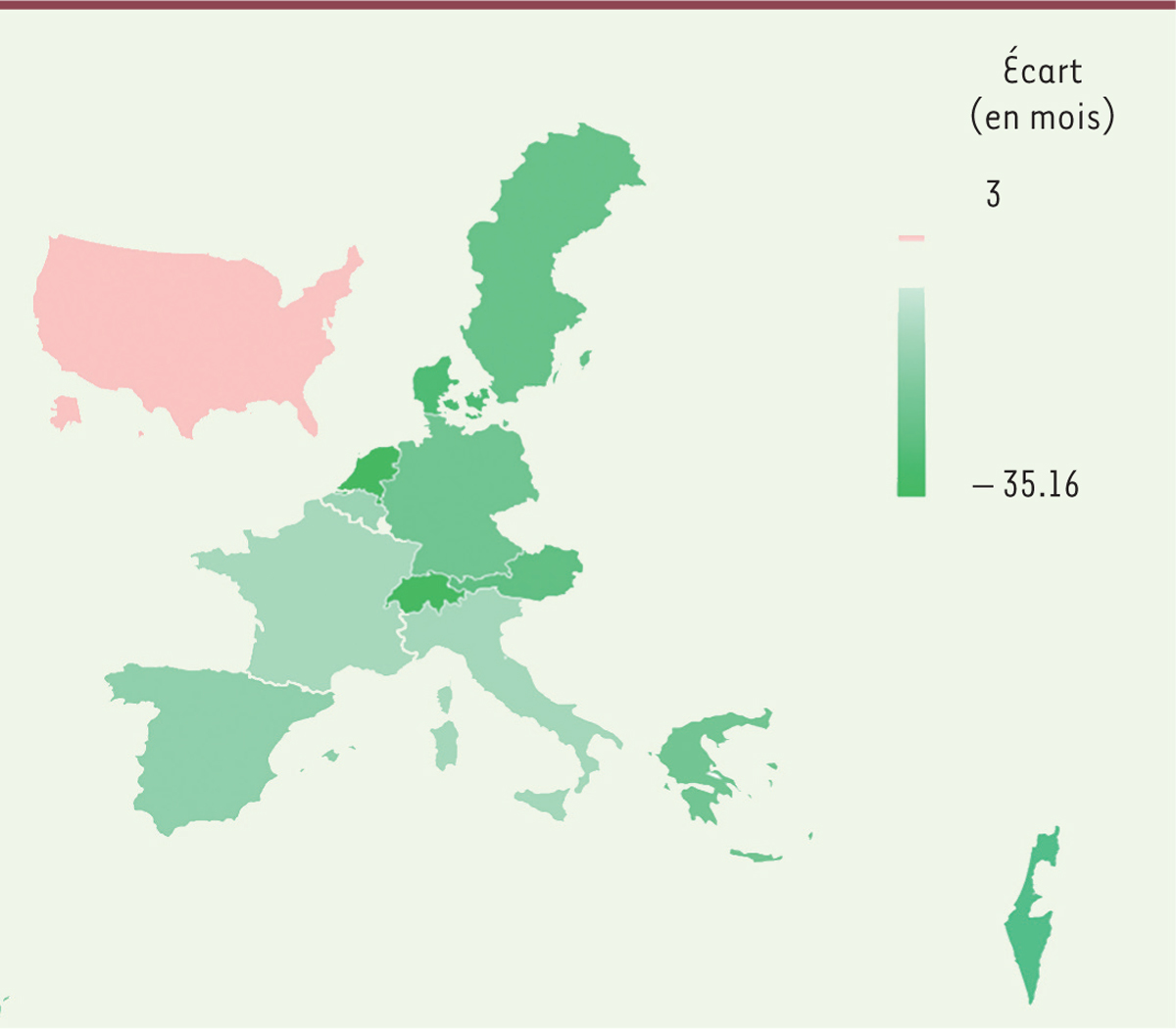
Les
Figures 2
et
3
permettent d’illustrer l’existence de ce gradient pour les aînés de la classe d’âge 70-75 ans. Elles décrivent la situation pour les individus les plus pauvres et les plus riches (qui appartiennent respectivement au quartile de richesse le plus faible et le plus élevé). L’écart entre les âges calendaire et physiologique est plus marqué chez les individus les plus pauvres que chez les individus les plus riches. La
Figure 2
montre en effet que les plus pauvres vieillissent mal dans les pays comme la France (écart de + 4,2 mois entre les âges physiologique et calendaire), alors qu’ils vieillissent plutôt bien dans les pays nordiques (Suède, Danemark), les Pays Bas, la Suisse et l’Autriche (écart négatif). La
Figure 3
montre que dans tous les pays, les individus les plus riches vieillissent bien. Ces résultats confirment ainsi la présence d’une forte inégalité face au vieillissement dans des pays comme la France, les États-Unis ou l’Italie, des inégalités peu observées dans les pays nordiques.
 | Figure 2.
Écart moyen entre âge calendaire et âge physiologique parmi les 25 % les plus pauvres des 70-75 ans.
Plus la couleur est foncée et plus l’écart (
intensity gap
) entre l’âge calendaire et l’âge physiologique est grand. Dans les pays en vert, l’écart est négatif (les aînés vieillissent bien). Dans les pays en blancs, l’écart est nul (les aînés font leur âge). Dans les pays en rouge, l’écart est positif (les aînés vieillissent mal) (selon [
16
], calcul des auteurs d’après les données harmonisées de la
Gateway to Global Aging
).
|
 | Figure 3.
Écart moyen entre âge calendaire et âge physiologique parmi les 25 % les plus riches des 70-75 ans.
Plus la couleur est foncée et plus l’écart (
intensity gap
) entre l’âge calendaire et l’âge physiologique est grand. Dans les pays en vert, l’écart est négatif (les aînés vieillissent bien). Dans les pays en blancs, l’écart est nul (les aînés font leur âge). Dans les pays en rouge, l’écart est positif (les aînés vieillissent mal) (selon [
16
], calcul des auteurs d’après les données harmonisées de la
Gateway to Global Aging
).
|
|
Dans cette synthèse, nous montrons que l’approche que nous avons suivie permet de mesurer et de comparer le vieillissement en bonne santé à partir de résultats d’enquêtes internationales. Ce travail apporte ainsi trois contributions : une mesure originale du bien-vieillir, réplicable dans les enquêtes nationales ou internationales sur le vieillissement, avec des résultats comparés obtenus dans 13 pays de l’OCDE. En particulier, il est montré que si les Français vieillissent physiologiquement (en moyenne) au même rythme que leur âge calendaire, les disparités socio-économiques semblent plus marquées que chez nos voisins européens, le vieillissement est donc plus inégalitaire. Cette hétérogénéité pourrait en partie s’expliquer par la générosité des aides publiques pour la perte d’autonomie, qui diffère fortement selon les pays. Un rapport récent de l’OCDE [
37
] souligne qu’en France, l’allocation personnalisée d’autonomie n’est pas assez généreuse pour financer les besoins des individus les moins riches quand ils vivent à leur domicile, et lorsque leur perte d’autonomie augmente. La générosité des aides pour les plus pauvres est plus élevée dans les pays nordiques, des pays dans lesquels les dépenses de dépendance sont les plus élevées au monde. Ces pays ont entrepris avec succès plusieurs réformes et ont développé une approche centrée sur les besoins des personnes, en proposant, par exemple, des aides publiques généreuses visant à la ré-autonomisation des personnes en situation de perte d’autonomie. Le rôle du capital humain, financier et social, dans les trajectoires de vieillissement en bonne santé, apparaît essentiel.
Il semble nécessaire que ces différentes observations puissent être prises en considération, notamment dans le cadre de débats concernant l’accès aux politiques sociales,
a fortiori
lorsqu’elles sont fondées sur l’âge, comme les retraites. Les critères d’éligibilité aux différents programmes et aides publiques devraient prendre en compte l’âge « véritable » des individus, c’est-à-dire l’âge physiologique et non l’âge calendaire.
Nous proposons ainsi une mesure fiable qui peut être répliquée à partir d’enquêtes reposant sur des auto-questionnaires garantissant son applicabilité « en routine ». Les travaux futurs pourraient s’intéresser aux effets des comportements individuels (notamment en termes de prévention) et des politiques publiques (générosité des aides) sur les trajectoires de vieillissement en bonne santé en considérant cette nouvelle mesure. |
Footnotes |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Papon
S
.
Bilan démographique 2021.
.
Insee Prem.
2022
.
2.
Moisy
M
.
Les Français vivent plus longtemps, mais leur espérance de vie en bonne santé reste stable.
.
Dir Rech Études Lévaluation Stat.
2018
.
3.
Fontaine
R
,
Pennec
S
.
Les inégalités sociales dans la vieillesse.
.
Gérontologie Société.
2020;
;
42
/
(162)
:
:19.
–
36
.
4.
Cambois
E
,
Jusot
F
. Ampleur, tendance et causes des inégalités sociales de santé et de mortalité en Europe : une revue des études comparatives. Numéro thématique. Les inégalités sociales de santé en France en
2006;
:
éléments de l’état des lieux.
.
Bull Epidemiol Hebd.
2007
;
:10.
–
14
.
5.
Gilgenkrantz
S.
Les inégalités sociales face à la mortalité et aux incapacités.
.
Med Sci (Paris).
2008;
;
24
:
:415.
–
418
.
6.
Feinstein
JS
The relationship between socioeconomic status and health: a review of the literature.
.
Milbank Q.
1993;
;
71
:
:279.
–
322
.
7.
Arrighi
Y
,
Rapp
T
,
Sirven
N
.
The impact of economic conditions on the disablement process: A Markov transition approach using SHARE data.
.
Health Policy Amst Neth.
2017;
;
121
:
:778.
–
785
.
8.
OECD.
.
Health at a Glance 2021: OECD Indicators.
.
Paris:
:
Organisation for Economic Co-operation and Development;
,
2021
.
9.
Chatterji
S
,
Byles
J
,
Cutler
D
,
et al.
Health, functioning and disability in older adults – current status and future implications.
.
Lancet.
2015;
;
385
:
:563.
–
575
.
10.
Räsänen
P
,
Roine
E
,
Sintonen
H
,
et al.
Use of quality-adjusted life years for the estimation of effectiveness of health care: A systematic literature review.
.
Int J Technol Assess Health Care.
2006;
;
22
:
:235.
–
241
.
11.
Polinder
S
,
Haagsma
JA
,
Stein
C
,
et al.
Systematic review of general burden of disease studies using disability-adjusted life years.
.
Popul Health Metr.
2012;
;
10
:
:21.
.
12.
Vos
T
,
Lim
SS
,
Abbafati
C
,
et al
.
Global burden of 369 diseases and injuries in 204 countries and territories, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019.
.
Lancet.
2020;
;
396
:
:1204.
–
22
.
13.
Belsky
DW
,
Caspi
A
,
Houts
R
,
et al.
Quantification of biological aging in young adults.
.
Proc Natl Acad Sci U S A.
2015;
;
112
:
:E4104.
–
E4110
.
14.
Jia
L
,
Zhang
W
,
Chen
X
.
Common methods of biological age estimation.
.
Clin Interv Aging.
2017;
;
12
:
:759.
–
772
.
15.
Jusot
F.
L’évolution favorable de l’espérance de vie correspond-elle à une augmentation du bien-être lié à la santé ?
.
Med Sci (Paris).
2016;
;
32
:
:231.
–
232
.
16.
Rapp
T
,
Ronchetti
J
,
Sicsic
J
.
Where Are Populations Aging Better? A Global Comparison of Healthy Aging Across Organization for Economic Cooperation and Development Countries.
.
Value Health J Int Soc Pharmacoeconomics Outcomes Res.
2022;
;
25
:
:1520.
–
7
.
17.
Grossman
M.
On the Concept of Health Capital and the Demand for Health.
.
J Polit Econ.
1972;
;
80
:
:223.
–
255
.
18.
Ravesteijn
B
,
van Kippersluis
H
,
van Doorslaer
E
.
The wear and tear on health: What is the role of occupation?
.
Health Econ.
2018;
;
27
:
:e69.
–
e86
.
19.
Juster
FT
,
Suzman
R
.
An Overview of the Health and Retirement Study.
.
J Hum Resour.
1995;
;
30
:
:S7.
–
S56
.
20.
The SHARE sampling procedures and calibrated design weights. The survey of health, aging, and retirement in europe-methodology.
.
Mannheim Research Institute for the Economics of Aging (MEA);
:
Börsch-Supan
A
,
Jürges
J
,
2005
: pp.
:28.
–
69
.
21.
Sicsic
J
,
Rapp
T
.
Frailty transitions and health care use in Europe.
.
Health Serv Res.
2019;
;
54
:
:1305.
–
1315
.
22.
Lee
J
,
Phillips
D
,
Wilkens
J
,
et al.
Cross-Country Comparisons of Disability and Morbidity: Evidence from the Gateway to Global Aging Data.
.
J Gerontol A Biol Sci Med Sci.
2018;
;
73
:
:1519.
–
1524
.
23.
Wagstaff
A.
The demand for health: An empirical reformulation of the Grossman model.
.
Health Econ.
1993;
;
2
:
:189.
–
198
.
24.
Kenkel
DS
.
The demand for preventive medical care.
.
Appl Econ.
1994;
;
26
:
:313.
–
325
.
25.
Contoyannis
P
,
Jones
AM
,
Rice
N
.
The dynamics of health in the British Household Panel Survey.
.
J Appl Econom.
2004;
;
19
:
:473.
–
503
.
26.
Rapp
T
,
Ronchetti
J
,
Sicsic
J
.
Are long-term care jobs harmful? Evidence from Germany.
.
Eur J Health Econ Health Econ Prev Care.
2021;
;
22
:
:749.
–
71
.
27.
Fried
LP
,
Tangen
CM
,
Walston
J
,
et al.
Frailty in older adults: evidence for a phenotype.
.
J Gerontol A Biol Sci Med Sci.
2001;
;
56
:
:M146.
–
M156
.
28.
Fried
LP
,
Ferrucci
L
,
Darer
J
,
et al.
Untangling the concepts of disability, frailty, and comorbidity: implications for improved targeting and care.
.
J Gerontol A Biol Sci Med Sci.
2004;
;
59
:
:255.
–
263
.
29.
Katz
S
,
Downs
TD
,
Cash
HR
,
et al.
Progress in development of the index of ADL.
.
The Gerontologist.
1970;
;
10
:
:20.
–
30
.
30.
Graf
C.
The Lawton Instrumental Activities of Daily Living Scale.
.
AJN Am J Nurs.
2008;
;
108
:
:52.
.
31.
Jürges
H.
True health vs response styles: Exploring cross-country differences in self-reported health.
.
Health Econ.
2007;
;
16
:
:163.
–
178
.
32.
Bernabei
R
,
Landi
F
,
Calvani
R
,
et al
.
Multicomponent intervention to prevent mobility disability in frail older adults: randomised controlled trial (SPRINTT project).
.
BMJ.
2022;
;
377
:
:e068788.
.
33.
Landi
F
,
Cesari
M
,
Calvani
R
,
et al.
The “Sarcopenia and Physical fRailty IN older people: multi-componenT Treatment strategies” (SPRINTT) randomized controlled trial: design and methods.
.
Aging Clin Exp Res.
2017;
;
29
:
:89.
–
100
.
34.
Levine
ME
.
Modeling the rate of senescence: can estimated biological age predict mortality more accurately than chronological age?
.
J Gerontol A Biol Sci Med Sci.
2013;
;
68
:
:667.
–
674
.
35.
Sirven
N
,
Dumontet
M
,
Rapp
T
.
The dynamics of frailty and change in socio-economic conditions: evidence for the 65+ in Europe.
.
Eur J Public Health.
2020;
;
30
:
:715.
–
9
.
36.
Davies
K
,
Maharani
A
,
Chandola
T
,
et al
.
The longitudinal relationship between loneliness, social isolation, and frailty in older adults in England: a prospective analysis.
.
Lancet Healthy Longev.
.
2021;
;
2
:
:e70.
–
7
.
37.
Hashiguchi
TCO
,
Llena-Nozal
A
.
The effectiveness of social protection for long-term care in old age: Is social protection reducing the risk of poverty associated with care needs?
Paris:
:
OCDE;
,
2020
.
|