| |
| Med Sci (Paris). 39(6-7): 544–550. doi: 10.1051/medsci/2023079.Les oscillations harmoniques des rythmes circadiens sortent de l’ombre Michèle Teboul1* and Franck Delaunay1 1Université Côte d’Azur, CNRS, Inserm, institut de biologie Valrose (iBV)
,
Nice
,
France |
Vignette (© Hélène Duez).
Les phénomènes périodiques sont omniprésents dans la nature et sont observés sur une immense plage de périodes, allant de quelques millisecondes pour les potentiels d’action des neurones jusqu’à plusieurs années pour les oscillations du système océan-atmosphère. Dans le monde vivant, de nombreuses fonctions oscillent avec une période d’environ vingt-quatre heures, grâce à un mécanisme endogène, appelé horloge circadienne (du latin
circa
, environ et
diem
, le jour), dont le rôle est de synchroniser la physiologie et le comportement des organismes avec l’alternance jour/nuit résultant de la rotation de la terre sur son axe [
1
]. Cette horloge, déjà présente chez les cyanobactéries, est essentielle chez les organismes complexes, comme les mammifères, pour coordonner temporellement leurs cycles comportementaux veille/sommeil, activité/repos et alimentation/jeûne au cours des vingt-quatre heures. Cette horloge procure également aux espèces un avantage adaptatif [
2
,
3
]. Le cœur de l’horloge circadienne est constitué d’un réseau de gènes « horloge » formant des boucles de rétroaction transcriptionnelles et post-traductionnelles et capables d’osciller avec une période d’environ vingt-quatre heures même en l’absence de signal rythmique externe. Chez les mammifères, on trouve une multitude d’oscillateurs organisés hiérarchiquement sous la forme d’une horloge centrale, située dans les noyaux suprachiasmatiques de l’hypothalamus, et d’horloges périphériques, présentes dans toutes les autres cellules de l’organisme.
L’horloge centrale est synchronisée chaque jour par la lumière
via
le tractus rétino-hypothalamique. Elle synchronise, en retour, les horloges périphériques
via
des signaux nerveux, endocrines, métaboliques, et la variation de la température corporelle [
4
,
5
] (
→
).
(→)Voir la Nouvelle de M. Teboul et F. Delaunay,
m/s
n° 8-9, août-septembre 2012, page 689
L’intégrité du système circadien est importante pour la santé. Lorsqu’il est perturbé, par exemple par le travail nocturne ou les décalages horaires chroniques, le risque de développer des maladies, telles que les cancers ou les maladies métaboliques comme l’obésité, le diabète de type 2 et les stéatopathies non alcooliques (NAFLD), augmente [
6
-
8
]. Réciproquement, de nombreuses maladies perturbent le système circadien, conduisant potentiellement à un cercle vicieux. Ces perturbations peuvent se traduire par une perte de rythmicité d’expression de certains gènes, une atténuation de leur amplitude, un déphasage, ou des oscillations
de novo
de gènes qui sont arythmiques en situation physiologique [
9
-
12
].
La compréhension de l’impact physiologique de la régulation circadienne a beaucoup progressé grâce aux approches de transcriptomique, de protéomique, de phosphoprotéomique et de métabolomique, qui ont révélé qu’un grand nombre de processus sont régulés par l’horloge circadienne avec une spécificité tissulaire très marquée [
13
-
15
]. L’analyse de 12 tissus chez la souris a ainsi permis d’estimer qu’environ 43 % du transcriptome avait une expression circadienne [
13
]. En reconstituant le transcriptome circadien chez l’homme, à partir de 46 tissus prélevés post-mortem, l’équipe de Félix Naef, à l’École polytechnique fédérale de Lausanne, en Suisse, a récemment révélé que plusieurs dizaines à plusieurs centaines de gènes sont rythmiques dans chacun de ces tissus [
16
]. Parmi tous les jeux de données accumulés ces vingt dernières années, un grand nombre montre que beaucoup d’ARN et de protéines rythmiques ont une acrophase (le moment où le maximum d’intensité du rythme apparaît) aux transitions jour/nuit ou nuit/jour [
13
,
16
-
19
]. Étonnamment, en échantillonnant le foie de souris toutes les heures pendant 48 h, le laboratoire de John Hogenesch, à l’université de Pennsylvanie, aux États-Unis, a découvert, en parallèle des 3 667 transcrits circadiens, 260 transcrits oscillant avec une période de 12 heures et 63 transcrits ayant une période de 8 h [
20
]. Cette rythmicité de 12 h est aussi observée dans le foie et l’ovaire humains [
16
]. Ces oscillations harmoniques de la période circadienne de vingt-quatre heures sont restées très mal comprises jusqu’à ce que Zhu
et al.
réanalysent récemment ce jeu de données exceptionnel avec un outil statistique mieux adapté à la détection de périodes non prédéfinies et commencent à décrypter le mécanisme sous-jacent [
21
,
22
] (→).
(→) Voir la Nouvelle de M. Teboul et F. Delaunay,
m/s
n° 1, janvier 2018, page 30
|
De nombreux gènes oscillentavec une période de douze heures
Contrairement aux méthodes classiquement utilisées en chronobiologie
1,
, qui ne peuvent détecter qu’une oscillation dominante avec une valeur de période prédéfinie, la méthode
eigenvalue
/
pencil
2
utilisée par Zhu
et al.
a l’avantage de pouvoir identifier des oscillations de périodicités multiples non prédéfinies et de faible amplitude. Il devient ainsi possible d’identifier, par exemple, des rythmes de 6h, 8h ou 12 heures qui ont échappé aux analyses précédentes car masqués par les oscillations de 24 h de plus grande amplitude (
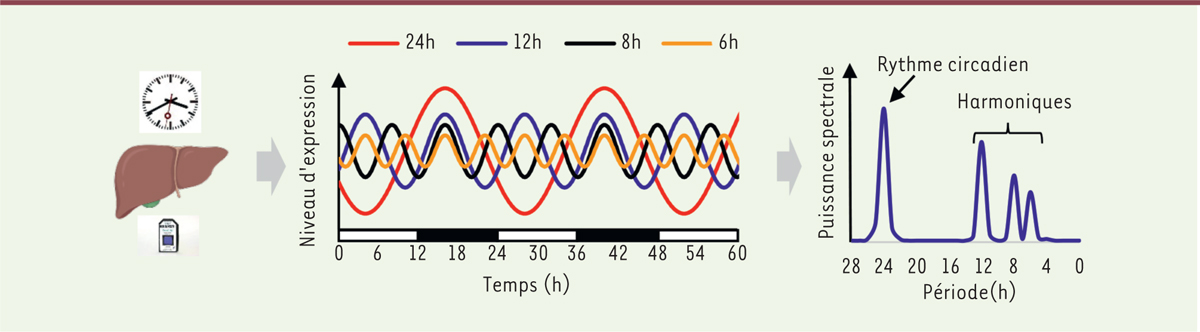
Figure 1
). Cependant, cette sensibilité accrue est obtenue au détriment de la puissance statistique, ce qui nécessite la validation des oscillations par d’autres méthodes comme RAIN (
rhythmicity analysis incorporating nonparametric
) [
23
,
24
]. Cette nouvelle approche a néanmoins permis d’identifier environ 3 600 transcrits présentant une oscillation de 12 h. Ce nombre élevé a été confirmé par l’analyse d’autres jeux de données, qui ont, de plus, révélé que près de la moitié de ces gènes avaient un rythme dominant de 12 heures [
25
,
26
]. Une expérience indépendante utilisant la méthode RAIN en prédéfinissant une période de 10 à 14 h a confirmé ces chiffres dans le foie de souris [
27
]. Ces cribles d’expression ont aussi révélé des amplitudes plus faibles pour les oscillations de 12 heures, en comparaison des oscillations circadiennes de 24 h. Les deux pics journaliers des transcrits oscillant avec une période de 12h sont situés préférentiellement aux transitions jour/nuit et nuit/jour et coïncident donc temporellement avec les pics de nombreux transcrits circadiens. Ces oscillations ultradiennes sont également observées au niveau protéique, avec, en particulier, 20 à 30 % du protéome hépatique présentant une rythmicité de 12 h. Comme dans le cas des oscillations circadiennes, le chevauchement avec le transcriptome reste limité (environ 35 %) traduisant l’importance des mécanismes post-transcriptionnels et post-traductionnels [
28
,
29
].
 | Figure 1.
Les multiples rythmicités du transcriptome hépatique.
L’analyse du transcriptome, dans le foie de souris, combinant un échantillonnage à une haute résolution temporelle (1 point/heure) et la méthode d’analyse du signal
eigenvalue/pencil
, permettent d’identifier plusieurs périodicités superposées pour un grand nombre de transcrits. Les barres blanches et noires représentent respectivement les phases lumineuses et obscures.
|
La découverte d’oscillations de 12 heures pour un grand nombre de gènes est intriguante et soulève beaucoup de questions : quelles fonctions sont régulées par cette rythmicité ? Par quels mécanismes cette rythmicité de 12 heures est-elle générée ? Est-elle liée à l’oscillateur circadien ? Ces rythmes de 12 heures sont-ils universels ? Ces oscillations sont-elles altérées dans le cas de maladies ? Des travaux récents commencent à apporter des réponses. |
Des processus cellulaires fondamentaux et ubiquitaires oscillent avec une période de douze heures
L’analyse ontologique des processus biologiques associés aux gènes dont l’expression oscille avec une période de 12 heures a montré un enrichissement des transcrits impliqués dans des mécanismes fondamentaux et ubiquitaires, tels que la régulation de la transcription basale, la maturation, l’épissage et l’export des ARN messagers (ARNm), la biogenèse des ribosomes, l’initiation de la traduction, le trafic des protéines dans le réticulum endoplasmique (RE) et l’appareil de Golgi, ainsi que des gènes impliqués dans la synthèse des purines, des pyrimidines et des hexoamines [
25
].
Parmi ces processus fondamentaux, l’étude de la protéostase a permis de commencer à lever le voile sur les mécanismes de cette rythmicité ultradienne. En effet, des oscillations d’expression de 12 heures ont été mises en évidence pour un groupe de 130 gènes impliqués dans la réponse UPR (
unfolded protein response
), déclenchée lors de la réponse au stress du RE [
21
,
22
]. Lorsque les protéines mal repliées s’accumulent, la protéine membranaire du RE, IRE1α (
inositol-requiring transmembrane kinase/endoribonuclease 1
α), induit l’épissage non conventionnel du préARNm
Xbp1
(
X-box binding protein 1
)
(
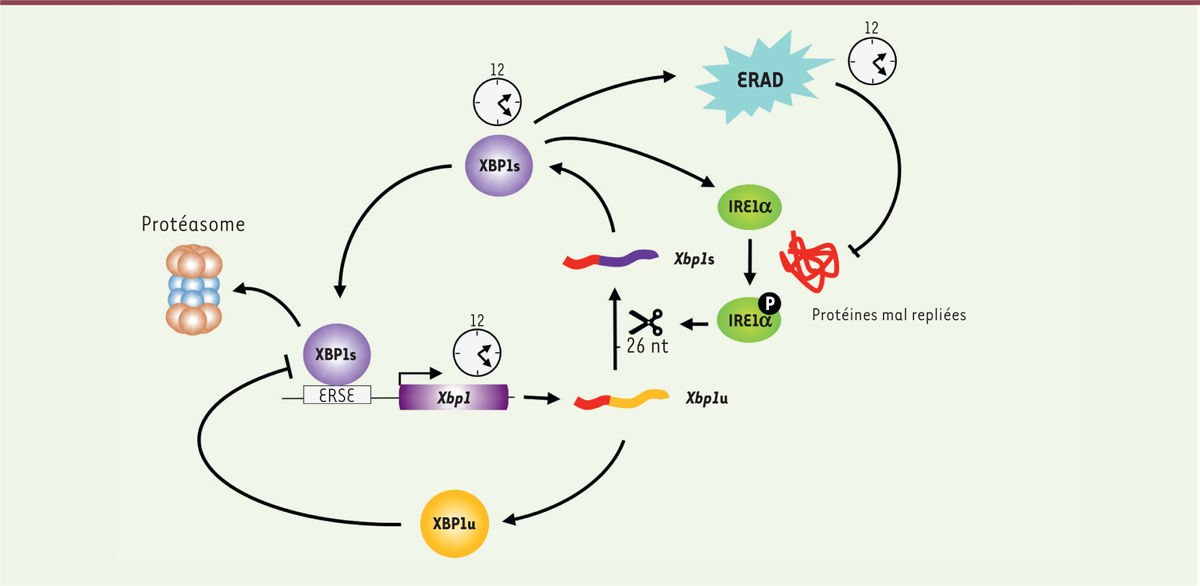
Figure 2
)
qui, au lieu de produire la protéine instable XBP1u, permet la traduction d’un variant appelé XBP1s (« s » pour
spliced
, épissé) [
30
,
31
] (→).
(→) Voir la Synthèse de F. Foufelle et P. Ferré, m/s n° 3, mars 2007, page 291
 | Figure 2.
Modèle de l’oscillateur XBP1.
Le gène
Xbp1
produit l’ARNm Xbp1u qui est traduit en protéine XBP1u ou qui peut être épissé et être alors traduit en protéine XBP1s, par un mécanisme dépendant de la protéine du stress du réticulum endoplasmique IRE1α. Cet épissage non conventionnel provoque la délétion de 26 nucléotides (nt) et conduit à un changement du cadre de lecture. XBP1s est un activateur transcriptionnel de son propre gène et des gènes de dégradation des protéines ERAD (
endoplasmic reticulum-associated degradation
). XBPu inhibe XBP1s en stimulant sa dégradation par le protéasome. XBP1 :
X-box binding protein 1
; ERSE : réponse au stress du réticulum endoplasmique ; IRE1α :
inositol-requiring transmembrane kinase/endoribonuclease 1
α.
|
La protéine XBP1s est un facteur de transcription oscillant avec une période de 12 heures, qui régule les gènes impliqués dans la réponse UPR, ainsi que ceux dont les produits participent au métabolisme lipidique [
32
]. La fonction de XBPu est d’entraîner la dégradation de XBP1s en l’absence de réponse UPR et de réguler d’autres fonctions indépendantes du stress du RE [
21
,
26
,
33
] (→).
(→) Voir la Synthèse de D. Vallée et al., m/s n° 2, février 2020, page 119
Plus de 200 gènes codant des protéines impliquées dans le métabolisme lipidique présentent un rythme de 12 h. Notons que parmi les gènes cibles de XBP1s, on trouve
LPCAT3
(
lysophosphatidylcholine acyltransferase 3
) qui code une acyltransférase favorisant l’incorporation d’acides gras polyinsaturés dans les phospholipides, ce qui augmente la fluidité membranaire et réduit ainsi le stress du RE. D’autres gènes de la lipogenèse, tels que
SCD1
(
stearoyl-CoA desaturase 1
),
DGAT2
(
diacylglycerol O-acyltransferase 2
) et
ACC2
(
acetyl-CoA carboxylase beta
)
,
sont aussi des cibles de XBP1s.
L’invalidation du gène
Xbp1
dans le foie de souris, amortit le rythme de 12 heures de LPCAT3 et réduit fortement la fluidité membranaire [
33
]. À l’âge de 20 semaines, bien que nourries avec un régime équilibré, ces souris développent une stéatose hépatique et une hyperinsulinémie, évoluant vers un diabète de type 2 à l’âge de 50 semaines [
26
]. Comme l’altération de la rythmicité de 12 heures précède la stéatose, elle n’en est pas la conséquence et pourrait au contraire contribuer au développement de la maladie. Peu d’informations concernent le rôle de la rythmicité de 12 heures chez l’homme. Néanmoins une diminution de l’expression des gènes oscillant avec une période de 12 heures est aussi associée à la progression de la stéatose hépatique et de la stéatohépatite non alcoolique [
21
].
|
Les rythmes de douze heures seraient-ils des marqueurs de la santé mentale ?
Très récemment, Scott
et al.
ont déterminé que, chez l’homme, 6 % des transcrits oscillent avec une période de 12 heures dans le cortex préfrontal dorsolatéral (CPDL), une région impliquée dans la cognition. Sur les 819 transcrits présentant un rythme de 12 heures, 620 sont communs avec ceux oscillant dans le foie de souris !
Alors que dans le foie de souris, les pics d’expression sont observés aux transitions jour/nuit et nuit/jour, dans le CPDL, on observe deux groupes de transcrits : l’un avec des transcrits présentant des pics en début de journée (9 h) ou de nuit (21 h), qui ont un enrichissement en lien avec les fonctions mitochondriales et le protéasome ; l’autre avec des transcrits présentant des pics en milieu de journée (15 h) et de nuit (3 h), codant des protéines impliquées dans le cytosquelette et la signalisation calcique [
34
]. Les auteurs de cette étude ont également montré que les patients atteints de schizophrénie présentaient une diminution du nombre de transcrits oscillant avec une période de 12 heures, en particulier ceux codant des protéines impliquées dans la réponse UPR, un déphasage de 6 h des oscillations des transcrits codant des protéines impliquées dans les fonctions mitochondriales, et des oscillations circadiennes
de novo
de transcrits codant des protéines également impliquées dans les fonctions mitochondriales. Ces observations sont cohérentes avec le fait que la schizophrénie est associée à une dysfonction mitochondriale.
|
L’oscillateur moléculaire de douze heures se dévoile
Alors que le mécanisme moléculaire de l’horloge circadienne est désormais relativement bien compris, celui régissant la rythmicité de 12 heures reste en grande partie à élucider. On sait qu’il est indépendant de l’oscillateur circadien, puisque, chez les souris dont le gène horloge
Bmal1
(
basic helix-loop-helix ARNT like 1
)
3,
a été invalidé, la plupart des oscillations de 12 heures persistent, alors que les rythmes circadiens sont abolis, comme nous pouvions nous y attendre [
21
]. Inversement, la perte de la rythmicité de 12 heures observée chez les souris dont le gène
Xbp1
a été invalidé n’a pas d’effet sur le transcriptome circadien. Se pose donc la question de l’existence d’un oscillateur moléculaire de 12 heures, comme on en connaît pour l’horloge somitique et les voies de signalisation associées à TP53 (
tumor protein 53
) et à NF-κB (
nuclear factor-kappa B
) [
35
]. Comme pour l’oscillateur de l’horloge circadienne, la clé de voûte de tous ces oscillateurs ultradiens est une boucle d’autorégulation négative dans laquelle un bras positif active un bras négatif inhibiteur du bras positif. Par analogie avec l’oscillateur circadien, on peut s’attendre à ce que l’oscillateur de 12 heures possède une période d’approximativement 12 heures en libre cours, qu’il soit synchronisé par des signaux externes, fonctionne à l’échelle cellulaire et repose sur une boucle d’autorégulation négative.
Conformément à ces prédictions, lorsque des cellules hépatocytaires MMHD3 (
Met mouse hepatocytes D3
) sont synchronisées par un choc de sérum
4,
, ou que des fibroblastes embryonnaires de souris sont soumis à une privation de sérum ou à un traitement avec de la tunicamycine, une fraction de leur transcriptome oscille avec une période de 12 heures [
21
,
25
]. Le facteur de transcription XBP1s est un rouage important de cet oscillateur de 12 heures [
25
,
26
]. L’invalidation du gène
Xbp1
dans le foie de souris altère en effet l’expression de la majorité des gènes oscillant avec une période de 12 heures (55 % deviennent arythmiques et 32 % voient leur amplitude diminuée). Cependant, seuls 550 gènes des 3 600 gènes présentant une oscillation de 12 heures, fixent XBP1s dans leur promoteur, ce qui indique qu’une grande partie du transcriptome oscillant avec une période de 12 heures est régulée indirectement par XBP1s, probablement
via
d’autres facteurs de transcription, comme dans le cas de l’oscillateur circadien.
Le modèle actuellement proposé par Zhu
et al.
est celui d’une boucle d’autorégulation négative dans laquelle l’oscillation de XBP1s est générée par l’action inhibitrice de XBPu, tandis que XBP1s autorégule positivement sa propre expression (
Figure 2
). Cette boucle « XBP1 » implique le coactivateur SRC-3 (
nuclear receptor coactivator 3
), qui est recruté sur les sites où se fixe XBP1s, avec une occupation maximale toutes les 12 heures dans le foie de souris. L’invalidation de
SRC-3
chez la souris conduit à la perte de rythmicité de 75 % des gènes oscillant avec une période de 12 heures dans le foie, 26 % des gènes présentant une oscillation dominante de 12 heures étant sous le contrôle de SRC-3 [
27
]. Les gènes dont la rythmicité de 12 heures dépend de SRC-3 sont impliqués dans les processus de maturation et le trafic des protéines dans le RE, le catabolisme des ARNm, l’organisation de la membrane mitochondriale, ainsi que dans le métabolisme des lipides, des acides aminés et des glucides. Les lipides hépatiques présentent des oscillations de 24 h mais aussi de 12 heures et 80 % de ces derniers perdent leur rythmicité chez les souris dont le gène codant SRC-3 est invalidé [
27
]. Un autre rouage important de l’oscillateur XBP1s semble être SON, une protéine d’échafaudage des
speckles
, des corps nucléaires stockant les facteurs d’épissage des pré-ARNm. SON augmente la fluidité des
speckles
et leur interaction avec la chromatine, ce qui accroît l’expression des ARNm et leur maturation. L’oscillateur XBP1 induit une rythmicité de 12 heures de SON, avec, pour conséquence, des oscillations de l’expression de nombreux gènes de la protéostase et du métabolisme lipidique [
29
] (
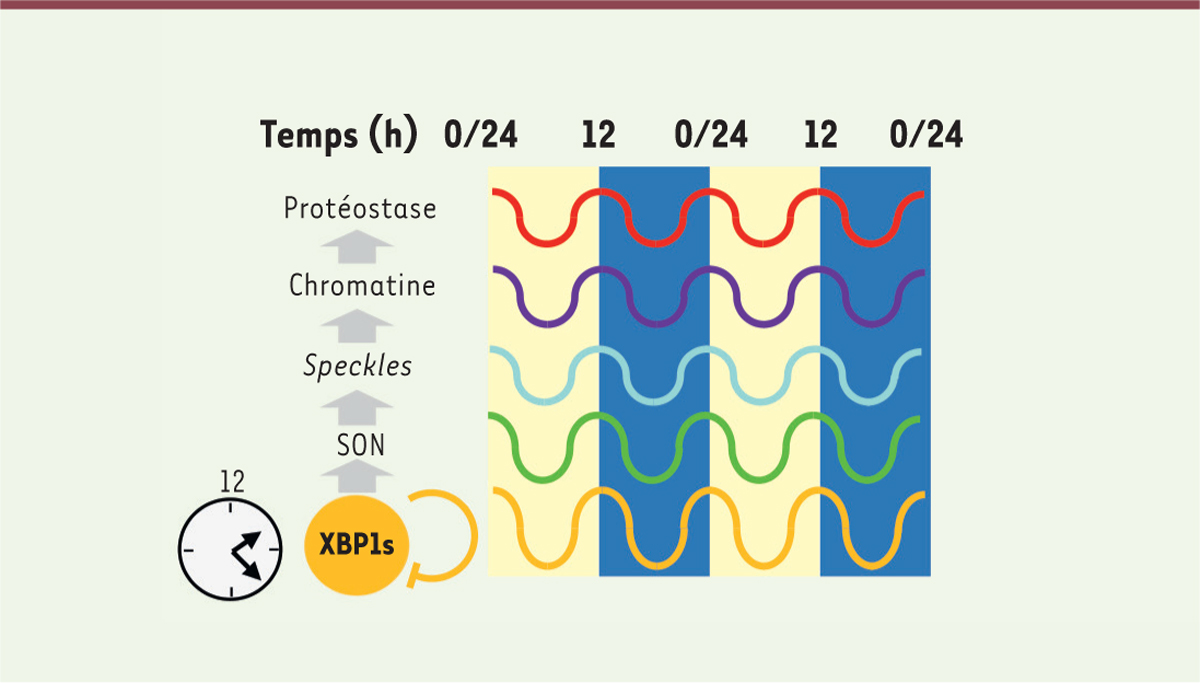
Figure 3
). L’expression de SON est inversement proportionnelle à la formation d’agrégats protéiques dans le RE, et sa surexpression augmente l’expression de XBP1s, ce qui suggère l’existence d’une boucle de rétrocontrôle positive entre XBP1s et SON. Le puzzle moléculaire de l’oscillateur de 12 h commence ainsi à s’assembler, mais comme pour tous les autres oscillateurs connus, des travaux de modélisation mathématique seront indispensables pour comprendre sa dynamique et ses propriétés quantitatives [
35
].
 | Figure 3.
Modèle de coordination de l’expression des gènes de la protéostase par l’oscillateur XBP1.
L’oscillation de 12 heures de XBP1s entraîne celle de SON qui induit à son tour un rythme de la fluidité des
speckles
et de leur interaction avec la chromatine, conduisant à une oscillation de l’expression des gènes de la protéostase. Sur un cycle de 24 h, les temps 0/24h et 12 heures correspondent respectivement aux transitions nuit/jour et jour/nuit. Les zones claires et sombres représentent respectivement les phases lumineuses et obscures. XBP1 :
X-box binding protein 1
.
|
|
L’oscillateur de douze heures, un rôle encore hypothétique chez les mammifères
L’avantage adaptatif d’une rythmicité de 12 heures est facilement compréhensible chez les organismes soumis aux marées semi-diurnes, mais son rôle chez les mammifères est moins intuitif. Curieusement, la comparaison du transcriptome de 12 heures, entre des organismes soumis au rythme des marées et la souris, révèle des gènes communs qui sont impliqués dans des fonctions fondamentales, telles que l’épissage des ARN, la synthèse, la maturation et l’export des protéines, dont XBP1 et SON [
25
]. Il est d’ailleurs remarquable que l’on retrouve les mêmes gènes oscillant avec une période de 12 heures dans différents organes et organismes, alors que les gènes circadiens semblent beaucoup plus spécifiques, puisque seuls un petit nombre d’entre eux sont communs à tous les organes [
13
]. La fonction de cette rythmicité de 12 heures chez les mammifères reste inconnue, mais on peut supposer qu’elle aurait un rôle dans les deux transitions journalières entre les phases de sommeil-repos-jeûne et éveil-activité-alimentation qui nécessitent des basculements métaboliques bien plus importants qu’à d’autres moments de la journée. C’est en effet à ces deux moments que l’on trouve préférentiellement les acrophases de transcrits et des protéines circadiennes.
|
Les oscillations de huit et douze heures sont des harmoniques du rythme circadien
Les oscillations ultradiennes de 6 h à 12 heures semblent être systématiquement des diviseurs de la période circadienne (20 à 28 h) comme le sont les harmoniques d’une onde sonore. Par exemple, les cellules de la lignée hépatocytaire MMHD3 présentent une période circadienne de 21,6 h, mais également des rythmes de période 10,8 et 7,3 h [
25
]. De même, si on soumet l’ascomycète
Neurospora crassa
à une alternance de 11 h de jour et 11 h d’obscurité, on observera des rythmes de 22 h, de 11 h et de 7 h [
36
]. Dans le foie de souris, les oscillations de 8 heures, qui nécessitent un pas d’échantillonnage d’une heure maximum pour être détectées, sont les troisièmes plus fréquentes, après celles de 24 h et celles de 12 heures [
37
]. Plus de 3 000 transcrits oscillent avec une période de 8 heures, période dominante pour 1 000 d’entre eux. L’analyse de ces derniers montre un enrichissement de transcrits impliqués dans les voies de signalisation du protéasome, des ribosomes, et de la phosphorylation oxydante. Des métabolites, tels que des acides aminés, et des intermédiaires du cycle de Krebs, oscillent aussi avec une période de 8 heures [
38
]. Ces rythmes de 8 heures ont une origine endogène puisqu’ils peuvent également être observés dans de simples cultures cellulaires, hors d’un contexte organisé [
25
]. Comme pour les oscillations de 12 heures, les rythmes de 8 heures sont indépendants de l’horloge circadienne. Ils persistent dans des cellules dans lesquelles le gène de l’horloge circadienne
Bmal1
est inhibé [
38
].
|
Les rythmes ultradiens de huit et douze heures, une vieille histoire ?
La durée de la rotation de la terre sur son axe n’a pas toujours été de 24 h et les géophysiciens proposent que la période de rotation de la terre sur son axe pourrait avoir été aussi courte que 6 h il y a 4 milliards d’années (Ga) [
39
]. Des travaux de modélisation récents ont reconstitué la dynamique d’augmentation de cette période jusqu’à la valeur de 24 h que l’on connaît à l’époque actuelle. Les résultats des simulations montrent qu’il y a 3,5 Ga, cette période était proche de 12 heures, puis a augmenté jusqu’à environ 21 h, au moment du précambrien. La période actuelle de 24 h date des derniers 500 millions d’années.
La vie est donc apparue dans un environnement rythmique mais dont la période était sans doute bien inférieure à 24 h. La périodicité circadienne a donc considérablement évolué au cours de l’évolution. Il est tentant de spéculer que les oscillations de 8 heures et 12 heures que l’on observe chez les espèces contemporaines proviennent de mécanismes adaptatifs ancestraux qui ont perduré et interagissent avec d’autres oscillateurs cellulaires, comme celui de l’horloge circadienne actuelle de 24 h, interaction facilitée par la possibilité de résonnance entre les différentes harmoniques. Cette origine primitive est cohérente avec la régulation de processus fondamentaux, comme l’expression génique et le stress cellulaire. Les gènes oscillant avec une période de 12 heures ou de 8 heures semblent plus anciens que ceux oscillant avec une période de 24 h [
40
]. Ceux qui oscillent avec une période de 8 heures sont impliqués dans le stress oxydant et la synthèse des stérols, des processus consommateurs d’oxygène. Les fossiles de roches sédimentaires contiennent des stéranes, suggérant l’existence d’une biosynthèse des stérols au Paléoprotérozoïque (-2,5 à -1,6 Ga), période marquée par l’augmentation du taux d’oxygène et l’apparition concomitante du stress oxydant [
41
]. La conservation évolutive des oscillations de 8-12 h pourrait aussi être liée à l’émergence précoce d’un mécanisme d’adaptation au cycle des marées de l’océan primitif.
|
Au cours de ces vingt dernières années, l’étude mécanistique des rythmes biologiques a porté principalement sur les rythmes circadiens. La découverte récente des rythmes de douze et huit heures suscite de nombreuses interrogations et relance la chasse aux gènes horloges. Il semble que là encore, le principe de boucle moléculaire d’autorégulation négative impliquant des facteurs de transcription soit à l’œuvre, au moins pour les oscillations de douze heures. Beaucoup reste à découvrir pour comprendre les détails des mécanismes moléculaires en jeu, leur importance physiologique et les éventuelles conséquences de leurs perturbations lors des maladies. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Patke
A
,
Young
MW
,
Axelrod
S
.
Molecular mechanisms and physiological importance of circadian rhythms.
.
Nat Rev Mol Cell Biol.
2020;
;
21
:
:67.
–
84
.
2.
Woelfle
MA
,
Ouyang
Y
,
Phanvijhitsiri
K
,
et al.
The adaptive value of circadian clocks: an experimental assessment in cyanobacteria.
.
Curr Biol.
2004;
;
14
:
:1481.
–
1486
.
3.
DeCoursey
PJ
,
Walker
JK
,
Smith
SA
.
A circadian pacemaker in free-living chipmunks: essential for survival?
.
J Comp Physiol A.
2000;
;
186
:
:169.
–
180
.
4.
Teboul
M
,
Delaunay
F
.
Les récepteurs REVERBα et REVERBβ donnent le tempo.
.
Med Sci (Paris).
2012;
;
28
:
:689.
–
692
.
5.
Bass
J
,
Lazar
MA
.
Circadian time signatures of fitness and disease.
.
Science.
2016;
;
354
:
:994.
–
999
.
6.
Shafi
AA
,
Knudsen
KE
.
Cancer and the Circadian Clock.
.
Cancer Res.
2019;
;
79
:
:3806.
–
3814
.
7.
Mukherji
A
,
Dachraoui
M
,
Baumert
TF
.
Perturbation of the circadian clock and pathogenesis of NAFLD.
.
Metabolism.
2020;
;
111S
:
:154337.
.
8.
Allada
R
,
Bass
J
.
Circadian Mechanisms in Medicine.
.
N Engl J Med.
2021;
;
384
:
:550.
–
61
.
9.
Gaucher
J
,
Kinouchi
K
,
Ceglia
N
,
et al.
Distinct metabolic adaptation of liver circadian pathways to acute and chronic patterns of alcohol intake.
.
Proc Natl Acad Sci U S A.
2019;
;
116
:
:25250.
–
25259
.
10.
Poolman
TM
,
Gibbs
J
,
Walker
AL
,
et al.
Rheumatoid arthritis reprograms circadian output pathways.
.
Arthritis Res Ther.
2019;
;
21
:
:47.
.
11.
Masri
S
,
Papagiannakopoulos
T
,
Kinouchi
K
,
et al.
Lung Adenocarcinoma Distally Rewires Hepatic Circadian Homeostasis.
.
Cell.
2016;
;
165
:
:896.
–
909
.
12.
Leclère
PS
,
Rousseau
D
,
Patouraux
S
,
et al.
MCD diet-induced steatohepatitis generates a diurnal rhythm of associated biomarkers and worsens liver injury in Klf10 deficient mice.
.
Sci Rep.
2020;
;
10
:
:12139.
.
13.
Zhang
R
,
Lahens
NF
,
Ballance
HI
,
et al.
A circadian gene expression atlas in mammals: implications for biology and medicine.
.
Proc Natl Acad Sci U S A.
2014;
;
111
:
:16219.
–
16224
.
14.
Robles
MS
,
Cox
J
,
Mann
M
.
In-vivo quantitative proteomics reveals a key contribution of post-transcriptional mechanisms to the circadian regulation of liver metabolism.
.
PLoS Genet.
2014;
;
10
:
:e1004047.
.
15.
Robles
MS
,
Humphrey
SJ
,
Mann
M
.
Phosphorylation Is a Central Mechanism for Circadian Control of Metabolism and Physiology.
.
Cell Metab.
2017;
;
25
:
:118.
–
127
.
16.
Talamanca
L
,
Gobet
C
,
Naef
F
.
Sex-dimorphic and age-dependent organization of 24-hour gene expression rhythms in humans.
.
Science.
2023;
;
379
:
:478.
–
83
.
17.
Ruberto
AA
,
Gréchez-Cassiau
A
,
Guérin
S
,
et al.
KLF10 integrates circadian timing and sugar signaling to coordinate hepatic metabolism.
.
Elife.
2021;
;
10
:
:e65574.
.
18.
Storch
K-F
,
Lipan
O
,
Leykin
I
,
et al.
Extensive and divergent circadian gene expression in liver and heart.
.
Nature.
2002;
;
417
:
:78.
–
83
.
19.
Panda
S
,
Antoch
MP
,
Miller
BH
,
et al.
Coordinated Transcription of Key Pathways in the Mouse by the Circadian Clock.
.
Cell.
2002;
;
109
:
:307.
–
320
.
20.
Hughes
ME
,
DiTacchio
L
,
Hayes
KR
,
et al.
Harmonics of Circadian Gene Transcription in Mammals.
.
PLOS Genetics.
2009;
;
5
:
:e1000442.
.
21.
Zhu
B
,
Zhang
Q
,
Pan
Y
,
et al.
A Cell-Autonomous Mammalian 12 hr Clock Coordinates Metabolic and Stress Rhythms.
.
Cell Metab.
2017;
;
25
:
:1305.
–
19.e9
22.
Teboul
M
,
Delaunay
F
.
Horloges biologiques — Un rythme peut en cacher un autre.
.
Med Sci (Paris).
2018;
;
34
:
:30.
–
33
.
23.
Hughes
ME
,
Hogenesch
JB
,
Kornacker
K
.
JTK_CYCLE: an efficient nonparametric algorithm for detecting rhythmic components in genome-scale data sets.
.
J Biol Rhythms.
2010;
;
25
:
:372.
–
380
.
24.
Thaben
PF
,
Westermark
PO
.
Detecting rhythms in time series with RAIN.
.
J Biol Rhythms.
2014;
;
29
:
:391.
–
400
.
25.
Pan
Y
,
Ballance
H
,
Meng
H
,
et al.
12-h clock regulation of genetic information flow by XBP1s.
.
PLoS Biol.
2020;
;
18
:
:e3000580.
.
26.
Meng
H
,
Gonzales
NM
,
Lonard
DM
,
et al.
XBP1 links the 12-hour clock to NAFLD and regulation of membrane fluidity and lipid homeostasis.
.
Nat Commun.
2020;
;
11
:
:6215.
.
27.
Meng
H
,
Gonzales
NM
,
Jung
SY
,
et al.
Defining the mammalian coactivation of hepatic 12-h clock and lipid metabolism.
.
Cell Rep.
2022;
;
38
:
:110491.
.
28.
Mauvoisin
D
,
Gachon
F
.
Proteomics in Circadian Biology.
.
J Mol Biol.
2020;
;
432
:
:3565.
–
77
.
29.
Dion
W
,
Ballance
H
,
Lee
J
,
et al.
Four-dimensional nuclear speckle phase separation dynamics regulate proteostasis.
.
Sci Adv.
2022;
;
8
:
:eabl4150.
.
30.
Luo
X
,
Alfason
L
,
Wei
M
,
et al.
Spliced or Unspliced, That Is the Question: The Biological Roles of XBP1 Isoforms in Pathophysiology.
.
Int J Mol Sci.
2022;
;
23
:
:2746.
.
31.
Foufelle
F
,
Ferré
P
.
La réponse UPR - Son rôle physiologique et physiopathologique.
.
Med Sci (Paris).
2007;
;
23
:
:291.
–
296
.
32.
Sriburi
R
,
Jackowski
S
,
Mori
K
,
et al.
XBP1: a link between the unfolded protein response, lipid biosynthesis, and biogenesis of the endoplasmic reticulum.
.
J Cell Biol.
2004;
;
167
:
:35.
–
41
.
33.
Vallée
D
,
Blanc
M
,
Lebeaupin
C
,
et al.
La réponse au stress du réticulum endoplasmique dans la physiopathologie des maladies chroniques du foie.
.
Med Sci (Paris).
2020;
;
36
:
:119.
–
29
.
34.
Scott
MR
,
Zong
W
,
Ketchesin
KD
,
et al.
Twelve-hour rhythms in transcript expression within the human dorsolateral prefrontal cortex are altered in schizophrenia.
.
PLOS Biology.
2023;
;
21
:
:e3001688.
.
35.
Mengel
B
,
Hunziker
A
,
Pedersen
L
,
et al.
Modeling oscillatory control in NF-κB, p53 and Wnt signaling.
.
Curr Opin Genet Dev.
2010;
;
20
:
:656.
–
664
.
36.
Ananthasubramaniam
B
,
Diernfellner
A
,
Brunner
M
,
et al.
Ultradian Rhythms in the Transcriptome of Neurospora crassa.
.
iScience.
2018;
;
9
:
:475.
–
86
.
37.
Hughes
ME
,
DiTacchio
L
,
Hayes
KR
,
et al.
Harmonics of circadian gene transcription in mammals.
.
PLoS Genet.
2009;
;
5
:
:e1000442.
.
38.
Krishnaiah
SY
,
Wu
G
,
Altman
BJ
,
et al.
Clock Regulation of Metabolites Reveals Coupling between Transcription and Metabolism.
.
Cell Metab.
2017;
;
25
:
:961.
–
74.e4
.
39.
Klatt
JM
,
Chennu
A
,
Arbic
BK
,
et al.
Possible link between Earth’s rotation rate and oxygenation.
.
Nat. Geosci.
2021;
;
14
:
:564.
–
70
.
40.
Castellana
S
,
Mazza
T
,
Capocefalo
D
,
et al.
Systematic Analysis of Mouse Genome Reveals Distinct Evolutionary and Functional Properties Among Circadian and Ultradian Genes.
.
Front Physiol.
2018;
;
9
:
:1178.
.
41.
Gold
DA
,
Caron
A
,
Fournier
GP
,
et al.
Paleoproterozoic sterol biosynthesis and the rise of oxygen.
.
Nature.
2017;
;
543
:
:420.
–
423
.
|