| |
| Med Sci (Paris). 39(6-7): 537–543. doi: 10.1051/medsci/2023082.Les neurones contactant le liquide cérébrospinal Une intégration sensorielle polymodale Claire Wyart1* 1Sorbonne université, Inserm U1127, UMR CNRS 7225, institut du cerveau (ICM)
,
47 boulevard de l’Hôpital
,
75013Paris
,
France |
Vignette (© Headquarter)
Le liquide cérébrospinal circule dans les ventricules cérébraux, au niveau du canal central au centre de la moelle épinière, et dans les espaces sous-arachnoïdiens entourant le système nerveux central. Ce liquide assure le transport de biomolécules essentielles à la neurogenèse dans le cerveau, ainsi que l’élimination des déchets toxiques et des métabolites pendant le sommeil. Le liquide cérébrospinal est produit à partir du plasma par l’épithélium des plexus choroïdes qui régit sa composition [
1
,
2
] en coordination avec d’autres structures dispersées dans le cerveau et la moelle épinière, telles que la glande pinéale, l’organe sous-commissural [
3
] ou les neurones de contact [
4
] (
Figure 1
). L’organe sous-commissural (SCO, pour
subcommissural organ
) sécrète en particulier la SCO-spondine, une glycoprotéine qui, en se polymérisant, forme la fibre de Reissner, une fibre protéique qui s’étend du troisième ventricule, au centre du cerveau, à l’extrémité caudale du canal central, dans la moelle épinière [
5
]. Bien que cette fibre ait été découverte en 1860, son rôle est resté inconnu avant que des modèles génétiques de perte de fonction ne permettent d’élucider ses fonctions [
6
-
8
]. Une question centrale se pose : du fait que le liquide cérébrospinal contient des substances neuroactives qui peuvent agir à longue distance, peut-il servir de voie de communication avec des neurones distants, voire même,
via
la circulation lymphatique et sanguine, agir sur d’autres cellules distribuées dans l’organisme ?
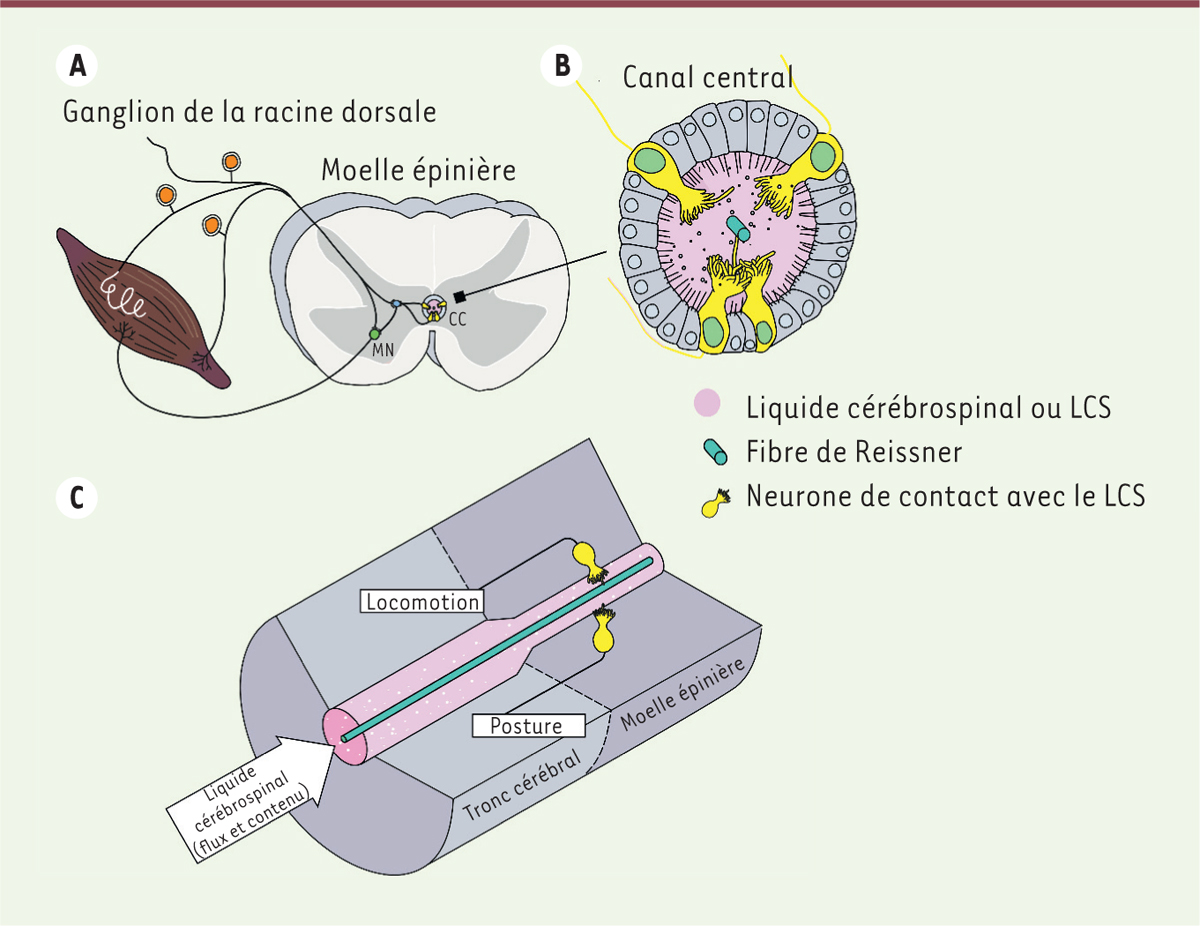
 | Figure 1.
Les neurones de contact avec le liquide cérébrospinal tapissent les parois du canal central où ils sont très proches de la fibre de Reissner. A.
Le canal central (CC) permet la circulation du liquide cérébrospinal (LCS) au sein de la moelle épinière, confinée dans la colonne vertébrale. Alors que l’emphase du contrôle sensoriel rétroactif a focalisé sur les circuits périphériques impliquant les neurones de la racine dorsale, les neurones de contact (en jaune) sont des cellules sensorielles localisées dans la moelle épinière elle-même, qui appartiennent au système nerveux central.
B
. Les neurones de contact dans la moelle épinière (en jaune) se logent entre les cellules épendymaires et se caractérisent par une extension apicale qui baigne dans le liquide cérébrospinal et est, chez les poissons, la lamproie, les rongeurs et les macaques, proche de la fibre de Reissner (en vert).
C.
Les neurones de contact détectent des changements du contenu ou du flux du liquide cérébrospinal
via
leur interaction avec la fibre de Reissner et modulent, en réponse, la locomotion et la posture (llustrations © Headquarter, Paris, France).
|
Récemment, le rôle majeur de neurones ciliés, en contact avec le liquide cérébrospinal (CSF-cN, pour
cerebrospinal fluid-contacting neurons
) dans le canal central, a été révélé. Ces neurones atypiques agissent comme des mécanorécepteurs ainsi que comme des chémorécepteurs. D’une part, ils détectent en effet la courbure de la colonne vertébrale [
9
,
10
], grâce à leur couplage avec la fibre de Reissner [
11
]. D’autre part, ils détectent les changements du contenu chimique du liquide cérébrospinal [
12
-
14
] et en régulent sa composition
via
une neurosécrétion active [
15
-
17
]. En réponse à ces modifications chimiques, ils libèrent des neurotransmetteurs qui agissent sur les circuits neuronaux locaux [
18
-
20
], mais aussi des neuropeptides et des protéines qui peuvent agir sur des cibles situées à longue distance, telles que les muscles squelettiques [
21
-
23
].
|
Les neurones en contact avec le liquide cérébrospinal
Les neurones de contact avec le liquide cérébrospinal s’immiscent entre les cellules épendymaires qui entourent le canal central, à proximité immédiate de la fibre de Reissner [
4
] (
Figure 1
). Leur pôle apical a une particularité : il présente une extension formée de nombreuses microvillosités, constituées d’actine et d’un cil composé de microtubules, qui baignent dans le liquide cérébrospinal, au sein du canal central [
10
]. La structure tridimensionnelle de ces microvillosités diffère selon les espèces. Néanmoins, cette extension apicale se caractérise par une architecture particulière, formée d’un col allongé de nature dendritique, reliant le corps cellulaire au pôle apical du neurone. Ce col est riche en récepteur canal PKD2L1 (
polycystic kidney disease 2-like 1
) [
12
,
24
], un canal cationique non sélectif, initialement étudié dans les cellules du goût chez la souris [
12
]. Dans les neurones de contact spinaux, ce récepteur canal est associé à la protéine transmembranaire PKD1L2, qui modulerait son activité [
25
]. Les neurones de contact expriment également d’autres récepteurs, des récepteurs de neurotransmetteurs, mais aussi de neuromodulateurs ou de peptides qui circulent dans le liquide cérébrospinal [
17
].
|
Modulation GABAergique et peptidergique des cibles neuronales et neurosécrétion à longue distance
Chez le macaque, la souris et le poisson zèbre, les neurones de contact spinaux sont de nature inhibitrice [
24
,
35
,
36
]. Chez le poisson zèbre comme chez la souris, ils ont une double origine développementale et sont associés à un positionnement, relatif au canal central, soit ventral, soit dorsolatéral [
35
,
36
]. L’examen attentif de l’ultrastructure de ces neurones a révélé la présence de vésicules claires, contenant de l’acide gamma-aminobutyrique (GABA), et de nombreuses autres granules de sécrétion à cœur dense [
15
,
35
,
36
]. Les neurones de contact ventraux et dorsolatéraux expriment différents peptides et neuromodulateurs, tels que la somatostatine [
17
,
33
] (pour une revue, voir [
36
]) ou les peptides de la famille de l’urotensine-II [
16
,
21
,
36
]. Chez les mammifères, ils expriment l’enzyme décarboxylase des acides aminés aromatiques (AADC), sans toutefois produire de sérotonine ni de dopamine [
37
,
38
], indiquant la possible production d’amines traces
1
, du peptide opioïde Met-Enk-Arg-Gly-Leu (méthionine-enképhaline-arginine-glycine-leucine) [
39
], et du peptide vasointestinal (VIP) [
40
]. Par ailleurs, la localisation de granules de sécrétion à cœur dense, sous l’extension apicale des neurones de contact, suggère une probable libération par ces neurones, dans le liquide cérébrospinal, de composés qui leur permettent d’agir à grande distance. Chez les larves de poisson zèbre, et plus récemment chez la souris, le marquage de neurones de contact isolés a révélé que leur axone s’étendait rostralement (en direction du rostre, du crâne) et ipsilatéralement (du même côté) dans la moelle épinière ventrale [
18
,
27
,
34
], et, pour les cellules les plus rostrales, vers le tronc cérébral [
20
].
Outre leur rôle dans la régulation des réponses neuronales, les neurones de contact ont également un rôle modulateur de la locomotion. Celui-là repose sur la libération par ces neurones de médiateurs comme le GABA [
18
] ou la somatostatine [
33
]. Une cartographie de la connectivité des neurones de contact a pu être établie grâce à l’optogénétique couplée à l’enregistrement des courants postsynaptiques
in vivo
[
18
-
20
,
27
,
34
]. Il a été ainsi montré que, dans la moelle épinière, ces neurones ciblaient des interneurones excitateurs prémoteurs, des motoneurones, des interneurones sensoriels, les neurones de contact eux-mêmes, ainsi que les axones des neurones réticulospinaux, qui se projettent de la formation réticulée (
Formatio reticularis
)
2,
jusqu’à la moelle épinière [
18
-
20
,
27
,
34
]. Les neurones de contact les plus rostraux forment aussi des synapses qui interagissent avec le soma et les dendrites des motoneurones occipitaux, dans la medulla
3,
, au niveau du tronc cérébral [
20
].
|
Les neurones de contact détectent les modifications chimiques du liquide cérébrospinal Réponses à l’acidification et à l’alcalinisation
La capacité des neurones de contact à détecter les variations de pH dans la moelle épinière a été initialement proposée par Huang
et al.
lorsque ces auteurs ont observé un changement de décharge des potentiels d’action spontanés selon l’acidification du milieu extracellulaire [
12
]. Depuis, il a été montré que les neurones de contact répondaient à l’acidification et à l’alcalinisation du milieu, par l’ouverture de canaux cationiques distincts : les ASIC (
acid-sensitive ion channels
) pour l’acidification, et les canaux PKD2L1 pour l’alcalinisation [
14
]. La localisation des canaux PKD2L1 au niveau de l’extension apicale des neurones de contact, chez le macaque, la souris et les poissons [
24
], a suggéré que ces neurones pouvaient détecter les variations de pH du liquide cérébrospinal.
Détection des métabolites bactériens lors d’une infection du système nerveux central
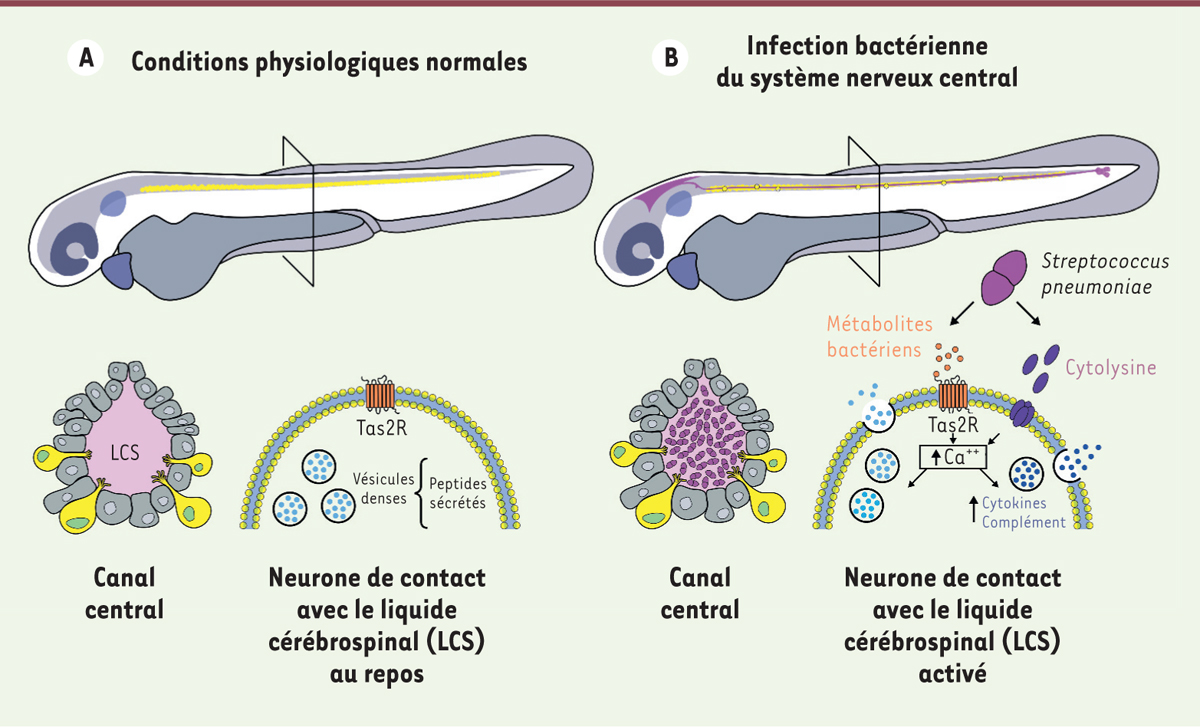
En plus des variations de pH, les neurones de contact sont capables de détecter différentes molécules circulant dans le liquide cérébrospinal, comme des métabolites bactériens [
17
] (
Figure 2
). Certaines bactéries pathogènes, qui pénètrent dans le système nerveux central, peuvent en effet envahir le liquide cérébrospinal, comme c’est le cas des bactéries responsables d’encéphalite ou de méningite. Dans des expériences mimant ces infections, par l’injection de la bactérie
Streptococcus pneumoniae
dans les ventricules cérébraux de poisson zèbre, un recrutement massif de neurones de contact a été observé [
17
]. Ces neurones de contact expriment des récepteurs au goût amer orphelins qui sont capables de détecter les métabolites sécrétés par la bactérie, dont certains sont reconnus par des récepteurs du goût comme des composés amers [
17
].
In vitro
, les neurones de contact s’activent au contact de surnageants de culture de
S. pneumoniae
. C’est également le cas en réponse à une exposition à des métabolites sécrétés par la bactérie qui déclenchent des variations de calcium importantes dans ces neurones, ce qui rappelle ce qui est observé
in vivo
[
17
].
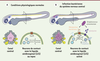 | Figure 2.
Les fonctions chémosensorielles des neurones de contact leur permettent de détecter les métabolites de bactéries pathogéniques lors d’infections du système nerveux central et de déclencher la libération de cytokines et de molécules du complément qui contribuent à augmenter la survie de l’hôte. A.
Sans infection du système nerveux, les neurones de contact ne montrent pas d’activité massive et ne libèrent aucun ou peu de peptides.
B.
Si une bactérie pathogénique pénètre et se reproduit dans le liquide cérébrospinal (LCS), les neurones de contact montrent une activité calcique massive en réponse aux métabolites bactériens, surexpriment et libèrent des peptides et des protéines telles que les molécules du complément et des cytokines qui permettent d’augmenter la survie de l’hôte.
|
S. pneumoniae
n’est pas le seul agent pathogène à activer les neurones de contact : la bactérie
Listeria monocytogenes,
mais aussi le virus neurotrope Sindbis,
via
le surnageant de cellules infectées, peuvent également induire d’importantes variations de concentration de calcium intracellulaire dans les neurones de contact [
17
]. Le rôle de testeurs des neurones de contact, pour détecter les pathogènes présents dans le liquide cérébrospinal, pourrait donc concerner, outre des bactéries et leurs métabolites, des virus ou d’autres agents pathogènes.
Un rôle des neurones en contact avec le liquide cérébrospinal dans la défense de l’hôte
Pour comprendre les différentes fonctions des neurones de contact, il est nécessaire de connaître le lien qui existe entre leur capacité de sécrétion et leur possible activité. Alors que des variations de calcium intracellulaire rapides sont associées à des potentiels d’action isolés et à la libération de vésicules claires contenant du GABA, la réponse des neurones de contact est différente lors de l’infection du système nerveux central par une bactérie telle que
S. pneumoniae
. En effet, les neurones de contact présentent, dans ces conditions, des variations du calcium intracellulaire massives et durables [
17
] qui permettent la libération de granules de sécrétion à cœur dense, typiquement plus éloignées de la membrane cellulaire que les vésicules claires ordinaires, et qui nécessitent, en conséquence, une plus grande élévation de la concentration de calcium intracellulaire pour fusionner avec la membrane. Chez le poisson zèbre, l’élimination des neurones de contact, ou le blocage de leur sécrétion, réduit la survie des larves infectées [
17
]. Il semble donc que ces neurones participent à l’immunité innée des poissons, en sécrétant des composés dans le liquide cérébrospinal. Les neurones de contact expriment également des cytokines, des composants du complément, et des peptides antimicrobiens, mais aussi des peptides capables de modifier le tonus musculaire ou la posture [
17
]. Il semble donc possible que cette surexpression de médiateurs de l’inflammation par les neurones de contact participe à l’augmentation de la concentration de ces molécules de l’immunité innée dans le liquide cérébrospinal. Les mécanismes par lesquels les neurones de contact peuvent améliorer la réponse de l’hôte infecté restent néanmoins peu compris, et leur possible participation dans la captation des signaux inflammatoires, présents dans le liquide cérébrospinal, n’a pas encore été étudiée.
|
Les neurones de contact, couplés à la fibre de Reissner, détectent la courbure spinale pour aligner l’axe du corps
Il y a déjà un siècle, deux anatomistes, Kolmer et Agduhr, avaient proposé que les neurones de contact soient des neurones mécanosensoriels. Chez la lamproie,
in vitro
, les neurones de contact répondent à des changements de flux du liquide cérébrospinal et les récepteurs canaux ASIC contribuent à la mécanotransduction [
9
]. Chez la larve de poisson zèbre,
in vivo
, la déformation mécanique de leur membrane active les neurones de contact en augmentant la probabilité d’ouverture du canal PKD2L1 [
26
]. Les neurones de contact détectent également une compression lors d’une courbure spinale, et y répondent uniquement du côté concave [
10
] (
Figure 3
). Il semble ainsi que ces neurones puissent évaluer la courbure spinale, de manière asymétrique, non en détectant le flux de liquide cérébrospinal, mais par un couplage avec la fibre de Reissner [
11
]. Chez des poissons mutants pour le gène codant la SCO-spondine, qui constitue la fibre de Reissner [
8
], la détection de la courbure par les neurones de contact est abolie [
11
]. Au repos, la fibre de Reissner est sous tension dans le canal central [
7
]. Lors de la flexion de la moelle épinière d’un côté, la fibre de Reissner, sous tension, peut donc provoquer une asymétrie en se rapprochant du côté de la courbure concave pendant la flexion. Chez les mammifères, l’activité mécanosensorielle des neurones de contact n’a pas encore été identifiée, même si ces neurones ont été décrits pour répondre aux chocs hypo-osmotiques qui gonflent la cellule, et ainsi étirent leur membrane plasmique [
13
]. Chez la souris, l’ablation des cils, uniquement dans les neurones de contact, suffit à reproduire les perturbations locomotrices que l’on observe après élimination de ces cellules, ce qui suggère que les cils des neurones de contact sont nécessaires à leurs fonctions sensorielles [
27
].
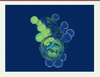 | Figure 3.
Les neurones de contact détectent la courbure spinale du côté de la compression uniquement via un couplage fonctionnel avec la fibre de Reissner.
La fibre de Reissner est sous tension dans le canal central. Lorsque la moelle épinière fléchit
via
une compression à gauche, la fibre de Reissner se rapproche des neurones de contact du côté concave et permet l’activation sélective des neurones de contact du côté gauche (illustrations © Headquarter, Paris, France).
|
|
La fibre de Reissner, les neurones en contact, et l’alignement de l’axe du corps
Lors du développement, un système sensoriel de détection de la courbure de l’axe du corps pourrait contribuer à l’aligner. Les poissons zèbre dont le gène
scospondin
est muté, et qui sont privés de la fibre de Reissner, se développent avec un axe du corps non plus droit mais courbé [
7
]. La fibre de Reissner joue donc un rôle critique dans le redressement de l’axe du corps lors de l’embryogenèse. Les peptides de la famille de l’urotensine II, Urp
(urotensin-II-related peptide)
1 et Urp2, exprimés dans la moelle épinière par les neurones de contact ventraux [
16
], jouent également un rôle capital dans ce processus [
21
]. Pendant l’embryogenèse, l’expression de ces peptides est sous le contrôle de la fibre de Reissner. Lorsque la fibre de Reissner ne se forme pas, chez les mutants dépourvus du gène
scospondin
[
7
], ces peptides sont en effet moins exprimés et l’axe du corps se courbe alors vers le bas [
21
,
28
]. L’induction de l’expression de ces peptides, dans les neurones de contact, permet de récupérer un axe droit [
29
]. L’action de ces peptides sur le redressement de l’axe du corps repose sur l’expression dans la musculature dorsale du récepteur UTS2R3 (
urotensin 2 receptor 3
), et sur un mécanisme actif de contraction de la musculature dorsale [
21
]. Les larves de poisson zèbre mutantes pour les gènes
urp1
et
urp2
présentent des défauts de l’axe du corps similaires à ceux observés chez les larves dont le gène
uts2r3
est muté [
21
-
23
].
Dans les neurones de contact, l’expression des peptides Urp1 et Urp2 est augmentée par la signalisation adrénergique [
28
,
29
]. Leur action sur le tonus musculaire, qui permet de redresser l’axe du corps et d’empêcher que l’embryon ne s’enroule vers le bas, nécessite qu’ils agissent à longue distance, grâce à la circulation du liquide cérébrospinal, en ciblant leur récepteur exprimé dans la musculature squelettique dorsale.
Chez le poisson zèbre, au stade juvénile/adulte, le système sensoriel formé par les neurones de contact, la fibre de Reissner et les peptides de la famille de l’Urotensine-II contribuent à la maintenance de la colonne vertébrale. Les mutants
pkd2l1
, dans lesquels la fonction mécanosensorielle des neurones de contact est abolie au stade larvaire [
10
,
26
], développent au stade adulte une cyphose avec une courbure ventrale de la colonne vertébrale excessive au niveau rostral [
26
]. Les mutations qui affectent la fibre de Reissner au stade juvénile, conduisent, quant à elles, à une torsion en trois dimensions de la colonne vertébrale [
7
,
8
,
22
,
23
], une caractéristique retrouvée dans la scoliose idiopathique chez l’être humain. Les peptides de la famille de l’urotensine-II semblent être à nouveau au centre de la morphogenèse de la colonne vertébrale chez les poissons juvéniles/adultes comme le montrent les déformations observées chez les mutants
urp1, urp2
et
uts2r3,
en aval de la fibre de Reissner qui reste intacte [
22
,
23
]. Le système sensoriel axial, détectant la courbure spinale, informe donc le processus de morphogenèse, en permettant l’alignement de l’axe puis de la colonne vertébrale tout au long de la vie.
Chez l’être humain, la génétique de la scoliose idiopathique reste mal comprise. Il semble que la signalisation reposant sur l’urotensine-II et sur son récepteur UTS2R3 soit altérée chez certains patients [
30
,
31
], suggérant que les peptides de cette famille pourraient contribuer à l’alignement de l’axe du corps chez l’homme. Néanmoins, le gène codant la SCO-spondine, capital pour former la fibre de Reissner, semble avoir disparu chez l’homme et les grands singes
4
. Déterminer si les neurones de contact, les peptides de la famille de l’urotensine-II et des composants de la protéine SCO-spondine contribuent à la morphogenèse de la colonne vertébrale reste important.
|
Rôles des neurones de contact dans la locomotion et la posture : un contrôle moteur
Dans la moelle épinière, les neurones de contact sont situés autour du canal central, à proximité des circuits générateurs du rythme locomoteur. L’activation optogénétique des neurones de contact GABAergiques chez la larve de poisson zèbre a un impact sur la locomotion selon l’état (actif ou passif) de l’animal [
32
,
18
]. Les neurones de contact augmentent la vitesse et l’amplitude du mouvement des réponses de fuite acousto-vestibulaires, engageant la locomotion rapide [
10
,
20
].
Les neurones de contact dorsolatéraux, qui sont activés par les flexions latérales et expriment la somatostatine, se projettent sur des interneurones excitateurs dans la moelle épinière [
18
]. Les larves de poisson zèbre dont le gène codant la somatostatine, SST1.1, a été muté, nagent spontanément plus longtemps [
33
], ce qui indique que la somatostatine inhibe la locomotion spontanée, possiblement en inhibant des interneurones prémoteurs excitateurs [
18
].
En revanche, les neurones de contact ventraux, qui sont activés par des flexions longitudinales et qui expriment les peptides de la famille de l’urotensine-II, se projettent sur les motoneurones de la moelle épinière et du tronc cérébral impliqués dans la nage rapide et le contrôle postural [
19
,
20
]. Les neurones de contact contribuent en effet, pendant la locomotion rapide, au contrôle postural actif.
Des travaux récents ont étudié la contribution sensorimotrice des neurones de contact chez la souris [
27
,
34
]. Chez ces animaux, l’ablation des neurones de contact entraîne une réduction des performances des mouvements fins, lorsque l’animal est mis au défi de traverser une échelle horizontale avec des pas importants ou une poutre de petit diamètre [
27
], ainsi qu’une réduction de la vitesse de la locomotion lors de l’exploration [
34
], comme cela est observé chez le poisson zèbre [
19
,
20
]. Ces résultats suggèrent une conservation de la fonction des neurones de contact entre le poisson zèbre et la souris, et indiquent qu’à travers les espèces vertébrées, les neurones de contacts forment un système sensoriel spinal qui peut moduler la sortie motrice pour affiner le contrôle moteur et optimiser stabilité et vitesse. Chez le macaque, la présence, en grand nombre, de neurones de contact soulève la question de leur rôle chez les primates non humains [
24
].
|
Un grand nombre de travaux récents ont révélé que les neurones en contact avec le liquide cérébrospinal forment, avec la fibre de Reissner, un nouveau système sensoriel de nature intéroceptive. Ce système sensoriel dans la moelle épinière est multimodal, car il répond à des changements mécaniques de la moelle épinière lors de la flexion corporelle et à des changements chimiques du contenu du liquide cérébrospinal. Ce système sensoriel axial est ainsi impliqué dans la mécanosensation et agit à différentes échelles temporelles : à l’échelle de la milliseconde
via
le GABA, pour optimiser la vitesse de la locomotion ou maintenir l’équilibre, et à l’échelle de jours, de semaines et de mois, pour aligner l’axe du corps et maintenir une courbure de la colonne vertébrale adéquate. Ce système sensoriel axial détecte également les changements du contenu du liquide cérébrospinal, tels que le pH, l’osmolarité ou la concentration de métabolites bactériens qui peuvent s’accumuler dans le contexte d’une infection. Activés, les neurones de contact libèrent du GABA ainsi que des neuropeptides et des protéines. Leurs actions permettent de moduler l’activité des centres générateurs des rythmes locomoteurs dans la moelle épinière mais aussi d’ajuster le contenu du liquide cérébrospinal
via
la neurosécrétion, au niveau de leur extension apicale. Cette fonction qui vient juste d’être mise en évidence [
17
], apparaît importante pour les experts de la méningite afin de comprendre les phases tardives d’une infection bactérienne du système nerveux central qui conduisent à l’opisthotonos
5,
, et, grâce aux effets mis en évidence chez le poisson zèbre, pouvoir ainsi espérer augmenter la survie de l’hôte infecté [
17
,
41
].
Une activation maintenue peut induire l’expression par les neurones de contact de peptides de la famille de l’urotensine-II. Ces peptides, qui sont reconnus par un récepteur exprimé par les muscles squelettiques, contrôlent ainsi l’alignement de l’axe du corps et de la colonne vertébrale en particulier. Des études futures permettront de déterminer si les fonctions mécanosensorielles et chémosensorielles des neurones de contact sont conservées chez les mammifères, en particulier chez l’être humain, et si des liens existent, chez les patients, entre l’alignement de l’axe du corps au niveau de la colonne vertébrale et des antécédents d’infections, comme des encéphalites ou méningites. Ce nouveau domaine de recherche a été permis
in vivo
grâce à la transparence du poisson zèbre et à l’accessibilité de la moelle épinière de lamproie pour sonder les circuits spinaux. Il n’en est aujourd’hui qu’à ses débuts. Une des questions majeures de ce nouveau domaine d’étude est de savoir si les neurones de contact sont présents dans la moelle épinière humaine, et si leurs propriétés de neurones immatures, qui montrent des caractéristiques de cellules souches mises en évidence chez la souris, seraient conservées suite à des lésions traumatiques.
|
L’auteure déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les travaux ont été possibles grâce à toute l'équipe SPINAL SENSORY SIGNALING (
https://wyartlab.org
) et ont reçu le soutien de l’Institut du Cerveau (ICM) (Fondation ICM et Inserm), de la compagnie Headquarter pour les illustrations, du Conseil européen de la recherche (European Research Council, ERC), de la New York Stem Cell Foundation (NYSCF) Robertson Award, du Human Frontier Science Program (HFSP), des National Institutes of Health (NIH), de la Fondation pour la Recherche Médicale (FRM), de la Fondation Bettencourt-Schueller (FBS), et de la Fondation Schlumberger pour l’éducation et la recherche (FSER).
|
Footnotes |
1.
Lun
MP
,
Johnson
MB
,
Broadbelt
KG
,
et al.
Spatially heterogeneous choroid plexus transcriptomes encode positional identity and contribute to regional CSF production.
.
J Neurosci.
2015;
;
35
:
:4903.
–
4916
.
2.
Dani
N
,
Herbst
RH
,
McCabe
C
,
et al.
A Cellular and spatial map of the choroid plexus across brain ventricles and ages.
.
Cell.
2021;
;
184
:
:3056.
–
74.e21
.
3.
Orts-Del’Immagine
A
,
Wyart
C
.
Cerebrospinal-fluid-contacting neurons.
.
Curr Biol.
2017;
;
27
:
:R1198.
–
200
.
4.
Reissner
E.
.
Beiträge zur Kenntnis vom Bau des Rückenmarkes von Petromyzon fluviatilis L.
.
Arch Anat Physiol Wiss Med.
1860
;
:545.
–
588
.
5.
Muñoz
RI
,
Kähne
T
,
Herrera
H
,
et al.
The subcommissural organ and the Reissner fiber : old friends revisited.
.
Cell Tissue Res.
2019;
;
375
:
:507.
–
529
.
6.
Cantaut-Belarif
Y
,
Sternberg
JR
,
Thouvenin
O
,
et al.
The Reissner fiber in the cerebrospinal fluid controls morphogenesis of the body axis.
.
Curr Biol.
2018;
;
28
:
:2479.
–
86.e2474
.
7.
Troutwine
BR
,
Gontarz
P
,
Konjikusic
MJ
,
et al.
The Reissner fiber is highly dynamic in vivo and controls morphogenesis of the spine.
.
Curr Biol.
2020;
;
30
:
:2353.
–
62.e2353
.
8.
Rose
CD
,
Pompili
D
,
Henke
K
,
et al.
SCO-Spondin defects and neuroinflammation are conserved mechanisms driving spinal deformity across genetic models of idiopathic scoliosis.
.
Curr Biol.
2020;
;
30
:
:2363.
–
73.e2366
.
9.
Jalalvand
E
,
Robertson
B
,
Wallén
P
,
Grillner
S
.
Ciliated neurons lining the central canal sense both fluid movement and pH through ASIC3.
.
Nat Commun.
2016;
;
7
:
:10002.
.
10.
Böhm
UL
,
Prendergast
AE
,
Djenoune
L
,
et al.
CSF-contacting neurons regulate locomotion by relaying mechanical stimuli to spinal circuits.
.
Nature Comm.
2016;
;
7
:
:10866.
.
11.
Orts-Del’Immagine
A
,
Cantaut-Belarif
Y
,
Thouvenin
O
,
et al.
Sensory neurons contacting the cerebrospinal fluid require the Reissner fiber to detect spinal curvature in vivo.
.
Curr Biology.
2020;
;
30
:
:827.
–
39.e4
.
12.
Huang
AL
,
Chen
X
,
Hoon
MA
,
et al.
The cells and logic for mammalian sour taste detection.
.
Nature.
2006;
;
442
:
:934.
–
938
.
13.
Orts-Del’Immagine
A
,
Wanaverbecq
N
,
Tardivel
C
,
et al.
Properties of subependymal cerebrospinal fluid contacting neurones in the dorsal vagal complex of the mouse brainstem.
.
J Physiol.
2012;
;
590
:
:3719.
–
41
.
14.
Jalalvand
E
,
Robertson
B
,
Tostivint
H
,
et al.
The spinal cord has an intrinsic system for the control of pH.
.
Curr Biology.
2016;
;
26
:
:1346.
–
1351
.
15.
Vigh-Teichmann
O
,
Vigh
B
.
The system of cerebrospinal fluid-contacting neurons.
.
Archivum Histologicum Japonicum.
1983;
;
46
:
:427.
–
468
.
16.
Quan
FB
,
Dubessy
C
,
Galant
S
,
et al.
Comparative distribution and in vitro activities of the Urotensin II-related peptides URP1 and URP2 in Zebrafish: Evidence for their colocalization in spinal cerebrospinal fluid-contacting neurons.
.
Plos One.
2015;
;
10
:
:e0119290.
.
17.
Prendergast
AE
,
Jim
KK
,
Marnas
H
,
et al.
CSF-contacting neurons respond to Streptococcus Pneumoniae and promote host survival during central nervous system infection.
.
Curr Biology.
2023;
;
33
:
:940.
–
56.e10
.
18.
Fidelin
K
,
Djenoune
L
,
Stokes
C
,
et al.
State-dependent modulation of locomotion by GABAergic spinal sensory neurons.
.
Curr Biology.
2015;
;
25
:
:3035.
–
3047
.
19.
Hubbard
JM
,
Böhm
UL
,
Prendergast
AE
,
et al.
Intraspinal sensory neurons provide powerful inhibition to motor circuits ensuring postural control during locomotion.
.
Curr Biology.
2016;
;
26
:
:2841.
–
2853
.
20.
Wu
MY
,
Carbo-Tano
M
,
Mirat
O
,
et al.
Spinal sensory neurons project onto the hindbrain to stabilize posture and enhance locomotor speed.
.
Curr Biology.
2021;
;
31
:
:3315.
–
29.e5
.
21.
Zhang
X
,
Jia
S
,
Chen
Z
,
et al.
Cilia-driven cerebrospinal fluid flow directs expression of urotensin neuropeptides to straighten the vertebrate body axis.
.
Nat Genet.
2018;
;
50
:
:1666.
–
1673
.
22.
Gaillard
AL
,
Mohamad
T
,
Quan
FB
,
et al.
Urp1 and Urp2 act redundantly to maintain spine shape in zebrafish larvae.
.
Dev Biology.
2023
;
S0012–1606(23)00018–0.
.
23.
Bearce
EA
,
Irons
ZH
,
O’Hara-Smith
JR
,
et al.
Urotensin II-related peptides, Urp1 and Urp2, control Zebrafish spine morphology.
.
eLife.
2022;
;
11
:
:e83883.
.
24.
Djenoune
L
,
Khabou
H
,
Joubert
F
,
et al.
Investigation of spinal cerebrospinal fluid-contacting neurons expressing PKD2L1: Evidence for a conserved system from fish to primates.
.
Front Neuroanatomy.
2014;
;
8
:
:26.
.
25.
Bushman
JD
,
Ye
W
,
Liman
ER
.
A proton current associated with sour taste : distribution and functional properties.
.
FASEB.
2015;
;
29
:
:3014.
–
3026
.
26.
Sternberg
JR
,
Prendergast
AE
,
Brosse
L
,
et al.
Pkd2l1 is required for mechanoception in cerebrospinal fluid-contacting neurons and maintenance of spine curvature.
.
Nat Commun.
2018;
;
9
:
:3804.
.
27.
Gerstmann
K
,
Jurcˇic΄
N
,
Blasco
E
,
et al.
The role of intraspinal sensory neurons in the control of quadrupedal locomotion.
.
Curr Biology.
2022;
;
32
:
:2442.
–
53.e4
.
28.
Cantaut-Belarif
Y
,
Orts Del’Immagine
A
,
Penru
M
,
et al.
Adrenergic activation modulates the signal from the Reissner fiber to cerebrospinal fluid-contacting neurons during development.
.
eLife.
2020;
;
9
:
:e59469.
.
29.
Lu
H
,
Shagirova
A
,
Goggi
JL
,
et al.
Reissner fibre-induced urotensin signalling from cerebrospinal fluid-contacting neurons prevents scoliosis of the vertebrate spine.
.
Biol Open.
2020;
;
9
:
:bio052027.
.
30.
Dai
Z
,
Wang
Y
,
Wu
Z
,
et al.
Novel Mutations in UTS2R are associated with adolescent idiopathic scoliosis in the chinese population.
.
Spine.
2021;
;
46
:
:E288.
–
93
.
31.
Xie
H
,
Kang
Y
,
Liu
J
,
et al.
Ependymal polarity defects coupled with disorganized ciliary beating drive abnormal cerebrospinal fluid flow and spine curvature in zebrafish.
.
Plos Biol.
2023;
;
21
:
:e3002008.
.
32.
Wyart
C
,
Del Bene
F
,
Warp
E
,
et al.
Optogenetic dissection of a behavioural module in the vertebrate spinal cord.
.
Nature.
2009;
;
461
:
:407.
–
410
.
33.
Quan
FB
,
Desban
L
,
Mirat
O
,
et al.
Somatostatin 1.1 contributes to the innate exploration of Zebrafish larva.
.
Sci Rep.
2020;
;
10
:
:15235.
.
34.
Nakamura
Y
,
Kurabe
M
,
Matsumoto
M
,
et al.
Cerebrospinal fluid-contacting neuron tracing reveals structural and functional connectivity for locomotion in the mouse spinal cord.
.
eLife.
2023;
:
12
:
:e83108.
.
35.
Djenoune
L
,
Desban
L
,
Gomez
J
,
et al.
The dual developmental origin of spinal cerebrospinal fluid-contacting neurons gives rise to distinct functional subtypes.
.
Sci Rep.
2017;
;
7
:
:719.
.
36.
Djenoune
L
,
Wyart
C
.
Light on a sensory interface linking the cerebrospinal fluid to motor circuits in vertebrates.
.
J Neurogenet.
2017;
;
31
:
:113.
–
127
.
37.
Jaeger
CB
,
Teitelman
G
,
Joh
TH
,
et al.
Some neurons of the rat central nervous system contain aromatic-L-amino-acid decarboxylase but not monoamines.
.
Science.
1983;
;
219
:
:1233.
–
1235
.
38.
Nagatsu
I
,
Sakai
M
,
Yoshida
M
,
Nagatsu
T
.
Aromatic L-amino acid decarboxylase-immunoreactive neurons in and around the cerebrospinal fluid-contacting neurons of the central canal do not contain dopamine or serotonin in the mouse and rat spinal cord.
.
Brain Research.
1988;
;
475
:
:91.
–
102
.
39.
Shimosegawa
T
,
Koizumi
M
,
Toyota
T
,
et al.
An immunohistochemical study of Methionine-Enkephalin-Arg6-Gly7-Leu8-like immunoreactivity-containing liquor-contacting neurons (LCNs) in the rat spinal cord.
.
Brain Research.
1986;
;
379
:
:1.
–
9
.
40.
Lamotte
CC
.
Vasoactive intestinal polypeptide cerebrospinal fluid-contacting neurons of the monkey and cat spinal central canal.
.
J Comp Neurol.
1987;
;
258
:
:527.
–
41
.
41.
MacCain
W
,
Tuomanen
E
.
Taste versus pain: A sensory feast in bacterial meningitis.
.
Cell Host Microbe.
2023;
;
31
:
:681.
–
2
.
|