Comment la traduction des ARN messagers (ARNm) en protéines peut-elle être contrôlée par le noyau cellulaire, alors même qu’elle a lieu dans le cytoplasme ? Un article récemment publié révèle le rôle critique d’un long ARN non codant : NEAT1 ( nuclear-enriched abundant transcript 1 ) [ 1 ]. L’histoire commence avec le stress cellulaire. Lorsqu’une cellule est soumise à un stress (hypoxie, infection virale, ou encore stress génotoxique lié à un traitement anti-cancéreux), la traduction des ARNm est fortement ralentie afin de diminuer la dépense énergétique de la cellule et de favoriser sa survie [ 2 ].
Un stress hypoxique par manque de dioxygène (O 2 ) survient dans les maladies cardio-vasculaires dues à une occlusion artérielle, tout particulièrement dans l’insuffisance cardiaque ischémique aiguë (infarctus du myocarde) ou chronique. Un tel stress survient également au cours du développement des tumeurs solides cancéreuses, dont le centre n’est pas irrigué par des vaisseaux sanguins. En dépit du blocage traductionnel lié au stress, certains ARNm continuent d’être traduits, parfois même plus activement. Dans la plupart des cas, ces ARNm codent des protéines impliquées dans la réponse au stress, par exemple des facteurs de croissance angiogéniques, dont la sécrétion par la cellule en hypoxie stimule la formation de néovaisseaux qui lui apporteront du dioxygène [ 3 , 4 ]. Cette activation traductionnelle permet donc de reperfuser les tissus lors de maladies cardio-vasculaires ischémiques, ou d’irriguer efficacement les tumeurs, ce qui favorise leur croissance. Dans le cas d’une tumeur cancéreuse, l’hypoxie active également la traduction d’ARNm codant des facteurs lymphangiogéniques, et la formation de néovaisseaux sanguins et lymphatiques augmente la dissémination métastatique [ 3 , 5 ].
En cas de stress, la cellule met donc en œuvre des mécanismes alternatifs de traduction de certains ARNm pour surmonter l’inhibition traductionnelle globale. L’un de ces mécanismes implique, au lieu du recrutement habituel du ribosome sur la coiffe présente à l’extrémité 5’ des ARNm , son recrutement interne, ce qui requiert la présence d’un élément structural particulier dans l’ARNm : le site d’entrée interne des ribosomes ( internal ribosome entry site , IRES) [ 2 ]. Nous avons identifié des IRES dans les ARNm codant les principaux facteurs angiogéniques et lymphangiogéniques appartenant aux familles des FGF ( fibroblast growth factors ) et des VEGF ( vascular endothelial growth factors ) : leur présence permet d’activer la traduction de ces ARNm en réponse à l’hypoxie [ 3 , 4 ]. L’IRES est présent le plus souvent dans la région 5’ non traduite de l’ARNm. Il permet le recrutement du ribosome indépendamment de la coiffe, avec la contribution de facteurs cellulaires, les ITAF ( IRES trans-acting factors ), qui peuvent être des protéines ou des ARN non codants [ 4 ]. Étonnamment, de nombreux ITAF sont des protéines majoritairement nucléaires. Plusieurs protéines de la famille des hnRNP ( heterogenous nuclear ribonucleoproteins ) sont impliquées dans le contrôle positif ou négatif de la traduction des ARNm IRES-dépendante. Nous avions précédemment montré que deux ITAF identifiés lors de l’activation de l’IRES de l’ARNm codant le facteur angiogénique FGF1, les protéines hnRNPM et P54 nrb /NONO, sont également capables de se lier au promoteur du gène FGF1 , et que la présence nucléaire de ces deux ITAF permet leur recrutement plus efficace sur l’ARNm et une activation importante de la traduction IRES-dépendante [ 6 ]. Les résultats de ce travail de recherche et d’autres travaux ont conduit à suggérer que l’activation de la traduction IRES-dépendante des ARNm cellulaires nécessite dans certains cas un évènement nucléaire [ 7 ].
Nous avons recherché quel pouvait en être le mécanisme. Une piste nous a été fournie par le fait que les deux ITAF que nous avions précédemment identifiés, hnRNPM et P54 nrb , interagissent au sein d’un corpuscule nucléaire qui se forme en réponse au stress, le paraspeckle , dont P54 nrb est un composant essentiel. Ce paraspeckle , dont on connaissait le rôle régulateur de l’expression génique par la rétention d’ARN messagers édités 1 et de facteurs de transcription, contient au moins sept ITAF différents [ 8 , 9 ]. Son principal composant est un long ARN non codant, NEAT1, qui en forme le squelette, et dont la synthèse est induite par l’hypoxie : il existe deux isoformes, NEAT1_1 et NEAT1_2, longues respectivement de 3,7 kb et 22,7 kb chez l’homme [ 8 ]. La présence des ITAF dans le paraspeckle nous a donc amenés à formuler l’hypothèse de son implication dans la traduction des ARNm IRES-dépendante. À l’appui de cette hypothèse, nous avions observé, dans plusieurs types de cellules, une corrélation entre l’activation des IRES et la synthèse de NEAT1 au début de l’hypoxie [ 1 ]. Dans des cardiomyocytes de souris HL-1 (des cellules immortalisées mais ayant conservé leur phénotype de cellules cardiaques contractiles) cultivés en hypoxie, nous avons donc réalisé une déplétion expérimentale de l’ARN NEAT1, ainsi que de trois composants protéiques majeurs du paraspeckle , p54 nrb , PSPC1 ( paraspeckle component 1 ) et SFPQ ( splicing factor proline- and glutamine-rich ), et nous avons testé, dans chaque cas, l’activité traductionnelle IRES-dépendante des ARNm codant les principaux facteurs de croissance (lymph)angiogéniques FGF1, FGF2, VEGFA, VEGFC et VEGFD, ainsi que deux protéines impliquées dans la cardioprotection, IGF1R ( insulin-like growth factor 1 receptor ) et c-MYC. L’activité d’un IRES d’origine virale, provenant du picornavirus EMCV ( encephalomyocarditis virus ) a également été testée. Nous avons ainsi montré que la déplétion de P54 nrb ou celle de PSPC1 diminue l’activité traductionnelle des ARNm de FGF1, FGF2 et VEGFA, alors que seule la déplétion de PSPC1 diminue celle de l’ARNm de VEGFC, et que celle des ARNm de VEGFD, IGF1R et c-MYC est insensible à la déplétion de l’une ou l’autre de ces deux protéines dans ce modèle cellulaire. Quant à la déplétion de SFPQ, elle n’affecte l’activité traductionnelle d’aucun de ces ARNm. En revanche, la traduction de tous ces ARNm est fortement inactivée par la déplétion de NEAT1. Nous sommes donc arrivés à la conclusion que les protéines P54 nrb et PSPC1 sont des ITAF qui ne régulent qu’un sous-groupe d’IRES, alors que NEAT1 est un ITAF activateur de l’ensemble des IRES d’ARNm cellulaires étudiés (mais pas de celui du picornavirus EMCV). Afin de déterminer si ce rôle régulateur de NEAT1 s’étend à d’autres ARNm cellulaires, nous avons étudié l’effet de sa déplétion sur le recrutement dans les polysomes (donc sur la traduction) de 96 ARNm contenant un IRES ou codant une protéine impliquée dans l’angiogenèse. Nos résultats ont révélé le rôle activateur de NEAT1, principalement NEAT1_2, sur la traduction de la plupart de ces ARNm dans les cellules soumises à l’hypoxie [ 1 ].
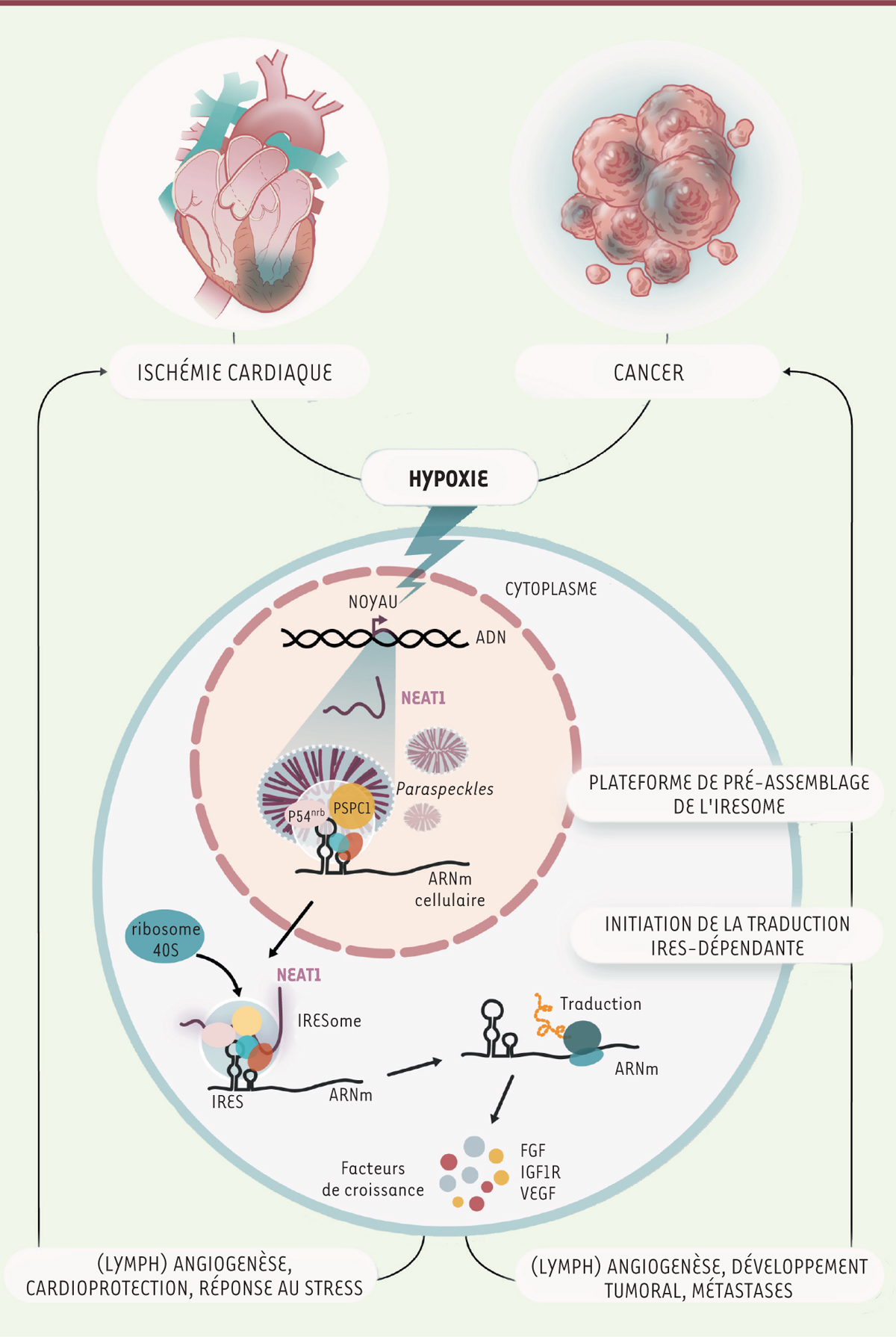
Comment NEAT1 exerce-t-il sa fonction d’ITAF ? Notre hypothèse est que le paraspeckle dont NEAT1 constitue le squelette joue le rôle d’une plateforme de recrutement des ARNm possédant des IRES, et qu’il est le site de formation de l’IRESome 2, . Nous avons montré, par des expériences de smiFISH ( single molecule inexpensive fluorescent in situ hybridization ), qu’un ARNm possédant un IRES est en effet colocalisé avec NEAT1 dans le paraspeckle lors de l’hypoxie [ 1 ] ( Figure 1 ). NEAT1 est-il ensuite exporté dans le cytoplasme avec l’IRESome pour activer directement la traduction IRES-dépendante ? Cela reste à prouver, mais cette hypothèse s’appuie sur un faisceau d’arguments : la présence de NEAT1 dans le cytoplasme a déjà été décrite, et nous avons nous-mêmes détecté sa présence dans les polysomes lors de l’hypoxie [ 3 ].
| Figure 1.
L’ARN non codant Neat1 et le paraspeckle activent la traduction de certains ARNm en réponse à l’hypoxie.
Les cellules du myocarde, en cas d’ischémie cardiaque, ou les cellules tumorales en cas de cancer, sont soumises à un stress hypoxique. L’ARN non codant NEAT1 est alors transcrit, et contribue à la formation d’une sous-structure nucléaire, le
paraspeckle,
dans lequel il est associé à différentes protéines, parmi lesquelles plusieurs ITAF (
IRES trans-acting factors
), dont p54
nrb
et PSPC1 (
paraspeckle component 1
). Les ARNm contenant un IRES sont recrutés dans ce corpuscule nucléaire, qui devient une plateforme de pré-assemblage de l’IRESsome, un processus impliquant NEAT1 ainsi que les protéines p54
nrb
et PSPC1. Le complexe ribonucléoprotéique ainsi formé est alors exporté dans le cytoplasme, où il est recruté par les polysomes et traduit en protéine (traduction IRES-dépendante) : facteur de croissance angiogénique ou lymphangiogénique, facteur cardioprotecteur, ou protéine du stress. Cette réponse cellulaire au stress induit notamment la formation de néovaisseaux, qui a un effet bénéfique dans le cas de l’ischémie cardiaque, alors qu’elle favorise le développement tumoral et les métastases dans le cas du cancer.
|
Cette étude aura permis de comprendre comment le mécanisme de la traduction IRES-dépendante des ARNm cellulaires possédant un IRES est déclenché dans le noyau, via un recrutement de ces ARNm dans le paraspeckle . Seul l’IRES du virus EMCV s’est montré insensible à la déplétion expérimentale de NEAT1, ce qui confirme un modèle proposé précédemment, selon lequel l’IRESome des ARNm viraux se formerait dans le cytoplasme, alors que celui des ARNm cellulaires se formerait dans le noyau [ 7 ].
Ainsi, un ARN non codant de longueur exceptionnelle, NEAT1, régule l’expression génique par plusieurs mécanismes. En plus de sa fonction cytoplasmique déjà connue d’éponge à micro-ARN [ 8 ], cette nouvelle fonction nucléo-cytoplasmique d’activateur de la traduction en fait un élément essentiel du contrôle traductionnel en réponse au stress. D’un point de vue physiopathologique, NEAT1 est surexprimé dans de nombreux cancers, et il est impliqué dans la résistance des cellules tumorales à certains traitements anticancéreux [ 8 ]. Par ailleurs, grâce à son rôle anti-apoptotique, il favorise la survie des cardiomyocytes lors de l’ischémie cardiaque. La capacité de NEAT1 à stimuler la traduction des ARNm des facteurs (lymph)angiogéniques lors de l’hypoxie en fait un promoteur de l’angiogenèse et de la lymphangiogenèse, ce qui favorise la revascularisation bénéfique dans les maladies cardio-vasculaires ischémiques, mais également une vascularisation indésirable dans le cancer, qui stimule alors le développement tumoral et la dissémination métastatique.