L’identification de mutations oncogéniques des gènes IDH1 ( isocitrate deshydrogenase 1 ) ou IDH2 dans les gliomes diffus de l’adulte a représenté une avancée majeure dans leur prise en charge [ 1 , 2 ]. Depuis, on distingue les gliomes IDH-mutés des gliomes « IDH de génotype sauvage ». Ces derniers sont majoritairement représentés par les glioblastomes, tandis que les gliomes IDH-mutés correspondent aux astrocytomes et aux oligodendrogliomes. Les astrocytomes sont caractérisés par la présence d’une mutation de IDH , de TP53 ( tumor protein 53 ) et de ATRX ( ATRX chromatin remodeler ), et les oligodendrogliomes, par la présence d’une mutation de IDH , d’une codélétion 1p/19q, et d’une mutation du promoteur de TERT ( telomerase reverse transcriptase ). Ces gliomes affectent des sujets jeunes, et sont de bien meilleur pronostic que les glioblastomes. Ils demeurent toutefois incurables quand, après avoir évolué en gliomes de haut grade, ils récidivent après chirurgie, radiothérapie et chimiothérapie [ 3 ].
Depuis l’identification des mutations de IDH , des progrès considérables ont été réalisés dans la compréhension de la formation des gliomes associée à la présence de ces mutations. On sait désormais que la protéine mutée acquiert une activité néomorphique (« gain de fonction ») et induit ainsi la formation d’un oncométabolite, le 2-hydroxyglutarate, qui inhibe de multiples dioxygénases dépendantes de l’α-cétoglutarate, en particulier des ADN-déméthylases et des histone-déméthylases, ce qui conduit à une hyperméthylation de l’ADN et des histones et à la transformation tumorale [ 4 ]. Peu après l’identification des mutations de IDH , plusieurs équipes ont identifié, par analyse du génome entier ( genome-wide association studies , GWAS), un polymorphisme nucléotidique ( single-nucleotide polymorphism , SNP) situé dans une région intronique du bras long du chromosome 8 (8q24), rs55705857-A/G, associé au risque de développer un gliome IDH-muté [ 5 – 7 ]. La présence de l’allèle « à risque » rs55705857-G multiplie par six le risque de développer un gliome IDH-muté, tandis qu’elle n’est pas associée à un risque accru de gliome de génotype IDH « sauvage ». Cet allèle est présent chez 7 % des individus issus de la population générale et chez 40 % des patients porteurs d’un gliome IDH-muté. Complétant les résultats d’une étude précédente suggérant que cet allèle augmentait l’expression du protooncogène MYC ( MYC proto-oncogene, bHLH transcription factor ) [ 8 ], des chercheurs viennent de montrer que, bien que le SNP rs55705857 soit situé dans une région non codante, il est en effet directement impliqué dans l’oncogenèse des gliomes IDH-mutés [ 9 ]. Ils ont d’abord montré qu’au sein de la région chromosomique 8q24, c’est bien l’allèle de ce SNP qui est associé au risque accru de gliome IDH-muté, puisque ce SNP est situé dans un amplificateur génique (en anglais, enhancer ) agissant spécifiquement dans les cellules d’origine neurale ou mélanocytaire, et également dans les cellules des gliomes IDH-mutés. Toutefois, dans ces gliomes, l’activité de cet enhancer est indépendante du génotype du SNP. Les chercheurs ont ensuite étudié l’effet de ce SNP sur la transcription des gènes situés à proximité. Le SNP rs55705857 est situé dans un intron de l’ARN non codant CCDC26 et dans une région de 2 Mb contrôlant l’expression du gène MYC . Le génotype de ce SNP n’a d’impact ni sur l’expression de CCDC26 ( CCDC26 long non-coding RNA ), ni sur celle de MYC . En revanche, l’allèle « à risque » rs55705857-G est associé à un profil transcriptomique plus agressif des gliomes IDH-mutés, suggérant une activation plus importante de la protéine MYC, les gènes cibles de ce facteur de transcription étant plus exprimés. Cette augmentation de l’activité de MYC sur l’expression de ses gènes cibles est similaire à celle observée dans des tumeurs plus agressives de génotype « IDH-sauvage », ce qui suggère que l’allèle rs55705857-G est en partie responsable du passage d’un profil transcriptomique de gliome de bas grade à un profil de gliome de haut grade.
Profitant du fait que ce SNP et la séquence nucléotidique environnante ont été très conservés au cours de l’évolution, les chercheurs ont pu étudier l’influence de l’allèle à risque rs55705857-G sur le développement embryonnaire du cerveau murin et ont montré que l ’enhancer dans lequel il est situé est actif dans les cellules de la glie radiaire et les cellules progénitrices oligodendrogliales, et que son activité est augmentée par la présence de cet allèle. Ils ont ensuite développé un modèle murin d’astrocytome en introduisant la mutation IDH1 Arg132His et en inactivant les gènes suppresseurs de tumeurs TP53 et ATRX , puis ils ont modifié génétiquement le locus rs55705857 chez ces souris, ce qui leur a permis de montrer que la mutation ou la suppression de ce locus était associée à l’apparition beaucoup plus rapide (172 versus 472 jours) et beaucoup plus fréquente (75 % versus 30 %) de gliomes. Ils ont découvert que ce SNP est situé dans un motif de liaison de l’ enhancer aux facteurs de transcription OCT ( octamer-binding transcription factor ) et que l’allèle à risque rs55705857-G perturbe la liaison des facteurs de transcription OCT2/4 à ce motif : ces facteurs de transcription ont une plus grande affinité pour l’allèle « non à risque » rs55705857-A que pour l’allèle rs55705857-G. Enfin, ils ont pu montrer que dans les cellules neurales et les cellules IDH-mutées, TP53-mutées et ATRX-mutées du modèle murin, rs55705857 interagit structurellement avec le locus de MYC , et ils ont apporté des preuves expérimentales que l’allèle rs55705857-G augmente la transcription de MYC en inhibant la fixation de OCT2/4 à l’ enhancer ( Figure 1 ).
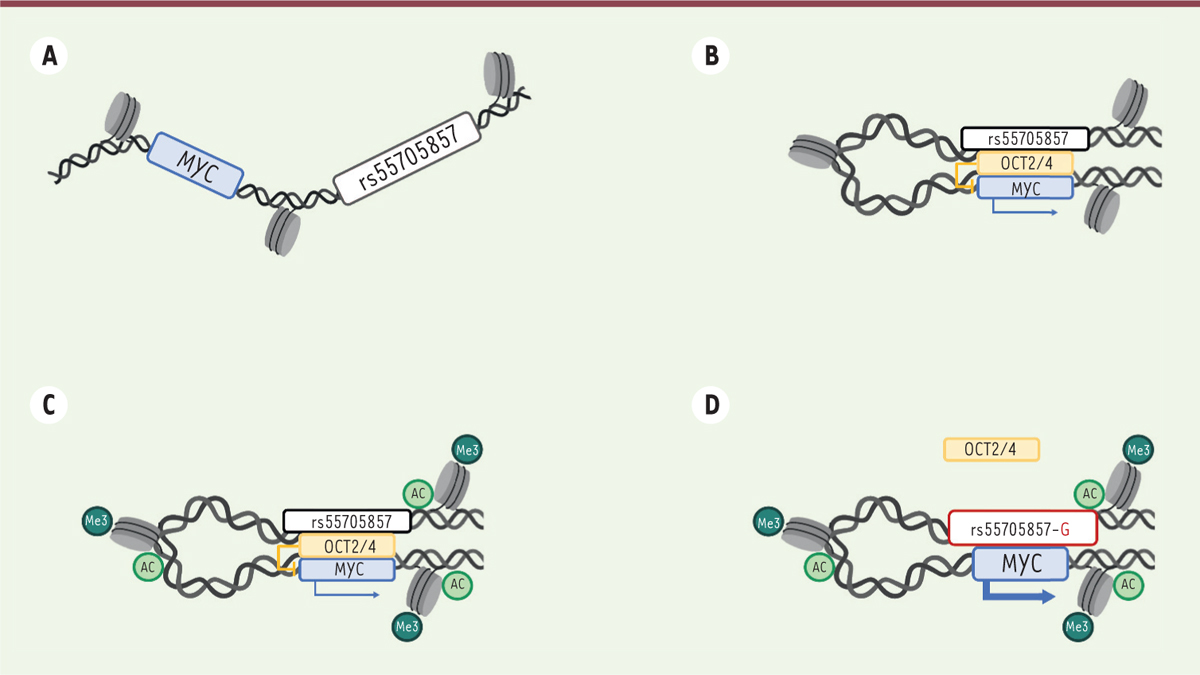
| Figure 1.
Implication du SNP rs55705857 dans l’expression du protooncogène MYC.
Dans la plupart des cellules somatiques, les positions distantes du gène
MYC
et du SNP (
single nucleotide polymorphism
) rs55705857 dans la région chromosomique 8q24 empêchent leur interaction
(
A
)
. Dans les cellules précurseurs de gliomes, ce SNP interagit avec le locus de
MYC
, et des facteurs de transcription comme OCT2 et OCT4 se lient à l’allèle « non à risque » rs55705857-A, ce qui réprime l’expression de
MYC (
B
)
. Les modifications épigénétiques liées à la présence de la mutation de
IDH1
dans les cellules tumorales aboutissent à une conformation ouverte et hyperactive de la chromatine dans cette région chromosomique
(
C
)
. La présence de l’allèle « à risque » rs55705857-G défavorise la liaison avec les facteurs de transcription OCT, ce qui augmente l’expression de
MYC (
D
)
(figure adaptée de [
9
]).
|
Alors que pour de nombreux types de cancers, des SNP de susceptibilité spécifiques ont également été identifiés dans le génome, comprendre l’interaction entre variants génétiques présents seulement dans les cellules tumorales et variants génétiques « constitutionnels », c’est-à-dire présents dans toutes les cellules de l’individu, est désormais un enjeu majeur. La très grande majorité des SNP associés au cancer sont situés dans des régions non codantes du génome, et sont généralement considérés comme de simples marqueurs du surrisque sans rôle direct dans l’oncogenèse. Les résultats présentés dans cet article sont donc remarquables en ce qu’ils montrent que l’allèle « à risque » rs55705857-G contribue directement au développement des gliomes IDH-mutés [ 9 ]. Un autre intérêt de ce travail de recherche est l’obtention d’un nouveau modèle murin d’astrocytome IDH-muté. L’utilisation thérapeutique d’inhibiteurs spécifiques de la protéine IDH mutée, qui a déjà prouvé son efficacité contre certaines leucémies aiguës myéloblastiques, est une stratégie très prometteuse dans les gliomes IDH-mutés lentement évolutifs [ 10 ]. En revanche, ces inhibiteurs semblent inefficaces contre des tumeurs ayant évolué vers des gliomes de haut grade, d’où l’intérêt de disposer de nouveaux modèles expérimentaux permettant d’identifier des stratégies thérapeutiques efficaces dans cette situation.