L’anévrisme de l’aorte est une maladie vasculaire fréquente, qui touche plus de 5 % des hommes âgés de plus 60 ans, essentiellement dans les pays développés [ 1 ]. Il s’agit d’une dilatation progressive de l’aorte, dont la principale complication est la dissection ou la rupture, potentiellement mortelle. Le traitement curatif de l’anévrisme est chirurgical, ou par voie endovasculaire, mais la maladie reste associée à une forte morbi-mortalité. Le mécanisme de la formation de l’anévrisme est complexe et incomplètement élucidé : dégradation des lames élastiques, remodelage du collagène, apoptose des cellules musculaires lisses de la paroi vasculaire, activation de cellules immunitaires telles que les macrophages [ 2 ].
Dans la paroi aortique anévrismale, coexistent des macrophages, exprimant la protéine CCR2 ( C-C chemokine receptor type 2 ), dérivés de monocytes circulants qui infiltrent la paroi en réponse à des stimulus inflammatoires, et des macrophages résidents qui se développent dans le sac vitellin au stade embryonnaire et colonisent les tissus au cours de la vie fœtale [ 3 ]. Les macrophages vasculaires résidents expriment le marqueur de surface LYVE-1 ( lymphatic vessel endothelial hyaluronan receptor-1 ), le récepteur du hyaluronate. En conditions physiologiques, ces macrophages maintiennent l’intégrité de la paroi aortique en contrôlant l’activité de ses cellules musculaires lisses [ 4 ]. Les résultats de plusieurs études expérimentales indiquent que les monocytes circulants contribuent, en revanche, à la formation de l’anévrisme de l’aorte. Ils infiltrent la paroi aortique et se différencient en macrophages qui libérent des chimiokines, des cytokines pro-inflammatoires, ainsi que des protéases responsables de la dégradation de la paroi aortique avec, pour conséquence, une fragilisation de cette dernière et l’apparition de l’anévrisme. En revanche, le rôle pathogénique des macrophages résidents n’est pas connu.
Nous nous sommes intéressés à l’effet de la mutation Val617Phe (valine en position 617 de la protéine modifiée en phénylalanine) de la protéine JAK2 ( Janus kinase 2 ) sur la maladie anévrismale aortique. JAK2 appartient à une famille de kinases agissant dans la voie de signalisation de récepteurs de cytokines ( e.g. , interleukine-6, interféron-γ) ou de facteurs de croissance (tels que l'érythropoïétine) qui sont exprimés par les cellules vasculaires et les cellules immunitaires. L’activation de JAK2 est impliquée dans la survie et la prolifération cellulaires, et dans l’inflammation [ 5 ]. La mutation JAK2 Val617Phe est une mutation clonale « gain de fonction » caractéristique des syndromes myéloprolifératifs, associant une augmentation des cellules des lignées myéloïdes dans le sang et une splénomégalie [ 6 ]. Les résultats de plusieurs études réalisées chez la souris ont montré que cette mutation aggrave l’athérosclérose et l’insuffisance cardiaque ischémique [ 9 , 10 ]. En revanche, l’implication de cette mutation dans la maladie anévrismale n’était pas connue.
La mesure, sur une image tomodensitométrique, du diamètre de l’aorte ascendante, descendante et abdominale, chez 157 patients ayant un syndrome myéloprolifératif et porteurs de la mutation JAK2 Val617Phe , a montré une augmentation significatice du diamètre de l’aorte thoracique ascendante et descendante par rapport à l’aorte thoracique ascendante des individus témoins de même sexe et de même âge. Chez des souris portant la mutation Jak2 Val617Phe dans les cellules hématopoïétiques et les cellules endothéliales (souris Jak2 Val617Phe HC-EC), nous avons constaté une augmentation du nombre de globules rouges, de globules blancs, et de plaquettes dans le sang, ainsi qu’une splénomégalie, caractéristiques d’un syndrome myéloprolifératif.
Dès l’âge de sept semaines, les souris déficientes présentent une dilatation aortique à l’examen échographique, ainsi qu’une dégradation de la paroi aortique caractérisée histologiquement par une destruction des lames élastiques et du collagène, et associée à une augmentation locale de l’activité métalloprotéasique. Près de la moitié de ces souris ont développé un anévrisme disséquant de l’aorte et n’ont pas atteint l’âge de 20 semaines. En revanche, nous avons montré que la présence restreinte aux cellules endothéliales de la mutation Jak2 Val617Phe n’avait aucun effet délétère sur la paroi aortique, alors que la présence de cette mutation uniquement dans les cellules hématopoiétiques reproduisait la maladie aortique des souris Jak2 Val617Phe HC-EC. Chez ces dernières, l’analyse histologique a montré une augmentation du nombre de macrophages dans la paroi aortique, une observation corroborée par le résultat d’une analyse transcriptomique globale du tissu aortique montrant la surexpression des signatures myéloïde et pro-inflammatoire. À la lumière de ces résultats, nous avons produit des souris porteuses de la mutation Jak2 Val617Phe uniquement dans les cellules myéloïdes (les souris Jak2 Val617Phe Myel), et avons montré que ces souris développaient spontanément des anévrismes disséquants de l’aorte entraînant leur mort avant l’âge de 15 semaines. La paroi aortique de ces souris était caractérisée par une augmentation de l’activité métalloprotéasique et une diminution de son contenu en élastine et en collagène, ainsi que par une signature transcriptomique pro-inflammatoire plus marquée, avec une augmentation de l’expression des gènes de cytokines, Il6 , Tnfa , Il1b . Nous avons également constaté une augmentation significative du nombre de macrophages adventiciels, sans augmentation du nombre de monocytes ou de granulocytes neutrophiles. À un stade précoce de la maladie aortique, la majorité de ces macrophages exprimaient LYVE-1, un marqueur des macrophages résidents, et ces cellules proliféraient localement. En revanche, à un stade avancé de la maladie anévrismale, les macrophages, encore plus nombreux, exprimaient essentiellement CCR2. L’accumulation de macrophages dans la paroi aortique des souris mutées au stade précoce de la maladie résultait donc vraisemblablement d’une prolifération locale des macrophages résidents, alors qu’à un stade plus avancé, les macrophages présents dans la paroi aortique provenaient principalement de l’infiltration et de la différenciation de monocytes circulants. L’analyse du transcriptome de cellules isolées a confirmé cette hypothèse : dans les aortes des jeunes souris Jak2 Val617Phe Myel, les macrophages ont des caractéristiques transcriptomiques de « résidents vasculaires », alors que dans les aortes des animaux plus âgés, porteurs d’anévrismes constitués, les macrophages ont une signature pro-inflammatoire monocytaire. Trois sous-populations de macrophages résidents exprimant LYVE-1 ont été identifiées : Res-MGL1 hi (enrichis en macrophage galactose-type lectin-1 ), Res-Txnip hi (enrichis en thioredoxin-interacting protein ), et Res-S100 hi (enrichis en protéine S100). Les macrophages résidents Res-MGL1 hi sont majoritaires, et leur profil transcriptomique est caractérisé par une plus forte expression des gènes codant des cytokines et chimiokines pro-inflammatoires, comme CCL2, par rapport aux deux autres sous-populations.
Nous avons croisé des souris Jak2 Val617Phe Flex avec des souris Pf4 Cre +/- pour obtenir des souris portant une mutation affectant spécifiquement la population de macrophages résidents (les souris Jak2 Val617Phe Pf4 ). Ces souris, dépourvues d’anomalie des cellules sanguines en dehors d’une augmentation du nombre de plaquettes, développent une dilatation aortique précoce et présentent les mêmes anomalies de la paroi aortique que celles précédemment décrites pour les autres modèles murins : augmentation du contenu en macrophages résidents, diminution du collagène adventiciel, dégradation des lames élastiques et augmentation de la signature pro-inflammatoire et protéasique du transcriptome. Finalement, près de 90 % de ces souris meurent précocement par rupture d’anévrismes disséquants de l’aorte.
Pour confirmer l’implication des macrophages résidents dans le phénotype vasculaire associé à la mutation Jak2 Val617Phe , nous avons administré aux souris Jak2 Val617Phe Myel, un inhibiteur du MCSF-1R ( macrophage colony-stimulating factor-1 receptor ) [ 4 ], le Ki20227, ce qui a permis de réduire spécifiquement la population des macrophages de la paroi aortique et de diminuer l’inflammation de cette paroi, et a empêché la formation d’un anévrisme disséquant chez ces souris. Enfin, le traitement des souris Jak2 Val617Phe Myel par un inhibiteur de la protéine JAK, le ruxolitinib, les a également protégées contre la formation de l’anévrisme.
Ainsi, nous avons mis en évidence le rôle pathogène de la mutation JAK2 Val617Phe dans la maladie aortique anévrismale chez la souris et chez l’homme. En utilisant différents modèles murins et des modulateurs pharmacologiques, nous avons montré que cette mutation induit un phénotype pro-inflammatoire des macrophages vasculaires résidents, responsable de la production locale de protéases matricielles, de cytokines et de chimiokines. Ces macrophages favorisent le remodelage délétère de la paroi aortique, qui est ensuite aggravé par le recrutement de monocytes du compartiment sanguin ( Figure 1 ). La déplétion des macrophages résidents ou l’inhibition pharmacologique de l’activité de la protéine kinase JAK2 protège les souris contre la maladie aortique induite par la mutation.
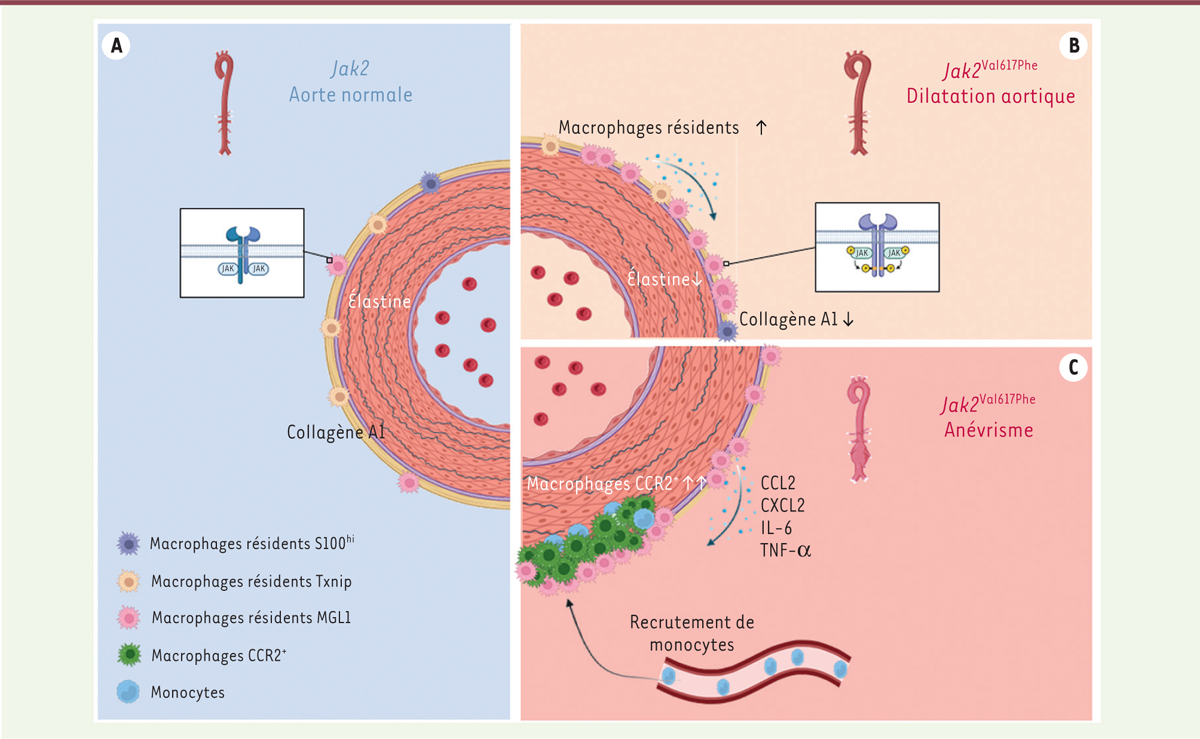
| Figure 1.
La mutation JAK2Val617Phe dans les macrophages résidents de l’aorte favorise le développement d’anévrismes disséquants. A.
En conditions physiologiques, la paroi aortique contient des macrophages résidents et du collagène dans l’adventice, et quatre ou cinq couches de lames élastiques dans la média.
B..
En présence de la mutation
JAK2
Val617Phe
, les macrophages résidents prolifèrent dans la paroi aortique et libèrent des cytokines et chimiokines pro-inflammatoires (CCL2 [
C-C motif chemokine ligand 2
], CXCL2 [
C-X-C motif chemokine ligand 2
], IL [interleukine]-6, TNF-α [
tumor necrosis factor alpha
]). Des métalloprotéases sont également libérées et induisent une destruction de la paroi (destruction du collagène et de l’élastine) responsable de la dilatation puis de l’anévrisme aortique.
C.
Au stade anévrismal, les monocytes circulants exprimant CCR2 (CCR2
+
) sont recrutés dans la paroi aortique, où ils se différencient en macrophages et aggravent l’inflammation pariétale, ce qui provoque la dissection. MGL1 :
macrophage galactose-type C lectin 1
; Txnip :
thioredoxin-interacting protein
.
|