| |
| Med Sci (Paris). 39(5): 445–451. doi: 10.1051/medsci/2023066.Toxicité des immunothérapies anti-cancéreuses Guillaume Rouvet1 and Olivier Lambotte1* 1Université Paris-Saclay, AP-HP, hôpital Bicêtre, service de médecine interne et d’immunologie clinique, UMR1184, Inserm, CEA
,
Le Kremlin-Bicêtre
,
France |
Vignette (© Olivier Lambotte).
Selon l’Organisation mondiale de la santé, le cancer restait, en 2020, la seconde cause de mortalité dans le monde avec près de dix millions de décès relevés cette année-là [
1
]. Depuis la seconde moitié du
xx
e
siècle, des progrès conséquents, en termes de thérapeutique anti-cancéreuse, ont été réalisés. Le développement de la chimiothérapie et de la radiothérapie ont en effet permis d’augmenter considérablement la survie des patients. Plus récemment, la compréhension des mécanismes moléculaires, génétiques et immunologiques participant au développement des tumeurs solides ou des hémopathies malignes, a permis d’identifier de nouvelles cibles thérapeutiques, et donc de développer de nouvelles molécules ciblant les mécanismes impliqués. Les thérapies ciblées et l’immunothérapie constituent ainsi depuis deux décennies des armes devenues indispensables dans le traitement des cancers et un champ de recherche clinique en pleine expansion.
L’immunothérapie consiste non seulement à cibler les cellules tumorales avec des anticorps comme le cétuximab ou le trastuzumab ou certains de leurs dérivés conjugués à des drogues cytotoxiques ou à utiliser des lymphocytes T cytotoxiques comme les TIL (
tumor-infiltrating T cells
) ou les cellules CAR T (
chimeric antigen receptor T cells
) pour détruire les cellules tumorales, mais aussi à agir sur les mécanismes qui permettent aux cellules tumorales d’échapper au système immunitaire. De nombreuses immunothérapies développées actuellement ciblent les points de contrôle immunitaire, impliqués dans l’inhibition de la réponse adaptative anti-tumorale, afin de les inhiber et ainsi libérer l’action cytotoxique des lymphocytes T infiltrant les tumeurs.
|
En partie due aux lymphocytes T et aux cellules NK (
natural killer
), la surveillance immunitaire a pour rôle d’éliminer les cellules tumorales qui apparaissent dans notre organisme. Elle met en jeu de multiples mécanismes. Ce sont des molécules impliquées dans certains de ces mécanismes qui ont servi de cibles pour le développement de molécules utilisées en immunothérapie. Ces molécules sont principalement des anticorps monoclonaux qui, en se liant à des points de contrôle du système immunitaire (
immune checkpoint
, ICP), les inhibent. Physiologiquement, ces points de contrôle sont des molécules exprimées par les cellules immunitaires qui permettent d’éteindre une réponse qui a atteint son objectif, mais également de maintenir quiescents des lymphocytes auto-réactifs ciblant les molécules du soi. Ces anticorps, appelés inhibiteurs de points de contrôle immunitaire (ou
ICP inhibitors
[ICPi]) ciblent notamment CTLA-4 (
cytotoxic T lymphocyte-associated protein 4
), comme l’ipilimumab, et PD-1 (
programmed cell-death 1
), comme le pembrolizumab ou le nivolumab, ou son ligand PD-L1 (
programmed cell-death ligand 1
), comme l’atezolizumab.
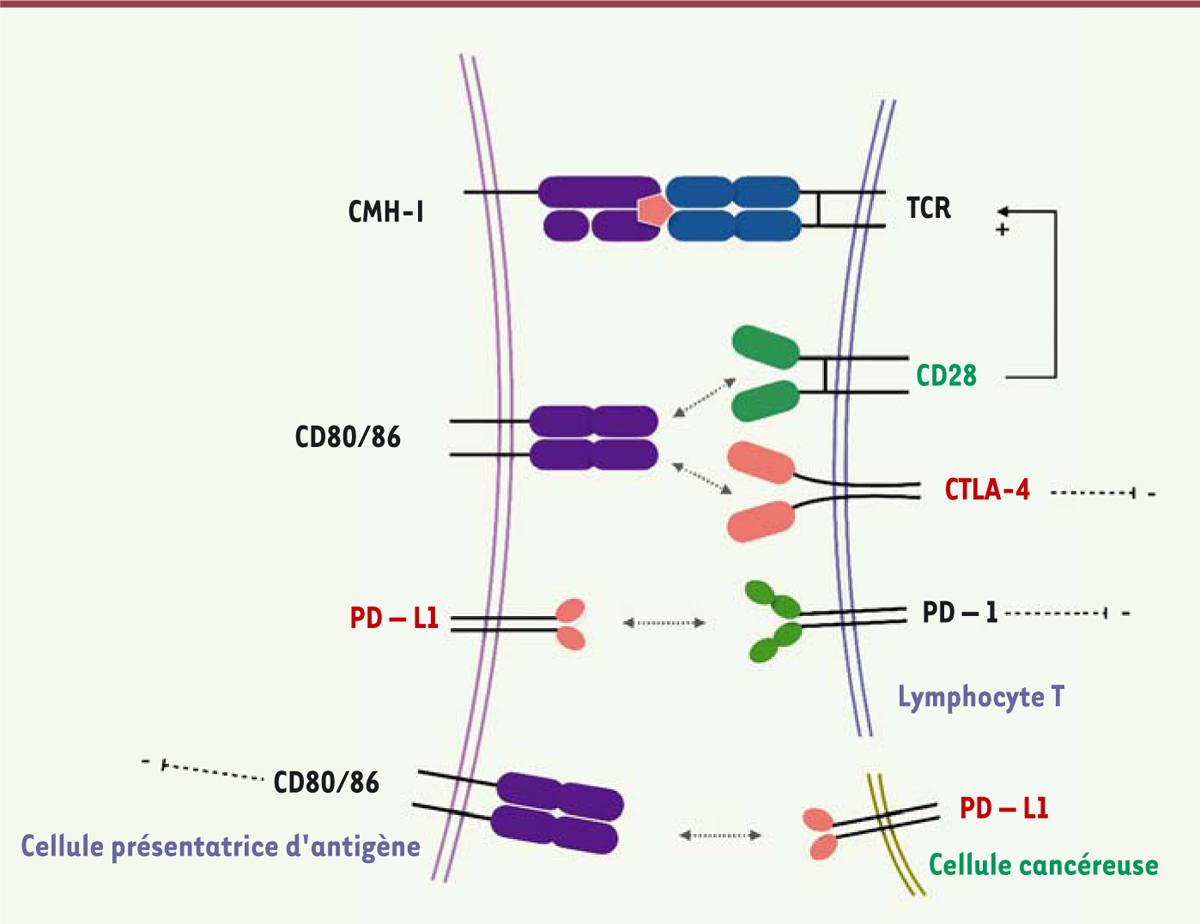
CTLA-4, exprimé par les lymphocytes T régulateurs et les lymphocytes T activés, inhibe le signal de co-stimulation donné par la liaison de CD28 à ses deux ligands présents à la surface des cellules présentatrices d’antigènes, CD80 et CD86 (B7-1 et B7-2). CTLA-4 se lie en effet avec une plus grande affinité que CD28 à ces deux molécules. La liaison de CTLA-4 à CD80 et CD86 permet ainsi d’activer les cascades moléculaires aboutissant à l’anergie lymphocytaire T. PD-1 est, quant à lui, exprimé à la surface de nombreuses cellules immunitaires (lymphocytes B, monocytes, cellules dendritiques, et lymphocytes infiltrant la tumeur), mais majoritairement par les lymphocytes T activés. Son ligand PD-L1 est exprimé par les cellules présentatrices d’antigènes, mais a aussi été détecté à la surface de cellules cancéreuses. La liaison de PD-1 à PD-L1 induit une cascade de signalisation menant à la régulation négative des mécanismes moléculaires à l’origine de la réponse pro-inflammatoire induite par l’activation du TCR (
T cell receptor
) des lymphocytes T. Cette liaison contribue ainsi à limiter la prolifération et la survie des cellules (
Figure 1
) [
2
].
 | Figure 1.
Les mécanismes d’activation et d’inhibition de la réponse lymphocytaire T.
En réponse à la présentation antigénique
via
les molécules du complexe majeur d’histocompatibilité (CMH) des cellules présentatrices, à son récepteur, le TCR (
T-cell receptor
), le lymphocyteT est activé. Un signal de co-stimulation est induit par la liaison concomitante de CD80/CD86 à CD28. CTLA-4 qui se lie avec une plus grande affinité que CD28 à CD80 et CD86 inhibe le signal de co-stimulation donné par l’engagement de CD28, aboutissant à l’anergie lymphocytaire T. PD-1 est majoritairement exprimé par les lymphocytes T. Son ligand PD-L1 est présent sur les cellules présentatrices d’antigènes. La liaison entre PD-1 et PD-L1 inhibe l’activation lymphocytaire. PD-L1 est aussi présent à la surface de cellules cancéreuses. Sa liaison à CD80/86 des cellules présentatrices interfère avec la réponse de ces cellules.
|
Physiologiquement, ces mécanismes de régulation participent au contrôle de la réponse immunitaire dirigée contre les antigènes du soi, ce qui permet de contrôler une possible auto-immunité et de maintenir la tolérance du soi, ainsi que de contrôler la durée et l’intensité de la réponse immunitaire contre des agents pathogènes par exemple.
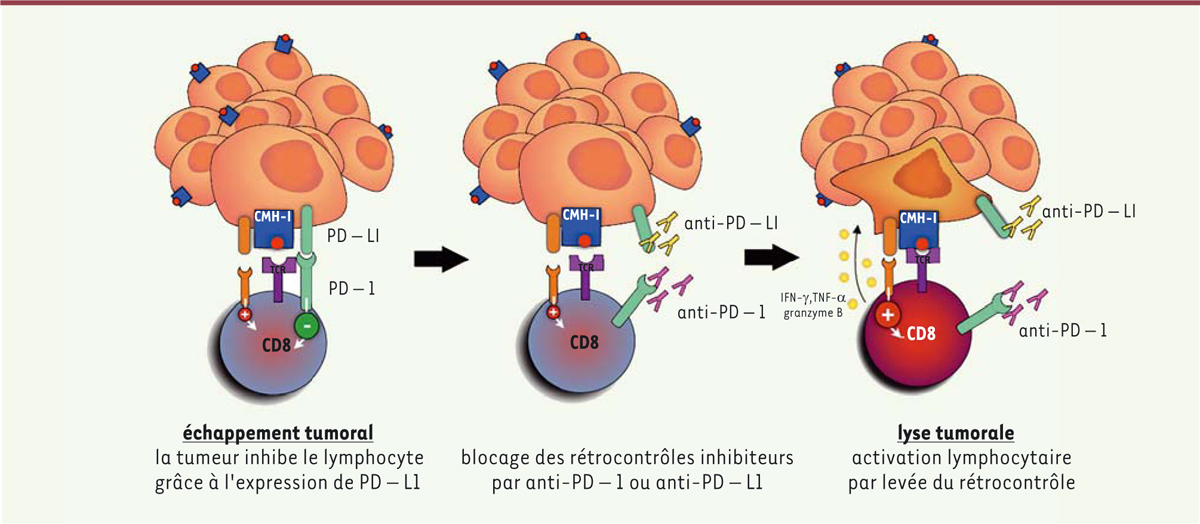
Les cellules tumorales, par divers mécanismes qui ne sont encore actuellement que partiellement compris, et qui incluent des modifications du micro-environnement tumoral par la production de métabolites, ou par une expression de CTLA-4 par les lymphocytes T présents dans ce micro-environnement [
3
], ou encore par une expression accrue de molécules comme PD-L1, détournent ces mécanismes de régulation pour bloquer la réponse anti-tumorale. La résultante est le détournement des ICP en faveur de la tumeur qui échappe alors à la surveillance immunitaire. Bloquer ces molécules inhibitrices permet donc de restaurer la défense anti-cancéreuse altérée (
Figure 2
).
 | Figure 2.
Mécanisme d’action des anticorps anti-PD-1 et anti-PD-L1
(extrait de [
13
]). IFN-γ : interféron gamma ; TNF-α :
tumor necrosis factor alpha
.
|
En ciblant ces systèmes moléculaires, qui impliquent des acteurs clés de la tolérance immunitaire au soi, l’immunothérapie expose cependant à un certain nombre d’effets indésirables dysimmunitaires, appelés toxicités « immuno-médiées », des effets secondaires immunologiques (ESI) qui diffèrent des toxicités classiquement observées avec les traitements par chimiothérapies ou par des thérapies ciblées. Les mécanismes à l’origine de ces toxicités sont multiples. Ils impliquent des facteurs intrinsèques au patient traité (génétique, microbiote, etc.) mais aussi des facteurs du micro-environnement tumoral [
4
]. Plusieurs études ont montré l’existence chez les patients d’une susceptibilité préexistante à l’auto-immunité, et donc aux toxicités des immunothérapies, avec une part de susceptibilité génétique polygénique, peu identifiée, impliquant divers polymorphismes nucléotidiques, ou certains haplotypes du complexe majeur d’histocompatibilité HLA (
human leukocyte antigen comple
x), et une part d’auto-immunité infraclinique pré-existante. Dans de nombreux modèles animaux, des études ont en effet mis en évidence la présence de lymphocytes T autoréactifs, sans qu’il n’y ait de manifestations cliniques auto-immunes. Chez l’homme, dans le cancer du poumon non à petites cellules, une étude a montré l’existence d’un lien entre le développement d’ESI, la réponse au traitement et la présence avant traitement d’anticorps communément associés à des manifestations auto-immunes, comme les facteurs anti-nucléaires ou le facteur rhumatoïde [
5
]. Une inflammation pré-existante (une colite ou l’inflammation pulmonaire des fumeurs, par exemple) pourrait également participer au développement de ces effets secondaires immunologiques. Le rôle du microbiote serait alors important [
6
]. Les données concernant les patients présentant des maladies auto-immunes restent cependant limitées, ces patients étant souvent exclus des essais cliniques testant l’effet des immunothérapies. Les données de la littérature sont néanmoins maintenant concordantes pour suggérer que certains sous-groupes de patients sont à risque élevé de développer des poussées de leur maladie sous immunothérapie, voire de nouvelles manifestations auto-immunes [
7
]
1
.
À ces facteurs intrinsèques au patient, s’ajoutent des mécanismes qui dérégulent l’équilibre immunitaire avec, comme conséquences, une activation des lymphocytes T dont les T résidents mémoires et les Th17, et une diminution des lymphocytes T régulateurs (Treg). Ces modifications pourraient contribuer à la rupture de la tolérance du soi et donc participer à la survenue des ESI liés à l’immunothérapie. Un exemple est l’activation du complément par l’ipilimumab (IgG1) sur les Treg et les cellules de l’hypophyse qui expriment CTLA-4 conduisant à des hypophysites. Les profils d’expression de cytokines sont également modifiés par les anticorps anti-PD-1 ou anti-CTLA-4, avec une augmentation de la production de cytokines pro-inflammatoires, comme le TNF-α (
tumor necrosis factor alpha
) ou d’IL (interleukine)-2, responsable de la prolifération des lymphocytes T [
8
].
Associés à ces mécanismes de dérégulation de l’équilibre immunitaire, des mécanismes tumoraux conduisant à des ESI ont été mis en évidence, comme l’expression d’antigènes du soi par les cellules tumorales conduisant à l’activation de lymphocytes auto-réactifs et à une toxicité immuno-médiée. Les uvéites survenant sous immunothérapie pourraient ainsi être liées à l’expression aberrante par la tumeur d’antigènes exprimés par l’uvée (iris, corps ciliaire et choroïde) [
9
]. C’est aussi le cas pour les myocardites immuno-médiées dans lesquelles une réactivité croisée entre des peptides tumoraux et des peptides myocardiques a été montrée [
10
]. De même, la présentation de multiples néo-antigènes par la tumeur serait à l’origine d’une diversification du répertoire T, favorisant la survenue d’ESI. Un rôle du profil mutationnel et donc de la présentation d’antigènes aberrants du soi en quantités importantes au système immunitaire par la tumeur a ainsi été suggéré [
11
].
Le micro-environnement tumoral pourrait par ailleurs constituer un autre facteur important dans le développement des toxicités de l’immunothérapie. Certaines cellules du micro-environnement tumoral, comme les fibroblastes ou les cellules endothéliales, qui participent à la néovascularisation tumorale, expriment en effet PD-L1. PD-L1, interagissant avec PD-1, pourrait favoriser un environnement propice au développement de toxicités immuno-médiées par rupture des mécanismes de tolérance. Des données récentes suggèrent également un rôle potentiel du microbiote dans l’émergence d’effets indésirables liés à l’immunothérapie [
12
]. La description de réactions immuno-géniques croisées entre des peptides issus d’un bactériophage et des peptides tumoraux présentés par les molécules du CMH de classe I chez des patients atteints de mélanome en est un bon exemple [
32
] (
→
).
(→) Voir la Nouvelle de M. Sroussi
et al
.,
m/s
n° 11, novembe 2021, page 970
|
Les effets secondaires des immunothérapies
Bien qu’étant une arme majeure du traitement du cancer, qui a connu un développement fulgurant au cours de la dernière décennie, l’immunothérapie présente des limites qui représentent des défis importants dans la gestion des effets secondaires et leur prise en charge. Les ESI peuvent affecter tous les organes, voire plusieurs simultanément, ce qui nécessite une prise en charge multidisciplinaire des patients. La gravité des effets secondaires varie. Elle est difficilement prévisible et s’évalue différemment selon le type de manifestations et l’organe touché. Les effets secondaires peuvent se manifester très tôt après le début du traitement, comme cela peut être le cas avec une chimiothérapie classique, mais ils ne surviennent le plus souvent que plusieurs mois après l’initiation du traitement, voire, parfois, après plusieurs années de prescription. La médiane d’apparition des effets secondaires est de 40 jours, mais il a été rapporté des ESI jusqu’à cent semaines après l’introduction du traitement. Certains ESI ont même été décrits après l’arrêt de l’immunothérapie. La question de l’imputabilité de ces effets secondaires au traitement est, dans ce cas, une question majeure et nécessite que le clinicien ait connaissance des spécificités de ces traitements [
13
]. En fonction du type de molécule utilisée, le profil de toxicité peut en effet être différent. Bien que la majorité des effets secondaires provoqués par les ICPi soient mineurs (de grade 1 ou 2) et facilement gérés en arrêtant le traitement (dès le grade 2) et en prenant en charge les symptomatologies (prurit, éruption cutanée, asthénie modérée, diarrhée), des effets indésirables ayant un impact sévère sur la qualité de vie ou mettant en jeu le pronostic vital (grades 3 à 5) peuvent survenir chez les patients, avec un pourcentage non négligeable de cas. L’analyse de séries de cas montre ainsi que les anticorps anti-CTLA-4 ont une plus grande toxicité : 20 à 25 % des patients traités avec ces anticorps présenteront une toxicité de grade 3 ou supérieure, contre seulement 7 à 12 % des patients traités par les anticorps anti-PD-1 ou anti-PD-L1 [
14
]. Les ESI associés aux anticorps anti-PD-1 et anti-PD-L1 sont similaires. Ces observations montrent ainsi la nécessité d’une prise en charge pluridisciplinaire et d’une vigilance accrue lors de l’utilisation de ces thérapeutiques (
Tableau I
).
Tableau I.
| Effets secondaires |
Fréquences |
Délai d’apparition en semaines (médiane) |
| Dermatologiques |
Éruption
: 0-73 %
Prurit
: 1-50 %
|
2 à 150 (4) |
|
| Gastro-intestinaux |
Diarrhée
:
35-54 % (anti-CTLA-4)
20 % (anti-PD-1)
Colite
:
12 % (anti-CTLA-4)
1 % (anti-PD-1)
Hépatite
:
1-25 % (anti-CTLA-4)
1-6 % (anti-PD-1)
|
1 à 107,5 (6) |
|
| Pulmonaires |
< 1 % (anti-CTLA-4)
1-3 % (anti-PD-1) |
1,5 à 127 (34) |
|
| Endocriniens |
Hypothyroïdie
:
8-14 % (anti-CTLA-4)
6-22 % (anti-PD-1)
Hypophysite
:
4-5 % (anti-CTLA-4)
< 1 % (anti-PD-1)
|
1,5 à 130 (14,5) |
|
| Neurologiques |
3,8 % (anti-CTLA-4)
6 % (anti-PD-1) |
1 à 68 (4) |
|
| Oculaires |
< 1 % |
1 à 72 (7) |
|
| Rhumatologiques |
15 à 40 % |
1 à 127 (38) |
|
| Hématologiques |
3-4 % |
1 à 84 (5,7) |
|
| Rénaux |
2,2 % |
6,5 à 21 (14) |
|
| Cardiovasculaires |
< 0,1 % |
2 à 54 (6) |
Fréquences et délai d’apparition des effets secondaires principaux liés aux immunothérapies
(selon [
8
] et [
15
]).
|
Pour prendre en charge ces effets indésirables graves, parfois peu courants, une prise en charge qui peut être différente de celle mise en place pour soigner les manifestations auto-immunes classiques non iatrogènes, les oncologues et les hématologues se retrouvent confrontés à des situations qui nécessitent l’intervention de spécialistes d’organes ou de médecins ayant une compétence en médecine interne. L’
American Society of Clinical Oncology
(ASCO) a publié en 2021 une mise à jour des recommandations pour la prise en charge des toxicités liées aux inhibiteurs de points de contrôle immunitaire [
15
] (
Tableau II
).
Tableau II.
| Grade |
Conduite à tenir |
|
1
|
Surveillance rapprochée, poursuite du traitement (sauf dans le cas de certaines toxicités hématologiques, neurologiques ou cardiaques) |
|
|
2
|
Envisager l’arrêt du traitement jusqu’à résolution ou retour au grade 1. Une corticothérapie (0,5-1mg/kg) peut être administrée |
|
|
3
|
Suspension du traitement et initiation d’une corticothérapie à haute dose.
Reprise possible selon évolution |
|
|
4
|
Arrêt définitif du traitement et corticothérapie à haute dose
(sauf dans le cas des endocrinopathies) |
Classification en grade des effets secondaires liés à l’immunothérapie et conduite à tenir
(selon l’
American Society of Clinical Oncology
, 2021).
|
Les manifestations dermatologiques
Les manifestations dermatologiques sont les manifestations les plus fréquentes, aussi bien avec les anticorps anti-CTLA-4 qu’avec les anticorps anti-PD-1. Sous traitement par les anticorps anti-CTLA-4, ces affections dermatologiques sont souvent précoces. Elles sont classées en trois grandes catégories : les réactions inflammatoires, les réactions bulleuses et les réactions sévères, comme le syndrome de Stevens-Johnson
2
ou les pustuloses exanthémateuses aiguës généralisées.
Les réactions inflammatoires sont les plus courantes : elles se manifestent par un prurit, une éruption maculo-papuleuse, parfois des réactions lichénoïdes, psoriasiformes ou granulomateuses. Le vitiligo est en particulier associé à l’utilisation des anticorps anti-PD-1 dans le mélanome. Il serait un marqueur prédictif positif de la réponse au traitement. Des cas d’alopécie ont également été rapportés. Les réactions sévères (grade supérieur à 2) sont rares. Elles nécessitent cependant l’arrêt du traitement et doivent être prises en charge par une équipe spécialisée. Les corticoïdes sont le traitement de référence, sous forme de dermocorticoïdes, mais ils sont rarement introduits par voie générale en dehors des réactions graves. Le traitement symptomatique (antihistaminiques, émollients) reste la base de la prise en charge [
16
].
Les manifestations gastro-intestinales
Les manifestations gastro-intestinales sont fréquemment rencontrées. Elles touchent principalement les voies digestives basses, et sont à l’origine de colites auto-immunes ou d’entérocolites. Les voies digestives hautes sont rarement affectées. Les colites auto-immunes se traduisent principalement par des diarrhées. La méthode diagnostique de référence est l’endoscopie. La physiopathologie de ces atteintes digestives reste peu comprise, mais l’impact du microbiote semble important. L’effet que peut avoir une transplantation fécale dans la gestion de ces effets secondaires est en cours d’étude. La prise en charge recommandée actuellement repose sur l’utilisation de corticoïdes, voire de traitements anti-inflammatoires, comme l’infliximab (un anticorps chimérique anti-TNF-α), ou le védolizumab en cas de corticorésistance, ou en seconde ligne [
17
]. Les hépatites auto-immunes se manifestent dans moins de 10 % des cas. Elles sont le plus souvent asymptomatiques et repérées par le dosage sanguin des enzymes hépatiques. Les hépatites fulminantes sont rares. La prise en charge repose sur la surveillance, l’administration de corticoïdes, voire d’immunosuppresseurs comme le mycophénolate mofétil, en cas de grade supérieur à 2 [
6
,
18
-
20
]. Des pancréatites auto-immunes, induites par l’immunothérapie, ont été rapportées. Mais elles restent des manifestations rares contrastant avec une élévation isolée de la lipase, le plus souvent sans conséquence.
Les manifestations pulmonaires
Les effets indésirables pulmonaires sont moins fréquents. Ils sont majoritairement induits par les anticorps anti-PD-1 et anti-PD-L1, chez les patients présentant des cancers pulmonaires, et de façon plus prévalente chez les patients présentant des comorbidités pulmonaires, ou chez les fumeurs, suggérant un effet potentiel de l’inflammation chronique dans le développement de ces toxicités. Il s’agit de différentes formes de pneumopathie interstitielle dont le diagnostic peut être difficile chez les patients atteints de cancer, avec une dyspnée, dont les causes sont nombreuses (métastases pulmonaires, embolie pulmonaire, anémie, infections, etc.). Face à une présentation clinique aspécifique, pouvant associer toux, dyspnée ou augmentation des besoins en oxygène, le diagnostic reposera sur l’imagerie par tomodensitométrie et, si nécessaire, une bronchoscopie. La prise en charge consistera en la prise de corticoïdes, sans qu’il n’y ait de recommandations claires pour les situations de corticorésistance. Certaines études montrent l’efficacité du mycophénolate mofétil ou des immunoglobulines intraveineuses (IgIV)
3
[
21
].
Les manifestations endocriniennes
Dans environ 10 % à 15 % des cas, une toxicité endocrine se manifeste à la suite des immunothérapies. Les dysthyroïdies sont les plus communes. Elles prennent majoritairement la forme d’hypothyroïdie, même si une hyperthyroïdie est possible, souvent transitoire. Les insuffisances surrénales primaires ou secondaires sont également possibles. Pour adapter la substitution médicamenteuse et ne pas aggraver d’autres déficits, en cas d’atteinte centrale, il est important de distinguer une atteinte centrale d’une atteinte périphérique. L’ipilimumab a été décrit comme étant à l’origine d’hypophysites, qui conduisent à des déficits hormonaux centraux. Des troubles visuels et des céphalées peuvent en être la manifestation clinique et doivent alerter le clinicien [
22
]. L’intérêt de la corticothérapie ou des traitements immunosuppresseurs dans la prise en charge des endocrinopathies induites par l’immunothérapie, n’a pas été démontré, en dehors de la substitution cortisonique des insuffisances surrénales. En effet, la substitution hormonale et la surveillance des paramètres biologiques hormonaux (TSH [
thyroid-stimulating hormone
], cortisol, ACTH [
adreno-corticotropic hormone
], etc.) permet de gérer les symptômes et de poursuivre le traitement dans la majorité des cas [
23
].
Les manifestations neurologiques et oculaires
Les manifestations neurologiques liées à l’immunothérapie sont multiples et peuvent toucher le système nerveux central et le système nerveux périphérique. Elles concernent 3 à 6 % des patients traités et se manifestent, dans plus de la moitié des cas, par des céphalées de grade 1. Néanmoins, des méningites aseptiques, des encéphalites, des syndromes de Guillain-Barré, des myasthénies, des neuropathies périphériques ou d’autres syndromes démyélinisants, ont été rapportés. La prise en charge nécessite toujours l’arrêt, au moins temporaire, du traitement, en plus des corticoïdes, en association, parfois, avec des échanges plasmatiques, l’administration d’IgIV ou de rituximab [
24
].
Les atteintes oculaires, également documentées, sont rares (3 % des patients traités). Un syndrome sec, des uvéites et des épisclérites sont des manifestations qui ont été rapportées dans la littérature. Le traitement repose généralement sur la corticothérapie topique, et ne nécessite pas, dans les cas d’atteinte isolée, d’arrêt du traitement. Rarement, des corticoïdes devront être administrés par voie générale [
25
].
Les manifestations rhumatologiques
Les effets indésirables rhumatologiques sont variés. Ils incluent des arthralgies, des myalgies et des arthrites. Près de 40 % des patients traités présentent de tels symptômes [
15
]. Leur prise en charge repose sur la corticothérapie, voire sur des biothérapies, les anti-inflammatoires non stéroïdiens restant peu efficaces. Toutes les articulations peuvent être touchées, parfois très à distance du traitement. Des formes cliniques ressemblant à des rhumatismes inflammatoires, polyarthrite rhumatoïde ou pseudo-polyarthrite rhizomélique, ont été décrites, sans que les auto-anticorps typiquement associés aux connectivites n’aient été retrouvés. La prise en charge de ces formes reste toutefois identique [
26
]. Les myosites sont rares mais potentiellement fatales [
27
]. Généralement séronégative (sans auto-anticorps), elles peuvent avoir une évolution fulminante, avec une rhabdomyolyse majeure (destruction des cellules musculaires) affectant le muscle cardiaque. Le pronostic, lorsqu’une myocardite auto-immune est associée, est généralement défavorable [
10
].
Les toxicités hématologiques
La toxicité hématologique des immunothérapies a une présentation hétérogène, allant de la simple éosinophilie asymptomatique à l’aplasie médullaire réfractaire. De multiples facteurs confondants rendent complexe l’évaluation de l’imputabilité du traitement. Des cas d’anémie hémolytique auto-immune, de purpura thrombocytopénique immunologique, et de neutropénie auto-immune, qui correspondent à 60 % des effets secondaires hématologiques, ont été décrits. La prise en charge repose sur l’utilisation de corticoïdes (sauf dans le cas des neutropénies, afin de diminuer le risque infectieux), de facteurs de croissance, d’IgIV, ou sur un support transfusionnel, avec un arrêt temporaire du traitement. L’aplasie médullaire est rare mais généralement fatale. Peu corticosensible, sa prise en charge nécessite un centre spécialisé. Des cas d’hémophilie acquise ont également été décrits [
28
].
Les atteintes rares
L’atteinte rénale est rare. Elle est observée chez 1 à 2 % des patients traités, mais tend à être majorée en cas de combinaisons d’anticorps. La forme majeure est une néphropathie interstitielle aiguë, dans plus de 90 % des cas. Les diagnostics différentiels sont multiples et l’évaluation de la fonction rénale est un élément majeur avant le traitement et pendant toute sa durée. La biopsie rénale n’est généralement pas nécessaire, et la prise en charge repose sur l’arrêt des ICPi et sur la corticothérapie, si le diagnostic est fortement suspecté [
29
].
Les effets secondaires cardiovasculaires restent rares, mais sont les plus sévères. Ils incluent avant tout des myocardites, mais aussi des péricardites, une insuffisance cardiaque, une maladie thromboembolique et des cas rares de vascularites immuno-induites. La corticothérapie et les thérapeutiques immunosuppressives, en plus des mesures de réanimation cardiovasculaire, sont souvent nécessaires [
30
].
|
Conclusion et perspectives La prise en charge des toxicités induites par les immunothérapies repose sur l’administration de corticostéroïdes, dès lors que le grade est supérieur à 2, et sur l’interruption momentanée ou définitive du traitement, sauf pour les endocrinopathies immuno-induites. Face à des thérapeutiques qui ont amélioré le pronostic d’un grand nombre de maladies malignes, il est important d’évaluer la balance bénéfice-risque afin ne pas interrompre un traitement efficace, tout en préservant la qualité de vie des patients. La compréhension des mécanismes impliqués dans la physiopathologie des effets secondaires de ces traitements est donc essentielle pour mieux prendre en charge ces patients. L’utilisation d’immunothérapies combinées (anticorps anti-PD-1 associé à un anticorps anti-CTLA-4) est liée à une augmentation de la fréquence des effets indésirables et de leur gravité. La multiplication des indications de bi-immunothérapies va donc, probablement, augmenter la fréquence des effets secondaires induits, notamment les manifestations considérées comme rares (rénales, cardiovasculaires, etc.). La recherche de marqueurs biologiques prédictifs, l’évaluation du lien de ces effets avec des maladies auto-immunes pré-existantes (qui ne sont pas des contre-indications aux ICPi), ou encore l’évaluation des effets secondaires lors d’association avec d’autres thérapies anti-cancéreuses, sont donc nécessaires et constituent les défis de l’avenir pour mieux intégrer ces molécules à l’arsenal thérapeutique oncologique. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Ferlay
J
,
Colombet
M
,
Soerjomataram
I
,
et al.
Cancer statistics for the year 2020 : An overview.
.
Int J Cancer.
2021
; Apr 5. doi :
10.1002/ijc.33588
.
2.
Bagchi
S
,
Yuan
R
,
Engleman
EG
.
Immune Checkpoint Inhibitors for the Treatment of Cancer : Clinical Impact and Mechanisms of Response and Resistance.
.
Annu Rev Pathol Mech Dis.
2021;
;
16
:
:223.
–
49
.
3.
Xia
L
,
Oyang
L
,
Lin
J
,
et al.
The cancer metabolic reprogramming and immune response.
.
Mol Cancer.
2021;
;
20
:
:28.
.
4.
Burke
KP
,
Grebinoski
S
,
Sharpe
AH
,
Vignali
DAA
.
Understanding adverse events of immunotherapy : A mechanistic perspective.
.
J Exp Med.
2021;
;
218
:
:e20192179.
.
5.
Toi
Y
Sugawara
S
,
Sugisaka
J
,
et al.
Profiling Preexisting Antibodies in Patients Treated With Anti–PD-1 Therapy for Advanced Non-Small Cell Lung Cancer.
.
JAMA Oncol.
2019;
;
5
:
:376.
–
383
.
6.
Dougan
M
,
Wang
Y
,
Rubio-Tapia
A
,
et al.
AGA clinical practice update on diagnosis and management of immune checkpoint inhibitor colitis and hepatitis : Expert Review.
.
Gastroenterology.
2021;
;
160
:
:1384.
–
93
.
7.
Menzies
AM
,
Johnson
DB
,
Ramanujam
S
,
et al.
Anti-PD-1 therapy in patients with advanced melanoma and preexisting autoimmune disorders or major toxicity with ipilimumab.
.
Ann Oncol.
2017;
;
28
:
:368.
–
376
.
8.
Ramos-Casals
M
,
Brahmer
JR
,
Callahan
MK
,
et al.
Immune-related adverse events of checkpoint inhibitors.
.
Nat Rev Dis Primers.
2020;
;
6
:
:38.
.
9.
Dow
ER
,
Yung
M
,
Tsui
E
.
Immune Checkpoint Inhibitor-associated Uveitis : Review of Treatments and Outcomes.
.
Ocul Immunol Inflamm.
2021;
;
29
:
:203.
–
11
.
10.
Johnson
DB
,
Balko
JM
,
Compton
ML
,
et al.
Fulminant myocarditis with combination immune checkpoint blockade.
.
N Engl J Med.
2016;
;
375
:
:1749.
–
1755
.
11.
Oh
DY
,
Cham
J
,
Zhang
L
,
et al.
Immune toxicities elicted by CTLA-4 blockade in cancer patients are associated with early diversification of the T cell repertoire.
.
Cancer Res.
2017;
;
77
:
:1322.
–
1330
.
12.
Gopalakrishnan
V
,
Helmink
BA
,
Spencer
CN
,
et al.
The influence of the gut microbiome on cancer, immunity, and cancer immunotherapy.
.
Cancer Cell.
2018;
;
33
:
:570.
–
580
.
13.
Laparra
A
,
Champiat
S
,
Michot
J-M
,
et al.
[
Management of adverse events associated with cancer immunotherapy.
].
Rev Prat.
2021;
;
71
:
:400.
–
7
.
14.
La Rochefoucauld
J
de
,
Noël
N
,
Lambotte
O
.
Management of immune-related adverse events associated with immune checkpoint inhibitors in cancer patients : a patient-centred approach.
.
Intern Emerg Med.
2020;
;
15
:
:587.
–
98
.
15.
Schneider
BJ
,
Naidoo
J
,
Santomasso
BD
,
et al.
Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy : ASCO guideline update.
.
J Clin Oncol.
2021;
;
39
:
:4073.
–
126
.
16.
Malviya
N
,
Tattersall
IW
,
Leventhal
J
,
et al.
Cutaneous immune-related adverse events to checkpoint inhibitors.
.
Clin Dermatol.
2020;
;
38
:
:660.
–
78
.
17.
Tang
L
,
Wang
J
,
Lin
N
,
et al.
Immune Checkpoint Inhibitor-associated colitis : From mechanism to management.
.
Front Immunol.
2021;
;
12
:
:800879.
.
18.
Cramer
P
,
Bresalier
RS
.
Gastrointestinal and hepatic complications of immune checkpoint inhibitors.
.
Curr Gastroenterol Rep.
2017;
;
19
:
:3.
.
19.
Thompson
JA
,
Schneider
BJ
,
Brahmer
J
,
et al.
Management of immunotherapy-related toxicities, Version 1.2019.
.
J Natl Compr Canc Netw.
2019;
;
17
:
:255.
–
289
.
20.
Martin
ED
,
Michot
J-M
,
Rosmorduc
O
,
et al.
Liver toxicity as a limiting factor to the increasing use of immune checkpoint inhibitors.
.
JHEP Report.
2020
;
:2.
.
21.
Chuzi
S
,
Tavora
F
,
Cruz
M
,
et al.
Clinical features, diagnostic challenges, and management strategies in checkpoint inhibitor-related pneumonitis.
.
Cancer Manag Res.
2017;
;
9
:
:207.
–
213
.
22.
Faje
AT
,
Sullivan
R
,
Lawrence
D
,
et al.
Ipilimumab-induced hypophysitis : a detailed longitudinal analysis in a large cohort of patients with metastatic melanoma.
.
J Clin Endocrinol Metab.
2014;
;
99
:
:4078.
–
4085
.
23.
Min
L
,
Hodi
FS
,
Giobbie-Hurder
A
,
et al.
Systemic high-dose corticosteroid treatment does not improve the outcome of ipilimumab-related hypophysitis : a retrospective cohort study.
.
Clin Cancer Res.
2015;
;
21
:
:749.
–
755
.
24.
Cuzzubbo
S
,
Javeri
F
,
Tissier
M
,
et al.
Neurological adverse events associated with immune checkpoint inhibitors : Review of the literature.
.
Eur J Cancer.
2017;
;
73
:
:1.
–
8
.
25.
Liu
X
,
Wang
Z
,
Zhao
C
,
et al.
Clinical diagnosis and treatment recommendations for ocular toxicities of targeted therapy and immune checkpoint inhibitor therapy.
.
Thorac Cancer.
2020;
;
11
:
:810.
–
8
.
26.
Kostine
M
,
Finckh
A
,
Bingham
CO
,
et al.
EULAR points to consider for the diagnosis and management of rheumatic immune-related adverse events due to cancer immunotherapy with checkpoint inhibitors.
.
Ann Rheum Dis.
2021;
;
80
:
:36.
–
48
.
27.
Shah
M
,
Tayar
JH
,
Abdel-Wahab
N
,
et al.
Myositis as an adverse event of immune checkpoint blockade for cancer therapy.
.
Semin Arthritis Rheum.
2019;
;
48
:
:736.
–
740
.
28.
Delyon
J
,
Mateus
C
,
Lambert
T
.
Hemophilia A induced by ipilimumab.
.
N Engl J Med.
2011;
;
365
:
:1747.
–
1748
.
29.
Perazella
MA
,
Shirali
AC
.
Immune checkpoint inhibitor nephrotoxicity : what do we know and what should we do?
Kidney Int.
2020;
;
97
:
:62.
–
74
.
30.
Jain
V
,
Bahia
J
,
Mohebtash
M
,
et al.
Cardiovascular complications associated with novel cancer immunotherapies.
.
Curr Treat Options Cardiovasc Med.
2017;
;
19
:
:36.
.
31.
van der Kooij
MK
,
Suijkerbuijk
KPM
,
Aarts
MJB
,
et al.
Safety and efficacy of checkpoint inhibition in patients with melanoma and preexisting autoimmune disease : A cohort study.
.
Ann Intern Med.
2021;
;
174
:
:641.
–
8
.
32.
Sroussi
M
,
Fluckiger
A
,
Zitvogel
L
.
Un bactériophage du microbiote intestinal induit une réponse anti-tumorale par un mécanisme de réactivité croisée.
.
Med Sci (Paris).
2021;
;
37
:
:970.
–
2
.
|