La maladie du greffon contre l’hôte ( graft versus host , GVH) est une complication majeure de la greffe allogénique de cellules hématopoïétiques. Elle est la traduction clinique de l’agression de tissus sains du receveur par les cellules immunitaires du donneur. Récemment, des travaux ont montré l’existence d’un lien, à la fois de causalité et de conséquence, entre la dysbiose digestive et la GVH. Ainsi, l’étude de modèles expérimentaux de la GVH a mis en évidence un appauvrissement de la diversité des bactéries commensales au profit de l’expansion de la bactérie Escherichia coli [ 1 , 2 ] ( → ).
(→) Voir la Nouvelle de B. Gaugler et al. , m/s n° 6-7, juin-juillet 2013, page 577
Depuis les années 1990, la translocation digestive du lipopolysaccharide (LPS) d’ E. coli , favorisée par un défaut de perméabilité de la barrière intestinale, a été identifiée à la fois comme un facteur déclenchant et comme un facteur de sévérité de la GVH [ 2 ]. Le LPS est un glycolipide composant la paroi des bactéries à Gram négatif, avec des propriétés inflammatoires reconnues. Des approches expérimentales avaient été proposées pour neutraliser cette molécule et ainsi prévenir ou réduire la sévérité de la GVH, mais leur application médicale s’est révélée décevante [ 2 ]. Depuis, la compréhension du métabolisme du LPS a progressé [ 2 ] ( Figure 1 ), en particulier dans le cadre du sepsis impliquant des bactéries à Gram négatif [ 3 ]. Grâce à sa structure lipidique, une partie du LPS peut être transportée dans l’organisme par les lipoprotéines, notamment les HDL ( high-density lipoproteins ), plus connues sous l’appellation « bon cholestérol ». La liaison aux lipoprotéines masque le domaine lipide A des LPS, qui possède l’activité pro-inflammatoire [ 3 ]. Ces lipoprotéines vont aussi permettre le transport des LPS vers le foie, où ils seront inactivés par l’action d’enzymes, comme l’acyloxyacyl hydrolase, puis excrétés dans la bile [ 3 ]. Cette voie de détoxification des LPS est appelée « transport inverse des LPS », par analogie avec le transport du cholestérol des tissus périphériques vers le foie [ 2 ]. Des protéines sériques, comme la protéine plasmatique de transfert des phospholipides, assurent le transfert des LPS circulants bioactifs sur les lipoprotéines [ 2 ] dans des conditions physiologiques. Les LPS bioactifs sont les LPS libres, c’est-à-dire non liés aux lipoprotéines. Ils sont responsables de l’activation des cellules de l’immunité innée par la voie du CD14/TLR4 ( toll-like receptor-4 ) ( Figure 1 ) [ 2 ]. Différents tests biologiques permettent de détecter les LPS libres [ 3 ], donc le risque d’activation du système immunitaire. Le plus utilisé est un test semi-quantitatif : le test LAL ( limulus amoebocyte lysate ), fondé sur la gélification d’un lysat de cellules immunitaires de la limule, les amibocytes, en présence de LPS libres [ 3 ]. Un autre test (Endoquant®), fondé sur la quantification directe du lipide A, permet de détecter à la fois les LPS libres et ceux liés aux lipoprotéines dans différents fluides biologiques tels que le sang. Ce test utilise la chromatographie liquide à haute performance associée à la spectrométrie de masse en tandem pour quantifier le 3-hydroxy-myristate du lipide A [ 4 ]. Outre le sepsis impliquant des bactéries à Gram négatif, où les LPS libres sont présents dans le sang en grande quantité, la présence de LPS libres circulants en quantités plus faibles exerce un effet dans de nombreuses maladies inflammatoires chroniques cardiovasculaires, rhumatismales ou hépatiques [ 3 ]. La présence de LPS libres dans le sang des patients en insuffisance rénale chronique participe également à l’inflammation chronique constatée chez ces patients. La transplantation rénale permet d’ailleurs de réduire la quantité de ces LPS libres, possiblement en corrigeant le métabolisme des lipoprotéines [ 5 ]. À la lumière de cette compréhension du métabolisme des LPS [ 2 ] et en utilisant le test Endoquant® [ 4 ], nous avons approfondi l’analyse du rôle des LPS de E. coli dans la pathogénie de la GVH et proposé un moyen de neutraliser leur activité pro-inflammatoire.
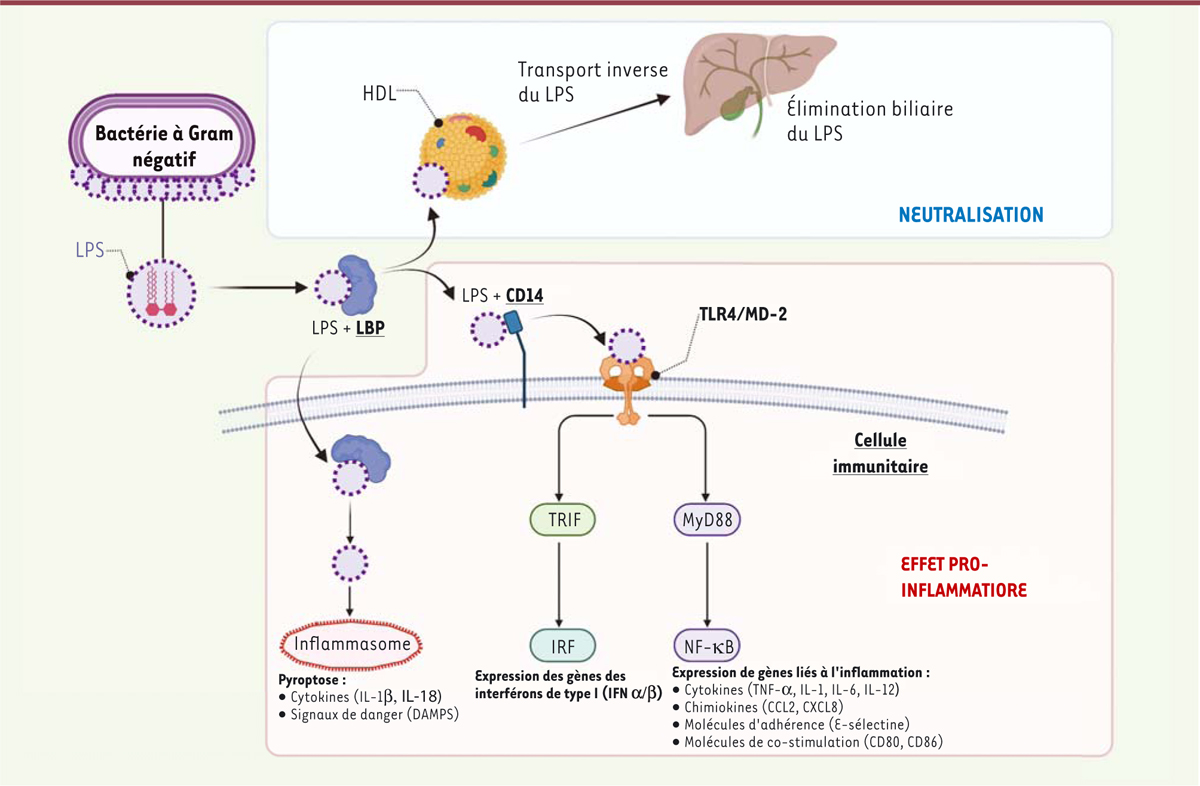
| Figure 1.
Le métabolisme des lipopolysaccharides.
Après leur translocation dans la circulation sanguine, les lipopolysaccharides (LPS) des bactéries intestinales à Gram négatif sont transportés par différentes protéines du plasma sanguin, dont la LBP (
LPS-binding protein
). Leur activité pro-inflammatoire est due à leur fixation à la molécule membranaire CD14 des cellules de l'immunité innée, suivie de leur capture par le complexe moléculaire TLR4 (
toll-like receptor 4
)/MD2 (
myeloid differentiation factor 2
). Deux voies de signalisation sont activées par le complexe LPS/TLR4/MD2 : les voies TRIF et MYD88, qui induisent la synthèse des cytokines inflammatoires (TNF-α, IL-1β, IL-6 et IL-12) ainsi que l'expression de molécules d'adhérence et de costimulation. Le LPS intracellulaire peut aussi activer l'inflammasome et induire une mort cellulaire inflammatoire : la pyroptose. De plus, le LPS peut se lier aux HDL (
high density lipoproteins
), ce qui permettrait de neutraliser son activité pro-inflammatoire (cadre bleu) : en effet, la liaison aux HDL masque la partie pro-inflammatoire des LPS, le lipide A, et permet leur transport vers le foie, où ils sont désactivés et sécrétés dans la bile. Un excès de translocation des LPS intestinaux dans le sang ou un défaut de neutralisation de leur activité pro-inflammatoire par les HDL majore l'inflammation. TRIF :
Toll-IL1-receptor (TIR) domain-containing adaptor-inducing IFN
β ; IRF :
interferon regulatory factors
; MyD88 :
myeloid differentiation primary response 88
; NF-κB :
nuclear factor-kappa B
. DAMP :
damage-associated molecular pattern molecules
, motifs moléculaires associés aux dégâts cellulaires (figure réalisée avec le logiciel BioRender).
|
Nous avons confirmé, dans deux modèles expérimentaux de GVH, l’augmentation de la forme libre, bioactive, des LPS circulants après une allogreffe de cellules hématopoïétiques [ 6 ]. Cette augmentation s’accompagne d’une baisse importante de la quantité de HDL circulantes six jours après l’allogreffe. Nous avons émis l’hypothèse que cette baisse des HDL entraînait une moindre neutralisation de l’activité pro-inflammatoire des LPS et leur moindre élimination biliaire par le foie. Nous avions en effet observé une aggravation des signes cliniques de la GVH et de la réponse alloréactive (impliquant les lymphocytes T CD4 + et CD8 + sécréteurs d’interféron-γ) chez des souris receveuses portant une mutation qui les rend déficientes en apolipoprotéine A1, la principale protéine constitutive des HDL (souris Apo1 tmUnc , caractérisées par un taux de HDL circulantes d’environ 25 % de sa valeur physiologique) [ 6 ] ( Figure 2 ). Cette observation nous a incités à évaluer l’effet d’une supplémentation en HDL dans un modèle murin de GVH, dans lequel nous avons montré que des injections répétées (de J-1 à J+20 post-greffe) de HDL isolées à partir de plasma humain réduisent la sévérité de la GVH. L’effet est surtout apparent dans le foie des souris traitées, dont on constate l’intégrité à l’examen macroscopique après autopsie, et où l’on note une réduction significative de l’inflammation des voies biliaires à l’examen histopathologique, ainsi qu’une réduction de l’infiltrat des macrophages dérivés des monocytes sanguins, qui viennent coloniser le foie lors du processus inflammatoire [ 6 ]. Ce traitement des souris diminue la sécrétion d’interleukine-12 (IL-12) par les cellules de Küpffer 1, [ 6 , 7 ] ( → ).
(→) Voir la Nouvelle de C. Blériot et F. Ginhoux, m/s n° 6–7, juin-juillet 2022, page 532
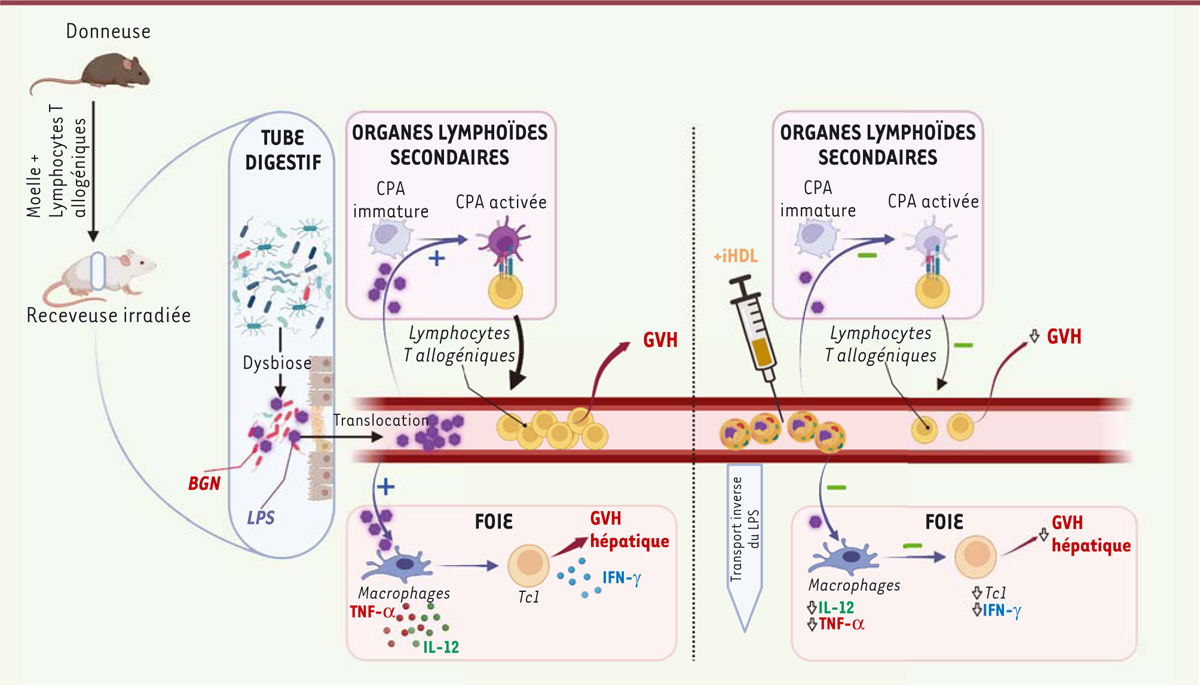
| Figure 2.
Modulation du métabolisme des lipopolysaccharides au cours de la maladie du greffon contre l'hôte et après l'administration répétée de lipoprotéines HDL dans un modèle murin.
Le conditionnement pré-greffe et la maladie du greffon contre l'hôte (
graft-versus-host
, GVH) sont à l'origine de la dysbiose et de la translocation des bactéries intestinales et de leurs constituants vers la circulation sanguine. Le lipopolysaccharide (LPS) libre circulant emprunte la voie pro-inflammatoire (
Figure 1
) avec l'engagement du récepteur TLR4 (
toll-like receptor 4
) stimulant les cellules présentatrices d'antigènes (CPA), que nous avons analysées dans la rate et le foie (sous-populations de macrophages, voir le texte principal). Cette activation des CPA aboutit à une boucle d'auto-amplification de la GVH et à des lésions intestinales et hépatiques accrues. La réponse alloréactive est associée à une baisse des HDL, ce qui réduit la neutralisation de l'activité pro-inflammatoire des LPS. Pour démontrer le rôle des HDL dans la sévérité de la GVH, des souris receveuses ont reçu des injections répétées de HDL isolées du plasma humain (iHDL) : cellesci ont entraîné une diminution de la réponse immunitaire allogénique. Dans le foie des souris traitées, on observe une diminution de l'infiltrat des lymphocytes T cytotoxiques (Tc1) et des macrophages dérivés des monocytes. Les deux populations de macrophages hépatiques (cellules de Küpffer et macrophages dérivés des monocytes) sécrètent moins d'interleukine-12 (IL-12). BGN : bactérie à Gram négatif ; iHDL : HDL injectées ; TNF-α : facteur de nécrose tumorale α ; IFN-γ : interféron γ (figure réalisée avec le logiciel BioRender).
|
et les macrophages dérivés des monocytes, et réduit l’infiltration hépatique des lymphocytes T cytotoxiques sécréteurs d’interféron-γ ( Figure 2 ). Il diminue également les taux circulants d’IL-6 [ 6 ]. En montrant cet effet anti-inflammatoire de l’administration intraveineuse de HDL dans un modèle murin de GVH, nous avons apporté la preuve de concept d’un nouveau traitement prophylactique de la GVH.
L’effet bénéfique des HDL ayant été préalablement établi dans le contexte de maladies cardiovasculaires, des approches de stimulation de l’efflux du cholestérol des cellules via les HDL ont été développées à des fins thérapeutiques. Ainsi, l’administration d’apolipoprotéine A1 permet de produire in vivo des HDL [ 8 ]. L’apolipoprotéine A1 interagit avec le transporteur membranaire ABCA1 ( ATP-binding cassette-A1 ) pour former les pré-HDL. L’apolipoprotéine A1 des pré-HDL ou des HDL2/3 2 interagit avec un autre transporteur membranaire de la même famille, ABCG1, pour produire les HDL matures. Ces mécanismes contribuent à l’efflux du cholestérol des cellules, permettant son retour vers le foie [ 9 ] ( → ).
(→) Voir la Nouvelle de E.L. Gautier et L. Yvan-Charvet, m/s n° 1, janvier 2011, page 9
Actuellement, des HDL reconstituées in vitro sont évaluées dans des essais cliniques pour extraire le cholestérol de la plaque d’athérome et agir ainsi contre les maladies cardiovasculaires [ 8 ].
Le mécanisme de la prévention de la GVH par administration répétée de HDL dans notre modèle murin reste à explorer. Après l’administration de HDL aux souris, nous avons constaté l’existence d’une corrélation entre la quantité des HDL plasmatiques et la quantité totale de LPS [ 6 ]. Une explication repose sur l’hypothèse selon laquelle la neutralisation des LPS par les HDL par un mécanisme d’efflux réduirait la sévérité de la GVH. Cependant, dans le modèle de souris génétiquement déficientes en apolipoprotéine A1, où la GVH est plus sévère, les quantités de LPS circulants sont plus faibles que chez les souris de génotype sauvage allogreffées [ 6 ], ce qui suggère un effet favorable intrinsèque de l’apolipoprotéine A1 ou des HDL en plus de leur effet de neutralisation des LPS. L’effet anti-inflammatoire de l’apolipoprotéine A1 et des HDL est connu. L’injection d’apolipoprotéine A1 dans un modèle d’athérosclérose diminue la quantité d’IL-6 circulante [ 10 ]. Les souris génétiquement déficientes en apolipoprotéine A1 (et par conséquent appauvries en HDL) ne présentent pas de phénotype immunitaire anormal, et la polarisation lymphocytaire chez ces souris est identique à celle des souris de génotype sauvage [ 6 ]. En revanche, chez ces souris déficientes en apolipoprotéine A1, l’arthrite expérimentale induite par le collagène bovin est plus sévère que chez les souris de génotype sauvage [ 1 ]. Comme dans la GVH [ 6 ], ces souris arthritiques déficientes en apolipoprotéine A1 présentent, dans leurs organes lymphoïdes secondaires, plus de lymphocytes Th1 et des cellules dendritiques activées [ 1 ]. Les HDL, quant à elles, interfèrent avec l’activation des macrophages en diminuant l’expression des TLR (dont certains reconnaissant le LPS, activateur de la GVH) et la synthèse des cytokines inflammatoires induite par l’activation de ces TLR [ 10 ]. Les HDL sont riches en sphingosine-1-phosphate, qui inhibe la synthèse de cytokines inflammatoires et la migration des lymphocytes T [ 10 ]. Ces processus jouent un rôle majeur dans la pathogénie de la GVH [ 1 ]. Les HDL peuvent aussi participer à l’épuration d’autres lipides inflammatoires d’origine bactérienne, comme l’acide lipotéchoïque de la paroi des bactéries à Gram positif, ou encore des lipides endogènes oxydés résultant de la mort cellulaire [ 3 ]. Les HDL épurent aussi le cholestérol des cellules présentatrices d’antigènes. Or l’accumulation de cholestérol dans ces cellules augmente leur capacité de présentation de l’antigène et la synthèse de cytokines inflammatoires [ 10 ]. Tous ces mécanismes peuvent concourir à l’effet protecteur de l’administration répétée des HDL contre la GVH, mis en évidence chez les souris après l’allogreffe de cellules hématopoïétiques.
Les causes de l’effondrement de la quantité de HDL circulantes pendant la GVH, dans le modèle murin, restent à préciser. Il pourrait s’agir d’une consommation accrue liée à l’épuration des lipides inflammatoires (bactériens ou endogènes) produits au cours de la GVH, ou d’un défaut de synthèse des HDL, fréquent au cours de l’inflammation. L’atteinte digestive initiale dans la GVH peut être responsable de l’effondrement des HDL circulantes, puisque environ deux tiers de l’apolipoprotéine A1 est produit par l’intestin grêle [ 12 ], qui est une cible de la GVH [ 1 ]. Enfin, il convient de noter qu’aucune donnée concernant les taux de HDL circulantes chez les patients allogreffés n’est encore disponible, information dont il sera pourtant nécessaire de disposer avant d’envisager une application médicale des résultats obtenus chez la souris.