| |
| Med Sci (Paris). 39(4): 390–391. doi: 10.1051/medsci/2023045.
Les répétitions PASTA de la protéine kinase StkP gouvernent la division de
Streptococcus pneumoniae
Anna Esposito-Farèse¹1* 1École normale supérieure de Lyon, département de biologie, Master Biosciences
,
Lyon
,
France MeSH keywords: Humains, Streptococcus pneumoniae, Protein-Serine-Threonine Kinases, Phosphorylation, Protéines bactériennes, métabolisme |
Pour toutes les cellules, les récepteurs membranaires sont fondamentaux pour intégrer de différents signaux intra- et extracellulaires. En particulier, ils sont essentiels à la survie des bactéries qui en dépendent pour s’adapter à leur environnement [
1
]. Pour mieux comprendre les mécanismes d’infection bactérienne chez l’homme, il est donc crucial d’identifier le rôle de ces récepteurs dans le cycle de vie bactérien. Parmi ces récepteurs, il a été montré récemment que les eSTK (
eukaryotic-like serine/threonine kinases
) sont indispensables pour la division de différentes cellules bactériennes [
2
,
3
]. Les eSTK sont surtout représentés chez les Firmicutes et les Actinobactéries [
2
]. Elles sont constituées de deux domaines : un domaine catalytique intracellulaire (kinase), similaire aux protéine-kinases des eucaryotes, et un domaine extracellulaire, absent chez les eucaryotes, composé d’un nombre variable de répétitions de domaines PASTA (
penicillin-binding-proteins and serine/threonine kinase associated domain
). Le nombre et la séquence de ces domaines PASTA diffèrent entre les espèces bactériennes, mais leur structure est conservée [
4
]. Les domaines PASTA de certaines eSTK peuvent se lier aux muropeptides pariétaux des bactéries, et pourraient donc servir de
senseur
de l’état de la paroi bactérienne [
5
]. Cependant, les mécanismes sous-jacents sont encore mal compris : les domaines PASTA pourraient avoir d’autres fonctions.
Dans une étude récente, Zucchini
et al.
ont exploré les rôles potentiels de ces domaines dans la multiplication bactérienne. Chez la bactérie
Streptococcus pneumoniae
, un modèle classique d’étude de bactérie à Gram positif de la famille des Firmicutes, ils ont étudié le récepteur StkP (
serine/threonine-protein kinase P
), qui fait partie de la famille des eSTK et possède quatre domaines PASTA [
6
]. Cette étude a un intérêt de santé publique important puisque
S. pneumoniae
est impliquée dans un grand nombre d’infections chez l’homme (pneumonies, otites, méningites) pour lesquelles il n’y a, aujourd’hui, pas de vaccin ou de traitements efficaces [
7
].
|
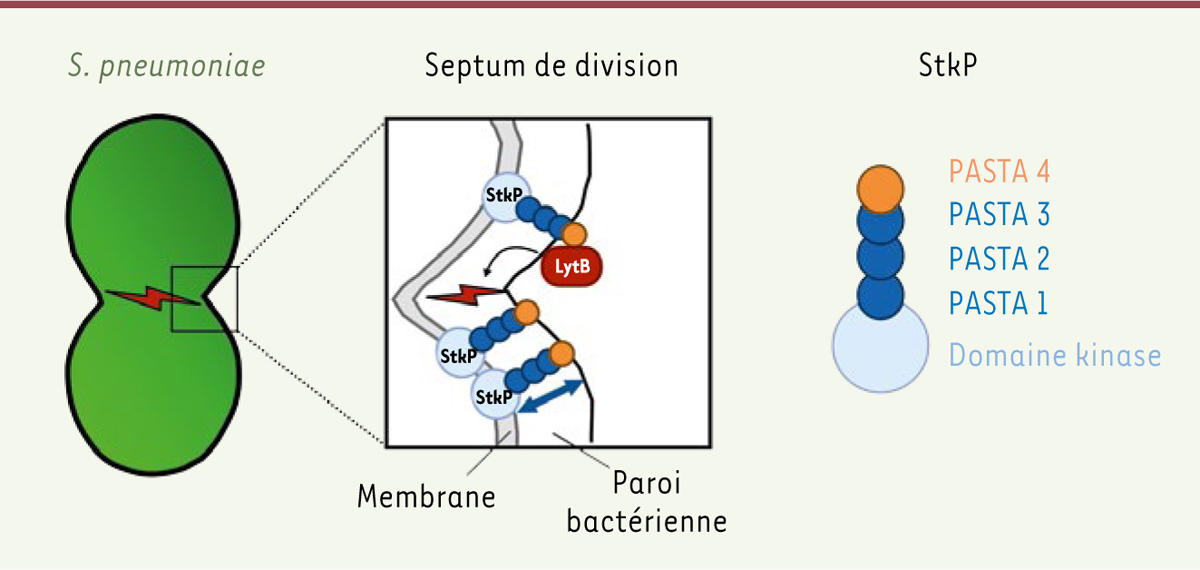
PASTA-4 est nécessaire aux étapes finales de la division de
S. pneumoniae
Pour identifier le rôle des domaines PASTA de StkP dans la division cellulaire, les auteurs ont construit des lignées mutantes de
S. pneumoniae
. Les bactéries de chacune de ces lignées expriment un récepteur StkP dans lequel un ou plusieurs domaines PASTA ont été supprimés. Les domaines sont nommés de PASTA-1 à PASTA-4, du plus proximal au plus distal par rapport à la membrane plasmique
(
Figure 1
)
. Les bactéries mutantes privées de la répétition la plus distale, PASTA-4, forment des chaînes de cellules bactériennes non séparées les unes des autres. Pourtant, aucune modification de l’activation du domaine kinase de StkP n’a été détectée dans ces bactéries mutantes. Ces données suggèrent ainsi que PASTA-4 est nécessaire aux dernières étapes de division et de séparation des cellules, indépendamment de l’activation de StkP.
 | Figure 1.
Modèle du rôle de StkP dans les étapes finales de division de
S. pneumoniae
. Les domaines PASTA-1, -2 et -3 de StkP déterminent l’épaisseur de la paroi bactérienne (« règles moléculaires »). Le domaine PASTA-4 terminal permettrait de recruter efficacement l’hydrolase LytB au septum de division, entraînant ainsi la séparation des cellules filles.
|
Le phénotype « en chaîne », observé chez les bactéries mutantes dépourvues du domaine PASTA-4, est semblable au phénotype d’autres mutants identifiés dans la littérature. En particulier, ce phénotype est observé chez des souches n’exprimant pas LytB, une hydrolase impliquée dans la division cellulaire [
8
]. Les auteurs ont donc voulu tester si PASTA-4 avait un rôle dans la fonction de LytB. Ils ont réalisé des expériences de co-immunoprécipitation et de résonance plasmonique de surface, et ont montré que LytB interagit avec le domaine PASTA-4 du récepteur StkP. L’affinité de cette interaction est réduite dans des souches mutantes pour cinq acides aminés de surface présents uniquement dans le domaine PASTA-4, et pas dans les domaines PASTA-1, -2 et -3.
En utilisant des bactéries exprimant LytB fusionnée à la GFP (
green fluorescent protein
), les auteurs ont confirmé que StkP joue un rôle dans la localisation de l’hydrolase LytB au septum de division, lors des étapes finales de la division cellulaire. Ainsi, le domaine PASTA le plus distal du récepteur StkP est nécessaire à la division cellulaire. Ce domaine recrute l’hydrolase LytB au septum de division, qui, elle-même, permet de séparer les parois des deux cellules filles
(
Figure 1
)
.
|
PASTA-1, -2, et -3 déterminent l’épaisseur de la paroi bactérienne Les auteurs ont également cherché à comprendre les fonctions des trois autres domaines PASTA dans la division bactérienne. Les souches pour lesquelles un seul des trois domaines PASTA-1, -2 ou -3 est supprimé, présentent une morphologie similaire aux bactéries sauvages. Le taux de phosphorylation de StkP (donc son activation) n’est pas modifié chez ces mutants. En revanche, une triple délétion des domaines PASTA-1, -2 et -3 empêche l’activation du récepteur StkP. Les domaines PASTA-1, -2 et -3 ont donc un rôle spécifique dans l’activation du récepteur.
Pour mieux comprendre le rôle de ces trois domaines, les auteurs ont testé si leur liaison à des muropeptides influençait la division cellulaire. Pour cela, ils ont construit une souche de
S. pneumoniae
exprimant un StkP transgénique : ses domaines PASTA-1, -2 et -3 ont été remplacés par ceux de l’eSTK d’une autre espèce de Firmicutes,
Bacillus subtilis
, ne pouvant pas se lier aux muropeptides de
S. pneumoniae
. Dans ces expériences, la morphologie et la division de ces souches mutantes n’étaient pas altérées. Ainsi, il semble que même si l’activation de StkP dépend des domaines PASTA-1, -2 et -3, elle est indépendante de la liaison de ces domaines à des muropeptides.
Les auteurs ont ensuite créé des souches transgéniques pour lesquelles les trois domaines PASTA-1, -2 et -3 ont été remplacés par trois répétitions de PASTA-1, ou de PASTA-2, ou de PASTA-3. Ces souches avaient toutes un phénotype sauvage : les trois domaines PASTA-1, -2 et -3 sont donc fonctionnellement équivalents.
Enfin, les auteurs ont émis l’hypothèse que le nombre de domaines PASTA-1, -2 ou -3 pouvait influer sur la synthèse et la structure de la paroi bactérienne. Des observations de microscopie électronique leur ont permis de constater que l’épaisseur de la paroi était directement corrélée au nombre de domaines PASTA. Ainsi, les domaines PASTA-1, -2, et -3 semblent avoir une fonction de règle moléculaire : plus le nombre de ces domaines est grand, plus la paroi synthétisée est épaisse
(
Figure 1
)
.
|
Ainsi, dans la partie extracellulaire du récepteur kinase StkP de
S. pneumoniae
, deux types de répétitions PASTA assurent des rôles fonctionnels distincts au cours de la division cellulaire : les répétitions de type PASTA-4 d’une part, et PASTA-1, -2 ou -3 d’autre part. Avec cette étude, Zucchini
et al.
ont proposé un modèle pour expliquer le rôle des différents domaines PASTA du récepteur StkP, récepteur appartenant au divisome, un complexe protéique impliqué dans la division bactérienne. Le domaine PASTA-4 de StkP recrute LytB au septum de division, et permet ainsi à LytB d’hydrolyser la paroi pour la séparation finale des cellules. PASTA-1, -2 et -3 sont nécessaires à l’activation de StkP et agissent comme des règles moléculaires qui déterminent l’épaisseur de la paroi et permettent donc à PASTA-4 de recruter LytB correctement. Il reste à déterminer quel rôle joue l’activation de la fonction kinase du récepteur lors de la division cellulaire.
|
L’auteure déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Camilli
A
,
Bassler
BL
.
Bacterial Small-Molecule Signaling Pathways.
.
Science.
2006;
;
311
:
:1113.
–
1116
.
2.
Manuse
S
,
Fleurie
A
,
Zucchini
L
,
et al.
Role of eukaryotic-like serine/threonine kinases in bacterial cell division and morphogenesis.
.
FEMS Microbiol Rev.
2016;
;
40
:
:41.
–
56
.
3.
Pereira
SFF
,
Goss
L
,
Dworkin
J
.
Eukaryote-Like Serine/Threonine Kinases and Phosphatases in Bacteria.
.
Microbiol Mol Biol Rev.
2011;
;
75
:
:192.
–
212
.
4.
Barthe
P
,
Mukamolova
GV
,
Roumestand
C
,
Cohen-Gonsaud
M
.
The Structure of PknB Extracellular PASTA Domain from Mycobacterium tuberculosis Suggests a Ligand-Dependent Kinase Activation.
.
Structure.
2010;
;
18
:
:606.
–
615
.
5.
Maestro
B
,
Novaková
L
,
Hesek
D
,
et al.
Recognition of peptidoglycan and β-lactam antibiotics by the extracellular domain of the Ser/Thr protein kinase StkP from Streptococcus pneumoniae.
.
FEBS Lett.
2011;
;
585
:
:357.
–
363
.
6.
Zucchini
L
,
Mercy
C
,
Garcia
PS
,
et al.
PASTA repeats of the protein kinase StkP interconnect cell constriction and separation of Streptococcus pneumoniae.
.
Nat Microbiol.
2018;
;
3
:
:197.
–
209
.
7.
Kim
GL
,
Seon
SH
,
Rhee
DK
.
Pneumonia and Streptococcus pneumoniae vaccine.
.
Arch Pharm Res.
2017;
;
40
:
:885.
–
893
.
8.
Garcia
P
,
Gonzalez
MP
,
Garcia
E
,
et al.
LytB, a novel pneumococcal murein hydrolase essential for cell separation.
.
Mol Microbiol.
1999;
;
31
:
:1275.
–
1277
.
|