| |
| Med Sci (Paris). 39(4): 387–389. doi: 10.1051/medsci/2023044.
D’ennemis à amants : la coopération trophique entre
S. aureus
et
P. aeruginosa
autour de l’acétoïne
Jules Blanc,1* Ninon Cadot-Jet,1** and Tom Deshayes1*** 1École normale supérieure de Lyon, département de biologie, Master Biosciences
,
Lyon
,
France |
L’actualité scientifique vue par les étudiants du Master 1 de biologie de l’École normale supérieure de Lyon
Équipe pédagogique
Nathalie Alazard-Dany (PRAG, ENS de Lyon). Responsable de l’UE microbiologie moléculaire et structurale. Administratrice scientifique centre international de recherche en infectiologie, Inserm U1111 – CNRS UMR5308, École normale supérieure de Lyon, Lyon, France.
Jean-François Bruxelles (ATER, ENS de Lyon). Équipe virus enveloppés, vecteurs, et immunothérapie, centre international de recherche en infectiologie, Inserm U1111 – CNRS UMR5308, École normale supérieure de Lyon, Lyon, France.
Amélie Joly (doctorante monitrice ENS de Lyon). Équipe génomique fonctionnelle des interactions hôte/bactéries, institut de génomique fonctionnelle de Lyon, université de Lyon, École normale supérieure de Lyon, CNRS UMR 5242, université Claude Bernard Lyon 1, Lyon, France.
Contact :
nathalie.alazard-dany@ens-lyon.fr
Série coordonnée par Sophie Sibéril.
La mucoviscidose est une maladie génétique caractérisée par un épaississement du mucus dans plusieurs organes [
1
] qui favorise l’infection par différents microbes, tels que
Pseudomonas aeruginosa
et
Staphylococcus aureus
, dans les poumons. L’infection par
S. aureus
se produit généralement pendant l’enfance. Elle est suivie par l’infection par
P. aeruginosa
à l’âge adulte [
2
]. Il a longtemps été admis que ces deux bactéries entretenaient des interactions compétitives, menant à la sélection de souches particulièrement virulentes de
P. aeruginosa
[
3
] au détriment de la survie de
S. aureus
. Cependant, il a été récemment montré que chez 65 % des patients présentant des infections chroniques, ces deux bactéries n’étaient pas compétitrices mais coexistaient [
4
]. En effet, chez ces patients, les bactéries observées lors de co-infections sont capables de coopérer, et cette coexistance a probablement un rôle dans la chronicité des infections [
5
].
Dans une étude récente, Camus
et al.
ont étudié les mécanismes mis en jeu lors des interactions entre
S. aureus
et
P. aeruginosa
[
6
]. Pour cela, les auteurs ont utilisé des souches de
S. aureus
et
P. aeruginosa
obtenues à partir d’échantillons de mucus prélevés chez des patients co-infectés et présentant une mucoviscidose. Ces souches ont alors été catégorisées soit comme souches compétitrices (si
P. aeruginosa
est capable d’inhiber la croissance de
S. aureus)
soit comme souches coexistantes (si la co-culture n’a pas d’impact sur la croissance des bactéries) [
4
].
|
La coexistence avec
S. aureus
induit une modification des gènes du métabolisme de l’acétoïne chez
P. aeruginosa
Dans un premier temps, les auteurs ont recherché si l’interaction entre les deux souches induisait un changement dans leur profil d’expression génétique. Ils ont comparé les modifications du transcriptome de
P. aeruginosa
en monoculture ou co-cultivées avec des souches coexistantes ou compétitrices de
S. aureus
. Une dérégulation de 105 gènes de
P. aeruginosa
en condition de coexistence a été observée, et de 68 gènes en condition de compétition. Plusieurs des gènes modifiés dans le contexte de coexistence codent des facteurs de virulence, indiquant une modification de la pathogénicité de
P. aeruginosa
dans cette situation. De nombreux gènes impliqués dans le métabolisme du carbone et de certains acides aminés sont surexprimés chez
P. aeruginosa
en condition de coexistence, notamment deux gènes appartenant à l’opéron
aco
, impliqué dans le métabolisme de l’acétoïne :
PA4148
et
acoR
. L’acétoïne (qui possède une agréable odeur de beurre) est un métabolite sécrété notamment par
S. aureus
lorsque l’environnement est riche en glucose, toxique à trop forte concentration [
7
]. Pour analyser le mécanisme d’induction de l’expression de ces gènes, les auteurs ont co-cultivé une souche de
P. aeruginosa
en présence de surnageants de culture d’une souche de
S. aureus
capable de produire de l’acétoïne, ou d’une souche possédant une mutation dans la voie de synthèse de l’acétoïne, et donc incapable d’en produire. Chez les bactéries
P. aeruginosa
cultivées en présence du surnageant de cette souche mutée de
S. aureus
, les gènes
PA4148
et
acoR
sont fortement sous-exprimés. Cette expression est rétablie par un ajout d’acétoïne exogène, suggérant que la production de ce métabolite par
S. aureus
est impliquée dans la modulation de ces deux gènes chez
P. aeruginosa
dans le contexte de coexistence entre les deux bactéries.
|
En conditions de coexistence,
S. aureus
produit de l’acétoïne consommée par
P. aeruginosa
Les gènes du catabolisme de l’acétoïne étant surexprimés chez
P. aeruginosa
en condition de coexistence avec
S. aureus
, les auteurs ont examiné si
P. aeruginosa
était capable de consommer l’acétoïne produite par
S. aureus
. Pour tester cette hypothèse, les souches de
S. aureus
et
P. aeruginosa
ont été cultivées ensemble ou séparément, dans un milieu contenant uniquement du glucose comme source de carbone. La mesure des concentrations de glucose et d’acétoïne dans chaque condition de culture a permis de montrer qu’en mono-culture, le glucose est entièrement consommé par chaque souche, mais que seule
S. aureus
est capable de produire de l’acétoïne. En co-culture,
P. aeruginosa
consomme l’acétoïne produite par
S. aureus
.
Les auteurs ont ensuite montré que les souches coexistantes de
S. aureus
produisent, au bout de six heures, quatre fois plus d’acétoïne que les souches compétitrices, mais seulement si elles sont en présence du surnageant de culture des souches de
P. aeruginosa
coexistantes. Les souches coexistantes de
P. aeruginosa
sont capables, là encore à condition d’être cultivées en présence du surnageant de culture de souches co-existantes de
S. aureus
, de consommer la totalité de l’acétoïne après six heures, contre seulement 47 % pour les souches compétitrices. Ainsi, l’état de coexistence améliore les capacités d’interactions métaboliques concernant de l’acétoïne. Les souches coexistantes de
S. aureus
produisent une quantité importante d’acétoïne pouvant ensuite être métabolisée par les souches coexistantes de
P. aeruginosa
.
|
Le métabolisme de l’acétoïne permet une meilleure survie de
P. aeruginosa
et de
S. aureus
Pour analyser l’impact de cette modulation métabolique sur la survie des différentes souches de bactéries, les auteurs ont réalisé des co-cultures de souches coexistantes de
S. aureus
avec des souches de
P. aeruginosa
sauvages ou mutantes pour le catabolisme de l’acétoïne, et ont mesuré la survie des bactéries après plusieurs jours. La survie de
S. aureus
cultivée avec une souche de
P.
aeruginosa
sauvage, et donc capable de cataboliser l’acétoïne, est plus élevée que celle observée avec une souche de
P. aeruginosa
mutante. L’acétoïne en forte concentration limiterait donc la survie de
S. aureus
. Les bactéries
P. aeruginosa
sauvages co-cultivées avec
S. aureus
ont, par ailleurs, un meilleur taux de survie que les souches mutantes incapables de cataboliser l’acétoïne.
Ces résultats suggèrent que la co-culture de souches coexistantes échangeant de l’acétoïne permet d’améliorer la survie des deux types de souches. En effet, l’acétoïne sécrétée par
S. aureus
offre une nouvelle source de carbone à
P. aeruginosa
et la consommation de l’acétoïne par
P. aeruginosa
permet de réduire la concentration du métabolite et donc sa toxicité pour
S. aureus. (
Figure 1
)
.
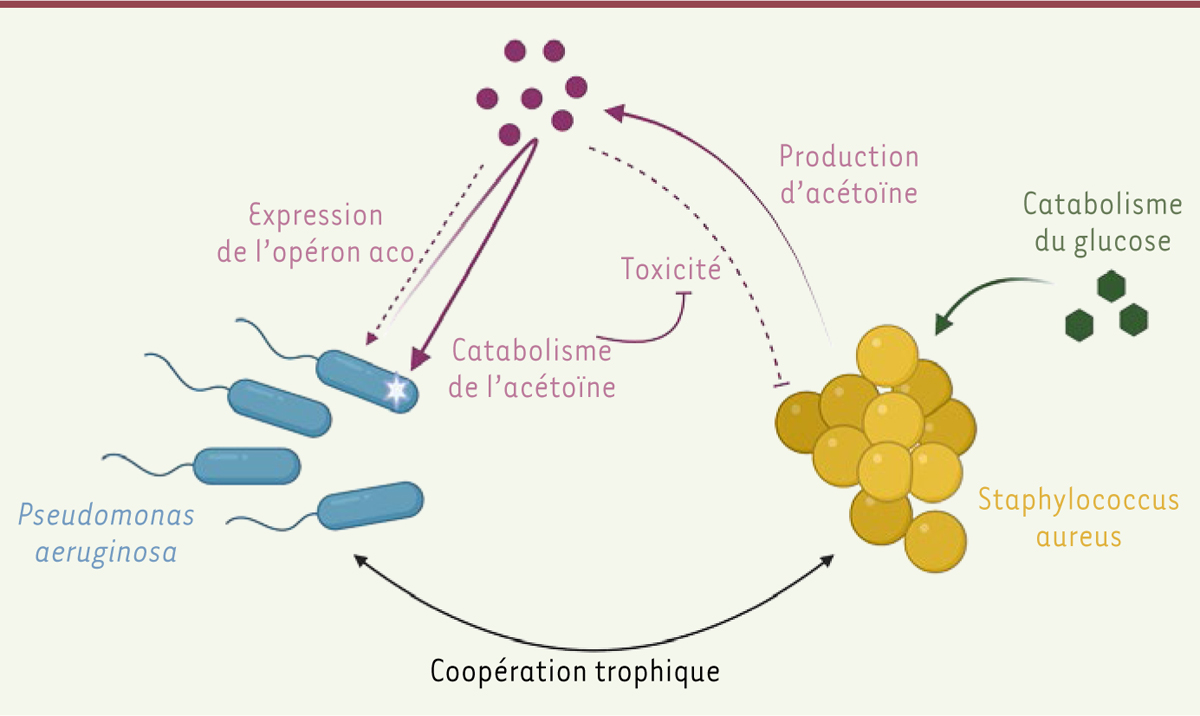
 | Figure 1.
Représentation schématique de la coopération trophique entre des souches coexistantes de
Pseudomonas aeruginosa
et
Staphylococcus aureus
.
Staphylococcus aureus
(en jaune) est capable de cataboliser le glucose de l’environnement et de produire une importe quantité d’acétoïne. L’augmentation de la concentration d’acétoïne promeut l’expression de l’opéron
aco
chez
Pseudomonas aeruginosa
(en bleu).
Pseudomonas aeruginosa
consomme alors l’acétoïne du milieu comme nouvelle source de carbone, ce qui favorise sa survie. La concentration d’acétoïne reste donc faible dans le milieu, ce qui favorise en retour la survie de
Staphylococcus aureus.
|
|
Cette étude offre de nouvelles perspectives dans la compréhension des infections chroniques chez les patients présentant une mucoviscidose. En effet, la chronicité de l’infection pourrait être liée à l’amélioration du taux de survie des deux bactéries en condition de coexistence. Cette cohabitation passerait par une modification de la pathogénicité de
P. aeruginosa
à l’égard de
S. aureus
et par une coopération trophique entre les deux bactéries. La surproduction d’acétoïne par
S. aureus
offrirait une nouvelle source de carbone à
P. aeruginosa
et la consommation de l’acétoïne par
P. aeruginosa
permettrait alors de détoxifier l’environnement de
S. aureus (
Figure 1
)
.
Cette étude a de nombreuses implications pour le traitement des infections chroniques, notamment parce qu’il a été montré qu’en cas de coexistence, la résistance aux antibiotiques de ces deux bactéries est augmentée [
4
]. Le dosage de l’acétoïne dans le mucus permettrait de déterminer si les souches bactériennes sont en condition de coexistence ou pas, et d’adapter, en conséquence, la stratégie thérapeutique pour éviter une surconsommation d’antibiotiques pouvant s’avérer inefficaces.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Turcios
NL
.
Cystic Fibrosis Lung Disease: An Overview.
.
Respir Care.
2020;
;
65
:
:233.
–
51
.
2.
O’Brien
TJ
,
Welch
M
.
Recapitulation of polymicrobial communities associated with cystic fibrosis airway infections: a perspective.
.
Future Microbiol.
2019;
;
14
:
:1437.
–
1450
.
3.
Hotterbeekx
A
,
Kumar-Singh
S
,
Goossens
H
,
Malhotra-Kumar
S
.
In vivo and In vitro Interactions between Pseudomonas aeruginosa and Staphylococcus spp.
.
Front Cell Infect Microbiol.
2017;
;
7
.
4.
Briaud
P
,
Bastien
S
,
Camus
L
,
et al
.
Impact of Coexistence Phenotype Between Staphylococcus aureus and Pseudomonas aeruginosa Isolates on Clinical Outcomes Among Cystic Fibrosis Patients.
.
Front Cell Infect Microbiol.
2020;
;
10
:
:266.
.
5.
Briaud
P
,
Camus
L
,
Bastien
S
,
et al.
Coexistence with Pseudomonas aeruginosa alters Staphylococcus aureus transcriptome, antibiotic resistance and internalization into epithelial cells.
.
Sci Rep.
2019;
;
9
:
:16564.
.
6.
Camus
L
,
Briaud
P
,
Bastien
S
,
et al
.
Trophic cooperation promotes bacterial survival of Staphylococcus aureus and Pseudomonas aeruginosa.
.
ISME J.
2020;
;
14
:
:3093.
–
105
.
7.
Xiao
Z
,
Xu
P
.
Acetoin metabolism in bacteria.
.
Crit Rev Microbiol.
2007;
;
33
:
:127.
–
140
.
|