| |
| Med Sci (Paris). 39(4): 344–350. doi: 10.1051/medsci/2023051.Quel cirque, ces virus Alexis Serge Chasseur,1 Benoît Muylkens,1 and Damien Coupeau1* 1Virologie moléculaire, Namur Research Institute for Life Sciences (Narilis), Unité de recherche vétérinaire intégrée, université de Namur (UNamur)
,
Namur
,
Belgique |
Vignette (© Philippe Roingeard).
Ni vivants, ni inertes, les virus sont au cœur d’un débat cherchant à définir les limites des formes de vie. Au-delà de la question philosophique que ce débat sous-tend, il convient de prendre conscience que ces unités biologiques sont probablement les plus variées et les plus variables des mondes (pseudo-) vivants. Une des hypothèses concernant leur apparition est celle de l’existence des viroïdes [
1
], des petits ARN circulaires (ARNcirc) infectant les végétaux. Les viroïdes ont été à l’origine de la découverte des ARNcirc par Diener et ses collaborateurs [
2
], lorsqu’ils ont décrit, en 1971, le viroïde du tubercule en fuseau, une maladie des plants de pommes de terre associée à une diminution de rendement pouvant atteindre 64 % [
3
]. Au-delà de l’impact économique des viroïdes sur l’agriculture, il faut souligner que ces ARN extrêmement stables ont la particularité de ne pas être traduits en protéine. Pour se répliquer, se propager et se circulariser, ils utilisent donc à la fois la machinerie des cellules qu’ils infectent et les propriétés biochimiques de l’ARN [
4
].
|
Synthèse et détection des ARNcirc
Dans le noyau cellulaire, la transcription des gènes en ARN messagers (ARNm) est généralement associée à un processus de tri et de sélection de l’information transcrite appelé « épissage » [
5
,
6
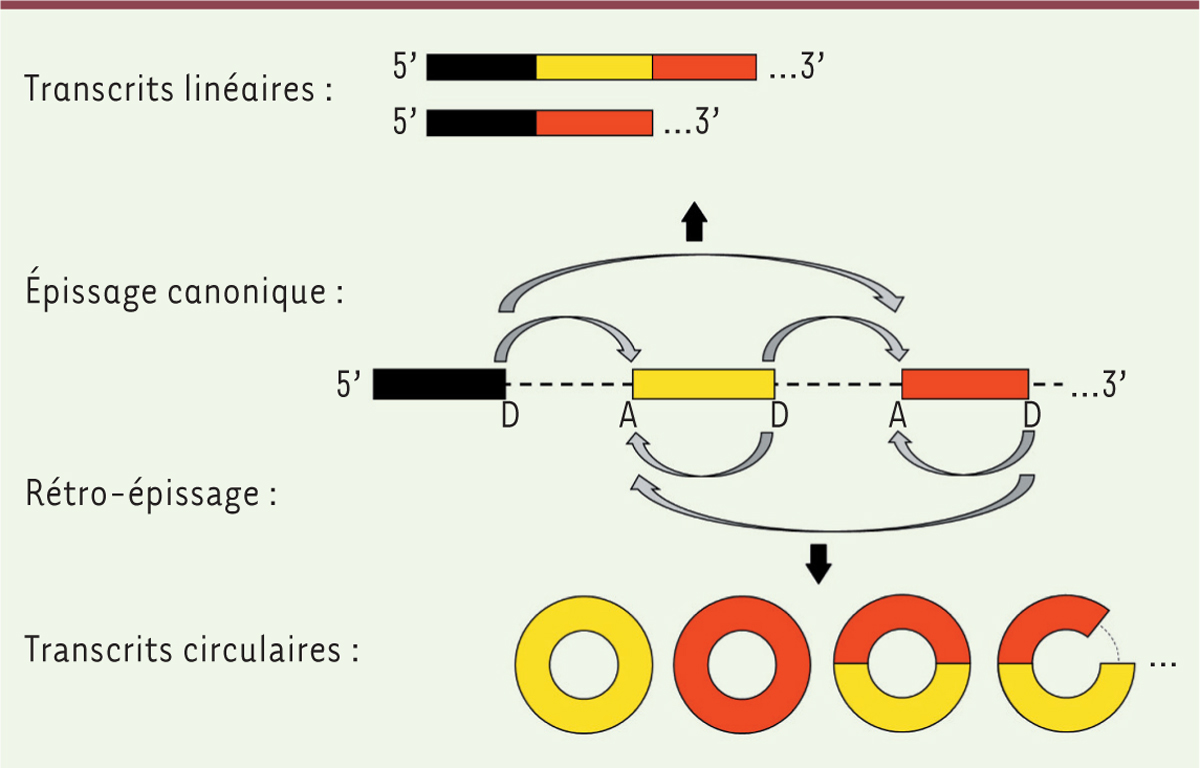
]. Le terme « épisser », utilisé dans la marine, désigne l’action d’assembler bout à bout les extrémités d’un cordage afin d’obtenir une structure continue. Par cette action, la machinerie cellulaire relie de manière continue les segments d’ARN transcrits destinés à sortir du noyau, les exons.
A contrario
, elle retient et élimine, toujours dans le noyau, les introns excisés des ARNm. La vision canonique de ce processus est l’obtention d’un transcrit linéaire, lorsque l’extrémité distale d’un exon est reliée à l’extrémité proximale d’un exon qui le suit dans la séquence nucléotidique. Cette vision a été bousculée par l’observation d’ARNcirc issus d’un rétro-épissage (
backsplicing
), lorsque l’extrémité distale d’un exon est reliée non pas à l’extrémité proximale d’un exon qui le suit mais à l’extrémité proximale d’un exon qui le précède dans la séquence (parfois lui-même). Ce phénomène produit une boucle d’ARN (un ARNcirc), comme le ferait une corde dont l’extrémité terminale serait jointe à l’extrémité initiale
(
Figure 1
)
.
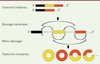 | Figure 1.
Représentation schématique des mécanismes d’épissage menant à la production des ARN linéaires (épissage canonique) et des ARN circulaires (rétro-épissage).
Bornes d’épissages accepteuses (A) et donneuses (D).
|
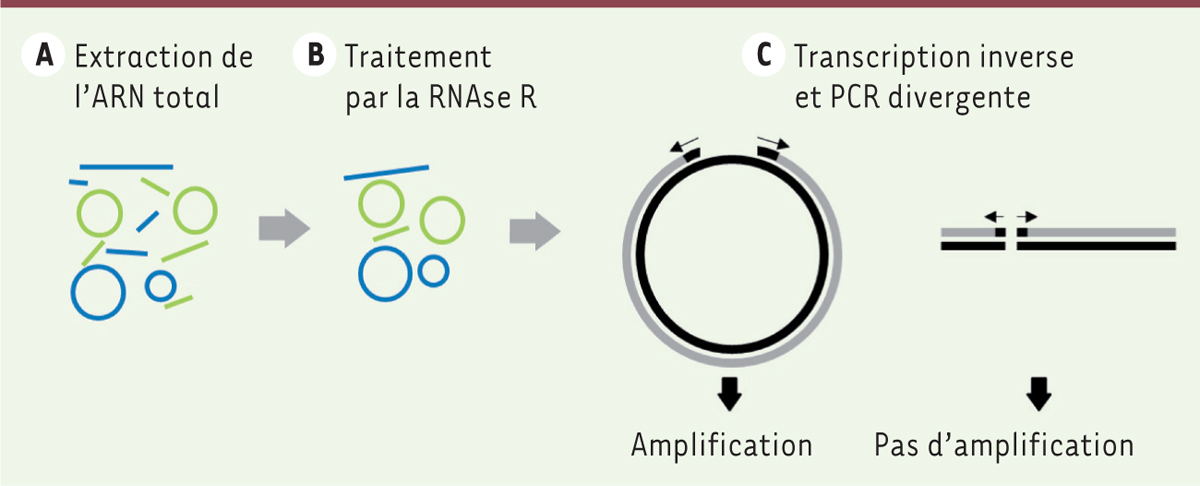
La détection de ces ARN dans les cellules revêt certaines particularités par rapport à leurs homologues linéaires. Tout d’abord, en raison de leur plus faible abondance, il est nécessaire de procéder à un enrichissement après l’étape d’extraction de l’ARN total. Ce traitement repose sur l’activité exoribonucléasique 3’-5’ de la ribonucléase R (RNase R) afin de dégrader les ARN linéaires. Ensuite, après transcription inverse (
reverse transcription
) des séquences d’ARNcirc, l’amplification par PCR (
polymerase chain reaction
) a la particularité d’utiliser des amorces inversées par rapport à celles qui sont habituellement utilisées pour un ARN linéaire : l’orientation des amorces sens et anti-sens doit en effet converger pour amplifier un matériel génétique linéaire, mais, en revanche, une orientation divergente des amorces donne lieu à un produit d’amplification permettant de démontrer la nature circulaire de la matrice amplifiée et donc l’existence d’un ARNcirc
(
Figure 2
)
[
7
].
 | Figure 2.
Méthodes permettant l’enrichissement et l’amplification des ARN circulaires.
|
|
La dérégulation de l’expression des ARNcirc que l’on observe dans de nombreuses maladies, en a fait des candidats biomarqueurs pour le diagnostic et le suivi clinique. Cela s’illustre notamment au cours de cancers et de maladies neurodégénératives, dans lesquelles ils sont soit sous-exprimés, soit sur-exprimés [
8
] (
→
).
(→) Voir la Nouvelle de J. Ladet et F. Mortreux,
m/s
n° 10, octobre 2020, page 935
Hansen
et al.
[
9
] ont ainsi défini, à partir de l’analyse des séquences des ARN isolés de 143 patients, une liste de cinq ARNcirc dont l’expression est significativement modifiée durant l’évolution du cancer de la prostate. Néanmoins, le rôle des ARNcirc ne se limite pas à un usage médical. De toutes les classes d’ARN, les ARNcirc sont probablement ceux qui présentent les rôles les plus variés [
10
] (
→
).
(→) Voir la Synthèse de E. Lacazette
et al.
,
m/s
n° 1, janvier 2020, page 38
Souvent considérés comme des ARN non codants, il conviendrait donc de considérer que les ARNcirc représentent une nouvelle classe spécifique d’ARN, puisque doués de multiples fonctions qui leur sont propres. Certains ARNcirc montrent en effet un potentiel codant, tandis que d’autres présentent une fonction d’éponge à microARN (miARN) du fait de leur capacité à lier ces derniers, par interaction de séquences, et à en inhiber les effets, et que certains autres jouent un rôle dans l’inhibition ou l’échafaudage de protéines par interaction directe avec celles-ci. D’autres fonctions sont actuellement explorées, comme leur impact sur la transcription par l’ARN polymérase II. Finalement, certains ARNcirc sont considérés comme des virus à part entière, comme les viroïdes (voir ci-dessus) ou certains virus « satellites » tels que le virus de l’hépatite delta.
L’objectif de cette revue est d’offrir un résumé actualisé des recherches sur les ARNcirc produits par des virus. Huit familles de virus sont connues pour exprimer des ARNcirc
(
Tableau I
)
, et ce, à des niveaux très variables. À titre d’exemples, un seul ARNcirc a été décrit dans le cas des
Hepadnaviridae
, et plus de 25 000 ARNcirc différents l’ont été dans le cas des
Coronaviridae
.
Tableau I.
Virus exprimant des ARN circulaires et fonctions associées.
GaHV-2 :
Gallid herpesvirus
2 [
13
] ; HCMV :
Human cytomegalovirus
[
34
] ; EBV :
Epstein-Barr virus
[
12
,
15
] ; KSHV :
Kaposi’s sarcoma-associated herpesvirus
[
14
,
15
,
35
] ; rLCV :
Rhesus monkey lymphocryptovirus
[
14
] ; MHV68 :
Murine herpesvirus 68
[
14
] ; CyHV-2 :
Cyprinid herpesvirus 2
[
36
] ; HBV :
Hepatitis B virus
[
21
] ; MCV :
Merkel cell polyomavirus
[
37
] ; RatPyV2 :
Rat polyomavirus 2
[
37
] ; HPV :
Human papillomavirus
[
22
] ; FAdV-4 :
Fowl adenovirus 4
[
38
] ; SARS-CoV :
Severe acute respiratory syndrome coronavirus
[
25
] ; MERS-CoV :
Middle East respiratory syndrome coronavirus
[
25
]
; RSV :
Respiratory syncytial virus
[
24
]
; BmCPV :
Bombyx mori cypovirus
[
27
]
; GCRV :
Grass carp reovirus
[
26
].
|
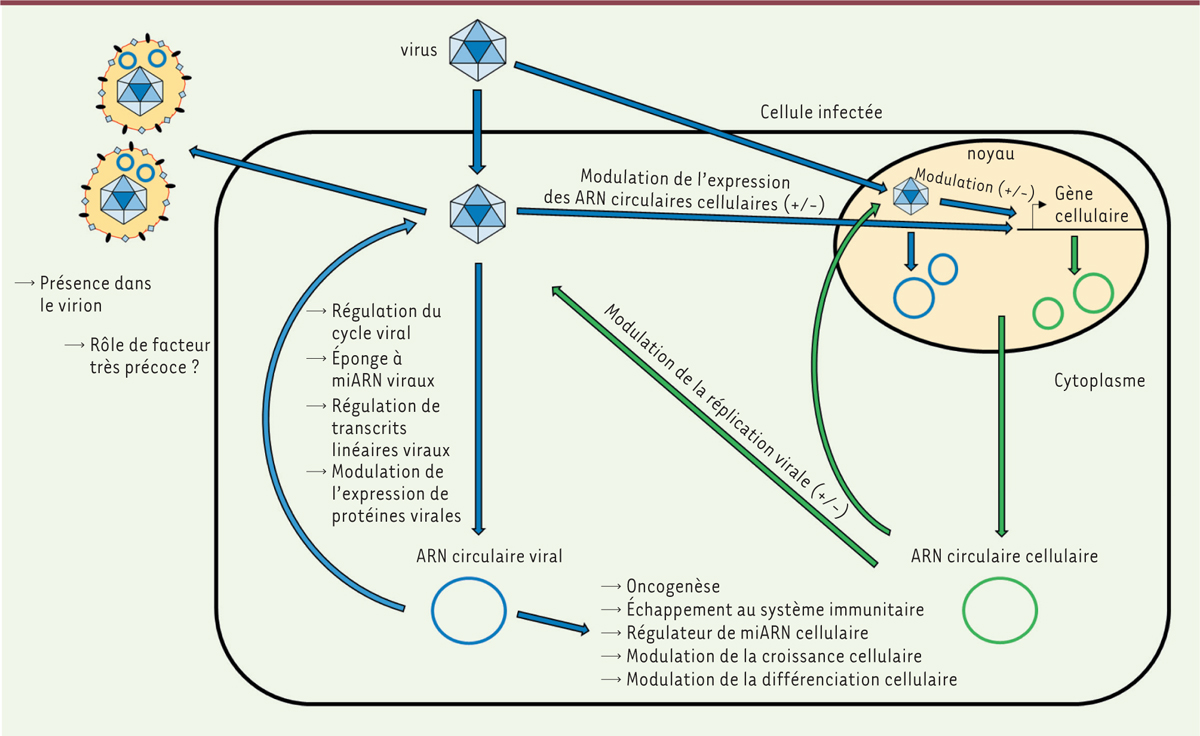
Pour illustrer l’éventail des rôles joués par les ARNcirc viraux, nous aborderons successivement différentes familles de virus à l’origine d’ARNcirc. Parmi les virus à ADN, la famille des herpèsvirus a été choisie en raison des travaux pionniers sur les ARNcirc viraux qu’elle a suscités. Nous décrirons ensuite la famille des hépadnavirus du fait de la particularité de la synthèse de ses ARNcirc. La famille des papillomavirus sera abordée en raison de la caractérisation précise d’un ARNcirc candidat oncogène. Nous examinerons également des ARNcirc plus particuliers, produits par des virus à ARN, notamment les coronavirus. Finalement, l’impact des ARNcirc dans les interactions hôte-pathogène sera présenté
(
Figure 3
)
.
 | Figure 3.
Impacts des ARN circulaires cellulaires et viraux sur la relation hôte-pathogène.
Les impacts des ARNcirc viraux sont représentés en bleu et les impacts des ARNcirc cellulaires sont représentés en vert.
|
|
Tout comme les premiers miARN viraux [
11
], les premiers ARNcirc viraux ont été identifiés au cours d’infections par des herpèsvirus [
12
]
(
Tableau I
)
. Ces virus ont un cycle infectieux particulier, avec la possibilité d’entrer dans une phase de latence (dormance) pouvant durer toute la vie de l’individu infecté. Cette phase est caractérisée par une expression extrêmement réduite des gènes viraux et l’absence de production de particules virales. Dans certaines circonstances, cet état de latence peut être interrompu, menant ainsi à la réactivation de l’infection.
Les herpèsvirus utilisent la machinerie d’épissage de la cellule qu’ils infectent pour produire les ARN linéaires. Il n’est donc pas surprenant que des ARNcirc aient été identifiés à partir de ces mêmes locus conduisant à la transcription d’ARNm. Soulignons d’ailleurs que nombre de ces locus sont impliqués dans l’oncogenèse associée à ces infections [
12
].
Récemment, notre équipe a décrit les premiers ARNcirc codés par un herpèsvirus oncogène infectant les gallinacés [
13
], le virus de la maladie de Marek, responsable de l’apparition de lymphomes dans un délai très court. Une expression différentielle d’ARNcirc a été observée en fonction des diverses phases du cycle viral, et plusieurs constats ont alors été effectués : 1) divers gènes exprimés durant la phase de latence et la phase d’oncogenèse viro-induite produisent d’abondants ARNcirc ; 2) les ARNcirc exprimés par les herpèsvirus sont produits à partir de locus communs à plusieurs espèces virales ; et 3) le rétro-épissage ne se résume pas à un épissage canonique fonctionnant à l’envers.
Le premier constat peut paraître trivial. Certains locus produisant des ARNcirc correspondent aux régions des longs transcrits épissés associés à la phase de latence virale [
13
–
15
]. La découverte d’ARNcirc associés à ces régions emblématiques des herpèsvirus devrait ainsi permettre une meilleure caractérisation de leurs fonctions. Ces régions étant également associées à une production de miARN, il ne serait pas étonnant que l’expression des ARNcirc affectent, modulent, voire leurrent, la fonction de ces miARN.
Des locus communs d’expression d’ARNcirc avaient déjà été mis en évidence par Ungerleider
et al.
[
14
] lors de la description des ARNcirc exprimés par divers herpèsvirus humains, murins et simiens. Les herpèsvirus possèdent dans leurs génomes des régions associées à leur réplication. Ces zones, appelées « origines de réplication », sont reconnues par les ADN polymérases virales et servent de site d’initiation à la réplication génomique [
16
]. Ungerleider et son équipe ont observé que différents herpèsvirus expriment des ARNcirc à partir de ces régions particulières alors même que ces origines de réplication ne sont ni situées dans un environnement génétique commun d’un virus à l’autre, ni encadrées par des gènes communs. Un lien entre l’expression des ARNcirc et les processus de réactivation du cycle du virus associé au sarcome de Kaposi (KSHV) a d’autre part été établi par Toptan
et al.
[
15
]. À partir de ces observations, deux hypothèses non exclusives peuvent être envisagées : 1) les ARNcirc pourraient être impliqués dans la réactivation du cycle viral, en inhibant des miARN viraux acteurs clefs de la latence ; 2) les ARNcirc stabiliseraient l’ouverture de la fourche de réplication impliquée dans la néosynthèse du génome viral. Ainsi, la découverte de régions spécifiques associées à l’expression d’ARNcirc et conservées entre les herpèsvirus suggère un rôle commun à ces molécules.
Le troisième constat découle de l’analyse précise des ARNcirc viraux. En effet, la caractérisation des séquences de rétro-épissage révèle que de nombreux motifs nucléotidiques sont différents de ceux observés lors de l’épissage canonique. Or, ces motifs n’ont pu être reliés à un mécanisme connu de la maturation des ARN, suggérant l’existence d’un nouveau processus à l’origine de ce rétro-épissage. Les herpèsvirus expriment d’ailleurs une protéine qui module l’épissage, ICP27 (
Infected-cell protein
27) chez les alphaherpesvirus [
17
]. Ces virus représentent donc un modèle qui devrait permettre de décrypter ce mécanisme en comparant des situations dans lesquelles chacun des deux types d’épissages intervient.
Des observations plus spécifiques à certains virus ont permis d’attribuer des fonctions particulières à des ARNcirc viraux. C’est le cas des ARNcirc codés par le virus d’Epstein-Barr (EBV) que sont circLMP2A, associé au gène codant la protéine LMP2A (
latent membrane protein 2A
) et circBART2.2, associé aux transcrits non codants dont les introns permettent la production de miARN. L’importance de circLMP2A a été établie par Gong
et al.
[
18
] dans le contexte du cancer gastrique, pour son rôle dans l’apparition de cellules souches au sein de la masse tumorale. Ces auteurs ont montré l’abondance et l’enrichissement de cet ARNcirc
in vitro
dans des cellules de lignées tumorales et
ex vivo
dans des échantillons prélevés chez des patients. De plus, un lien a été établi entre l’abondance de circLMP2A et le mauvais pronostic d’évolution du cancer chez les patients. Dans un modèle murin d’infection par l’EBV, l’inhibition de l’ARNcirc a réduit le nombre de cellules souches ainsi que la taille de la tumeur. Inversement, la surexpression de circLMP2A a favorisé la tumorigenèse et amplifié le nombre de cellules souche. Le transcrit circulaire se lierait à un miARN cellulaire, régulant la protéine suppresseur de tumeur TP53 (
tumor protein 53
), interférant ainsi avec l’inhibition de la tumorigenèse.
Le rôle de circBART2.2 a, quant à lui, été mis en évidence dans un processus d’échappement immunitaire qui est observé dans le carcinome nasopharyngé associé à l’infection par l’EBV [
19
]. L’expression élevée de circBART2.2 chez les patients affectés par la maladie est en effet liée à une espérance de vie plus courte. Son rôle est étroitement associé à celui de la protéine régulatrice PD-L1 (
programmed death – ligand 1
) dont l’expression est contrôlée par RIG-1 (
retinoic acid induced gene 1
). En se fixant à son récepteur PD-1 (
programmed cell death protein 1
) exprimé par les lymphocytes T, PD-L1 régule la réponse immunitaire. En raison de son interaction avec RIG-1, circBART2.2 induit l’augmentation de la synthèse de PD-L1, provoquant l’arrêt de la réponse lymphocytaire, et promouvant ainsi la cancérogenèse et le développement de métastases.
|
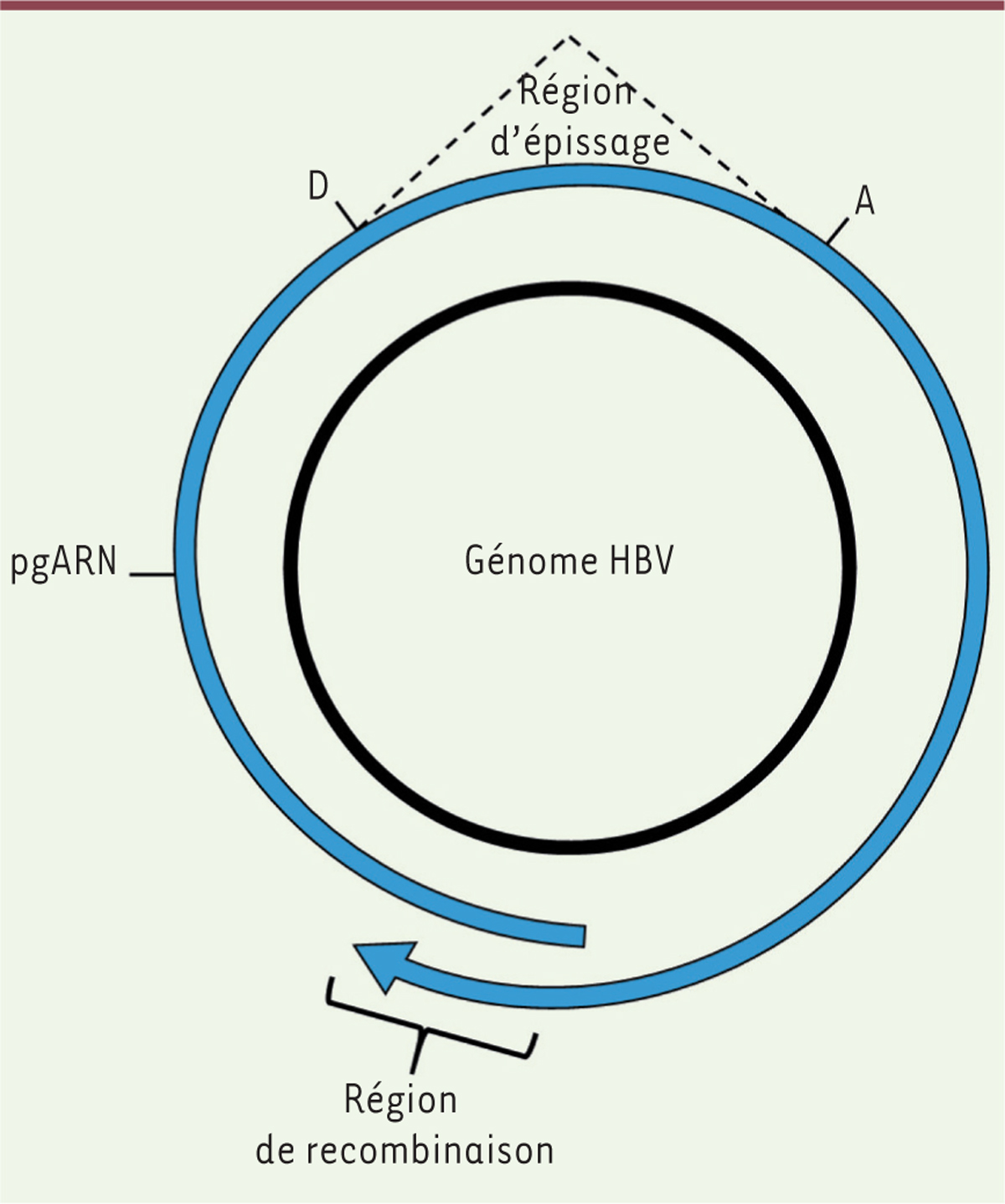
L’intrigant ARNcirc du virus de l’hépatite B
Le virus de l’hépatite B (HBV) est un virus à ADN partiellement double brin circulaire de 3,2 kb (kilobases). Ce génome atypique est à l’origine d’un cycle de réplication particulier. La réplication du génome d’HBV nécessite en effet la production d’un ARN prégénomique (ARNpg) qui est utilisé comme matrice de rétrotranscription pour reproduire le génome viral. Malgré cette configuration atypique, aucun épissage n’avait été décrit jusqu’alors pour la maturation des ARNm ou de l’ARNpg. Pourtant, la production d’un ARNcirc d’origine virale a été décrite lors d’infection par ce virus, y compris dans des tissus prélevés à partir d’individus souffrant d’un carcinome hépatocellulaire, conséquence ultime de la transformation cellulaire induite par l’HBV. L’ARNcirc d’HBV résulterait d’un rétro-épissage qui dépendrait d’un mécanisme de recombinaison entre les extrémités 5’ et 3’ de l’ARNpg
(
Figure 4
)
[
20
,
21
].
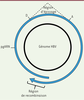 | Figure 4.
Biogenèse de l’ARNcirc transcrit par le virus de l’hépatite B.
|
|
ARNcirc et papillomavirus : l’exemple du circE7
Les papillomavirus humains à haut risque (HR-HPV) sont des virus à ADN double brin responsables de nombreux cas de cancers (cancers du col de l’utérus, du vagin, de la vulve, de l’anus, du pénis et cancers des voies aérodigestives supérieures). Ces virus sont ceux pour lesquels la caractérisation d’un ARNcirc est la plus avancée
(
Tableau I
)
grâce à la description en 2019 de l’ARNcirc circE7 [
22
] qui a révélé les nombreuses caractéristiques qui en font aujourd’hui l’archétype de l’ARNcirc viral codant.
CircE7 contient l’entièreté du cadre ouvert de lecture de l’oncoprotéine virale E7, responsable de la transformation cellulaire induite par le virus. Bien qu’il ne représente que 3 % des transcrits codant la protéine, sa contribution dans la traduction en protéine E7 serait plus importante que celle de la version linéaire du transcrit. L’inhibition spécifique de circE7 réduit en effet la production de la protéine E7, ainsi que la taille des tumeurs diminuée de moitié dans un modèle murin d’infection [
22
]. Aucune structure tridimensionnelle permettant le recrutement des ribosomes cellulaires pour la traduction de la protéine n’a été identifiée sur la base de la séquence nucléotidique de circE7. Or, ces motifs permettent la traduction des ARNm dépourvus de coiffe. L’ARNcirc circE7 est pourtant capable de recruter les ribosomes cellulaires, mais, dans ce cas, le ribosome est recruté par l’intermédiaire de séquences enrichies en adénosines méthylées présentes dans sa séquence [
22
]. Les méthylations des adénosines en position 6 (m
6
A), largement caractérisées [
23
], sont les modifications épitranscriptomiques les plus fréquentes. Elles ont une influence sur le (rétro-)épissage, sur la localisation des transcrits ARNcirc et sur leur traduction. En l’absence de ces méthylations, l’abondance de circE7 est altérée et la production de l’oncoprotéine
via
sa traduction est même impossible. Cela confirme que ces sites enrichis en adénosines méthylées permettent le recrutement des ribosomes et la traduction de circE7 [
22
].
|
Les virus à ARN et leurs ARNcirc inattendus
L’expression d’ARNcirc a été validée pour plusieurs familles de virus à ARN (
Paramyxoviridae
[
24
],
Coronaviridae
[
25
] et
Spinareoviridae
[
26
,
27
])
(
Tableau I
)
. Dans le cas des
Spinareoviridae
, et plus précisément du
Bombyx mori cypovirus
[
27
], l’expression des ARNcirc a notamment été associée à la production d’un micropeptide régulant la réplication du virus. Mais l’intérêt d’identifier des ARNcirc produits par des virus à ARN ne se limite pas à la compréhension de leur rôle au cours de l’infection. En effet, ces virus se répliquent dans le cytoplasme de la cellule et aucun transcrit épissé n’a jamais été observé, ce qui semble exclure une production d’ARNcirc. Néanmoins, ces trois familles de virus ont la capacité commune de produire des transcrits alternatifs au cours de leurs cycles de réplication. Bien que ces processus ne soient pas liés directement à un épissage, ils pourraient participer à la production d’ARNcirc. En effet, la vitesse de l’ARN polymérase, les structures secondaires de l’ARN, et la proximité de sites de liaisons à des protéines, ont toutes un impact sur la biogenèse des ARNcirc [
28
]. Il devient alors judicieux de s’interroger sur les mécanismes de biogenèse de ces transcrits particuliers.
En ce qui concerne les coronavirus [
25
], les premières analyses ont démontré une proximité des bornes de rétro-épissage avec des séquences nucléotidiques complémentaires. Néanmoins, aucune circularisation issue de la machinerie d’épissage canonique n’a été décrite. La formation d’ARNcirc pourrait être liée à la transcription discontinue des ARN subgénomiques, mais de plus amples analyses restent nécessaires.
Les ARNcirc des paramyxovirus ont été étudiés dans le modèle du virus respiratoire syncytial (RSV) [
24
]. L’analyse des bornes de rétro-épissage à l’origine de ces ARNcirc a permis d’identifier un motif d’épissage, AT/TA, s’avérant différent du motif dit canonique, GT/AG. Il serait donc surprenant que la machinerie impliquée soit similaire à celle participant à la production des ARNcirc cellulaires. La circularisation des transcrits de ces virus se produirait en dehors du noyau cellulaire, donc indépendamment de la machinerie d’épissage, ce qui tend à confirmer l’existence d’une machinerie alternative qui pourrait impliquer des protéines cellulaires et des protéines virales. Les ARNcirc de ces virus semblent être produits dans les « usines virales » de transcription et de réplication. Au sein de ces usines, sont produits de nombreux ARNm viraux flanqués du motif AT/TA. La polymérase virale nécessiterait donc ces motifs AT/TA pour la production des ARN viraux et leur circularisation.
Les réovirus offrent une vision très singulière de l’épissage [
26
,
27
]. Ils utiliseraient en effet la machinerie cellulaire classique d’épissage pour exprimer leurs ARNcirc. Aucun épissage n’a pourtant été décrit pour leurs transcrits linéaires, et leur réplication n’a jamais été observée dans le noyau cellulaire où l’épissage est supposé avoir lieu. La description d’ARNcirc exprimés par ces virus est donc pour le moins inattendue et nécessite de plus amples études.
Ces trois exemples de virus capables de produire des ARNcirc sans que l’on en comprenne exactement le mécanisme ont éveillé la curiosité de la communauté scientifique et offrent de nombreuses raisons de s’intéresser aux transcrits circulaires, avec la nécessité de briser certains dogmes. Ils montrent également l’utilité des virus, non plus comme modèles de pathogenèse, mais comme nouveaux outils de recherche en biologie. Un virus est, par définition, dépendant de son hôte, dont il exploite plus ou moins les voies biochimiques pour se répliquer. Dans le cas des ARNcirc, il est possible, et même probable, que les voies utilisées pour leur synthèse soient identiques à celles qu’emprunte l’hôte. En traquant les virus, ces voies, pourraient être identifiées et caractérisées.
Alors que le mot
virion
n’a été proposé qu’en 1959 [
29
], soit presque 300 ans après qu’Antoni van Leeuwenhoek (1632-1723) eut observé pour la première fois des microbes, les virus apparaissent aujourd’hui comme un outil indispensable à l’observation et la caractérisation de processus cellulaires qui échappent aux techniques de biologie moléculaire classiques.
|
Les ARNcirc font partie intégrante de la relation hôte-pathogène
(
Figure 3
)
. La dérégulation de l’expression des ARNcirc cellulaires avait d’abord été décrite durant les infections virales, avec notamment un effet de rétro-contrôle sur le virus lui-même. Plus récemment, de nombreux ARNcirc viraux ont été identifiés. Ils ont été le sujet d’études fonctionnelles, leur attribuant des rôles régulateurs, aussi bien du cycle cellulaire que du cycle viral. Ils ont ainsi été associés à l’oncogenèse viro-induite, à la régulation du système immunitaire et à la différenciation cellulaire. À ce jour, leur caractérisation s’est limitée à des mécanismes déjà décrits (éponge à miARN, modulation de l’action des protéines et de leur expression, etc.). Il est néanmoins probable que de nouveaux mécanismes de régulation induite par des ARNcirc soient découverts grâce à des modèles viraux.
Il convient de rappeler l’importance de ces modèles viraux pour l’étude de la biologie cellulaire. Certains virus à ARN expriment leurs propres ARNcirc, par un mécanisme d’épissage encore inconnu, révélant l’existence d’une biogenèse plus complexe que celle utilisée dans les modèles canoniques d’épissage. Tous les virus étudiés s’avèrent ainsi être de potentiels modèles, simples à manipuler, pour étudier cet épissage particulier, qu’il soit canonique ou non.
L’étude des transcrits circulaires viraux donne l’impression d’avoir ouvert une boîte de Pandore avec des possibilités infinies de découvertes. CircE7 en est le parfait exemple. Au travers de cinq études [
22
,
30
–
33
], circE7 a en effet alimenté un débat entre deux visions sur l’impact de ce transcrit particulier. Alors que les deux premières recherches avaient pointé l’importance de circE7 dans le cancer, la validité de ces observations et leurs interprétations ont été remises en question par les recherches suivantes. À l’heure de recherches linéaires et dogmatiques, les virus apparaissent comme de parfaits outils pour explorer ce cirque foisonnant et passionnant de la vie, offrant un vent de fraîcheur scientifique.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Cette recherche a été financée par un Fonds pour la Recherche Industrielle et Agronomique (FRIA/FNRS ; référence N° 40009229) accordé à AC.
|
1.
Moelling
K
,
Broecker
F
.
Viroids and the Origin of Life.
.
IJMS.
2021;
;
22
:
:3476.
.
2.
Diener
TO
.
Potato spindle tuber “virus”.
.
Virology.
1971;
;
45
:
:411.
–
428
.
3.
Singh
R
,
Finnie
R
,
Bagnall
R
.
Losses due to the potato spindle tuber virus.
.
American Potato Journal.
1971;
;
48
:
:262.
–
267
.
4.
Sastry
KS
.
Plant virus and viroid diseases in the tropics.
.
Dordrecht New York:
:
Springer;
,
2013
:
361 p.
.
5.
Berget
SM
,
Moore
C
,
Sharp
PA
.
Spliced segments at the 5’ terminus of adenovirus 2 late mRNA.
.
Proc Natl Acad Sci USA.
1977;
;
74
:
:3171.
–
3175
.
6.
Black
DL
.
Mechanisms of Alternative Pre-Messenger RNA Splicing.
.
Annu Rev Biochem.
2003;
;
72
:
:291.
–
336
.
7.
Kristensen
LS
,
Andersen
MS
,
Stagsted
LVW
,
et al.
The biogenesis, biology and characterization of circular RNAs.
.
Nat Rev Genet.
2019;
;
20
:
:675.
–
691
.
8.
Ladet
J
,
Mortreux
F
.
Les ARN circulaires, acteurs et biomarqueurs dans le cancer.
.
Med Sci (Paris).
2020;
;
36
:
:935.
–
8
.
9.
Hansen
EB
,
Fredsøe
J
,
Okholm
TLH
,
et al
.
The transcriptional landscape and biomarker potential of circular RNAs in prostate cancer.
.
Genome Med.
2022;
;
14
:
:8.
.
10.
Lacazette
E
,
Diallo
LH
,
Tatin
F
,
et al
.
L’ARN circulaire nous joue-t-il des tours ?
Med Sci (Paris).
2020;
;
36
:
:38.
–
43
.
11.
Pfeffer
S
,
Zavolan
M
,
Grässer
FA
,
et al.
Identification of Virus-Encoded MicroRNAs.
.
Science.
2004;
;
304
:
:734.
–
736
.
12.
Ungerleider
N
,
Concha
M
,
Lin
Z
,
et al.
The Epstein Barr virus circRNAome.
.
PLoS Pathog.
2018;
;
14
:
:e1007206.
.
13.
Chasseur
AS
,
Trozzi
G
,
Istasse
C
,
et al
.
Marek’s Disease Virus Virulence Genes Encode Circular RNAs.
.
J Virol.
2022;
;
96
:
:e00321.
–
2
.
14.
Ungerleider
NA
,
Jain
V
,
Wang
Y
,
et al.
Comparative Analysis of Gammaherpesvirus Circular RNA Repertoires: Conserved and Unique Viral Circular RNAs.
.
J Virol.
2019;
;
93
:
:e01952.
–
e01918
.
15.
Toptan
T
,
Abere
B
,
Nalesnik
MA
,
et al.
Circular DNA tumor viruses make circular RNAs.
.
Proc Natl Acad Sci USA.
2018;
;
115
:
:E8737.
–
E8745
.
16.
Spaete
R
.
Frenkel. The herpes simplex virus amplicon: A new eucaryotic defective-virus cloning-amplifying vector.
.
Cell.
1982;
;
30
:
:295.
–
304
.
17.
Sandri-Goldin
R M.
The many roles of the regulatory protein ICP27 during herpes simplex virus infection.
.
Front Biosci.
2008;
;
5241
:
18.
Gong
L
,
Chen
J
,
Dong
M
,
et al
.
Epstein-Barr virus-derived circular RNA LMP 2A induces stemness in EBV-associated gastric cancer.
.
EMBO Rep.
2020;
;
21
:
:e49689.
.
19.
Ge
J
,
Wang
J
,
Xiong
F
,
et al
.
Epstein-Barr Virus-Encoded Circular RNA CircBART2.2 Promotes Immune Escape of Nasopharyngeal Carcinoma by Regulating PD-L1.
.
Cancer Res.
2021;
;
81
:
:5074.
–
88
.
20.
Sekiba
K
,
Otsuka
M
,
Ohno
M
,
et al.
DHX9 regulates production of hepatitis B virus-derived circular RNA and viral protein levels.
.
Oncotarget.
2018;
;
9
:
:20953.
–
20964
.
21.
Zhu
M
,
Liang
Z
,
Pan
J
,
et al
.
Hepatocellular carcinoma progression mediated by hepatitis B virus-encoded circRNA HBV_circ_1 through interaction with CDK1.
.
Mol Ther Nucleic Acids.
2021;
;
25
:
:668.
–
82
.
22.
Zhao
J
,
Lee
EE
,
Kim
J
,
et al.
Transforming activity of an oncoprotein-encoding circular RNA from human papillomavirus.
.
Nat Commun.
2019;
;
10
:
:2300.
.
23.
Jiang
X
,
Liu
B
,
Nie
Z
,
et al
.
The role of m6A modification in the biological functions and diseases.
.
Sig Transduct Target Ther.
2021;
;
6
:
:74.
.
24.
Yao
W
,
Pan
J
,
Liu
Z
,
et al
.
The Cellular and Viral circRNAome Induced by Respiratory Syncytial Virus Infection.
.
mBio.
2021;
;
12
:
:e03075.
–
21
.
25.
Cai
Z
,
Lu
C
,
He
J
,
et al
.
Identification and characterization of circRNAs encoded by MERS-CoV, SARS-CoV-1 and SARS-CoV-2.
.
Brief Bioinform.
2021;
;
22
:
:1297.
–
308
.
26.
Pan
J
,
Zhang
X
,
Zhang
Y
,
et al
.
Grass carp reovirus encoding circular RNAs with antiviral activity.
.
Aquaculture.
2021;
;
533
:
:736135.
.
27.
Zhang
Y
,
Zhang
X
,
Dai
K
,
et al
.
Bombyx mori Akirin hijacks a viral peptide vSP27 encoded by BmCPV circRNA and activates the ROS-NF-κB pathway against viral infection.
.
Int J Biol Macromol.
2022;
;
194
:
:223.
–
32
.
28.
Conn
VM
,
Hugouvieux
V
,
Nayak
A
,
et al.
A circRNA from SEPALLATA3 regulates splicing of its cognate mRNA through R-loop formation.
.
Nat Plants.
2017;
;
3
:
:17053.
.
29.
Lwoff
A
,
Anderson
T
,
Jacob
F
.
Remarques sur les caractéristiques de la particule virale infectieuse.
.
Annales de l’Institut Pasteur.
1959;
;
97
:
:281.
–
289
.
30.
Chamseddin
BH
,
Lee
EE
,
Kim
J
,
et al.
Assessment of circularized E7 RNA, GLUT1, and PD-L1 in anal squamous cell carcinoma.
.
Oncotarget.
2019;
;
10
:
:5958.
–
5969
.
31.
Yu
L
,
Zheng
Z-M
.
Human Papillomavirus Type 16 Circular RNA Is Barely Detectable for the Claimed Biological Activity.
.
mBio.
2022;
;
13
:
:e03594.
–
21
.
32.
Yu
L
,
Lobanov
A
,
Zheng
Z-M
.
Reply to Wang, et al. Assessment of the Abundance and Potential Function of Human Papillomavirus Type 16 Circular E7 RNA.
.
mBio.
2022;
;
13
:
:e00758.
–
22
.
33.
Wang
RC
,
Lee
EE
,
Zhao
J
,
et al
.
Assessment of the Abundance and Potential Function of Human Papillomavirus Type 16 Circular E7 RNA.
.
mBio.
2022;
;
13
:
:e00411.
–
22
.
34.
Yang
S
,
Liu
X
,
Wang
M
,
et al
.
Circular RNAs Represent a Novel Class of Human Cytomegalovirus Transcripts.
.
Microbiol Spectr.
2022;
;
10
:
:e01106.
–
22
.
35.
Tagawa
T
,
Gao
S
,
Koparde
VN
,
et al.
Discovery of Kaposi’s sarcoma herpesvirus-encoded circular RNAs and a human antiviral circular RNA.
.
Proc Natl Acad Sci USA.
2018;
;
115
:
:12805.
–
12810
.
36.
Zhu
M
,
Dai
Y
,
Tong
X
,
et al
.
Circ-Udg Derived from Cyprinid Herpesvirus 2 Promotes Viral Replication.
.
Microbiol Spectr.
2022;
;
10
:
:e00943.
–
22
.
37.
Abere
B
,
Zhou
H
,
Li
J
,
et al
.
Merkel Cell Polyomavirus Encodes Circular RNAs (circRNAs) Enabling a Dynamic circRNA/microRNA/mRNA Regulatory Network.
.
mBio.
2020;
;
11
:
:e03059.
–
20
.
38.
Liu
X-N
,
Guo
XR
,
Han
Y
,
et al
.
The Cellular and Viral circRNAs Induced by Fowl Adenovirus Serotype 4 Infection.
.
Front Microbiol.
2022;
;
13
:
:925953.
.
|