Vignette (© iStock).
L’hyperoxalurie est un symptôme biochimique qui peut être la traduction d’une maladie héréditaire du métabolisme (hyperoxalurie primitive, ou HP) mais aussi la conséquence d’une maladie acquise (hyperoxalurie secondaire, ou HS). L’oxalate, impliqué dans ces maladies, est un composé très peu soluble. Il accroît donc le risque de lithiase rénale et de néphrocalcinose, et induit, secondairement, une insuffisance rénale chronique (IRC) qui pourra évoluer rapidement vers l’insuffisance rénale terminale (IRT). Cette IRT nécessitera un traitement de suppléance (dialyse ou transplantation) [ 1 ].
Parmi les hyperoxaluries, les hyperoxaluries secondaires sont les plus fréquentes. Elles sont liées à une augmentation de l’absorption intestinale d’oxalate dans des contextes de malabsorption (après une chirurgie bariatrique, une insuffisance pancréatique, par exemple en cas de mucoviscidose, de maladie inflammatoire digestive, telle que la maladie de Crohn, ou une atteinte de l’intestin grêle), de carence calcique sévère, ou, plus rarement, d’augmentation des apports alimentaires en oxalate [ 2 ]. En dehors de toute maladie, dans la lumière digestive, l’oxalate se lie au calcium, formant l’oxalate de calcium qui est insoluble et sera excrété par le tube digestif. Le traitement actuel des hyperoxaluries entériques est conservateur, comme le rappellent les recommandations européennes de 2022, qui préconisent une hyperhydratation avec augmentation des apports hydriques, un régime pauvre en oxalate et en graisses, et des corrections des facteurs favorisant la lithogenèse 1 (apports calciques ad hoc , supplémentation en citrate ou magnésium) [ 3 ]. Les résultats d’une telle approche restent néanmoins limités alors que les hyperoxaluries ne sont pas à négliger en termes de santé publique : aux États-Unis, 300 000 interventions de chirurgie bariatrique ont lieu chaque année ! Et un nombre significatif de patients présenteront des lithiases et une IRC, par essence multifactorielles, mais aussi du fait d’erreurs nutritionnelles, comme des apports sodés ou protéiques excessifs.
L’industrie pharmaceutique ne s’y est d’ailleurs pas trompée avec le développement récent de la reloxaliase, une oxalate décarboxylase recombinante synthétisée par la bactérie Bacillus subtilis, dont l’objectif est de catalyser la conversion de l’oxalate dans la lumière intestinale. En dépit d’un concept séduisant et de résultats cliniques initiaux prometteurs [ 4 , 5 ], le deuxième essai, randomisé contrôlé contre placebo, demandé par l’agence américaine du médicament, la FDA ( Food and Drug Administration ), a été interrompu prématurément pour « futilité », mettant ainsi un coup d’arrêt au développement de cette molécule. Ce fiasco est probablement expliqué par l’effet « essai clinique » dans des maladies nutritionnelles et multifactorielles, où le simple fait de participer à un essai clinique induit, chez les participants, une modification des habitudes nutritionnelles (au moins sur le court terme), mais également par le fait que les concepteurs de ces études se sont focalisés sur l’hyperoxalurie, et pas sur les apports protéiques et sodés éminemment variables et pouvant avoir un réel effet sur le critère de jugement principal des études [ 6 ]. Espérons que les prochaines études s’intéressant aux molécules qui arriveront sur le marché tiendront compte de ces particularités…
Les hyperoxaluries primitives sont, quant à elles, des maladies génétiques exceptionnelles. Elles sont transmises sur le mode autosomique récessif. Il s’agit d’affections rares et souvent graves, engageant le pronostic rénal et parfois le pronostic vital, notamment dans les formes qui débutent précocement. Trois types d’hyperoxaluries primitives ont été identifiés : le type 1 (HP1) est de loin le plus fréquent et le plus grave. Il justifiait jusqu’à très récemment une double transplantation hépatique et rénale, mais son approche thérapeutique a été complétement révolutionnée, depuis 2020, par l’avènement des ARN interférents (ARNi) [ 7 ].
L’HP1 résulte d’un déficit enzymatique, celui de l’alanine-glyoxylate aminotransférase (AGT) dans les peroxysomes du foie, à l’origine d’une hyperoxalurie. Cette affection se présente sous cinq formes : la forme infantile, particulièrement sévère, avec une IRT au cours de la première année de vie ; une forme associée à la survenue de lithiases répétées liées à une altération progressive de la fonction rénale dans l’enfance ou l’adolescence ; une forme tardive, avec émission de plusieurs lithiases à l’âge adulte ; et une récidive, après transplantation rénale en l’absence de diagnostic préalable à la greffe. Des sujets présymptomatiques, issus d’une famille où un cas index a été identifié, ont également été observés [ 1 ]. Liée à la diminution de la filtration glomérulaire, une surcharge systémique en oxalate apparaît (ce que l’on appelle oxalose). Cette surcharge n’épargne aucun organe, notamment l’os [ 8 ].
Avant l’avènement des ARN interférents, le traitement conservateur (pyridoxine, hyperhydratation, inhibiteurs de la cristallisation) était la seule option pour ralentir l’évolution de l’IRC vers le stade terminal et la dialyse. Le concept d’hyperhydratation peut paraître assez simple pour le lecteur, mais il faut imaginer l’impact sur la qualité de vie d’une gastrostomie et d’une hydratation continue jour et nuit, avec de multiples levers nocturnes pour le patient (et, à l’âge pédiatrique, pour ses parents) pour imaginer ce que les anglo-saxons nomment avec pudeur le « burden of disease » 2 . Au stade d’IRT, aucune méthode de dialyse n’est suffisamment efficace pour compenser la production endogène d’oxalate. La double transplantation hépatique et rénale devrait, idéalement, être planifiée avant le stade d’insuffisance rénale avancée, pour limiter les dégâts de la thésaurismose (accumulation pathologique). Cela était parfois difficilement possible, du fait de l’accès limité aux greffons, ce qui nécessitait des protocoles très lourds de dialyse intensive, avec des séances d’hémodialyse, six jours sur sept, voire parfois l’association d’une hémodialyse quotidienne la journée, et d’une dialyse péritonéale la nuit. Là encore, l’impact sur la qualité de vie du patient et de sa famille est majeur : on demande beaucoup à ces familles, alors même que ces techniques d’épuration ne permettent pas de compenser la surproduction hépatique d’oxalate. Au stade de la double greffe, qu’elle soit combinée ou séquentielle, la mortalité à court terme n’est pas négligeable, en partie liée à la greffe hépatique elle-même, et le risque à long terme de complications infectieuses et tumorales, associées à une immunosuppression chronique, est resté une réelle préoccupation.
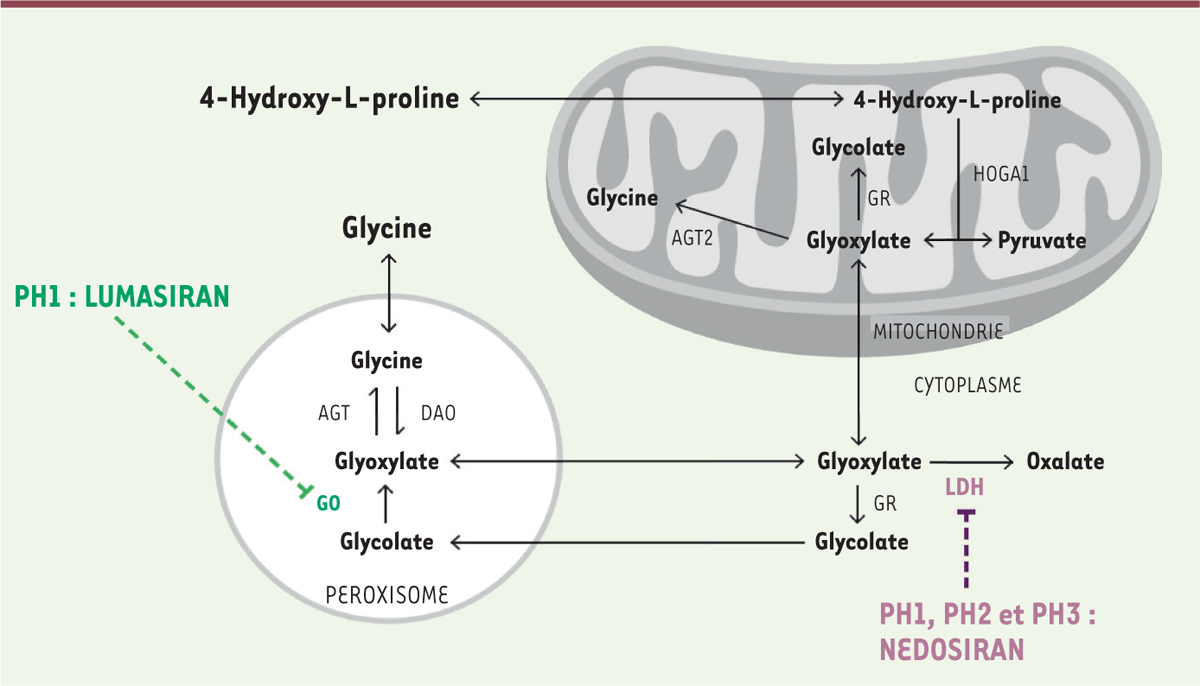
Le pronostic de cette maladie orpheline a heureusement été récemment révolutionné par l’apparition des traitements par les ARNi qui permettent de diminuer la production endogène d’oxalate, par injection sous-cutanée régulière (mensuelle puis trimestrielle). Le principe utilisé ici est triple : cibler spécifiquement l’hépatocyte en conjuguant l’ARNi d’intérêt à la N-acétyl galactosamine (système GalNac) qui permet également l’administration sous-cutanée ; stabiliser l’ARNi par des modifications chimiques, notamment de fluoration, pour augmenter sa demi-vie dans l’hépatocyte ; et inhiber une enzyme en amont de l’alanine glyoxylate aminotransférase (AGT) pour dévier la voie métabolique complexe de l’oxalate vers la voie non toxique du glycolate ( Figure 1 ) [ 9 ]. Le premier ARNi qui a été développé, le lumasiran, ciblait la glycolate oxydase (GO) et son utilisation était limitée à l’hyperoxalurie primitive de type 1 (HP1). D’autres cibles sont désormais envisagées, comme la lactico-déshydrogénase A (LDH-A), en cours d’évaluation pour les trois types d’HP avec le nedosiran.
| Figure 1.
Voies métaboliques de l’oxalate et cibles thérapeutiques actuelles des ARN interférents
. Actuellement, deux ARN interférents (ARNi) ont été développés : le lumasiran, qui cible la glycolate oxydase (GO) dans l’HP1, et le nedosiran ciblant la « voie finale commune » et la lactico-déshydrogénase A (LDH), dans l’HP1, 2 et 3 (d’après [
9
]). AGT : alanine-glyoxylate aminotransférase ; GR : glyoxylate réductase ; HOGA : 4-hydroxy- 2-oxoglutarate aldolase.
|
Les résultats des essais cliniques sont spectaculaires [ 7 ] et signent probablement la fin des doubles transplantations foie/rein dans cette indication, tout du moins dans les pays développés. La preuve de concept d’une transplantation rénale isolée sous couverture d’un ARNi a été publiée en 2022 par une équipe française [ 10 ], et cinq autres cas ont été depuis colligés [ 11 ]. La possible prévention d’une oxalose infantile par un traitement précoce par ARNi dès neuf jours de vie chez un nouveau-né ayant bénéficié d’un dépistage néonatal familial a également été rapportée [ 12 ]. D’autres pistes thérapeutiques sont à l’étude, avec le nedosiran pour les HP1-2-3, le stiripentol, les inhibiteurs oraux de la glycolate oxydase ou la thérapie génique ; des avancées sont donc attendues dans un futur très proche. De nombreuses questions restent d’ores et déjà ouvertes : efficacité à long terme sur des critères « durs » du lumasiran, pronostic des transplantations rénales isolées sous ARNi, évolution de l’oxalose systémique en dialyse sous ARNi, conduite à tenir en cas de grossesse, etc.
Dans le champ des maladies rares, les questionnements éthiques et médico-économiques sont essentiels et les HP ne font pas exception. On peut regretter, comme dans d’autres maladies orphelines, le fossé qui existe entre pays développés et pays en voie de développement pour le diagnostic, l’accès aux tests génétiques et bien évidemment l’accès aux thérapies innovantes [ 13 ]. La disponibilité en Europe et aux États-Unis des très coûteux ARNi ne fera qu’accentuer ce problème, alors que l’HP1 est un véritable fléau dans certains pays en voie de développement. Des approches plus conventionnelles, mais tout autant séduisantes, d’inhibition pharmacologique de la lactico-déshydrogénase par le stiripentol, déjà utilisé dans le syndrome de Dravet (une épilepsie rare), pourraient changer les choses dans ces pays [ 14 ]. Même si le coût de la recherche et du développement de ces médicaments orphelins est faramineux, le coût pour la société et l’impact organisationnel le sont tout autant : en France, on évalue, en général, entre 75 et 150 k€ par an et par patient le coût de ces thérapies orphelines. Dans leur globalité, les maladies rares ne sont pas si rares… On estime à 3 000 000 le nombre de patients qui en souffrent en France. Ces thérapies représentent une avancée majeure pour les patients, mais il devient urgent de trouver des modèles médico-économiques pérennes et réalistes.
Les nouvelles recommandations européennes sur le diagnostic et la prise en charge des HP vont être publiées prochainement, en lien avec le réseau d’experts OxalEurope et le réseau européen des maladies rénales rares ERKNet ( European Rare Kidney Disease Reference Network ). C’est une chance pour la France et l’Europe de disposer d’une telle structuration pour les maladies rares ! Que l’on parle d’HP ou d’HS, les choses bougent donc très vite : même les lecteurs les plus avertis devront faire une veille bibliographique régulière pour rester up-to-date !