| |
| Med Sci (Paris). 39(3): 253–261. doi: 10.1051/medsci/2023025.Cystinose De la découverte du gène aux premiers essais de thérapie génique Stéphanie Cherqui1* 1Department of Pediatrics, Division of Genetics, University of California
,
San Diego, La Jolla, California
,
États-Unis |
Vignette (© iStock).
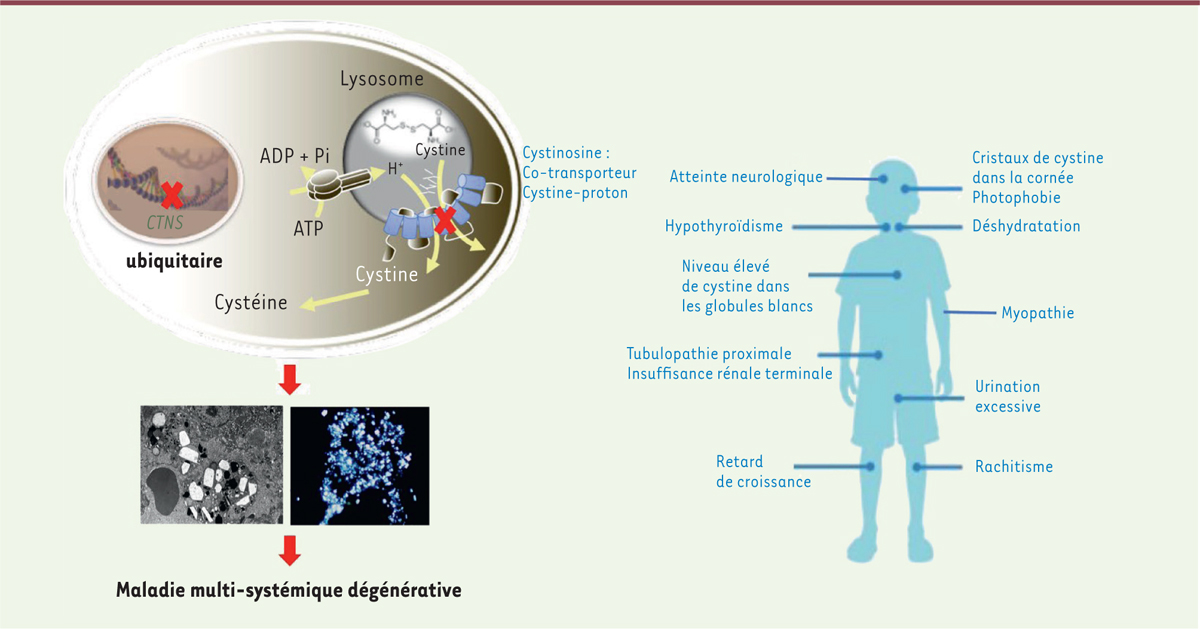
La cystinose est une maladie héréditaire de transmission autosomique récessive dont l’incidence annuelle est estimée à 1/100 000 à 1/200 000 naissances [
1
]. La cystinose fait partie des maladies de surcharge lysosomale et est caractérisée par une accumulation de cystine, un dimère de cystéine, dans les lysosomes de tous les organes, liée à un défaut de transport de la cystine à travers la paroi lysosomale [
2
]. La cystine libre est normalement transportée à travers la membrane lysosomale vers le cytosol où elle est réutilisée par la cellule après sa réduction en cystéine. Au cours de la cystinose, la cystine est stockée dans les lysosomes et tend à former des cristaux [
3
]. Il existe trois formes cliniques de la maladie : la forme infantile, la forme juvénile et la forme oculaire. La forme la plus grave et la plus fréquente est la forme infantile qui débute vers l’âge de 6 à 8 mois par un syndrome de Toni-Debré-Fanconi, qui se caractérise par une tubulopathie proximale et un retard de croissance [
3
]. La cystinose est d’ailleurs la cause la plus fréquente de ce syndrome représentant 20 % des patients atteints de tubulopathie proximale héréditaire [
4
]. Les patients évoluent vers une insuffisance rénale terminale à différents âges, de l’adolescence à l’adulte jeune. Les manifestations cliniques extra-rénales incluent une atteinte oculaire, liée à l’accumulation de cristaux de cystine dans la cornée entraînant une photophobie, un diabète, une hypothyroïdie, des atteintes neurologique et osseuse, une myopathie vacuolaire distale, une insuffisance respiratoire et des troubles de la déglutition [
5
]. La forme juvénile débute vers l’âge de 12-15 ans par une atteinte rénale qui évolue vers une insuffisance rénale terminale [
6
]. La forme oculaire, comme son nom l’indique, se caractérise exclusivement par une atteinte oculaire [
7
].
Le traitement de la cystinose repose sur la cystéamine, qui permet le clivage de la cystine et la formation d’un complexe cystéine-cystéamine, et de la cystéine, qui peuvent alors facilement sortir des lysosomes [
8
]. Si ce traitement est instauré précocement et à fortes doses, il permet de retarder l’évolution de la maladie. Cependant, il doit être pris régulièrement toutes les 6 ou 12 heures, et présente de nombreux effets secondaires qui rendent son administration difficile [
9
,
10
]. Chaque symptôme étant traité individuellement, les enfants doivent prendre des dizaines de médicaments, plusieurs fois par jour. Lorsqu’ils atteignent le stade d’insuffisance rénale, ils ont alors recours à la dialyse et la transplantation rénale.
|
Identification du gène impliqué dans la cystinose
Le locus qui a été rendu responsable de la cystinose a été identifié sur le bras court du chromosome 17, en 1995, grâce à l’identification de délétions dans cette région [
11
]. Par des approches associant
exon-trapping
1
, clonage positionnel et séquençage génomique, un nouveau gène a été identifié dans l’intervalle minimum de délétion. La découverte de mutations ponctuelles inactivatrices de ce gène chez des patients présentant une cystinose a permis d’identifier ce gène comme le gène responsable de la cystinose [
12
]. Ce gène, dénommé
CTNS
, couvre une région de 23 kilobases (kb), comporte 12 exons et est à l’origine d’un transcrit de 2,6 kb exprimé dans tous les organes testés
(
Figure 1
). CTNS
code une protéine de 367 acides aminés, la cystinosine, qui possède sept domaines transmembranaires, un signal potentiel d’adressage au lysosome en C-terminal (GY-XX-résidu hydrophobe) et sept sites potentiels de glycosylation, en N-terminal. L’ensemble de ces éléments permettait de prédire que la cystinosine était une protéine de la membrane lysosomale, ce qui était compatible avec la fonction attendue.
 | Figure 1.
Physiopathologie de la cystinose.
La cystinose est une maladie héréditaire monogénique causée par des mutations ou des délétions dans le gène
CTNS
qui est exprimé de façon ubiquitaire. Ce gène code une protéine lysosomale à sept domaines transmembranaires, un co-transporteur de cystine et de protons. Chez les patients présentant une cystinose, il y a une accumulation de cystine dans tous les tissus, entraînant une maladie multi-systémique.
|
|
Caractérisation de la cystinosine
En utilisant des constructions contenant le gène
CTNS
fusionné avec l’ADNc codant la GFP (
green fluorescent protein
), transfectées dans des cellules rénales, il a été possible par microscopie confocale de montrer que la cystinosine était effectivement une protéine lysosomale [
13
]. La délétion du signal d’adressage lysosomale potentiel de la cystinosine (GY-DQ-L), situé à son extrémité C-terminale, induisant la redirection partielle de la protéine vers la membrane plasmique, prouvait que ce motif était impliqué dans l’adressage de la cystinosine au lysosome. Un second signal d’adressage lysosomal a également été identifié au niveau de la troisième boucle cytoplasmique de la cystinosine. Ces travaux ont permis de montrer que la cystinosine était bien une protéine membranaire du lysosome et que son transport vers le lysosome était réalisé grâce à l’intervention de deux systèmes d’adressage lysosomal, dont l’un était un nouveau signal, qui, pour la première fois, avait été localisé dans une boucle cytoplasmique et non dans l’extrémité C-terminale de la protéine [
13
].
En utilisant un système cellulaire
in vitro
et de la cystine marquée avec un radio-élément, il a ensuite été montré que la cystinosine était bien un transporteur de cystine, tout particulièrement un symporteur cystine-proton permettant l’export de la cystine hors des lysosomes
(
Figure 1
)
[
14
]. La cystinosine semblait ainsi appartenir à une nouvelle famille de transporteurs à sept domaines transmembranaires, qui sont des symporteurs substrat-proton et qui présentent une taille similaire (entre 300 et 400 acides aminés), une topologie prédite identique (sept domaines transmembranaires) et des motifs répétés conservés, incluant la séquence PQ (proline-glutamine), situés dans le premier domaine transmembranaire et dans la troisième boucle cytoplasmique [
15
].
|
Corrélations génotype/phénotype
Les études de localisation subcellulaire de la cystinosine et du transport de cystine par la cystinosine ont permis d’étudier les conséquences des différentes mutations faux-sens et de types insertions/délétions en phase retrouvées chez les patients présentant trois différentes formes de cystinose (31 mutations) [
16
]. Grâce à ces études, il a pu être montré que les mutations retrouvées chez les patients présentant une forme infantile de cystinose avaient pour conséquence, dans la majorité des cas, d’abolir totalement le transport de cystine par la cystinosine. En revanche, pour les mutations détectées chez les patients présentant une cystinose juvénile ou oculaire, une simple diminution du transport de cystine a été observée. Grâce à ces études fonctionnelles de la cystinosine, il est ainsi possible de prévoir la gravité d’une nouvelle mutation détectée chez un patient. Notons que la mutation la plus fréquente dans la cystinose est la délétion de 57 kb qui élimine non seulement le gène
CTNS
mais aussi le gène
SHPK
(
sedoheptulokinase
ou
CARKL,
pour
carbohydrate kinase-like protein
) [
17
]. Cette mutation est trouvée chez 60 % des patients d’origine européenne [
18
].
|
Création d’un modèle murin de la cystinose
Afin de produire un model murin de cystinose, le gène
Ctns
homologue murin du gène humain a été cloné et caractérisé [
19
].
Ctns
est composé de dix exons et code une protéine de 367 acides aminés qui présente 92,6 % de similitude avec la cystinosine.
Le gène
Ctns
a donc été invalidé dans des cellules embryonnaires murines et des souris
Ctns
-/-
sur un fond génétique 129sv/C57Bl/6 ont été fabriquées [
34
]. Ces souris se reproduisent selon un ratio mendélien normal et ont une croissance, un développement et une fertilité normaux. Les souris
Ctns
-/-
accumulent significativement la cystine dans tous les organes testés, à des taux comparables à ceux observés chez les patients cystinotiques, le ratio d’accumulation entre les souris
Ctns
-/-
et
Ctns
+/+
augmentant avec l’âge. Des cristaux de cystine sont observés dans la plupart des organes. Cependant, malgré l’importance de l’accumulation de cystine dans le rein et la présence de cristaux et de mitochondries « géantes »
(
Figure 2
)
, les souris
Ctns
-/-
ne développent pas de tubulopathie ni d’insuffisance rénale. En revanche, ces souris présentent des anomalies oculaires très similaires à celles retrouvées chez les enfants présentant une cystinose avec des dépôts cornéens de cystine, des taches de dépigmentation dans la rétine
(
Figure 2
)
, et des électrorétinogrammes plats ou « supernormaux », qui seraient dus à la réfraction de la lumière sur les cristaux de cystine [
20
]. Les souris
Ctns
-/-
présentent également une déminéralisation osseuse avec déformation des os longs, ainsi que des anomalies musculaires
(
Figure 2
)
. Enfin, ces souris présentent des troubles du comportement dans un environnement dit d’exploration, traduisant des troubles neurologiques ou visuels.
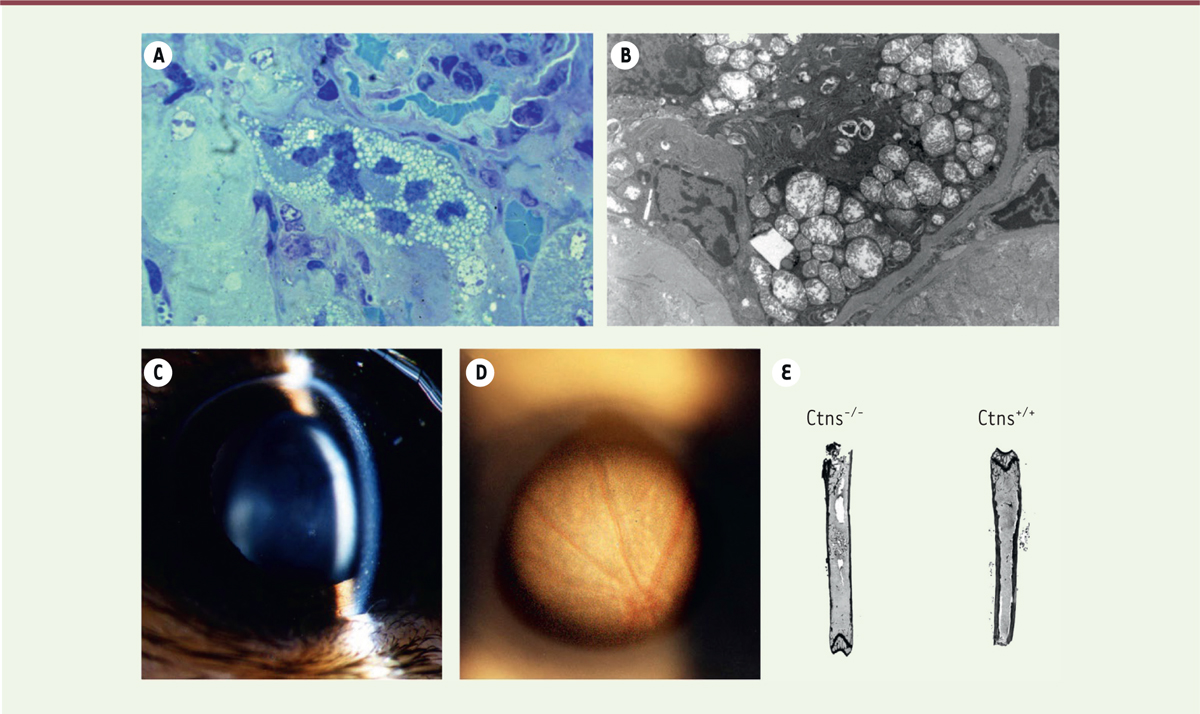
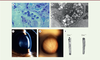 | Figure 2.
Phénotype des souris Ctns
-/-
représentant un modèle de cystinose. (A, B)
Sections histologiques de rein de souris Ctns
-/-
de huit mois. Coupe semi-fine
(A)
et microscopie électronique
(B)
montrant des mitochondries géantes et des cristaux de cystine dans des cellules tubulaires proximales.
(C, D)
Atteinte oculaire des souris Ctns
-/-
.
(C)
Des cristaux de cystine sont observés dans la cornée par lampe à fente.
(D)
Des taches de dépigmentation sont présentes au niveau de la rétine.
(E)
Atteinte osseuse des souris Ctns
-/-
. Les os des souris Ctns
-/-
sont déminéralisés, avec une ostéoporose caractérisée par un amincissement de la diaphyse (selon [
34
]).
|
Par la suite, le groupe de Corinne Antignac (hôpital Necker-Enfants malades) a généré des souris
Ctns
-/-
sur un autre fond génétique, le fond homozygote C57Bl/6J, par croisements répétés des souris du modèle original 129sv/C57Bl/6 avec des souris C57Bl/6J. Ces souris
Ctns
-/-
présentent une tubulopathie proximale dès l’âge de deux mois, et une maladie rénale chronique évoluant vers une insuffisance rénale terminale [
21
]. Ces travaux illustrent l’importance des fonds génétiques des souris utilisées, qui peuvent influencer considérablement le phénotype des animaux modifiés génétiquement. Ces souris invalidées pour le gène
Ctns
représentent donc un bon modèle animal de la cystinose et s’avèrent ainsi être un outil indispensable pour développer de nouvelles thérapeutiques mieux tolérées et plus efficaces que les traitements disponibles.
|
Développement d’un nouveau traitement pour la cystinose
En raison de la nature multi-systémique de la cystinose et de tous les médicaments nécessaires pour compenser l’absence de cystinosine, une approche de thérapie génique a été envisagée pour cette maladie. Cependant, comme le gène
CTNS
est exprimé par tous les tissus, l’approche de thérapie génique de cette maladie était particulièrement difficile. Cela est particulièrement vrai puisque la cystinosine est une protéine transmembranaire lysosomale, et n’est donc pas secrétée. Un « véhicule » capable de transporter la protéine vers tous les tissus était ainsi nécessaire. Les cellules souches de la moelle osseuse sont alors apparues comme de bons candidats.
Études précliniques : impact des cellules souches de la moelle osseuse sur la cystinose
Deux types de cellule souches sont présentes dans la moelle osseuse : les cellules souches hématopoïétiques (CSH) et les cellules souches mésenchymateuses (CSM). Ces cellules se distinguent par leur potentiel à produire différents types cellulaires. En effectuant des transplantations syngéniques de CSH et de CSM provenant de souris sauvages transgéniques exprimant la GFP, ces deux types cellulaires ont été testés dans les souris
Ctns
-/-
. Ces cellules souches expriment un gène
Ctns
fonctionnel mais aussi le gène rapporteur codant la GFP, ce qui permet de suivre par fluorescence les cellules après transplantation [
22
]. Ces cellules souches de souris
Ctns
-/-
ont été transplantées à des souris à l’âge de deux mois, après irradiation de ces dernières afin de détruire les cellules souches endogènes. Les cellules souches transplantées devaient reconstituer la moelle dans laquelle elles allaient résider et se multiplier. Des souris
Ctns
-/-
, utilisées comme contrôle, ont été transplantées avec des cellules souches isolées de souris
Ctns
-/-
. Analysées quatre mois après la transplantation, cette dernière expérience a montré que les CSM n’avaient pas intégré efficacement les organes et n’avaient qu’un effet bénéfique provisoire sur la teneur en cystine des tissus et sur la fonction rénale. Cela est en fait en accord avec nos connaissances actuelles des CSM : ces cellules n’intègrent pas de façon stable les tissus et n’ont qu’un effet bénéfique transitoire [
22
]. En revanche, chez les souris traitées avec les CSH exprimant
Ctns
, la teneur en cystine des différents organes a pu être réduite. La microscopie confocale et les PCR (
polymerase chain reaction
) quantitatives (qPCR) ont révélé la présence d’une grande quantité de cellules dérivées de la moelle osseuse dans tous les organes testés
(
Figure 3
)
. La progression naturelle des anomalies rénales et le dépôt de cristaux de cystine sur la cornée ont été significativement réduits chez les souris traitées, quatre mois après transplantation.
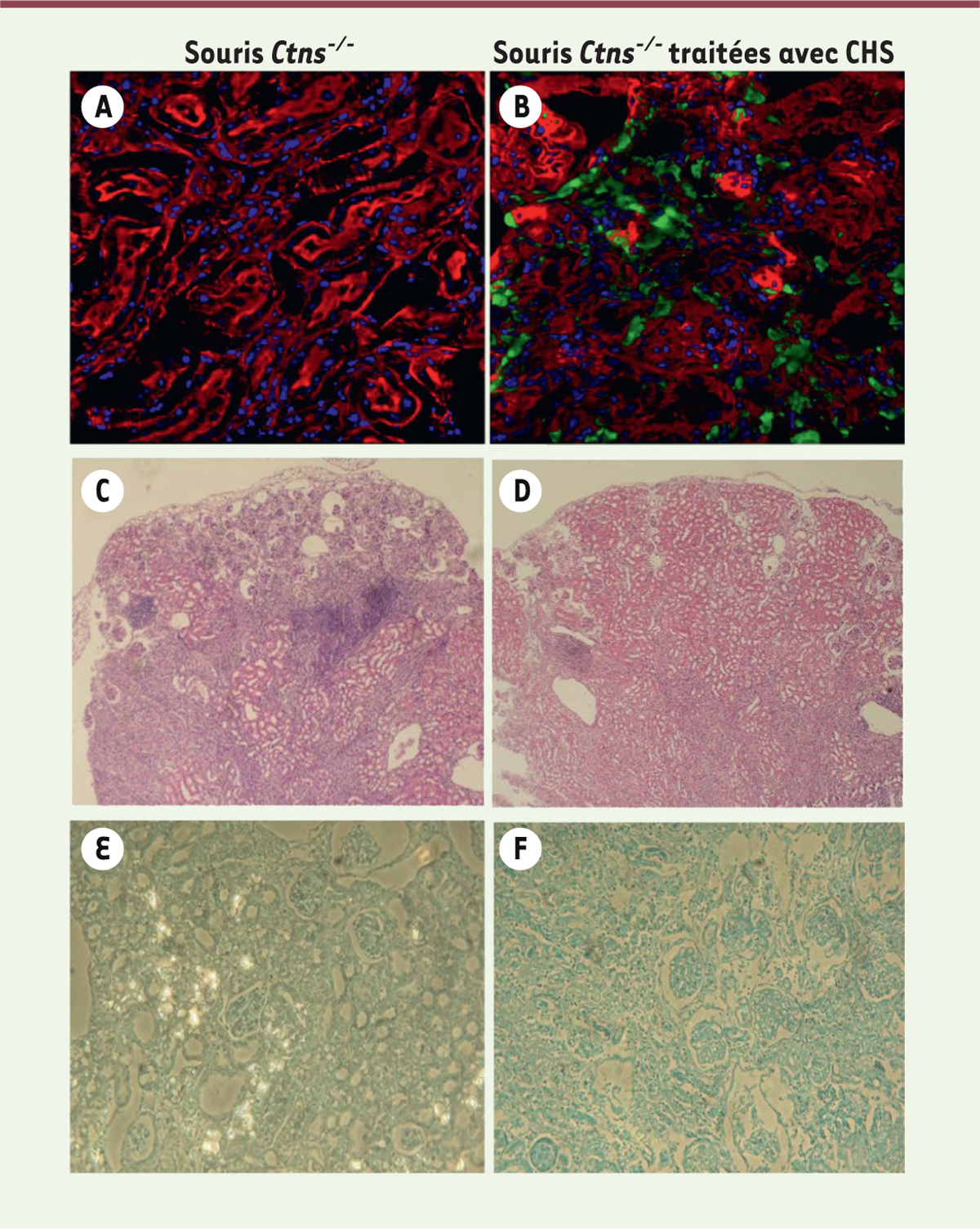
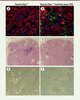 | Figure 3.
Efficacité d’intégration des cellules dérivées de la moelle osseuse dans les tissus. (A, B)
Photos de microscopie confocale de rein de souris
Ctns
-/-
non traitées
(A)
ou traitées avec des CSH sauvages exprimant la GFP (
green fluorescent protein
)
(B)
. Les cellules dérivées de la moelle osseuse sont colorées en vert, les noyaux cellulaires en bleu et les tubes proximaux en rouge [
22
].
(C, D)
Photos d’histologie de souris
Ctns
-/-
à l’âge de 15-17 mois non traitées
(C)
ou traitées avec des CSH sauvages plus d’un an après transplantation
(D)
, montrant les nombreuses anomalies rénales chez les souris
Ctns
-/-
, qui ne sont que focales chez les souris traitées (d’après [
23
]).
(E, F)
Photos d’histologie montrant les cristaux de cystine abondants dans les reins de souris
Ctns
-/-
contrôle
(E)
et peu nombreux dans les reins de souris
Ctns
-/-
traitées avec des CSH sauvages
(F)
(d’après [
23
]).
|
Effet à long terme de la transplantation de CSH exprimant un gène Ctns
Une question était, ensuite, de déterminer si la transplantation de cellules souches hématopoïétiques exprimant le gène fonctionnel
Ctns
pouvait avoir un effet thérapeutique à long terme chez les souris cystinotiques. Les souris ont donc été examinées 7 à 15 mois après la transplantation [
23
] et il a été montré que la teneur en cystine était effectivement diminuée de manière significative dans tous les tissus (entre 54 % dans les reins jusqu’à 96,5 % dans le foie). Les CSH transplantées exprimant
Ctns
se sont également révélées être capables de fournir une protection à long terme des reins des souris
Ctns
-/-
(
Figure 3
)
. Toutefois, l’efficacité du traitement dépend de la quantité de cellules souches exprimant
Ctns
dans la moelle osseuse. En effet, plus le nombre de cellules exprimant
Ctns
est élevé dans la moelle osseuse, plus la quantité de cellules exprimant
Ctns
est élevée dans le rein, et plus la fonction rénale est préservée (un taux supérieur à 50 % de CSH exprimant
Ctns
est nécessaire). Ces résultats ont donc suggéré qu’il est important d’obtenir un nombre élevé de cellules exprimant le gène
Ctns
chez les patients pour obtenir un traitement optimal de la cystinose, et surtout une préservation des reins. Les cristaux de cystine, abondants dans les reins des souris
Ctns
-/-
non traitées, ont par ailleurs significativement diminué chez les souris transplantées
(
Figure 3
)
. Ces résultats prouvent donc que le traitement est stable et efficace pendant toute la vie de la souris.
La greffe de CSH saines a également permis la préservation à long terme des yeux chez les souris
Ctns
-/-
[
27
]. Chez les souris traitées, de nombreuses cellules exprimant la GFP, dérivées de la moelle osseuse ont été détectées dans la cornée, mais également dans la sclérotique, le corps ciliaire, la rétine, la choroïde et le cristallin. Pour visualiser et quantifier les cristaux de cystine dans la cornée, un microscope confocal particulier a été utilisé pour explorer des souris vivantes. Là encore, un traitement efficace semblait dépendre du nombre de CSH exprimant le gène
Ctns
dans la moelle osseuse. Un an après la transplantation, alors que les souris
Ctns
-/-
avec un faible taux de prise de greffe (moins de 50 %) présentaient une réduction partielle du nombre de cristaux dans la cornée, les souris ayant des nombres élevés de prise de greffe (plus de 50 %) présentaient quant à elles une réduction presque complète des cristaux de la couche épithéliale au stroma moyen [
27
]. De plus, ces souris
Ctns
-/-
traitées par transplantation de CHS présentent une épaisseur, une structure cornéennes, et une pression intraoculaire normales. Ces travaux suggèrent donc que ce type d’approche thérapeutique pourrait permettre aux patients présentant une cystinose d’arrêter le traitement par gouttes oculaires de cystéamine.
L’impact de la transplantation des CSH saines sur la thyroïde a également été examiné chez les souris
Ctns
-/-
, sachant que les patients présentant une cystinose développent une hypothyroïdie [
26
]. Pierre Courtoy (Institut de Duve, université catholique de Louvain, Belgique) a montré que la fonction et la structure de la thyroïde des souris
Ctns
-/-
étaient anormales, présentant une élévation de l’hormone thyroïdienne thyréostimuline (TSH) et une hypertrophie des thyrocytes, une hyperplasie, et une prolifération vasculaire [
17
]. Les souris
Ctns
-/-
traitées par greffe de CSH présentent, en revanche, une histologie quasiment normale et une normalisation des valeurs de cystine et de TSH [
26
].
Mécanisme d’action des CSH pour la préservation des tissus, notamment le rein
L’étendue de l’efficacité des cellules souches hématopoïétiques pour préserver les tissus chez les souris présentant une cystinose était donc surprenante, d’autant plus que la cystinosine est une protéine lysosomale transmembranaire, donc non secrétée. Dans les différents tissus,
in vivo
, les CSH se différencient en macrophages.
In vitro
, des co-cultures réalisées en utilisant des macrophages exprimant le gène
Ctns
et la GFP et des fibroblastes dépourvus du gène
Ctns
, ont révélé des niveaux de cystine diminués de plus de 75 % dans les fibroblastes lorsque les deux populations sont physiquement en contact, contrairement à ce qui est observé lorsque les cellules des deux types sont séparées par des membranes poreuses ne laissant passer que les microvésicules [
24
,
25
]. Ces résultats montraient ainsi qu’un transfert de la cystinosine des macrophages aux cellules cystinotiques, pouvait se produire, même s’il s’agit d’une protéine transmembranaire lysosomale, et que le contact direct entre cellules est nécessaire à ce transfert. Les macrophages étendent de longues extensions membranaires, appelées
tunneling nanotubes
(TNT) qui peuvent, en fait, assurer le transfert de lysosomes contenant la cystinosine, jusqu’aux fibroblastes
Ctns
-/-
. Ces résultats ont été confirmés
in vivo
. Les macrophages dérivés des CSH exprimant la GFP produisent des TNT qui sont capables de traverser la membrane basale des tubes proximaux dans les reins des souris
Ctns
-/-
et transférer alors les lysosomes contenant la cystinosine associée à la GFP aux cellules tubulaires proximales (CTP)
(
Figure 4
)
, permettant leur préservation. Un mécanisme thérapeutique similaire affectant les CSH dans la cornée et la thyroïde a été observé chez les souris
Ctns
-/-
[
26
,
27
].
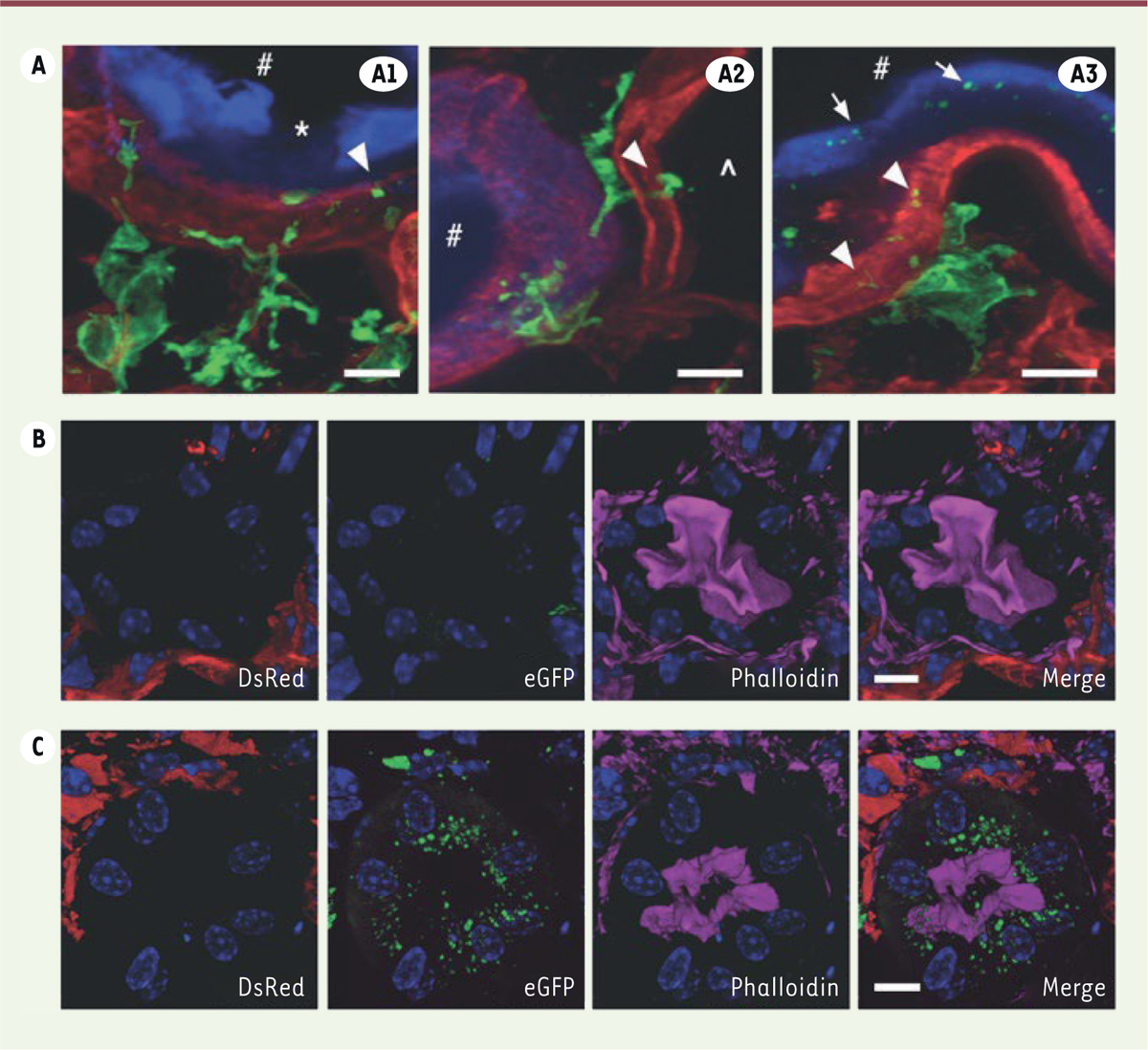
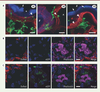 | Figure 4.
Transfert effectué par l’intermédiaire des « tunneling nanotubes » (TNT) in vivo et étude du rein. (A)
Images de microscopie confocale de rein de souris
Ctns
-/-
âgées de huit mois, six mois après la transplantation avec des CSH saines exprimant la GFP (
green fluorescent protein
). Les cellules tubulaires proximales (CTP) sont marquées par la lectine Lotus Tetragonobus (bleu). La laminine apparaît en rouge. (
A1, A2, A3
) Les macrophages dérivés des CSH exprimant la GFP (vert) ont de nombreux TNT capables de traverser la membrane basale des CTP (pointes de flèches). (*) : CTP apoptotique. (
B, C
) Images de microscopie confocale de rein de souris
Ctns
-/-
transplantées avec des CSH rouges DsRed-Ctns-/- (contrôle, B) ou des CSH rouges DsRed-Ctns-/- transduites avec un vecteur lentiviral exprimant la cystinosine-GFP (
C
). Des lysosomes contenant la cystinosine-GFP sont présents dans les macrophages rouges dérivés des CSH mais aussi dans le cytoplasme des CTP, mettant en évidence un transfert de la cystinosine-GFP
via
les TNT (
C
). (
B, C
) Les noyaux sont colorés en bleu (DAPI). Barres d’échelle : 5 μm (
A
), 10 μm (
B, C
) (selon [
25
]).
|
Ce mécanisme a été à l’origine d’une préoccupation majeure pour l’application clinique de la transplantation de CSH chez les patients homozygotes pour la délétion de 57 kb. En effet, cette délétion élimine non seulement le gène
CTNS
mais également le gène
SHPK
qui code la sédopheptulose kinase, une enzyme métabolique pouvant influencer la polarisation des macrophages [
28
]. Pour étudier si l’absence de
SHPK
pouvait avoir un impact négatif sur l’efficacité des CSH transplantées à se différencier en macrophages dans les tissus, un modèle murin déficient pour
Shpk
et
Ctns
, dans lequel des CSH de souris
Shpk
-/-
sont transplantées, a été développé [
29
]. Dans ce modèle, la transplantation des CSH
Shpk
-/-
a toujours un bénéfice thérapeutique pour la cystinose, évalué par la réduction des taux de cystine dans les tissus, la restauration de l’expression de
Ctns
et la préservation de la morphologie rénale chez les souris
Ctns
-/-
transplantées.
L’ensemble de ces travaux suggèrent ainsi qu’une transplantation de CSH exprimant un gène
CTNS
fonctionnel pourrait permettre d’éviter le développement des différentes complications chez les patients présentant une cystinose, et militent en faveur d’un recrutement de patients homozygotes pour la délétion de 57 kb dans un essai clinique.
|
Transplantation autologue de cellules souches hématopoïétiques génétiquement modifiées pour exprimer le gène CTNS
Les transplantations allogéniques de CSH sont à l’origine d’un taux élevé de mortalité, en raison des risques de rejet et de la réaction du greffon contre l’hôte (GVH). Une transplantation allogénique de CSH a été réalisée chez un patient de 16 ans atteint de cystinose [
30
]. Ce patient a développé une GVH aiguë qui est devenue chronique. Il est décédé 35 mois après la transplantation. Malgré ce dénouement tragique, il a pourtant été observé une amélioration de sa fonction rénale, de sa photophobie et une diminution des cristaux de cystine dans des biopsies gastriques. La stratégie pour le traitement de la cystinose est donc désormais de développer une transplantation non plus allogénique mais de cellules autologues, c’est-à-dire la transplantation de cellules souches isolées du patient, cellules qui seront modifiées génétiquement
ex vivo
afin de leur faire exprimer un gène
CTNS
fonctionnel. Cette procédure présente beaucoup moins de risque que la transplantation allogénique. Afin d’introduire un gène fonctionnel dans les cellules souches hématopoïétiques, un vecteur lentiviral est utilisé. Il s’agit d’un virus-vecteur dérivé du virus de l’immunodéficience humaine (VIH) qui permet une infection efficace et stable des cellules souches ; ce vecteur est déjà utilisé pour la vectorisation d’autres gènes dans différents essais cliniques [
31
].
Études précliniques
Un vecteur lentiviral exprimant le gène humain
CTNS
(pCCL-CTNS) a été produit pour les études précliniques qui ont été réalisées chez la souris
(
Figure 5
)
. Des CSH isolées de souris
Ctns
-/-
ont été infectées avec ce vecteur puis transplantées chez des souris
Ctns
-/-
. Ces souris ont été analysées quatre et huit mois après transplantation. Une amélioration de la fonction rénale a été observée chez les souris traitées avec les cellules souches modifiées par le vecteur lentiviral exprimant
CTNS
, de même qu’une diminution significative du niveau de cystine et des cristaux de cystine dans le rein, comparé aux souris
Ctns
-/-
non traitées
(
Figure 5
)
[
32
].
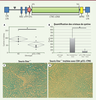 | Figure 5.
Cellules souches hématopoïétiques génétiquement modifiées avec le vecteur lentiviral pCCL-CTNS
. Panneau du haut : structure du vecteur lentiviral pCCL-CTNS. SINLTR : self-inactivating long terminal repeat ; ψ :
Psi sequence
; RRE :
rev responsive element
; cPPT :
central polypurine tract
; EFS :
elongation factor 1a short
; CTNS
cDNA
:
CTNS ADNc humain
; WPRE :
woodchuck hepatitis post-transcriptional regulatory element
.
A.
Taux de cystine dans les reins de souris
Ctns
-/-
mâles non traitées (KO) ou traitées avec des CSH
Ctns
-/-
génétiquement modifiées avec pCCL-CTNS huit mois après transplantation (pCCL-CTNS), montrant une diminution significative du taux de cystine chez les souris traitées.
B.
L’histogramme représente la quantification des cristaux de cystine sur des coupes histologiques de rein de souris sauvages,
Ctns
-/-
non traitées (
C
), ou traitées avec des CSH Ctns-/- génétiquement modifiées avec pCCL-CTNS (
D
) ; *
P
< 0,05 (selon [
32
]).
|
Dans la perspective d’un essai clinique, des études de pharmacologie/toxicologie, et le développement de la production des cellules souches génétiquement modifiées à grande échelle en utilisant une préparation lentivirale pouvant être utilisée en clinique, ont été réalisés. Les études pharmacologiques et toxicologiques ont été effectuées avec des souris
Ctns
-/-
, afin de déterminer l’impact clinique, biochimique et histologique des CSH génétiquement modifiées ainsi que le nombre de copies vectorielles (VCN ; représentant la moyenne des copies de vecteur par cellule) dans le sang, la moelle osseuse et les cellules hématopoïétiques, et par la caractérisation des sites d’intégration du vecteur chez chaque souris transplantée. Ces études ont montré un bénéfice thérapeutique des CSH modifiées
ex vivo
avec le vecteur et son innocuité. Un protocole pour la modification génétique des cellules humaines CD34
+
a été optimisé. Il a été transféré à la plateforme permettant la production des cellules pour une utilisation clinique.
Essai clinique de phase I/II (voir Encadré)
Sur la base des résultats précliniques obtenus, une demande a été soumise à la FDA (
Food and Drug Administration
) pour des essais utilisant les CSH autologues CD34
+
génétiquement modifiées avec le vecteur pCCL-CTNS pour le traitement de la cystinose (CTNS-RD-04). Cette demande a été acceptée pour un essai clinique de phase I/II, le 19 décembre 2018. L’essai a débuté en juillet 2019 après avoir reçu un financement du
California Institute of Regenerative Medicine
(CIRM), de la
Cystinosis Research Foundation
et des
National Institutes of Health
(NIH). Un total de six patients devait être enrôlés, échelonné par cohorte de deux patients. Les objectifs principaux de l’essai clinique consistent à évaluer l’innocuité ainsi que l’efficacité du protocole CTNS-RD-04. L’impact du traitement par le vecteur sera testé en mesurant les niveaux de cystine dans le sang et le nombre de cristaux de cystine dans différents tissus, ainsi qu’en suivant l’évolution des complications cliniques associées à la cystinose, y compris la fonction rénale, la vision, la force musculaire, la fonction respiratoire, la densité osseuse, la fonction endocrinienne et la qualité de vie. Afin de disposer d’un outil non invasif pour visualiser et quantifier les cristaux de cystine dans la peau, une nouvelle méthode utilisant la microscopie confocale intradermique et un logiciel d’imagerie avancé a été développée.
Six patients présentant une cystinose ont été transplantés, le premier patient ayant été infusé le 7 octobre 2019. L’évaluation des résultats chez chaque patient est en cours. Un partenariat a été établi avec la société de biotechnologie de thérapie génique,
AVROBIO
,
Inc
, pour la prochaine phase de ces essais cliniques.
|
Le traitement de la cystinose est lourd et pénible et retarde seulement l’évolution de la maladie. Dans cette revue, nous avons décrit les étapes allant de la découverte du gène à la thérapie génique pour traiter la cystinose, en passant par la caractérisation de la fonction de la protéine et la génération d’un modèle murin. Le transfert des études précliniques à un essai clinique a demandé d’importants investissements matériels, humains et financiers, et de nombreuses années. La transplantation autologue de cellules souches hématopoïétiques génétiquement modifiées pour exprimer le gène
CTNS
représente une nouvelle approche thérapeutique prometteuse pour traiter la cystinose. Cette approche pourrait potentiellement traiter la plupart des complications associées à cette maladie. L’essai clinique en cours évaluera son potentiel chez les patients.
|
Stéphanie Cherqui est co-inventeure d’un brevet soumis, intitulé « Methods of treating lysosomal disorders » (#20378-101530), et est co-fondatrice, actionnaire et membre du conseil scientifique et du conseil d’administration de Papillon Therapeutics Inc. Stéphanie Cherqui est consultante pour AVROBIO, Inc. et reçoit une rémunération pour ses services. Elle est également membre du comité d’évaluation scientifique et du conseil d’administration de la Cystinosis Research Foundation. Les termes de cet accord ont été examinés et approuvés par l’Université de Californie à San Diego.
|
Essai clinique
Les critères d’inclusion de l’essai clinique comprennent un diagnostic de cystinose infantile, un débit de filtration glomérulaire > 15 mL/min/1,73 m
2
, une fonction thyroïdienne adéquate (TSH : 0,27-4,2 mUI/L et T4 < 2 × LSN mcg/dL), et une fonction respiratoire adéquate (FEV1 > 50 %). Pour les patients ayant reçu une greffe de rein auparavant, une année post-greffe est requise pour pouvoir participer à l’essai. Les cellules souches du sang périphérique sont isolées après mobilisation par les facteurs de stimulation G-CSF et plerixafor, suivie par une aphérèse ; la combinaison G-CSF/plerixafor améliore non seulement la quantité de cellules mobilisées mais aussi le nombre de cellules souches primitives [
33
], cette combinaison est donc préférentiellement choisie dans les protocoles de thérapie génique. Les cellules CD34
+
sont isolées, transduites à l’aide du vecteur lentiviral pCCL-CTNS et congelées pendant la caractérisation du produit cellulaire. Si toutes les conditions d’acceptabilités du produit sont remplies, CTNS-RD-04 est alors perfusé par voie intraveineuse à la dose minimale de 3 × 10
6
cellules CD34
+
/kg après chimiothérapie avec l’agent busulfan, qui n’est pas néphro-toxique, une propriété particulièrement importante dans le cas des patients présentant une cystinose. Les patients interrompent le traitement par cystéamine orale deux semaines avant la chimiothérapie et les gouttes oculaires de cystéamine un mois après la perfusion de CTNS-RD-04.
|
|
Ces travaux ont reçu le financement de la Cystinosis Research Foundation, des National Institutes of Health (NIH) RO1-DK090058 and R01-NS108965, et du California Institute of Regenerative Medicine (CIRM, CLIN-09230 and CLIN2-11478).
|
Footnotes |
1.
Levy
M
,
Feingold
J
.
Estimating prevalence in single-gene kidney diseases progressing to renal failure.
.
Kidney Int.
2000;
;
58
:
:925.
–
943
.
2.
Gahl
WA
,
Thoene
JG
,
Schneider
JA
.
Cystinosis.
.
N Engl J Med.
2002;
;
347
:
:111.
–
121
.
3.
Gahl
WA
,
Schneider
JA
,
Aula
P
.
Lysosomal transport disorders : cystinosis and sialic acid storage disorders.
. In:
The Metabolic and Molecular Basis of Inherited Disease.
. eds
Scriver
CR
,
Beaudet
AL
,
Sly
WS
,
Valle
D
. 7
th
ed.
1995
:
:3763.
–
97
.
4.
Haffner
D
,
Weinfurth
A
,
Manz
F
et al.
Long-term outcome of paediatric patients with hereditary tubular disorders.
.
Nephron.
1999;
;
83
:
:250.
–
260
.
5.
Lemire
J
,
Kaplan
BS
.
The various renal manifestations of the nephropathic form of cystinosis.
.
Am J Nephrol.
1984;
;
4
:
:81.
–
85
.
6.
Langman
CB
,
Moore
ES
,
Thoene
JG
,
Schneider
JA
.
Renal failure in a sibship with late-onset cystinosis.
.
J Pediatr.
1985;
;
107
:
:755.
–
756
.
7.
Lietman
PS
,
Frazier
PD
,
Wong
VG
.
et al.
Adult cystinosis-a benign disorder.
.
Am J Med.
1966;
;
40
:
:511.
–
7
.
8.
Gahl
WA
,
Reed
GF
,
Thoene
JG
et al.
Cysteamine therapy for children with nephropathic cystinosis.
.
N Engl J Med.
1987;
;
316
:
:971.
–
977
.
9.
Dohil
R
,
Fidler
M
,
Gangoiti
JA
et al.
Twice-daily cysteamine bitartrate therapy for children with cystinosis.
.
J Pediatr.
2010;
;
156
:
:71.
–
5 e1–3
.
10.
Schneider
JA
.
Approval of cysteamine for patients with cystinosis.
.
Pediatr Nephrol.
1995;
;
9
:
:254.
.
11.
The Cystinosis Collaborative Research Group.
.
Linkage of the gene for cystinosis to markers on the short arm of chromosome 17.
.
Nat Genet.
1995;
;
10
:
:246.
–
248
.
12.
Town
M
,
Jean
G
,
Cherqui
S
et al.
A novel gene encoding an integral membrane protein is mutated in nephropathic cystinosis.
.
Nat Genet.
1998;
;
18
:
:319.
–
324
.
13.
Cherqui
S
,
Kalatzis
V
,
Trugnan
G
,
Antignac
C
.
The targeting of cystinosin to the lysosomal membrane requires a tyrosine-based signal and a novel sorting motif.
.
J Biol Chem.
2001;
;
276
:
:13314.
–
13321
.
14.
Kalatzis
V
,
Cherqui
S
,
Antignac
C
,
Gasnier
B
.
Cystinosin, the protein defective in cystinosis, is a H(+)-driven lysosomal cystine transporter.
.
Embo J.
2001;
;
20
:
:5940.
–
5949
.
15.
Zhai
Y
,
Heijne
WH
,
Smith
DW
,
Saier
MH
,
Jr.
.
Homologues of archaeal rhodopsins in plants, animals and fungi : structural and functional predications for a putative fungal chaperone protein.
.
Biochim Biophys Acta.
2001;
;
1511
:
:206.
–
223
.
16.
Kalatzis
V
,
Nevo
N
,
Cherqui
S
et al.
Molecular pathogenesis of cystinosis : effect of CTNS mutations on the transport activity and subcellular localization of cystinosin.
.
Hum Mol Genet.
2004;
;
13
:
:1361.
–
1371
.
17.
Gaide Chevronnay
HP
,
Janssens
V
,
Van Der Smissen
P
,
et al.
,
A mouse model suggests two mechanisms for thyroid alterations in infantile cystinosis: decreased thyroglobulin synthesis due to endoplasmic reticulum stress/unfolded protein response and impaired lysosomal processing.
.
Endocrinology.
2015;
;
156
:
:2349.
–
2364
.
18.
Forestier
L
,
Jean
G
,
Attard
M
et al.
Molecular characterization of CTNS deletions in nephropathic cystinosis : development of a PCR-based detection assay.
.
Am J Hum Genet.
1999;
;
65
:
:353.
–
359
.
19.
Cherqui
S
,
Kalatzis
V
,
Forestier
L
,
et al.
Identification and characterisation of the murine homologue of the gene responsible for cystinosis.
.
Ctns. BMC Genomics.
2000;
;
1
:
:2.
.
20.
Dufier
JL
,
Dhermy
P
,
Gubler
MC
,
et al.
Ocular changes in long-term evolution of infantile cystinosis.
.
Ophthalmic Paediatr Genet.
1987;
;
8
:
:131.
–
137
.
21.
Nevo
N
,
Chol
M
,
Bailleux
A
,
et al.
Renal phenotype of the cystinosis mouse model is dependent upon genetic background.
.
Nephrol Dial Transplant.
2010;
;
25
:
:1059.
–
1066
.
22.
Syres
K
,
Harrison
F
,
Tadlock
M
,
et al.
Successful treatment of the murine model of cystinosis using bone marrow cell transplantation.
.
Blood.
2009;
;
114
:
:2542.
–
2552
.
23.
Yeagy
BA
,
Harrison
F
,
Gubler
MC
,
et al.
Kidney preservation by bone marrow cell transplantation in hereditary nephropathy.
.
Kidney Int.
2011;
;
79
:
:1198.
–
1206
.
24.
Goodman
S
,
Naphade
S
,
Khan
M
,
et al.
Macrophage polarization impacts tunneling nanotube formation and intercellular organelle trafficking.
.
Sci Rep.
2019;
;
9
:
:14529.
.
25.
Naphade
S
,
Sharma
J
,
Gaide Chevronnay
HP
,
et al.
Brief reports : lysosomal cross-correction by hematopoietic stem cell-derived macrophages via tunneling nanotubes.
.
Stem Cells.
2015;
;
33
:
:301.
–
309
.
26.
Gaide Chevronnay
HP
,
Janssens
V
,
Van Der Smissen
P
,
et al.
Hematopoietic Stem Cells Transplantation Can Normalize Thyroid Function in a Cystinosis Mouse Model.
.
Endocrinology.
2016;
;
157
:
:1363.
–
1371
.
27.
Rocca
CJ
,
Kreymerman
A
,
Ur
SN
,
et al.
Treatment of Inherited Eye Defects by Systemic Hematopoietic Stem Cell Transplantation.
.
Invest Ophthalmol Vis Sci.
2015;
;
56
:
:7214.
–
7223
.
28.
Haschemi
A
,
Kosma
P
,
Gille
L
,
et al.
The sedoheptulose kinase CARKL directs macrophage polarization through control of glucose metabolism.
.
Cell Metab.
2012;
;
15
:
:813.
–
826
.
29.
Goodman
S
,
Khan
M
,
Sharma
J
,
et al.
Deficiency of the sedoheptulose kinase (Shpk) does not alter the ability of hematopoietic stem cells to rescue cystinosis in the mouse model.
.
Mol Genet Metab.
2021;
;
134
:
:309.
–
16
.
30.
Elmonem
MA
,
Veys
K
,
Oliveira Arcolino
F
,
et al.
Allogeneic HSCT transfers wild-type cystinosin to nonhematological epithelial cells in cystinosis : First human report.
.
Am J Transplant.
2018;
;
18
:
:2823.
–
2828
.
31.
Cartier
N
,
Hacein-Bey-Abina
S
,
Bartholomae
CC
,
et al.
Hematopoietic stem cell gene therapy with a lentiviral vector in X-linked adrenoleukodystrophy.
.
Science.
2009;
;
326
:
:818.
–
823
.
32.
Harrison
F
,
Yeagy
BA
,
Rocca
CJ
,
et al.
Hematopoietic stem cell gene therapy for the multisystemic lysosomal storage disorder cystinosis.
.
Mol Ther.
2013;
;
21
:
:433.
–
444
.
33.
Yannaki
E
,
Karponi
G
,
Zervou
F
,
et al.
Hematopoietic stem cell mobilization for gene therapy : superior mobilization by the combination of granulocyte-colony stimulating factor plus plerixafor in patients with beta-thalassemia major.
.
Hum Gene Ther.
2013;
;
24
:
:852.
–
860
.
34.
Cherqui
S
,
Sevin
C
,
Hamard
G
,
et al.
Intralysosomal cystine accumulation in mice lacking cystinosin, the protein defective in cystinosis.
.
Mol Cell Biol.
2002;
;
22
:
:7622.
–
7632
.
|