| |
| Med Sci (Paris). 39(3): 246–252. doi: 10.1051/medsci/2023029.Atteinte neurologique et syndrome néphrotique cortico-résistant Des chevauchements troublants Olivia Boyer,1,2 Géraldine Mollet,2 and Guillaume Dorval2,3* 1Service de néphrologie pédiatrique, AP-HP, Centre de référence de maladies rénales rares de l’enfant et de l’adulte (MARHEA), hôpital Necker - Enfants Malades
,
Paris
,
France 2
Université Paris Cité, institut
Imagine
, laboratoire des maladies rénales héréditaires, Inserm UMR1163
,
Paris
,
France 3Service de génétique moléculaire, AP-HP, hôpital Necker-Enfants Malades
,
Paris
,
France |
Vignette (©iStock).
Les études génétiques portant sur le syndrome néphrotique héréditaire ont identifié une soixantaine de gènes qui, quand ils sont mutés, entraînent la survenue d’un syndrome néphrotique cortico-résistant (SNCR) isolé ou généralisé. La plupart de ces gènes codent des protéines exprimées dans le podocyte, comme des facteurs de transcription, des protéines mitochondriales, mais surtout des protéines de structure du diaphragme de fente
1
ainsi que des protéines associées au cytosquelette (maintien et régulation). Le dénominateur commun de toutes ces anomalies génétiques est l’apparition d’une protéinurie qui, lorsqu’elle est massive, peut conduire au développement d’un SNCR. Tous les phénotypes, secondaires à ces variations génétiques, ont été regroupés sous le terme de podocytopathies héréditaires.
Le podocyte, de par sa structure et sa physiologie, est une cellule unique. Il partage cependant de nombreuses similitudes avec le neurone. En effet, ces deux cellules post-mitotiques sont hautement différenciées, polarisées, et présentent une architecture arborisée marquée par des extensions cytoplasmiques épaisses enrichies en microtubules (neurites [axones et dendrites pour le neurone] et pieds primaires pour le podocyte) qui partent du corps cellulaire et desquelles émergent d’autres protusions plus fines enrichies en actine (épines dendritiques pour les neurones et pédicelles pour les podocytes) [
1
]. Neurones et podocytes interagissent entre eux au niveau de plateformes intercellulaires spécifiques : respectivement la synapse et le diaphragme de fente. En microscopie électronique, la face cytoplasmique du diaphragme de fente rappelle la zone post-synaptique des neurones, avec la synapse neuronale qui forme une fente de 20 à 50 nm, assez semblable à la distance existante entre deux pédicelles, qui est estimée à 40 nm au niveau du diaphragme de fente. Ces deux structures sont, par ailleurs, résistantes au détergent Triton-X-100, ce qui indique qu’elles sont enrichies en radeaux lipidiques, des microdomaines de la membrane plasmique riches en cholestérol qui jouent un rôle essentiel dans la signalisation cellulaire en concentrant des protéines, comme des récepteurs. Au niveau structurel, la zone post-synaptique contient de nombreux récepteurs de neurotransmetteurs et canaux ioniques qui sont liés au cytosquelette d’actine par des protéines adaptatrices. Les réarrangements du cytosquelette induits par les signaux présynaptiques sont essentiels à la plasticité neuronale et au fonctionnement du système nerveux, rappelant la structure du diaphragme de fente.
Parallèlement à ces aspects morphologiques, plusieurs études ont mis en évidence des similitudes fonctionnelles et biochimiques entre les podocytes et les neurones. Dans ce sens, un nombre croissant de protéines, autrefois spécifiques des neurones, sont désormais également identifiées dans les podocytes
(
Tableau I
)
, et
vice versa
. Par exemple, les podocytes et certains neurones expriment les mêmes molécules spécifiques, comme la néphrine et les protéines Neph1 (
nephrin-like protein 1
) [
2
], la densine [
3
], GLEPP1 (
glomerular epithelial protein 1
) [
4
], la synaptopodine [
5
], les transporteurs d’acides aminés, les canaux ioniques, les récepteurs des catécholamines et les facteurs de guidage axonal [
6
]. Parmi ceux-ci, il a été démontré que MEC-2 (
mechanosensory protein 2
), l’orthologue de la podocine chez
Caenorhabditis elegans
, est située dans la membrane des neurones sensoriels et s’associe aux canaux ioniques pour réguler la mécanosensation [
7
]. Les protéines néphrine et Neph1, composants majeurs du diaphragme de fente, jouent également un rôle clé dans la structure et la fonction de la synapse du motoneurone chez
C. elegans
. Dans les neurones centraux murins, la protéine kinase Fyn phosphoryle la néphrine, activant ainsi une voie de signalisation intraneuronale similaire à celle décrite dans le podocyte. De plus, les souris déficientes pour le gène
Fyn
développent une podocytopathie avec effacement des pédicelles entraînant une protéinurie, mais elles développent aussi des défauts cognitifs [
8
]. Enfin, la néphrine interagit également avec les récepteurs du glutamate et l’exocytose du glutamate est perturbée si la néphrine est inhibée par interférence à l’ARN [
9
].
Tableau I.
| Protéine |
Localisation dans le podocyte |
Localisation dans le neurone |
| Densine |
Diaphragme de fente |
Synapse |
| Synaptopodine |
Pédicelles |
Dendrites |
| Rab3a / Rabphilline3a |
Diaphragme de fente |
Vésicules synaptiques |
| Néphrine |
Diaphragme de fente |
Synapse |
| Neph1 |
Diaphragme de fente |
Synapse |
| GLEPP1 / PTPRO |
Diaphragme de fente |
Vésicules post-synaptiques |
Liste des protéines exprimées dans les neurones et les podocytes.
|
Dans le rein, la densine, décrite à l’origine comme une protéine spécifique des synapses, est également présente dans les pédicelles où elle interagit avec la néphrine et l’α-actinine-4
(
Tableau I
)
. La synaptopodine, exprimée dans les podocytes et les dendrites du télencéphale [
5
], stabilise RhoA dans les podocytes, en se liant à la forme GDP, et favorise la polymérisation des filaments d’actine. Giardano
et al.
ont postulé l’existence d’une synapse glomérulaire en observant l’expression dans le podocyte mature de la GTPase Rab3A, et de son effecteur, la rabphilline 3A [
10
]. Comme dans la zone neuronale présynaptique, ces deux protéines permettent l’exocytose calcium-dépendante de vésicules synaptiques glutamatergiques par le podocyte. En outre, les podocytes expriment le récepteur du N-méthyl-D-aspartate (NMDA). Les souris
Rab3a
-/-
développent une protéinurie avec effacement des pédicelles, et l’administration d’antagonistes pharmacologiques du récepteur du glutamate de type NMDA induit une protéinurie glomérulaire
in vivo
, ainsi que des altérations du cytosquelette d’actine
in vitro
dans des podocytes en culture [
10
]. Ces résultats suggèrent un rôle important de la signalisation glutamatergique dans la fonction des podocytes.
Des machineries cellulaires communes entre les podocytes et les cellules de Schwann ont également été démontrées. Plaisier
et al.
ont montré l’expression par les podocytes de la protéine P0, spécifique des cellules de Schwann [
11
], l’un des principaux composants de la myéline périphérique. De plus, le fait que les souris
P0
-/-
développent une protéinurie glomérulaire a confirmé le rôle essentiel de cette molécule dans l’intégrité de la barrière de filtration glomérulaire [
11
]. D’autres protéines sont communes à ces deux types cellulaires comme la periaxine et la dynamine 2, codées respectivement par les gènes
PRX
et
DNM2,
dont les variants conduisent à la maladie démyélinisante autosomique récessive de Charcot-Marie-Tooth (CMT) [
12
].
Ces données suggèrent donc que les podocytes possèdent des machineries similaires à celles des neurones, mais aussi des cellules de Schwann. Dans cette revue, nous nous concentrerons uniquement sur les syndromes génétiques associant les podocytopathies héréditaires à une atteinte neurologique centrale et/ou périphérique. Nous montrerons l’apport de la génétique à une meilleure compréhension des mécanismes communs aux podocytes et aux cellules du système nerveux. |
SNCR avec atteinte du système nerveux central Syndrome de Galloway-Mowat Aspects généraux
Le syndrome de Galloway-Mowat (GAMOS, OMIM#251300) est une forme syndromique extrêmement rare de podocytopathie héréditaire autosomique récessive ou liée au chromosome X. Depuis sa première description en 1968 par Galloway et Mowat, environ 140 cas ont été publiés. La maladie est généralement diagnostiquée dans les premiers mois de la vie, mais peut être détectée dans l’enfance avec un début plus tardif. Les manifestations cliniques, qui touchent principalement les reins et le système nerveux central, sont hétérogènes. Les manifestations rénales vont de la protéinurie isolée au syndrome néphrotique précoce, multi-résistant et évoluant rapidement vers l’insuffisance rénale terminale (IRT). Le spectre des atteintes neurologiques est décrit dans le
Tableau II
. La variabilité clinique du GAMOS reflète son hétérogénéité génétique, avec des variants causaux identifiés dans dix gènes à ce jour
(
Tableau II
)
.
| Tableau II.
Variabilité clinique du GAMOS.
|
WDR73 et GAMOS 1 (OMIM#251300)
2
En 2014, notre groupe a identifié
WDR73
(
WD repeat domain 73
)
,
le premier gène à être muté dans un sous-ensemble particulier d’enfants atteints de GAMOS [
13
]. Le phénotype clinique associé aux variants de ce gène est caractérisé par une microcéphalie secondaire, une atrophie cérébelleuse sévère, un dysfonctionnement rétinien et une néphropathie tardive, avec l’apparition, entre deux et huit ans, de lésions de hyalinose segmentaire et focale (HSF) à la biopsie, voire une absence de néphropathie dans certains cas.
WDR73
code une protéine localisée le long des microtubules pendant l’interphase et au niveau des pôles du fuseau et des microtubules astraux pendant la mitose. Les embryons de poisson zèbre inactivés pour
wdr73
présentent un déficit de croissance du cerveau résultant d’un défaut de prolifération et de différenciation des cellules progénitrices neurales [
14
]. WDR73 joue un rôle essentiel dans la maturation de certains petits ARN nucléaires non codants qui sont impliqués dans l’épissage des ARN pré-messagers [
15
].
Modification t6A des ARN de transfert et GAMOS 2-5 et GAMOS 9,10 (OMIM#301006, 617729, 617730, 617731 et 619603, 619609)
Les ARN de transfert (ARNt) sont des acteurs clés de la synthèse des protéines car ils décodent l’information génétique portée par l’ARN messager (ARNm) et organisée en codons, chaque codon correspondant à un acide aminé différent (64 codons pour 20 acides aminés). Pour être fonctionnels, les ARNt subissent d’importantes modifications post-transcriptionnelles, catalysées par différentes enzymes [
16
]. Des travaux récents ont montré que des hypomodifications de ces ARNt, qui les rendent moins stables, sont retrouvées dans plusieurs maladies, telles que les mitochondriopathies, la maladie d’Alzheimer, les maladies métaboliques et aussi divers troubles du neurodéveloppement [
17
].
Parmi ces modifications post-transcriptionnelles, la modification t
6
A (N6-thréonyl-carbamoyl-adénosine) est l’une des rares modifications de l’ARNt universellement conservées entre les espèces. Elle consiste en l’ajout d’un groupement thréonyl-carbamoyl sur l’adénosine en position 37, en 3’ de l’anticodon des ARNt décodant les codons ANN
3
, dont l’ARNt
Met
, initiateur de la traduction [
18
]
(
Figure 1
)
. Cette modification joue donc un rôle crucial dans l’efficacité et la fidélité de la traduction, affectant ainsi la synthèse des protéines. La biosynthèse du t
6
A se déroule en deux étapes : la protéine YRDC (
yrdC N6-threonylcarbamoyltransferase domain containing
) / Sua5 synthétise d’abord un intermédiaire thréonyl-carbamoyl-AMP, puis le groupement thréonyl-carbamoyl (TC) est transféré sur l’ARNt par le complexe multiprotéique KEOPS (
kinase, endopeptidase and other proteins of small size
) très conservé au cours de l’évolution
(
Figure 1
)
[
19
]. Le complexe humain est constitué de quatre sous-unités, LAGE3, OSGEP, TP53RK et TPRKB, OSGEP étant la sous-unité catalytique. Une cinquième sous-unité, GON7, a été très récemment identifiée chez l’homme [
20
].
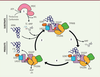 | Figure 1.
Mécanisme de la catalyse de la dernière étape de biosynthèse conduisant à la modification t6A par le complexe KEOPS. (1)
Synthèse du TC-AMP (thréonyl-carbamoyle-AMP) : YRDC catalyse la synthèse du TC-AMP à partir de la thréonine, du bicarbonate et de l’ATP. Cette étape conduit à la production d’un TC-AMP instable et à la libération de pyrophosphate inorganique.
(2)
Liaison de l’ARNt et du TC-AMP au complexe KEOPS : le TC-AMP se lie au site actif d’OSGEP et interagit directement avec l’atome de fer via la partie thréonyle de la molécule. La liaison de l’ARNt au complexe induit des changements de conformation dans ce dernier, y compris le déplacement de l’extrémité C-terminale de TP53RK (TP53 regulating kinase) (indiqué par une flèche rouge). LAGE3 et OSGEP sont impliqués dans la plupart des contacts (triangles gris et *) avec l’ARNt, tandis que TP53RK est impliquée dans la liaison de l’ARNt par son extrémité C-terminale. Une boucle anticodon portant le nucléotide cible A37 est positionnée à l’entrée de la cavité du site actif de l’OSGEP, près de l’intermédiaire TC-AMP et de l’atome de fer.
(3)
Transfert du L-thréonyl-carbamoyl à l’ARNt : la fraction L-thréonyl-carbamoyl est transférée à l’A37 de l’ARNt du substrat indépendamment de l’ATP, et l’AMP est libéré.
(4)
Libération de l’ARNt modifié en 6A : l’hydrolyse de l’ATP catalysée par TP53RK entraîne des changements de conformation, en particulier le déplacement de l’extrémité C-terminale de TP53RK (indiquée par la flèche rouge), ce qui conduit à la dissociation de l’ARNt modifié du complexe KEOPS. Le complexe KEOPS résultant est alors compétent pour un autre cycle catalytique (adapté de [
18
]).
|
Variants des gènes codant les composants de la voie de biosynthèse du t6A : phénotypes associés
En 2017, 22 variants ont été identifiés (4 variants à l’origine de protéines tronquées et 17 variants faux-sens) parmi les quatre gènes codant les sous-unités du complexe KEOPS :
LAGE3, OSGEP, TP53RK
et
TPRKB
[
21
]. Ces variants ont été mis en évidence chez 37 personnes atteintes de GAMOS issues de 32 familles non apparentées. Près de la moitié des variants du gène
OSGEP
ont été identifiés. Les variants à l’origine de protéines tronquées étaient toujours associés à une mutation faux-sens. L’absence totale de ces protéines ne semble pas compatible avec la vie. Le phénotype clinique retrouvé chez les patients porteurs de variants de ces gènes est très sévère. Il consiste en une microcéphalie primaire, un retard de développement. Les patients présentent de plus une protéinurie précoce à l’âge médian de trois mois avec une IRT à l’âge médian de onze mois incluant un SN congénital pour certains. Des anomalies cérébrales ont été retrouvées chez 33 des 37 patients. Elles consistaient principalement en une atrophie corticale et cérébelleuse, des anomalies de gyration et des défauts de myélinisation. Les biopsies rénales ont montré des lésions de HSF ou de SMD (sclérose mésangiale diffuse). La plupart des enfants atteints sont décédés à un âge médian de six mois [
21
]. Deux variants ont ensuite été identifiés dans le gène
GON7,
chez onze personnes atteintes de GAMOS issues de cinq familles non apparentées, et trois variants dans le gène
YRDC,
chez trois enfants issus de deux familles non apparentées. Les patients porteurs de variants du gène
GON7
avaient un phénotype moins sévère que ceux qui portaient des variants du gène
YRDC
. Le niveau de t
6
A était diminué dans les fibroblastes isolés des patients portant des variants des gènes
OSGEP
and
YRDC
, confirmant l’implication de la biosynthèse du t
6
A dans la pathogenèse du GAMOS chez ces patients.
Modification m7G des ARNt, WDR4 (complexe WDR4/METTL1) et GAMOS 6 (OMIM#618347)
En 2018, Braun
et al.
ont identifié dans une fratrie de quatre enfants présentant un GAMOS, une mutation homozygote du gène
WDR4
, connu pour être muté dans le nanisme microcéphalique ostéodysplasique primordial [
22
]. Cette mutation affecte un nucléotide au niveau du site accepteur d’épissage de l’intron 4 du gène. Le phénotype des quatre enfants, âgés de quatre à quinze ans, était moins sévère que celui des patients présentant des variants des gènes
KEOPS
et similaire à celui des patients présentant des variants du gène
WDR73
. Trois des quatre enfants présentaient une protéinurie de type néphrotique, mais aucune insuffisance rénale n’a été observée. Les patients présentaient une microcéphalie, un retard de développement léger à sévère, une clinodactylie, un retard de croissance, mais une IRM (imagerie par résonance magnétique) cérébrale normale. Le gène
WDR4
code un composant de l’holoenzyme METTL1/WDR4, responsable de la modification post-transcriptionnelle hautement conservée de la N7-méthyl-guanosine (m
7
G) des ARNt [
23
]. Il semble donc que les neurones et les podocytes soient deux types cellulaires particulièrement sensibles aux défauts de modification des ARNt.
Nucléoporines et GAMOS 7,8 (OMIM#618348, 618349)
Le GAMOS peut également être dû à des variants des gènes
NUP
, en particulier
NUP107
et
NUP133
, codant des nucléoporines qui sont les composants principaux des pores nucléaires, les plus grands complexes macromoléculaires des cellules eucaryotes. Ces pores traversent l’enveloppe nucléaire, formant une barrière sélective entre le cytoplasme et le noyau. Ils participent à une grande variété de processus cellulaires, notamment le transport bidirectionnel entre le cytoplasme et le noyau, mais aussi la régulation de la transcription, l’organisation de la chromatine et la division cellulaire [
24
].
Une mutation intronique du gène
NUP107
(c.3335-11T>A ; p.1111_1112insValPheIle) a été identifiée chez cinq enfants de deux familles turques, qui présentaient une microcéphalie, un retard de développement, avec ou sans protéinurie détectée entre quatre et douze ans, et une IRT à onze ans, avec une hyalinose segmentaire et focale observée sur la biopsie. Une clinodactylie et une petite taille ont également été décrites [
25
]. Une mutation homozygote du gène
NUP133
(c.303G>A ; p.Met101Ile) a par ailleurs été identifiée chez des patients présentant une microcéphalie, un retard de développement neurologique, une déficience intellectuelle profonde et une apparition dans l’enfance d’un syndrome néphrotique cortico-résistant [
26
]. Le syndrome néphrotique a débuté entre l’âge de onze mois et de deux ans et dix mois et l’IRT est apparue entre deux et quatre ans environ. Bien que ces études aient montré que ces variants diminuent l’expression de NUP107 et NUP133, que la mutation du gène
NUP133
empêche l’interaction avec NUP107, et que la mutation du gène
NUP107
entraîne une réduction du nombre de pores nucléaires, les mécanismes moléculaires et cellulaires qui sous-tendent la physiopathologie du GAMOS en cas de déficience des gènes codant les nucléoporines ne sont toujours pas élucidés.
Syndrome de Pierson (OMIM#609049)
Le syndrome de Pierson est une maladie autosomique récessive comprenant un syndrome néphrotique congénital avec sclérose mésangiale diffuse (SMD) et plus rarement une hyalinose segmentaire et focale, et des anomalies oculaires distinctes, notamment une microcorie (rétrécissement extrême non réactif des pupilles) due à l’hypoplasie des muscles ciliaires et pupillaires. De nombreux patients meurent dans la petite enfance, et ceux qui survivent ont tendance à présenter un retard du développement neurologique et une perte de la vue. La cartographie de l’homozygotie dans deux familles consanguines a conduit à l’identification d’un locus sur le chromosome 3p et, rapidement, à l’identification de variants du gène
LAMB2
(
laminin subunit beta 2
) [
23
]. Les souris déficientes pour
Lamb2
présentent une protéinurie congénitale, un syndrome néphrotique, des anomalies de la rétine et de la vision et des jonctions neuromusculaires aberrantes [
27
]. Ce gène code la sous-unité bêta-2 de la laminine, présente dans la membrane basale glomérulaire et la membrane oculaire. Les laminines sont des protéines de la matrice extracellulaire qui fournissent la structure de base pour l’assemblage des autres composants de la membrane basale glomérulaire, notamment le collagène de type IV, le nidogène/entactine et les protéoglycanes sulfatés. Notons que les variants les moins sévères de
LAMB2
entraînent un syndrome néphrotique congénital apparemment isolé avec des défauts oculaires mineurs ou inexistants et un développement psychomoteur normal [
28
]. Dans le modèle de souris
Lamb2
-/-
, la surexpression de
Lamb1
a permis de réduire la sévérité de la protéinurie, ouvrant ainsi la voie à des thérapies potentielles [
29
].
ARHGDIA et défauts neurologiques
Des variants du gène
ARHGDIA
(
Rho GDP-dissociation inhibitor alpha
) peuvent entraîner des phénotypes rénaux et neurologiques. En effet, certains variants entraînent un syndrome néphrotique congénital/infantile et une IRT avant l’âge de trois ans, avec des lésions histologiques de sclérose mésangiale diffuse, associées à des atteintes neurologiques multiples (déficience intellectuelle, surdité de perception, épilepsie, cécité corticale)[
30
].
ARHGDIA
code la protéine
Rho GDP-dissociation inhibitor 1
(RhoGDIα), impliquée dans la régulation du cytosquelette d’actine et la motilité cellulaire
in vitro
. Des modèles de souris et de poisson zèbre peuvent présenter le phénotype pathologique observé chez l’homme qui peut être partiellement amélioré par des inhibiteurs de RAC1, ouvrant ainsi la voie à la thérapie de certaines formes de SN héréditaire [
30
].
|
Podocytopathie avec neuropathie périphérique Charcot-Marie-Tooth-FSGS (OMIM#614455)
La maladie de Charcot-Marie-Tooth (CMT) est un groupe hétérogène de neuropathies périphériques sensori-motrices chroniques et héréditaires. Leur prévalence est estimée entre 10 et 80/100 000, ce qui en fait la maladie neuromusculaire héréditaire la plus fréquente [
31
]. Les symptômes apparaissent généralement au cours de la première ou de la seconde décennie. Le déficit moteur distal et symétrique est progressif, touchant d’abord les membres inférieurs, et aboutissant à une amyotrophie symétrique, une diminution des réflexes tendineux profonds et des déformations des pieds, le plus souvent de type
pes cavus
(pied à voûte plantaire élevée) et des orteils prenant la forme de griffes [
32
]. L’atteinte tardive des membres supérieurs se caractérise par une faiblesse et une atrophie des muscles de la main, une rétraction musculaire et des doigts arqués. Le déficit sensoriel symétrique est généralement d’apparition lente et peu invalidant. Cependant, des troubles sensoriels profonds peuvent entraîner des déficits importants de la posture et de l’équilibre. Une perte auditive légère à modérée est présente chez 5 % des patients [
33
].
Plus de 80 gènes différents ont été associés aux formes autosomiques dominantes, récessives ou liées à l’X du CMT, permettant un diagnostic moléculaire chez près de 70 % des patients [
32
]. Curieusement, la prévalence estimée de la hyalinose segmentaire et focale (HSF) est de 1/400 chez les patients présentant une CMT, contre 1/1 000 000 dans la population générale [
34
]. Cependant, les bases moléculaires communes à ces deux entités nosologiques sont restées longtemps méconnues. Des variants du gène
INF2
(
inverted formin-2
) situés au niveau du domaine inhibiteur diaphane (DID) de la protéine, sont une cause majeure de podocytopathies avec hyalinose segmentaire, représentant jusqu’à 17 % des cas autosomiques dominants et 1 % des cas sporadiques. La formine INF2 joue un rôle essentiel dans le remodelage des cytosquelettes d’actine et de microtubules. Notre groupe a postulé que des variants du gène
INF2
pouvaient être responsables de l’association entre CMT et HSF. Neuf nouveaux variants hétérozygotes ont été identifiés dans douze des seize familles que nous avons étudiées, ce qui correspond à un taux de mutation de 75 % [
35
]. Tous ces variants se situent dans les exons 2 et 3 codant le domaine DID, et n’ont pas été trouvés chez les patients présentant une CMT isolée. La protéinurie a été détectée à un âge médian de 18 ans, et onze patients avaient présenté une IRT à un âge médian de vingt-et-un ans. Tous présentaient des lésions de HSF. La CMT est apparue à un âge médian de treize ans. Ces données suggèrent un phénotype CMT intermédiaire associé aux variants du gène
INF2
; la maladie est désormais officiellement appelée CMT intermédiaire dominant sous-type E (CMTDIE ; OMIM 614455). Ces résultats ont élucidé les bases moléculaires d’une double maladie neuro-rénale décrite il y a 50 ans, et nous incitent à rechercher le
pes cavus
(pied à voûte plantaire élevée) et à tester les réflexes tendineux profonds chez les patients présentant une HSF, et à recommander à nos collègues neurologues de vérifier les bandelettes urinaires chez leurs patients CMT. Les cas de CMT-HSF sont principalement associés à des variants dans les exons 2 et 3, tandis que les variants provoquant une HSF isolée sont répartis dans les exons 2, 3, 4 et 6 du gène [
36
].
|
Les troubles neuro-rénaux sont hétérogènes et peuvent affecter le système nerveux central (GAMOS - syndrome de Pierson) ou le système nerveux périphérique (CMT-HSF). Les mécanismes cellulaires sous-jacents ne sont pas tous clairement identifiés et suggèrent la présence de voies de signalisation cellulaire partagées entre les podocytes et les neurones et/ou les cellules de Schwann. Il semble que les modifications post-transcriptionnelles des ARNt, impliqués dans la synthèse protéique, jouent un rôle important dans les fonctions des podocytes et des neurones, la plupart des gènes dont les variants pathogènes conduisent au GAMOS étant impliqués dans ce processus cellulaire. De même, une régulation adéquate des cytosquelettes d’actine et de microtubules est essentielle à la biologie des podocytes, des neurones et des cellules de Schwann. D’autres études sont nécessaires pour mieux caractériser les mécanismes cellulaires communs et, espérons-le, dans un avenir proche, pour identifier des cibles thérapeutiques pour ces maladies actuellement incurables. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Schell
C
,
Huber
TB
The Evolving Complexity of the Podocyte Cytoskeleton.
.
J Am Soc Nephrol JASN.
2017;
;
28
:
:3166.
–
3174
.
2.
Grahammer
F
,
Wigge
C
,
Schell
C
,
et al.
A flexible, multilayered protein scaffold maintains the slit in between glomerular podocytes.
.
JCI Insight.
2016
;
:1.
.
3.
Ahola
H
,
Heikkilä
E
,
Aström
E
et al.
A novel protein, densin, expressed by glomerular podocytes.
.
J Am Soc Nephrol.
2003;
;
14
:
:1731.
–
1737
.
4.
Beltran
PJ
,
Bixby
JL
,
Masters
BA
Expression of PTPRO during mouse development suggests involvement in axonogenesis and differentiation of NT-3 and NGF-dependent neurons.
.
J Comp Neurol.
2003;
;
456
:
:384.
–
395
.
5.
Mundel
P
,
Heid
HW
,
Mundel
TM
et al.
Synaptopodin: an actin-associated protein in telencephalic dendrites and renal podocytes.
.
J Cell Biol.
1997;
;
139
:
:193.
–
204
.
6.
Weide
T
,
Huber
TB
Signaling at the slit: podocytes chat by synaptic transmission.
.
J Am Soc Nephrol.
2009;
;
20
:
:1862.
–
1864
.
7.
Syntichaki
P
,
Tavernarakis
N
Genetic models of mechanotransduction: the nematode Caenorhabditis elegans.
.
Physiol Rev.
2004;
;
84
:
:1097.
–
1153
.
8.
Verma
R
,
Wharram
B
,
Kovari
I
et al.
Fyn binds to and phosphorylates the kidney slit diaphragm component Nephrin.
.
J Biol Chem.
2003;
;
278
:
:20716.
–
20723
.
9.
Li
M
,
Armelloni
S
,
Ikehata
M
et al.
Nephrin expression in adult rodent central nervous system and its interaction with glutamate receptors.
.
J Pathol.
2011;
;
225
:
:118.
–
128
.
10.
Giardino
L
,
Armelloni
S
,
Corbelli
A
et al.
Podocyte glutamatergic signaling contributes to the function of the glomerular filtration barrier.
.
J Am Soc Nephrol.
2009;
;
20
:
:1929.
–
1940
.
11.
Plaisier
E
,
Mougenot
B
,
Verpont
MC
et al.
Glomerular permeability is altered by loss of P0, a myelin protein expressed in glomerular epithelial cells.
.
J Am Soc Nephrol.
2005;
;
16
:
:3350.
–
3356
.
12.
Boerkoel
CF
,
Takashima
H
,
Stankiewicz
P
et al.
Periaxin mutations cause recessive Dejerine-Sottas neuropathy.
.
Am J Hum Genet.
2001;
;
68
:
:325.
–
333
.
13.
Colin
E
,
Huynh Cong
E
,
Mollet
G
et al.
Loss-of-function mutations in WDR73 are responsible for microcephaly and steroid-resistant nephrotic syndrome: Galloway-Mowat syndrome.
.
Am J Hum Genet.
2014;
;
95
:
:637.
–
648
.
14.
Ben-Omran
T
,
Fahiminiya
S
,
Sorfazlian
N
et al.
Nonsense mutation in the WDR73 gene is associated with Galloway-Mowat syndrome.
.
J Med Genet.
2015;
;
52
:
:381.
–
390
.
15.
Tilley
FC
,
Arrondel
C
,
Chhuon
C
,
et al.
Disruption of pathways regulated by Integrator complex in Galloway-Mowat syndrome due to WDR73 mutations.
.
Sci Rep.
2021;
;
11
:
:5388.
.
16.
Machnicka
MA
,
Olchowik
A
,
Grosjean
H
et al.
Distribution and frequencies of post-transcriptional modifications in tRNAs.
.
RNA Biol.
2014;
;
11
:
:1619.
–
1629
.
17.
Ramos
J
,
Fu
D
The emerging impact of tRNA modifications in the brain and nervous system.
.
Biochim Biophys Acta Gene Regul Mech.
2019;
;
1862
:
:412.
–
428
.
18.
El Yacoubi
B
,
Hatin
I
,
Deutsch
C
et al.
A role for the universal Kae1/Qri7/YgjD (COG0533) family in tRNA modification.
.
EMBO J.
2011;
;
30
:
:882.
–
893
.
19.
Perrochia
L
,
Guetta
D
,
Hecker
A
et al.
Functional assignment of KEOPS/EKC complex subunits in the biosynthesis of the universal t6A tRNA modification.
.
Nucleic Acids Res.
2013;
;
41
:
:9484.
–
9499
.
20.
Wan
LCK
,
Maisonneuve
P
,
Szilard
RK
et al.
Proteomic analysis of the human KEOPS complex identifies C14ORF142 as a core subunit homologous to yeast Gon7.
.
Nucleic Acids Res.
2017;
;
45
:
:805.
–
817
.
21.
Braun
DA
,
Rao
J
,
Mollet
G
et al.
Mutations in KEOPS-complex genes cause nephrotic syndrome with primary microcephaly.
.
Nat Genet.
2017;
;
49
:
:1529.
–
1538
.
22.
Braun
DA
,
Shril
S
,
Sinha
A
et al.
Mutations in WDR4 as a new cause of Galloway-Mowat syndrome.
.
Am J Med Genet A.
2018;
;
176
:
:2460.
–
2465
.
23.
Alexandrov
A
,
Martzen
MR
,
Phizicky
EM
Two proteins that form a complex are required for 7-methylguanosine modification of yeast tRNA.
.
RNA NYN.
2002;
;
8
:
:1253.
–
1266
.
24.
Hezwani
M
,
Fahrenkrog
B
The functional versatility of the nuclear pore complex proteins.
.
Semin Cell Dev Biol.
2017;
;
68
:
:2.
–
9
.
25.
Rosti
RO
,
Sotak
BN
,
Bielas
SL
et al.
Homozygous mutation in NUP107 leads to microcephaly with steroid-resistant nephrotic condition similar to Galloway-Mowat syndrome.
.
J Med Genet.
2017;
;
54
:
:399.
–
403
.
26.
Fujita
A
,
Tsukaguchi
H
,
Koshimizu
E
et al.
Homozygous splicing mutation in NUP133 causes Galloway-Mowat syndrome.
.
Ann Neurol.
2018;
;
84
:
:814.
–
828
.
27.
Libby
RT
,
Lavallee
CR
,
Balkema
GW
et al.
Disruption of laminin beta2 chain production causes alterations in morphology and function in the CNS.
.
J Neurosci.
1999;
;
19
:
:9399.
–
9411
.
28.
Matejas
V
,
Al-Gazali
L
,
Amirlak
I
et al.
A syndrome comprising childhood-onset glomerular kidney disease and ocular abnormalities with progressive loss of vision is caused by mutated LAMB2.
.
Nephrol Dial Transplant.
2006;
;
21
:
:3283.
–
3286
.
29.
Jh
S, G J
,
Rg
V
,
et al.
Forced expression of laminin beta1 in podocytes prevents nephrotic syndrome in mice lacking laminin beta2, a model for Pierson syndrome.
.
Proc Natl Acad Sci USA.
2011;
;
108
:
:15348.
–
15353
.
30.
Gee
HY
,
Saisawat
P
,
Ashraf
S
et al.
ARHGDIA mutations cause nephrotic syndrome via defective RHO GTPase signaling.
.
J Clin Invest.
2013;
;
123
:
:3243.
–
3t53
.
31.
Barreto
LCLS
,
Oliveira
FS
,
Nunes
PS
et al.
Epidemiologic Study of Charcot-Marie-Tooth Disease: A Systematic Review.
.
Neuroepidemiology.
2016;
;
46
:
:157.
–
165
.
32.
Pareyson
D
,
Marchesi
C
Diagnosis, natural history, and management of Charcot-Marie-Tooth disease.
.
Lancet Neurol.
2009;
;
8
:
:654.
–
667
.
33.
Szigeti
K
,
Lupski
JR
Charcot-Marie-Tooth disease.
.
Eur J Hum Genet.
2009;
;
17
:
:703.
–
710
.
34.
De Rechter
S
,
De Waele
L
,
Levtchenko
E
et al.
Charcot-Marie-Tooth: Are you testing for proteinuria?
.
Eur J Paediatr Neurol.
2015;
;
19
:
:1.
–
5
.
35.
Boyer
O
,
Nevo
F
,
Plaisier
E
et al.
INF2 Mutations in Charcot-Marie-Tooth Disease with Glomerulopathy.
.
N Engl J Med.
2011;
;
365
:
:2377.
–
2388
.
36.
Labat-de-Hoz
L
,
Alonso
MA
.
The formin INF2 in disease: progress from 10 years of research.
.
Cell Mol Life Sci.
2020;
;
77
:
:4581.
–
600
.
|