| |
| Med Sci (Paris). 39(3): 234–245. doi: 10.1051/medsci/2023028.Les grandes avancées en néphro-génétique pédiatrique Marguerite Hureaux,1,2,3 Laurence Heidet,3,4,5 Rosa Vargas-Poussou,1,3,5 and Guillaume Dorval1,3,6* 1Service de médecine génomique des maladies rares, AP-HP, université Paris Cité
,
France 2
Inserm U970,
Paris CardioVascular Research Center
, université Paris Cité, faculté de médecine
,
France 3Centre de référence des maladies rénales héréditaires de l’enfant et de l’adulte MARHEA, hôpital Necker-Enfants Malades
,
Paris
,
France 4Service de néphrologie pédiatrique, AP-HP, université Paris Cité
,
France 5CNRS, centre de recherche des Cordeliers, Inserm UMRS 1138, Sorbonne université, université Paris Cité
,
France 6Inserm U1163, Laboratoire des maladies rénales héréditaires, institut Imagine, université Paris Cité
,
France |
Vignette (© iStock).
Au cours des dernières décennies, la médecine a connu des progrès remarquables dans le domaine des maladies rénales héréditaires, en particulier grâce à l’identification de nombreux gènes impliqués dans ces maladies. Cela a permis de comprendre la physiopathologie de ces maladies et de développer de nouvelles approches thérapeutiques dans certains cas. Le diagnostic moléculaire des maladies rénales a ainsi pris une place importante dans la prise en charge des patients. En effet, l’amélioration des performances des tests génétiques, l’augmentation des connaissances dans la classification des variants, et la diminution des coûts du séquençage ont placé ces tests en première ligne dans la démarche diagnostique de nombreuses maladies rénales de l’enfant ou de l’adulte. De multiples études suggèrent ainsi qu’environ 10 % de la population adulte et 30 % des enfants issus de cohortes pédiatriques présentant une maladie rénale chronique ont une maladie monogénique identifiable [
1
,
2
]. Groopman
et al.
ont par ailleurs montré que le diagnostic génétique apportait un nouvel éclairage clinique dans près de 75 % des cas, en identifiant, reclassant ou précisant l’étiologie de la maladie, ou en permettant de préciser le pronostic, le traitement ou les décisions de transplantation [
1
].
Dans cette revue, nous proposons de reprendre les étapes clefs qui ont conduit à l’établissement des connaissances actuelles, et de présenter succinctement nos connaissances sur quelques atteintes héréditaires fréquentes observées en pédiatrie. Nous n’aborderons pas les maladies associées à des facteurs de susceptibilité dépendante du complément. |
Étapes clefs de l’histoire du diagnostic moléculaire Approche par clonage positionnel
Dans les premières années de la génétique rénale, le clonage positionnel (analyses de liaison, cartographie par recherche d’homozygotie) a permis d’analyser la co-transmission d’un trait morbide (par exemple, la protéinurie ou le syndrome néphrotique) avec des marqueurs microsatellites répartis sur l’ensemble du génome. Cette approche visait à identifier un locus dans lequel les gènes candidats étaient alors séquencés. Elle nécessitait la sélection de plusieurs familles informatives ou de grandes familles consanguines. Elle a permis l’identification de gènes impliqués dans les maladies héréditaires dont la physiopathologie était alors inconnue, comme le gène
NPHS2
codant la podocine, identifié en 2000, et dont les variants pathogènes sont impliqués dans le développement d’un syndrome néphrotique cortico-résistant [
3
]. La découverte de causes monogéniques responsables de certains syndromes néphrotiques cortico-résistants a permis de grands progrès dans la compréhension de ces maladies, et a considérablement influencé les décisions thérapeutiques pour les familles affectées, épargnant aux patients des traitements immunosuppresseurs inutiles [
4
]. Cette approche a également conduit à l’identification du gène
CTNS
, codant la cystinosine, responsable de cystinose [
5
,
6
].
Approche par gène-candidat
L’approche par gène-candidat est fondée sur la connaissance des fonctions des protéines et de leurs interactions, ou sur l’observation dans un modèle animal d’un phénotype, laissant supposer l’implication d’un gène particulier en pathologie humaine. Elle vise donc à identifier des variants pathogènes de ces gènes. Cette approche a été utilisée, seule ou en association avec les analyses de liaison génétique, pour identifier un gène candidat à un locus identifié. Ce type d’études a permis d’identifier de nombreux gènes responsables de maladies génétiques rares, en particulier plusieurs gènes dont les variants pathogènes sont responsables d’anomalies du développement rénal. Ainsi, en 1995, Sanyanusin
et al.
ont identifié pour la première fois un variant pathogène dans le gène
PAX2
(
paired box 2
), dans une famille chez laquelle le diagnostic de syndrome rein colobome se révélait très proche du phénotype présenté dans un modèle murin préalablement rapporté et impliquant le paralogue de
PAX2
(modèle Krd pour
kidney and retinal defects
) [
7
]. En 2006, l’étude ESCAPE (
Evaluation Study of Congestive. Heart Failure and Pulmonary Catheterization Effectiveness
) a fourni une analyse complète des gènes du développement rénal chez les enfants présentant une hypodysplasie rénale non syndromique, montrant une prévalence élevée de variants pathogènes des gènes
PAX2
et
TCF2,
codant le facteur de transcription HNF1-B [
8
]. Cette approche a conduit également à l’identification de variants pathogènes des gènes du système rénine-angiotensine (SRA) dans des formes sévères de dysgénésie rénale [
9
]. La connaissance de mécanismes de réabsorption de NaCl dans le tubule rénal a également permis d’identifier les gènes responsables des tubulopathies avec perte de sel, telles que le syndrome de Bartter et le syndrome de Gitelman.
L’avènement du séquençage de nouvelle génération
L’avènement des techniques de séquençage de nouvelle génération (NGS) (également connues sous le nom de séquençage massif en parallèle) utilisées pour les tests génétiques de routine et dans les laboratoires de recherche a considérablement amélioré le rendement diagnostique. Les techniques NGS peuvent traiter des millions de réactions de séquençage en parallèle. Elles permettent théoriquement la détection de tous les types de variants génétiques, depuis les variants mononucléotidiques jusqu’aux grands variants structurels (comme les variations du nombre de copies ou CNV). Cette approche peut être adaptée à différents types d’applications, telles que le séquençage du génome (WGS), le séquençage de l’exome (WES), le séquençage de panels de gènes, le séquençage de l’ARN, les études de méthylation, le séquençage de longs fragments d’ADN (
long-reads
), etc. L’analyse du très grand nombre de variants identifiés chez chaque individu (plusieurs millions pour un séquençage de génome), par rapport à la séquence de référence, nécessite des étapes de filtration et d’annotation, grâce à des outils bio-informatiques et à l’existence de bases de données publiques contenant des informations de séquençage de nombreux individus contrôles, d’origines ethniques différentes.
Les preuves d’un lien de causalité entre un variant identifié et le phénotype présenté par un patient sont parfois difficiles à apporter, en particulier dans les maladies extrêmement rares. L’interprétation des variants génomiques identifiés est donc délicate et peut conduire à une surinterprétation, voire à un faux diagnostic. Afin d’améliorer la précision du diagnostic génétique, des recommandations pour l’interprétation des variants ont été élaborées par l
’American College of Medical Genetics
(ACMG) [
10
]. Ces recommandations sont fondées sur plusieurs paramètres, tels que les données de la littérature, les études fonctionnelles, les bases de données, les scores de prédiction
in silico
, et les études de ségrégation intrafamiliale. Ces recommandations permettent de classer les variants selon cinq niveaux : pathogènes, probablement pathogènes, de signification incertaine, probablement bénins, et bénins. Les variants de signification inconnue sont ceux qui posent le plus de difficultés et ne doivent pas être utilisés en conseil génétique. Pour les reclasser, il est parfois possible de réaliser des explorations complémentaires qui ne peuvent pas toujours être entreprises dans le cadre du diagnostic (mais qui, parfois, peuvent être intégrées dans des programmes de recherche).
L’analyse des données post-séquençage est devenue l’étape clé du NGS. Ainsi, alors que le coût du séquençage diminue rapidement, la quantité de données générées augmente, ce qui fait que l’analyse et le stockage des données représentent les fractions les plus importantes du coût réel du séquençage.
Au-delà de l’identification de variations ponctuelles, le NGS peut également permettre l’identification de variants de structure, quel que soit le remaniement en cas d’analyse de génome entier, et limité à l’étude des variations du nombre de copies en cas de NGS ciblé (panel ou exome). Cela est d’une importance fondamentale, puisque les variations du nombre de copies représentent une cause fréquente de néphropathies héréditaires, comme, par exemple, de néphronophtise, en rapport avec une délétion récurrente du gène
NPHP1
(néphrocystine 1), de cystinose, en rapport avec la délétion partielle du gène
CTNS,
ou encore des anomalies congénitales des reins et des voies urinaires (CAKUT).
|
Principales maladies rénales héréditaires Les ciliopathies
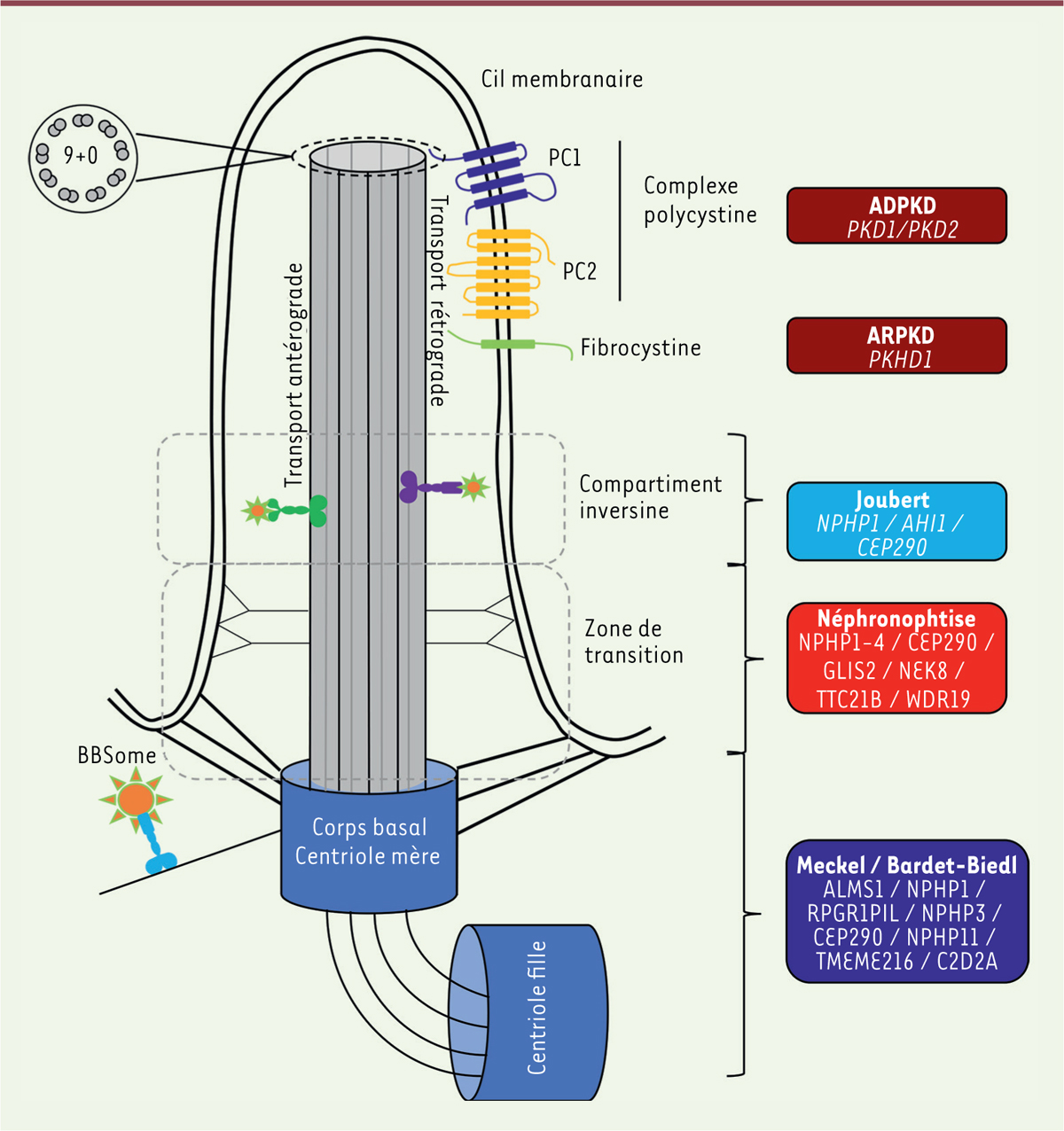
Le terme « ciliopathies » englobe un ensemble de maladies pouvant toucher différents organes et ayant pour origine une altération de la fonction ou de la structure du cil primaire [
11
,
12
]. Le cil primaire est un organite faisant saillie de la membrane plasmique vers l’environnement extra-cellulaire et organisé autour d’un cytosquelette de microtubules. Les organes les plus régulièrement touchés sont les reins, les yeux, les oreilles, le foie, les poumons, le cœur et le cerveau. Les maladies associées aux ciliopathies rénales comprennent la polykystose, la néphronophtise (NPHP), certaines anomalies congénitales des reins et des voies urinaires (CAKUT) [
11
] et certaines ciliopathies syndromiques, telles que le syndrome de Joubert et les maladies connexes, le syndrome de Bardet-Biedl et le syndrome de Meckel-Gruber [
13
]. L’architecture du cil et les principaux gènes incriminés dans les différents phénotypes sont représentés dans la
Figure 1
.
 | Figure 1.
Représentation schématique du cil primaire et principales ciliopathies héréditaires
. Le cil primaire est organisé autour de l’axonème central composé de neuf doublets de microtubules externes sans doublet central, ce qui le différencie du cil moteur. Les protéines ciliaires, les récepteurs et les protéines de signalisation migrent selon des directions antérograde et rétrograde sur l’axonème grâce aux complexes de transport intraflagellaire (IFT) (en vert et violet). Le complexe BBSome participe au trafic à la base du cil et coopère ensuite avec les IFT. Le cil se développe à partir du centriole mère. La base du cil est séparée du cytoplasme par la zone de transition définie par la présence de liaisons Y. Le cil primaire est érigé à partir de la zone de transition. Les variations pathogènes survenant dans certains gènes codant des protéines ciliaires peuvent conduire à des phénotypes hétérogènes regroupés sous le nom de ciliopathies. Les principaux gènes mutés, la localisation des protéines codées par ces gènes et leur implication dans les principaux phénotypes sont représentés.
|
La polykystose rénale autosomique récessive
est causée par des mutations bialléliques du gène
PKHD1,
codant la fibrocystine [
14
]. Elle peut être dépistée sur l’image de l’échographie anténatale par la mise en évidence de gros reins hyperéchogènes, et dans les cas extrêmes, par une séquence de Potter (hypoplasie pulmonaire, faciès caractéristique et déformations des membres) due à un oligo-anamnios
1
[
15
]. Le diagnostic peut également être réalisé plus tard dans l’enfance. Le développement de registres internationaux a permis de mettre en évidence une corrélation entre génotype et phénotype [
16
,
17
].
La polykystose autosomique dominante
est l’une des maladies génétiques les plus fréquentes, mais elle est rarement symptomatique à l’âge pédiatrique. Elle est principalement secondaire à des mutations hétérozygotes des gènes
PKD1 ou PKD2
, codant respectivement les protéines polycystine-1 et polycystine-2
(
Figure 1
)
, qui interviennent dans la signalisation dépendante du calcium dans le cil primaire [
18
]. Plus des deux tiers des patients présentent un variant du gène
PKD1
. Les gènes récemment décrits, tels que
GANAB (glucosidase II alpha subunit)
et
DNAJB11 (dnaj heat-shock protein family (Hsp40) member B11),
ne sont, quant à eux, jamais associés à un phénotype pédiatrique [
19
-
21
]. La maladie évolue vers l’insuffisance rénale, avec une corrélation entre génotype et phénotype. Il existe une variabilité intrafamiliale [
22
], suggérant que d’autres facteurs génétiques et/ou environnementaux pourraient modifier le cours de cette maladie [
23
].
L’appellation
néphronophtise
représente un groupe hétérogène de maladies kystiques des reins. De transmission autosomique récessive, elle est l’une des premières causes génétiques d’insuffisance rénale terminale à l’âge pédiatrique [
12
]. Elle est caractérisée par une diminution de la capacité des reins à concentrer les urines. Sur le plan morphologique, elle se manifeste par une fibrose tubulo-interstitielle, une dilatation et une atrophie tubulaire, et la formation de kystes cortico-médullaires. Il existe trois types de néphronophtise : les formes infantile, juvénile et de l’adolescent, selon l’âge d’apparition de l’insuffisance rénale terminale. La forme juvénile est la plus courante [
24
]. Près de 10 à 20 % des patients présentant une néphronophtise ont des manifestations extrarénales, telles qu’une maladie rétinienne, une maladie neurologique, une fibrose hépatique et une dysplasie squelettique. La néphronophtise est également fréquemment associée à plusieurs ciliopathies syndromiques (syndromes de Joubert et maladies connexes, de Bardet-Biedl et de Meckel-Gruber) [
25
].
Les anomalies congénitales des reins et des voies urinaires
Les anomalies congénitales des reins et des voies urinaires (ou CAKUT pour
congenital anomalies of the kidney and the urinary tract
) sont des maladies causées par des anomalies du développement embryonnaire et fœtal. Elles surviennent dans trois à six naissances vivantes sur 1 000, représentent environ 20 % des anomalies détectées avant la naissance [
26
], et constituent la principale cause de maladie rénale chronique chez l’enfant [
27
].
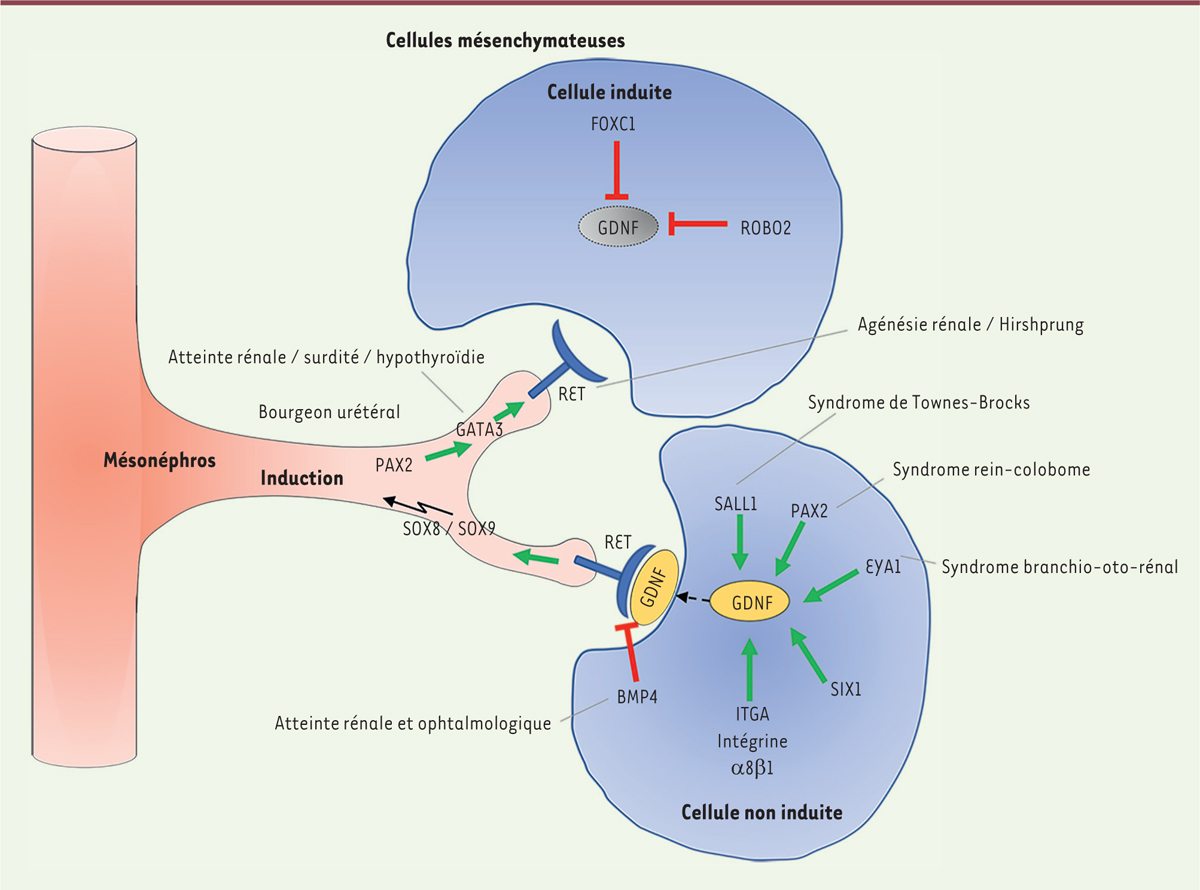
Les malformations, telles que le syndrome de la jonction pyélo-urétéral, l’agénésie rénale, la dysplasie rénale multikystique, l’hypo-dysplasie rénale, le reflux vésico-urétéral et les systèmes doubles, entrent dans le spectre des CAKUT [
28
]. Les CAKUT peuvent être sporadiques ou familiales, isolées ou syndromiques. Des variations pathogènes dans plus de cinquante gènes ont été rapportées, avec un mode de transmission autosomique dominant ou, plus rarement, autosomique récessif. Les CAKUT syndromiques sont généralement associées à des anomalies de certains facteurs de transcription qui régulent les étapes critiques du développement rénal précoce, comme, par exemple, les divisions dichotomiques du bourgeon urétéral vers le mésenchyme métanéphrique et l’induction/condensation du mésenchyme. Les principaux phénotypes associés à un défaut de cette étape clé du développement rénal sont représentés dans la
Figure 2
. C’est le cas, par exemple, du syndrome rein-colobome, secondaire à des variants pathogènes du gène
PAX2
[
29
], un facteur de transcription régulant directement l’action du facteur neurotrophique dérivé de la lignée cellulaire gliale (GDNF pour
glial-derived neurotrophic factor
)
(
Figure 2
)
. Il s’agit d’une CAKUT syndromique de transmission autosomique dominante, caractérisée par une dysplasie du nerf optique et des anomalies rénales congénitales se présentant comme une hypo-dysplasie rénale généralement peu sévère, parfois accompagnée d’une hypoacousie [
30
]. Histologiquement, les reins présentent peu de glomérules de grande taille, un phénotype appelé oligoméganéphronie. Le syndrome branchio-oto-rénal (BOR) est également une maladie autosomique dominante secondaire à des variants pathogènes des gènes
EYA1
(
eyes absent transcriptional coactivator and phosphatase 1
)
, SIX1
ou
SIX5
(
sine oculis-related homeobox
)
(
Figure 2
)
[
31
]. Il est caractérisé par l’association d’anomalies rénales, branchiales et oto-rhino-laryngologiques [
32
], avec une variabilité d’expression qui, au niveau rénal, peut aller d’une absence complète d’anomalie à une agénésie (absence) rénale bilatérale incompatible avec la vie [
33
].
 | Figure 2.
Développement du bourgeon urétéral et rôle des facteurs impliqués dans son induction et son développement
. Au cours du développement embryonnaire, le GDNF est exprimé dans le mésenchyme métanéphrique. Le récepteur tyrosine kinase RET est exprimé dans le mésonéphros. Lors de la liaison du GDNF au récepteur RET (et à un corécepteur non représenté ici), la formation du bourgeon urétéral est induite. Des facteurs de transcription comme PAX2 (
paired box gene 2
), GATA3 (
transacting T-cell-specific transcription factor GATA3
), EYA1 (
eyes absent homolog 1
), SIX1 (
sine oculis-related homeoBox 1 homolog protein SIX1
), SALL1 (
Sal-like 1
) et HOX11 (
homeoBox 11
) agissent comme régulateurs positifs du GDNF. L’activité du GDNF est réprimée par des facteurs de transcription comme FOXC1/FOXC2 (
forkhead box C1/C2
) et le SLIT2-ROBO2 (
slit homolog 2-roundabout homolog 2
). La régulation négative du GDNF est importante pour assurer un bourgeon urétéral unique. Des mutations impliquant des régulateurs négatifs conduisent à la formation de bourgeons urétraux multiples dans des modèles de souris. Le facteur de croissance TGFB1 et la protéine morphogénique osseuse 4 (
BMP4
) sont des inhibiteurs endogènes de la voie de signalisation GDNF/RET et limitent la croissance du bourgeon urétéral à un seul emplacement. Le facteur de transcription WT1 induit également la formation du bourgeon urétéral de manière indépendante. En parallèle, la condensation du mésenchyme induit la formation de la vésicule rénale qui donnera naissance au corps en S puis au néphron fonctionnel.
|
Les CNV peuvent être associés à des CAKUT isolées ou syndromiques. En effet, une étude publiée en 2012 a montré qu’un CNV était identifié dans 16 % des cas d’hypodysplasie rénale et pourrait être impliqué dans le phénotype [
34
]. Plus récemment, dans une série comparant 2 824 patients présentant une CAKUT à 21 498 sujets témoins, un enrichissement significatif de CNV intéressant des régions codantes chez les patients présentant une CAKUT a été identifié. L’analyse du risque attribuable au CNV des régions codantes a été évaluée à 4,1 % dans cette série (OR 1,64 ; IC à 95 % 1,44-1,87 ; P = 3,23 × 10
-13
) [
35
]. Une origine monogénique est identifiée dans 15 à 20 % des cas, suggérant une hérédité complexe dans la majorité des cas.
|
Anomalie de la fonction des reins Chaque rein possède entre 400 et 1 000 000 de néphrons, les unités fonctionnelles permettant d’assurer deux fonctions principales : 1) la filtration du sang au niveau des glomérules (un litre de sang filtré chaque minute permettant la constitution de 180 litres d’urines primitives par jour), et 2) l’homéostasie, grâce à une fonction de transport complexe, réalisée par des protéines spécialisées réparties le long des tubules rénaux, permettant la réabsorption de 99 % de l’urine primitive. Les variants pathogènes des gènes codant certaines protéines des cellules épithéliales pariétales glomérulaires (les podocytes) ou des cellules tubulaires peuvent conduire à une dysfonction cellulaire spécifique à l’origine d’un phénotype particulier. Cette dysfonction peut, par la suite, être à l’origine d’un déclin de la fonction rénale. Ces anomalies sont regroupées sous les termes respectifs de podocytopathies et tubulopathies héréditaires. Les podocytopathies héréditaires
Les podocytopathies héréditaires représentent un
continuum
phénotypique ayant en commun, sur le plan clinique, une protéinurie glomérulaire souvent massive, parfois caractérisée par un syndrome néphrotique cortico-résistant (SNCR) – soit une protéinurie supérieure à 200 mg/mmol de créatinine et une hypoalbuminémie inférieure à 30 g/L –, et, sur le plan morphologique, une perte de l’architecture des podocytes en microscopie électronique. Les podocytes sont des cellules épithéliales glomérulaires hautement spécialisées dont la forme rappelle celle des neurones avec un corps, des projections primaires maintenues par un cytosquelette de microtubules, et des projections secondaires, appelées pédicelles, maintenues par un réseau d’actine et interagissant entres elles au niveau de jonctions serrées très spécifiques, le diaphragme de fente. Elles sont indispensables au maintien de la structure et de la fonction du filtre glomérulaire. Après différenciation terminale, ces cellules ont perdu leur capacité de se diviser.
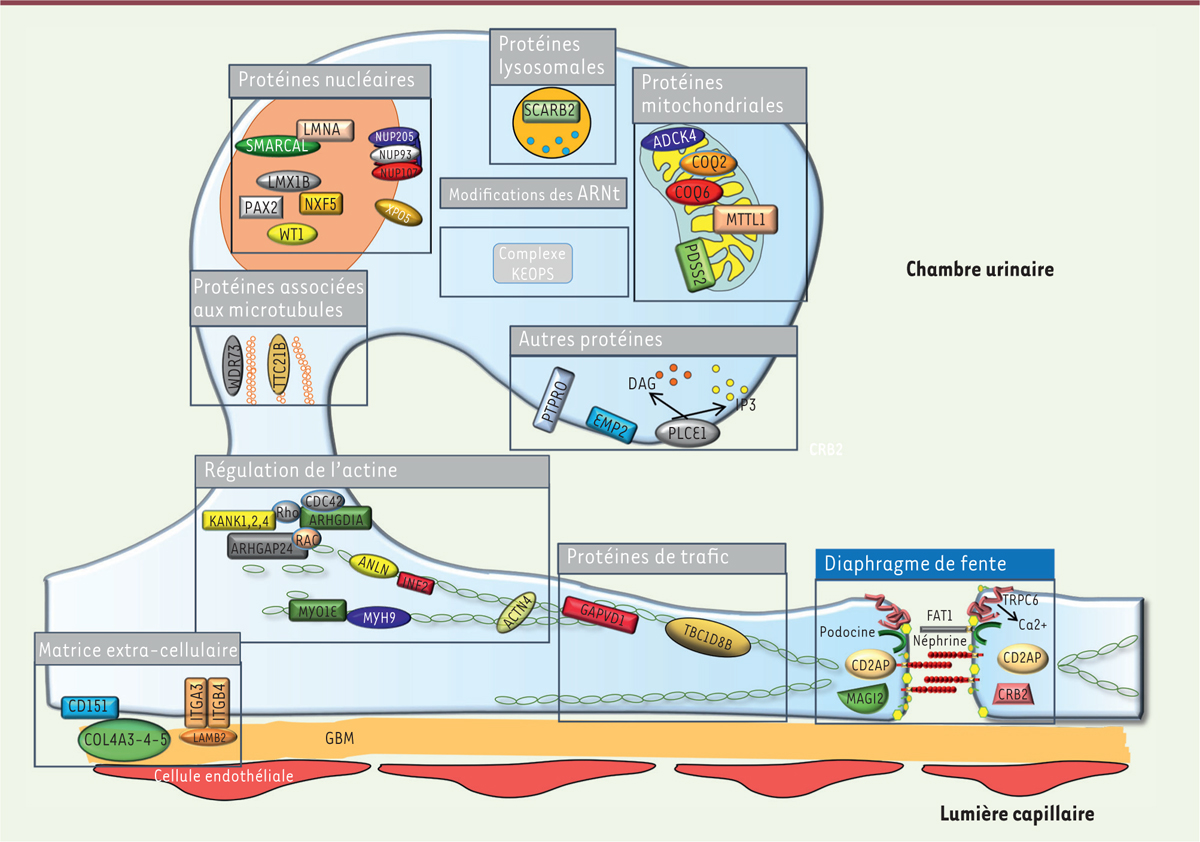
La mise en évidence au début des années 2000 de variants pathogènes de gènes codant des protéines exprimées par les podocytes, plus particulièrement au niveau du diaphragme de fente, a constitué un réel tournant dans la compréhension du fonctionnement et de l’architecture du filtre glomérulaire [
3
]. Une soixantaine de gènes codant des protéines impliquées dans différentes fonctions du podocyte ont ainsi été identifiés comme responsables de podocytopathie héréditaires, lorsqu’ils sont des variants pathogènes
(
Figure 3
)
. Chez l’enfant, les chances d’identifier une cause moléculaire sont inversement proportionnelles à l’âge de survenue du SNCR, allant de 80 % en cas de syndrome néphrotique congénital, principalement lié aux variants pathogènes des gènes
NPHS1
,
NPHS2
,
LAMB2
(
laminin subunit beta 2
),
PLCE1
(
phospholipase C epsilon 1
) et
WT1
(
Wilms’ tumor 1
), à 10 % en cas de SNCR familial survenu entre 13 et 18 ans [
36
,
37
]. Les formes les plus fréquentes chez l’enfant sont les formes autosomiques récessives, le plus souvent isolées et liées aux variants des gènes
NPHS1
et
NPHS2
codant la néphrine et la podocine, deux protéines spécifiques du podocyte et exprimées au niveau du diaphragme de fente
(
Figure 3
)
. Il existe quelques formes syndromiques, impliquant principalement le système génito-urinaire (mutation du gène
WT1
et syndromes de Denys Drash et de Frasier), et le système nerveux central (syndrome de Galloway-Moat).
 | Figure 3.
Représentation schématique du podocyte et des principales protéines dont les mutations sont impliquées dans la survenue d’un SNCR
. Le podocyte est une cellule épithéliale glomérulaire apposée sur la membrane basale glomérulaire (GBM). Les cellules interagissent entre elles au niveau du diaphragme de fente, plateforme de signalisation permettant le maintien de l’architecture et la transmission de signaux à l’intérieur de la cellule. Toutes les localisations cellulaires ont été impliquées dans la survenue du SNCR, la plus importante étant celui du diaphragme de fente.
|
Chez les patients présentant des podocytopathies héréditaires, le diagnostic moléculaire est très important puisqu’il guide la prise en charge clinique et renseigne sur le pronostic. Outre l’arrêt d’une immunosuppression inefficace et potentiellement toxique chez ces patients, il peut conduire à la mise en place de traitements spécifiques : par exemple, la mise en évidence de variants bialléliques de certains gènes impliqués dans le métabolisme du coenzyme Q10 permet un traitement de supplémentation spécifique en coenzyme Q10 [
38
].
Les tubulopathies
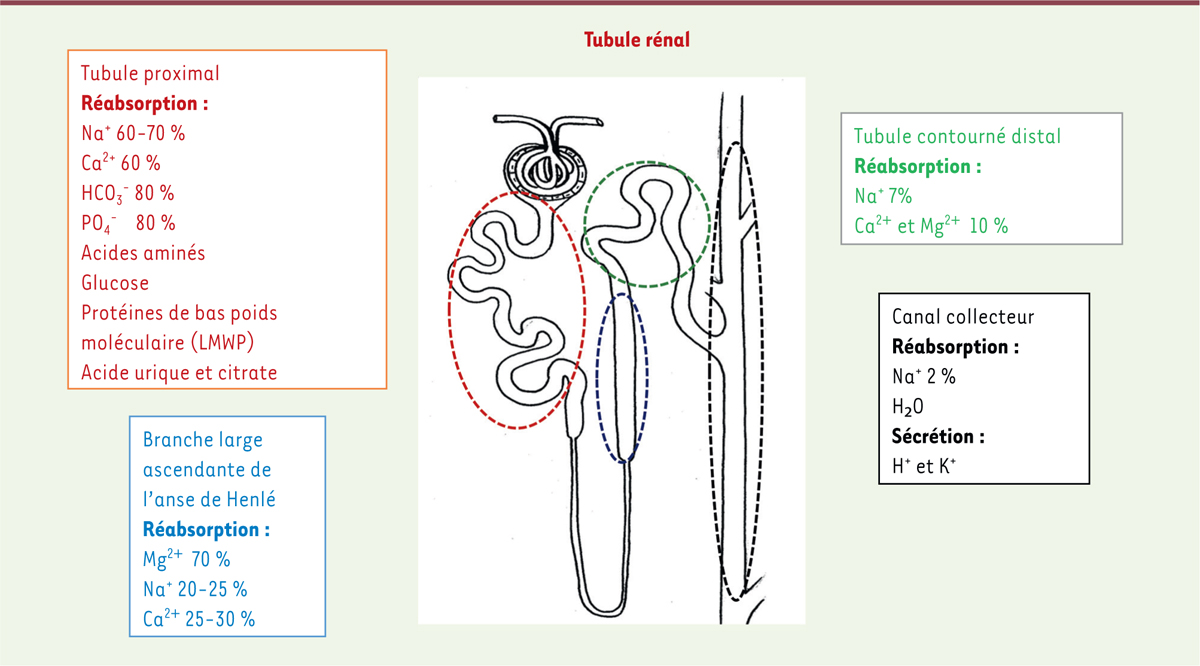
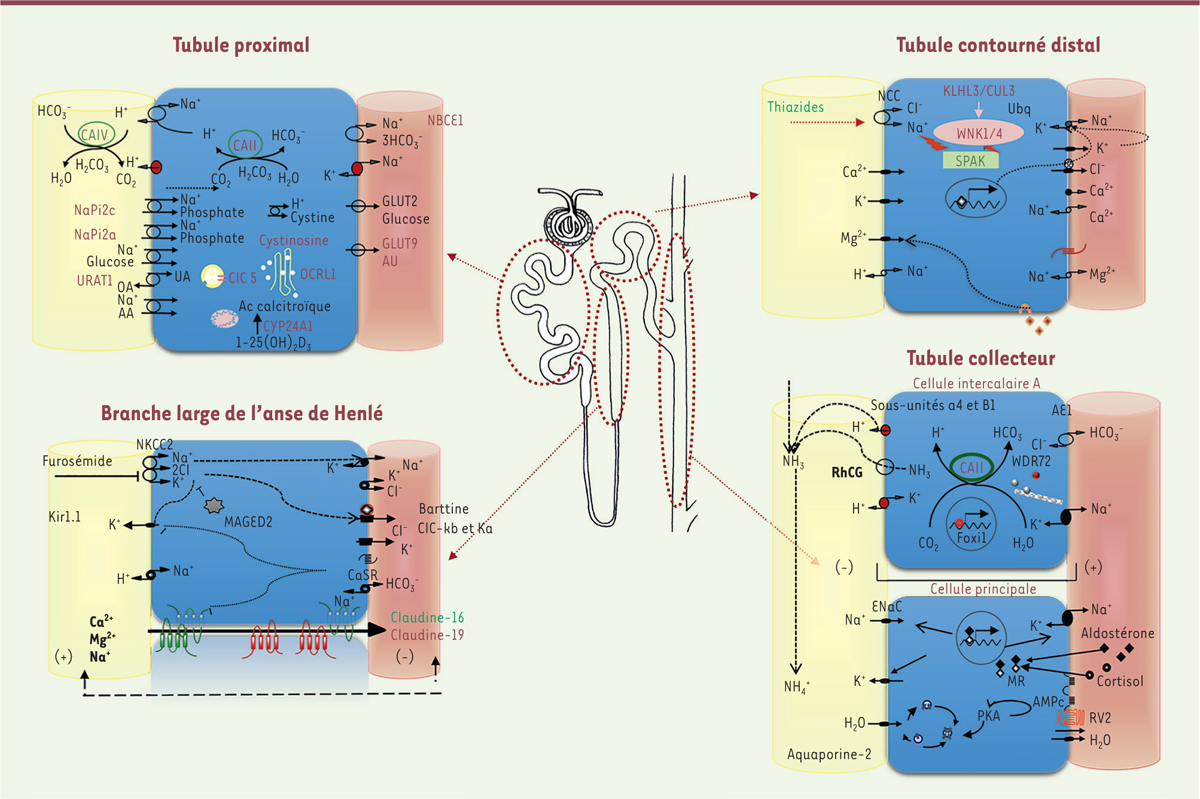
L’identification de nombreux gènes impliqués dans la survenue d’une dysfonction tubulaire rénale a permis de grandes avancées dans la compréhension de la physiologie rénale. Les tubulopathies héréditaires sont un groupe hétérogène de maladies affectant la réabsorption des solutés dans les différents segments du tubule rénal. Elles sont liées à des variations pathogènes dans des gènes codant soit les transporteurs spécifiques de solutés, soit leurs protéines régulatrices. Elles peuvent être classées selon le soluté impliqué : syndromes de perte rénale de sel, hypomagnésémies d’origine rénale, défauts de réabsorption de calcium et/ou de phosphore, glycosurie rénale, hypo- ou hyperuricémies rénales, ou défauts de réabsorption d’eau, etc. Elles peuvent également être classées selon le segment où la protéine impliquée joue un rôle prépondérant : tubulopathies proximales, de l’anse d’Henlé, du tube contourné distal, du tubule collecteur, ou tubulopathies mixtes. La
Figure 4
montre les différents segments du néphron et les solutés qui sont réabsorbés ou sécrétés dans chaque segment. À ce jour, des variants pathogènes de gènes codant environ 80 protéines ont été impliqués dans la survenue d’une tubulopathie. Dans la
Figure 5
sont représentés les différents systèmes de transport dans les cellules de chaque segment. À titre d’exemple, les protéines dont les anomalies sont responsables des cinq tubulopathies les plus fréquentes chez l’enfant sont indiquées. Ces tubulopathies et leurs principales caractéristiques sont détaillées dans le
Tableau I
.
Tableau I.
| Maladie |
Mécanisme et segment du néphron |
OMIM |
Mode de transmission |
Gène/Locus |
Protéine |
Principales caractéristiques cliniques |
Principales caractéristiques paracliniques |
| Bartter type 1 |
Défaut de réabsorption de NaCl dans la branche large ascendante de l’anse d’Henlé |
601678 |
AR |
SLC12A1/ 15.21.1
|
Cotransporteur NKCC2 |
Hydramnios, prématurité, retard de croissance, polyurie, déshydratation. |
Alcalose hypokaliémique, hypochlorémie, hyperaldostéronisme secondaire, hypercalciurie/néphrocalcinose |
| Bartter type 2 |
241200 |
KCNJ1/ 11q24.3
|
Canal potassique Kir1.1 |
Hydramnios, prématurité, retard de croissance, polyurie, déshydratation |
Hyperkalémié néonatale transitoire suivie d’alcalose hypokaliémique, hypochlorémie, hyperaldostéronisme secondaire, hypercalciurie/néphrocalcinose |
| Bartter type 3 |
607364 |
CLCNKB/ 1p.36.13
|
Canal chlore ClC-Kb |
Présentation variable (anténatale avec hydramnios modérée/néonatale ou chez l’enfant), retard de croissance, polyurie, déshydratation. |
Alcalose hypokaliémique, hypochlorémie sévère, hyperaldostéronisme secondaire, excrétion urinaire de calcium variable |
| Bartter type 4a |
602522 |
BSND/ 1p32.3
|
Sous-unité des canaux chlore: Barttine |
Hydramnios, prématurité, retard de croissance, polyurie, déshydratation, surdité |
Alcalose hypokaliémique, hypochlorémie, hyperaldostéronisme secondaire, excrétion urinaire de calcium variable |
| Bartter type 4b |
613090 |
CLCNKA-
CLCNKB/ 1p.36.13
|
Canaux chlore ClC-Ka/ ClC-Kb |
| Bartter type 5 |
300971 |
Lié à l’X |
MAGED2/ Xp11.21
|
MAGED2 (protéine chaperonne) |
Hydramnios (parfois plus sévère que les autres types), prématurité, macrosomie. Polyurie et fuite sodée transitoires (amélioration pendant la première année de vie) |
Alcalose hypokaliémique et hyperaldostéronisme secondaire, transitoires |
|
| Syndrome de Gitelman |
Défaut de réabsorption de NaCl dans le tube contourné distal |
263800 |
AR |
SLC12A3/ 16q13
|
Cotransporteur NCC |
Souvent asymptomatique; découverte fortuite (enfant, adolescent, adulte), fatigabilité, crampes, crises de tétanie, appétence pour le sel |
Alcalose hypokaliémique, hypochlorémie, hyperaldostéronisme secondaire, hypomagnésémie, hypocalciurie |
|
| Acidose tubulaire distale (Type 1) |
Défaut de sécrétion des ions H
+
dans les cellules intercalaires A du tubule collecteur
|
267300 |
AR |
ATP6V1B1/
2913.3
|
Sous-unité B1 de la pompe à protons |
Retard de croissance, déshydratation, vomissements, surdité fréquente et précoce |
Acidose hyperchlorémique, hypokaliémie, pH urinaire alcalin (inadapté à l’acidose), hypercalciurie, néphrocalcinose |
| 602722 |
ATP6V0A4/
7q34
|
Sous-unité a4 de la pompe à protons |
Retard de croissance, déshydratation, vomissements, surdité moins fréquente avec âge variable |
| NA |
AR |
FOXI1/ 5q35.1
|
Facteur de transcription Foxi1 |
Retard de croissance, déshydratation, vomissements, surdité constante |
Acidose hyperchlorémique, hypokaliémie, pH urinaire alcalin (inadapté à l’acidose), hypercalciurie, néphrocalcinose. Dilatation de l’aqueduc vestibulaire |
| NA |
WDR72/ 15q21.3
|
WDR72 (protéine jouant un rôle dans le trafic intracellulaire) |
Retard de croissance, déshydratation, vomissements, amélogenèse imparfaite constante |
Acidose hyperchlorémique, hypokaliémie, pH urinaire alcalin (inadapté à l’acidose), hypercalciurie, néphrocalcinose. |
| 19800 611590 |
AD AR |
SLC4A1/ 17q21.31
|
Échangeur chlore/ bicarbonate AE1 |
AD : crises de coliques néphrétiques AR : retard de croissance, déshydratation, vomissements, anémie |
AD: acidose hyperchlorémique et hypokaliémie modérées, pH urinaire alcalin (inadapté à l’acidose), hypercalciurie, néphrolithiase, néphrocalcinose, ostéoporose AR: acidose hyperchlorémique, hypokaliémie, pH urinaire alcalin (inadapté à l’acidose), hypercalciurie, néphrocalcinose. Anémie hemolytique |
|
| Diabète insipide néphrogénique |
Défaut de réabsorption d’eau dans les cellules principales du tubule collecteur |
304800 |
Lié à l’X |
AVPR2/
Xq28
|
Récepteur V2 de la vasopressine |
Fièvres inexpliquées, déshydratation, retard de croissance, polyurie-polydipsie au cours des premiers mois de vie |
Hypernatrémie, hyperosmolalité plasmatique, osmolalité urinaire basse inapproprié. |
| 125800 |
AR et AD |
AQP2/ 12q13.12
|
Canal aqueux Aquaporine-2 |
Fièvres inexpliquées, déshydratation, retard de croissance, polyurie-polydipsie au cours des premiers mois de vie pour l’AR; plus tardivement pour l’AD |
Hypernatrémie, hyperosmolalité plasmatique, osmolalité urinaire basse inappropriée. |
|
| Pseudohypo-aldostéronisme de type 1 |
Défaut de réabsorption de Na dans les cellules principales du tubule collecteur |
177735 |
AD |
NR3C2/
4q31.23
|
MR: récepteur minéralo- corticoïde |
Retard de croissance, vomissements, déshydratation, polyurie. |
Hyponatrémie, hyperkaliémie, acidose métabolique, aldostérone et rénine très élevées. Excrétion urinaire de sodium élevée et potassium basse. Amélioration avec l’âge. |
| 264350 620125 620126 |
AR |
SCNN1A
SCNN1B/
12p13.31
SCNN1G/
16p12.2
|
Sous-unités du canal sodium ENaC |
Retard de croissance, vomissements, déshydratation, polyurie. Manifestations respiratoires (infections pulmonaires récurrentes). Dermite sudorale |
Hyponatrémie, hyperkaliémie, acidose métabolique, aldostérone et rénine très élevées. Symptomatologie persistante |
Tubulopathies héréditaires fréquemment diagnostiquées chez l’enfant.
OMIM: Online Mendelian Inheritance in Man (https://www.omim.org); AR: autosomique récessive; AD : autosomique dominante.
|
 | Figure 4. Représentation schématique d’un néphron avec les principaux segments du tubule rénal et les solutés réabsorbés ou sécrétés dans chaque segment. |
 | Figure 5.
Représentation schématique des cellules de chaque segment du néphron et des systèmes de transport
. Les protéines impliquées dans les tubulopathies plus fréquentes chez l’enfant sont soulignées. Les gènes et noms de ces maladies sont détaillés dans le
Tableau I
.
|
Après élimination d’une origine acquise de l’atteinte tubulaire (par exemple, une origine iatrogène ou toxique), l’identification des bases génétiques et la confirmation moléculaire d’une tubulopathie héréditaire sont cruciales pour permettre un suivi adapté et un conseil génétique précis pour le patient et sa famille. Les tubulopathies héréditaires peuvent être de transmission autosomique, dominante ou récessive, ou liées au chromosome X. Leur diagnostic est le plus souvent fait dans l’enfance, l’âge de découverte variant selon les tubulopathies et leur mode de transmission. Le diagnostic peut être anténatal (pour le syndrome de Bartter anténatal), pendant les premiers mois de vie (pour les acidoses tubulaires distales, le diabète insipide néphrogènique et le pseudohypoaldostéronisme de type 1), ou dans l’enfance-adolescence et à l’âge adulte (pour le syndrome de Gitelman). Bien que les signes cliniques soient spécifiques selon le transporteur du soluté en cause et la portion du tubule affectée, plusieurs tubulopathies peuvent avoir des phénotypes proches, telles que le syndrome de Bartter et de Gitelman ou les tubulopathies affectant le métabolisme phoshocalcique comme l’hypercalcémie infantile ou l’hypophosphatémie avec néphrolithiase et ostéoporose. Ce « chevauchement » phénotypique a impulsé le développement par les laboratoires de référence, du séquençage à haut débit (NGS) sur panel de gènes spécifiques des tubulopathies [
39
,
40
]. Si, pour certaines indications, la baisse du coût et l’accès facilité à l’exome et au génome ont permis d’élargir les outils de diagnostic, pour les tubulopathies héréditaires, l’approche privilégiée reste le panel de gènes spécifiques, permettant une couverture élevée des gènes d’intérêt à un moindre coût, avec un rendement diagnostic supérieur à 60 % chez l’enfant [
39
]. La
Figure 6
présente le rendement de ce type de panel dans une étude collaborative européenne et les principales tubulopathies diagnostiquées chez l’enfant, par ordre de fréquence [
39
].
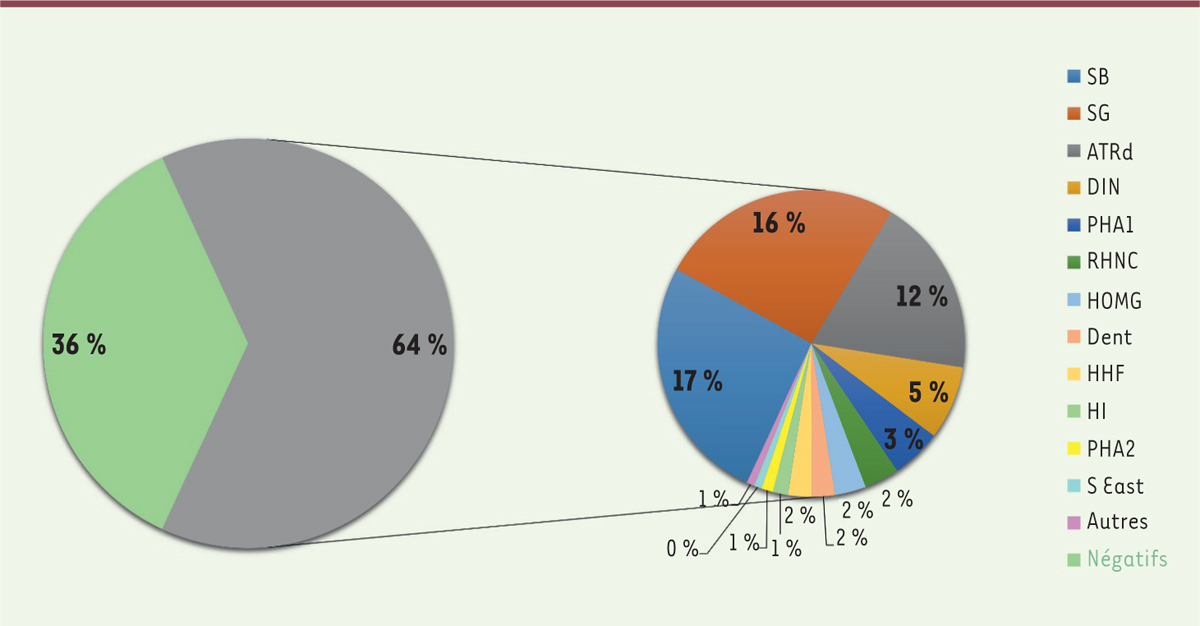
 | Figure 6.
Rendement du panel de gènes pour le diagnostic de tubulopathies et principales maladies diagnostiquées chez l’enfant (adapté de [
39
], données obtenues à partir de 384 enfants du Royaume-Uni, de Belgique et de France). SB : syndrome de Bartter ; SG : syndrome de Gitelman ; ATRd : acidose tubulaire rénale distale ; DIN : diabète insipide néphrogénique ; PHA1 : pseudohypoaldostéronisme de type 1 ; RHNC : rachitisme hypophosphatémique avec néphrocalcinose ; HOMG : hypomagnésémies ; Dent : maladies de Dent 1 et 2 ; HHF : hypercalcémie-hypocalciurie familiale ; HI : hypercalcémie infantile ; PHA2 : pseudohypoaldostéronisme de type 2 ; S East : syndrome East ; ATDKD ATRp: acidose tubulaire rénale proximale.
|
|
L’avènement de la génétique dans l’étude des néphropathies de l’enfant a permis des avancées majeures dans la compréhension de la physiopathologie des maladies et la prise en charge des patients. La dynamique de développement des techniques de séquençage et d’analyse bioinformatique offre des performances nouvelles et des outils de diagnostic précis aux familles. Ce diagnostic est fondamental puisqu’il permet de fournir un conseil de plus en plus précis. La génétique moléculaire a contribué à faire entrer les patients dans l’ère d’une médecine de précision. Certaines options thérapeutiques ciblées sont déjà disponibles ou à l’étude, fondées sur le génotype des patients, comme c’est le cas pour l’hyperoxalurie primitive, ou grâce à la thérapie génique comme pour le traitement de la cystinose. Il ne fait aucun doute que les générations à venir verront cette révolution thérapeutique s’amplifier. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Groopman
EE
,
Marasa
M
,
Cameron-Christie
S
,
et al.
Diagnostic Utility of Exome Sequencing for Kidney Disease.
.
N Engl J Med.
2019;
;
380
:
:142.
–
151
.
2.
Connaughton
DM
,
Hildebrandt
F
.
Personalized medicine in chronic kidney disease by detection of monogenic mutations.
.
Nephrol Dial Transplant.
2020;
;
35
:
:390.
–
7
.
3.
Boute
N
,
Gribouval
O
,
Roselli
S
,
et al.
NPHS2, encoding the glomerular protein podocin, is mutated in autosomal recessive steroid-resistant nephrotic syndrome.
.
Nat Genet.
2000;
;
24
:
:349.
–
354
.
4.
Kemper
MJ
,
Lemke
A
.
Treatment of Genetic Forms of Nephrotic Syndrome.
.
Front Pediatr.
2018
;
:6.
.
5.
Jean
G
,
Fuchshuber
A
,
Town
MM
,
et al.
High-resolution mapping of the gene for cystinosis, using combined biochemical and linkage analysis.
.
Am J Hum Genet.
1996;
;
58
:
:535.
–
543
.
6.
Town
M
,
Jean
G
,
Cherqui
S
,
et al.
A novel gene encoding an integral membrane protein is mutated in nephropathic cystinosis.
.
Nat Genet.
1998;
;
18
:
:319.
–
324
.
7.
Sanyanusin
P
,
Schimmenti
LA
,
McNoe
LA
,
et al.
Mutation of the PAX2 gene in a family with optic nerve colobomas, renal anomalies and vesicoureteral reflux.
.
Nat Genet.
1995;
;
9
:
:358.
–
364
.
8.
Weber
S
,
Moriniere
V
,
Knüppel
T
,
et al.
Prevalence of mutations in renal developmental genes in children with renal hypodysplasia: results of the ESCAPE study.
.
J Am Soc Nephrol.
2006;
;
17
:
:2864.
–
2870
.
9.
Gribouval
O
,
Gonzales
M
,
Neuhaus
T
,
et al.
Mutations in genes in the renin-angiotensin system are associated with autosomal recessive renal tubular dysgenesis.
.
Nat Genet.
2005;
;
37
:
:964.
–
968
.
10.
Richards
S
,
Aziz
N
,
Bale
S
,
et al.
Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology.
.
Genet Med.
2015;
;
17
:
:405.
–
424
.
11.
Devlin
LA
,
Sayer
JA
Renal ciliopathies.
.
Curr Opin Genet Dev.
2019;
;
56
:
:49.
–
60
.
12.
Hildebrandt
F
,
Zhou
W
Nephronophthisis-associated ciliopathies.
.
J Am Soc Nephrol.
2007;
;
18
:
:1855.
–
1871
.
13.
Sang
L
,
Miller
JJ
,
Corbit
KC
,
et al.
Mapping the NPHP-JBTS-MKS protein network reveals ciliopathy disease genes and pathways.
.
Cell.
2011;
;
145
:
:513.
–
528
.
14.
Zerres
K
,
Rudnik-Schöneborn
S
,
Senderek
J
,
et al.
Autosomal recessive polycystic kidney disease (ARPKD).
.
J Nephrol.
2003;
;
16
:
:453.
–
458
.
15.
Guay-Woodford
LM
,
Desmond
RA
Autosomal recessive polycystic kidney disease: the clinical experience in North America.
.
Pediatrics.
2003;
;
111
:
:1072.
–
1080
.
16.
Burgmaier
K
,
Brinker
L
,
Erger
F
,
et al.
Refining genotype-phenotype correlations in 304 patients with autosomal recessive polycystic kidney disease and PKHD1 gene variants.
.
Kidney Int.
2021;
;
100
:
:650.
–
9
.
17.
Bergmann
C
,
Senderek
J
,
Windelen
E
,
et al.
Clinical consequences of PKHD1 mutations in 164 patients with autosomal-recessive polycystic kidney disease (ARPKD).
.
Kidney Int.
2005;
;
67
:
:829.
–
848
.
18.
Barroso-Gil
M
,
Olinger
E
,
Sayer
JA
.
Molecular genetics of renal ciliopathies.
.
Biochem Soc Trans.
2021;
;
49
:
:1205.
–
20
.
19.
Porath
B
,
Gainullin
VG
,
Cornec-Le Gall
E
,
et al.
Mutations in GANAB, Encoding the Glucosidase IIα Subunit, Cause Autosomal-Dominant Polycystic Kidney and Liver Disease.
.
Am J Hum Genet.
2016;
;
98
:
:1193.
–
1207
.
20.
Besse
W
,
Choi
J
,
Ahram
D
,
et al.
A noncoding variant in GANAB explains isolated polycystic liver disease (PCLD) in a large family.
.
Hum Mutat.
2018;
;
39
:
:378.
–
382
.
21.
Cornec-Le Gall
E
,
Olson
RJ
,
Besse
W
,
et al.
Monoallelic Mutations to DNAJB11 Cause Atypical Autosomal-Dominant Polycystic Kidney Disease.
.
Am J Hum Genet.
2018;
;
102
:
:832.
–
44
.
22.
Idrizi
A
,
Barbullushi
M
,
Petrela
E
,
et al.
The influence of renal manifestations to the progression of autosomal dominant polycystic kidney disease.
.
Hippokratia.
2009;
;
13
:
:161.
–
164
.
23.
Harris
PC
,
Rossetti
S
Determinants of renal disease variability in ADPKD.
.
Adv Chronic Kidney Dis.
2010;
;
17
:
:131.
–
139
.
24.
O’Toole
JF
,
Otto
EA
,
Hoefele
J
,
et al.
Mutational analysis in 119 families with nephronophthisis.
.
Pediatr Nephrol Berl Ger.
2007;
;
22
:
:366.
–
370
.
25.
Luo
F
,
Tao
Y-H
Nephronophthisis: A review of genotype-phenotype correlation.
.
Nephrol Carlton Vic.
2018;
;
23
:
:904.
–
911
.
26.
Levi
S.
Mass screening for fetal malformations: the Eurofetus study.
.
Ultrasound Obstet Gynecol.
2003;
;
22
:
:555.
–
558
.
27.
Sanna-Cherchi
S
,
Ravani
P
,
Corbani
V
,
et al.
Renal outcome in patients with congenital anomalies of the kidney and urinary tract.
.
Kidney Int.
2009;
;
76
:
:528.
–
533
.
28.
Sahay
M.
Congenital anomalies of kidney and urinary tract (CAKUT).
.
Clin Queries Nephrol.
2013;
;
2
:
:156.
–
165
.
29.
Okumura
T
,
Furuichi
K
,
Higashide
T
,
et al.
Association of PAX2 and Other Gene Mutations with the Clinical Manifestations of Renal Coloboma Syndrome.
.
PLoS One.
2015;
;
10
:
:e0142843.
.
30.
Gendreau
S
,
Servais
A
,
Cohen
C
.
The Case | Atrophic kidney and ocular abnormalities.
.
Kidney Int.
2020;
;
98
:
:1059.
–
60
.
31.
Chang
EH
,
Menezes
M
,
Meyer
NC
,
et al.
Branchio-oto-renal syndrome: the mutation spectrum in EYA1 and its phenotypic consequences.
.
Hum Mutat.
2004;
;
23
:
:582.
–
589
.
32.
Mironovich
OL
,
Bliznetz
EA
,
Markova
TG
,
et al.
Molecular Genetic Causes and Clinical Description of Branchio-Oto-renal Syndrome.
.
Russ J Gene.
2019;
;
55
:
:630.
–
638
.
33.
Lindau
TA
,
Cardoso
ACV
,
Rossi
NF
,
et al.
Anatomical Changes and Audiological Profile in Branchio-oto-renal Syndrome: A Literature Review.
.
Int Arch Otorhinolaryngol.
2014;
;
18
:
:68.
–
76
.
34.
Sanna-Cherchi
S
,
Kiryluk
K
,
Burgess
KE
,
et al.
Copy-number disorders are a common cause of congenital kidney malformations.
.
Am J Hum Genet.
2012;
;
91
:
:987.
–
997
.
35.
Verbitsky
M
,
Westland
R
,
Perez
A
,
et al.
The copy number variation landscape of congenital anomalies of the kidney and urinary tract.
.
Nat Genet.
2019;
;
51
:
:117.
–
127
.
36.
Trautmann
A
,
Lipska-Zie˛tkiewicz
BS
,
Schaefer
F
.
Exploring the Clinical and Genetic Spectrum of Steroid Resistant Nephrotic Syndrome: The PodoNet Registry.
.
Front Pediatr.
2018;
;
6
:
:200.
.
37.
Sadowski
CE
,
Lovric
S
,
Ashraf
S
,
et al.
A single-gene cause in 29.5 % of cases of steroid-resistant nephrotic syndrome.
.
J Am Soc Nephrol.
2015;
;
26
:
:1279.
–
1289
.
38.
Atmaca
M
,
Gulhan
B
,
Korkmaz
E
,
et al.
Follow-up results of patients with ADCK4 mutations and the efficacy of CoQ10 treatment.
.
Pediatr Nephrol Berl Ger.
2017;
;
32
:
:1369.
–
1375
.
39.
Ashton
EJ
,
Legrand
A
,
Benoit
V
,
et al.
Simultaneous sequencing of 37 genes identified causative mutations in the majority of children with renal tubulopathies.
.
Kidney Int.
2018;
;
93
:
:961.
–
967
.
40.
Hureaux
M
,
Ashton
E
,
Dahan
K
,
et al.
High-throughput sequencing contributes to the diagnosis of tubulopathies and familial hypercalcemia hypocalciuria in adults.
.
Kidney Int.
2019;
;
96
:
:1408.
–
1416
.
|