| |
| Med Sci (Paris). 39(3): 227–233. doi: 10.1051/medsci/2023030.Prise en charge prénatale des obstacles sous-vésicaux Nicolas Vinit,1,3* Yves Ville,2,3** and Thomas Blanc1,3*** 1Service de chirurgie viscérale et urologie pédiatrique, Hôpital Necker-Enfants Malades, AP-HP
,
149 rue de Sèvres
,
75015Paris
,
France 2Service d’obstétrique, médecine et chirurgie fœtale, Hôpital Necker-Enfants Malades, AP-HP
,
149 rue des Sèvres
,
75015Paris
,
France 3UFR de médecine Paris Centre, université Paris Cité
,
Paris
,
France |
Vignette (© iStock).
Depuis les années 1990, de nombreuses équipes se sont intéressées au traitement prénatal des obstacles sous-vésicaux avec des résultats souvent mitigés en termes de bénéfices sur la fonction rénale. L’objectif de cette intervention prénatale est de lever précocement l’obstacle sous-vésical pour permettre la vidange vésicale, stopper ou limiter le processus de dysplasie rénale, et rétablir une quantité de liquide amniotique suffisante pour éviter une séquence de Potter
2
. Les différents résultats, bénéfices attendus, complications et limites de la cystoscopie fœtale et du drain vésico-amniotique seront présentés dans cette revue.
|
Mégavessie et diagnostic étiologique
Le principal signe d’appel échographique pour le diagnostic d’obstacle sous-vésical est la mégavessie fœtale. Définie comme une longueur vésicale sagittale supérieure à 7 mm, ou supérieure à 10 % de la longueur cranio-caudale du fœtus, la mégavessie du premier trimestre est spontanément résolutive dans 20 à 50 % des cas mais peut néanmoins révéler la présence d’une anomalie chromosomique [
1
,
2
]. Au deuxième et au troisième trimestre, la mégavessie est définie comme l’absence de vidange d’une volumineuse vessie pendant toute la durée de l’examen échographique, soit au moins 40 minutes. Dans le cas d’une mégavessie persistante, la présence d’un obstacle sous-vésical en est la cause majoritaire (environ 50 % des cas) [
3
]. Les principales autres étiologies de mégavessie incluent : un reflux vésico-urétéral, le syndrome de mégavessie-microcôlon-hypopéristaltisme intestinal, la séquence de Prune-Belly
3
, des malformations pelviennes complexes (malformation anorectale, cloaque, syndrome de régression caudale) et des anomalies chromosomiques [
4
]. Devant la prévalence élevée d’anomalies chromosomiques associées à une mégavessie (15 à 30 % des cas), un examen chromosomique doit être réalisé de manière systématique [
3
,
4
].
Fontanella
et al
[
5
] ont développé un score prédictif, après 18 semaines d’aménorrhée (SA), de la présence d’un obstacle chez des fœtus présentant une mégavessie. Ce score comprend le volume vésical (supérieur à 35 cm
3
) ou la présence d’une ascite au diagnostic, le degré de dilatation urétérale, la quantité de liquide amniotique, le sexe fœtal, et le terme au moment du diagnostic. La performance diagnostique de ce score (AUC = 0,84, p < 0,001) est supérieure à celle de la triade diagnostique « habituelle » (mégavessie, dilatation de l’urètre postérieur, hydronéphrose) (AUC = 0,63, p = 0,07). Notons que la faible sensibilité de la présence d’une dilatation de l’urètre postérieur (
keyhole sign
) pour le diagnostic d’obstacle sous-vésical avait déjà été établie par Bernardes
et al
[
6
].
Dans le cas où un obstacle sous-vésical est présent, la cause de l’obstruction peut avoir plusieurs origines : une valve de l’urètre postérieur, une atrésie urétrale, une sténose urétrale ou une urétérocèle
4
qui obstrue le col vésical.
En dehors de l’urétérocèle obstructive, aucun signe échographique ne permet de déterminer avec certitude la cause de l’obstacle [
7
]. Le degré de distension vésicale peut cependant orienter vers un obstacle complet (atrésie urétrale) ou incomplet (valve de l’urètre postérieur, sténose de l’urètre). Ainsi, Fontanella
et al
[
8
] ont montré qu’un Z-score
5
de longueur sagittale vésicale supérieur à 2,4 était associé à un diagnostic d’atrésie urétrale avec une sensibilité de 85 % et une spécificité de 99 %. Outre la publication de nomogrammes de distension vésicale, cette étude a constitué une première étape vers l’identification et la sélection objectives des fœtus affectés.
Avec la description d’un cas de visualisation d’une valve de l’urètre postérieur à 29 semaines d’aménorrhée (SA), l’IRM (imagerie par résonance magnétique) fœtale s’est révélée être également un outil possible pour déterminer la nature de l’obstacle. Mais aucune étude n’a, à ce jour, évalué les capacités diagnostiques de l’IRM pour déterminer la cause de l’obstacle sous-vésical [
9
,
10
].
Outre son importance pour déterminer s’il existe une indication potentielle à un traitement prénatal
(
Figure 1
)
, le diagnostic étiologique de l’obstacle est nécessaire pour apporter un conseil adapté aux parents. La cystoscopie fœtale pourrait ainsi être réalisée à but diagnostique dans certains cas, si les parents souhaitent connaître la nature de l’obstacle pour décider d’une éventuelle interruption médicale de grossesse, par exemple.
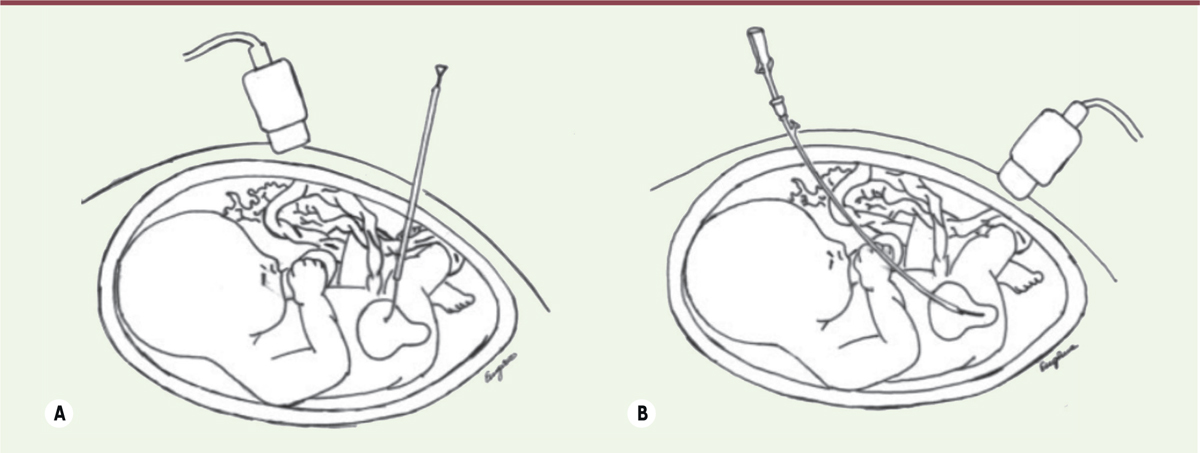
 | Figure 1.
Traitement prénatal des obstacles sous-vésicaux.
Drain vésico-amniotique (
A
) et cystoscopie fœtale (
B
) (d’après [
26
]).
|
|
Les critères de sélection des fœtus
Il n’existe, à ce jour, aucun critère validé permettant de sélectionner les fœtus qui bénéficieraient d’une levée prénatale de l’obstacle [
11
]. L’objectif de la prise en charge est de réaliser cette intervention sur des fœtus présentant un obstacle traitable (valve de l’urètre postérieur, sténose urétrale) avec des lésions rénales peu sévères, pour stopper ou ralentir l’évolution naturelle vers l’insuffisance rénale terminale dans les premières années de vie. Actuellement, cette intervention pourrait être proposée aux fœtus présentant un obstacle sous-vésical défini comme sévère, c’est-à-dire une mégavessie (supérieure à 5,4 cm
3
) et/ou une diminution de la quantité de liquide amniotique avec un dosage de la b2-microglobuline en faveur d’une fonction rénale préservée [
12
,
13
].
La b2-microglobuline est le marqueur de la fonction rénale fœtale le plus performant disponible à l’heure actuelle en routine [
14
]. Son dosage peut être plasmatique (ponction de sang fœtal, après 20 SA) ou urinaire (ponction vésicale, quel que soit le terme) avec une valeur seuil de 5 mg/L [
15
]. Lorsque la valeur de la b2-microglobuline se situe dans la « zone grise », c’est-à-dire entre 5 et 6 mg/L, le dosage peut-être répété pour augmenter sa sensibilité [
16
]. D’autres marqueurs plus performants pour estimer la fonction rénale fœtale utilisant la protéomique sont actuellement en cours d’étude [
17
].
L’aspect anormal des reins (hyperéchogènes, multikystiques, dédifférenciation cortico-médullaire) observé par échographie peut être le reflet d’une atteinte rénale liée à une uropathie obstructive [
18
]. En dehors de la visualisation d’une atteinte rénale multikystique bilatérale, ces images sont cependant difficiles à interpréter. En effet, les reins fœtaux apparaissent, avant 18 SA, physiologiquement hyperéchogènes lors d’une échographie, et un aspect normal à l’échographie n’élimine pas la présence d’une atteinte hypo-dysplasique sous-jacente [
19
]. Dans leur étude de corrélation entre l’échographie prénatale et l’analyse urinaire par méthodes biochimiques, Nassr
et al
n’ont trouvé aucune relation entre l’aspect échographique des reins, la quantité de liquide amniotique et la biochimie des urines fœtales [
20
].
Étant donné la mortalité périnatale élevée associée au diagnostic prénatal précoce d’obstacle sous-vésical sévère et l’absence d’option thérapeutique, l’interruption médicale de grossesse peut être acceptée par le Centre pluridisciplinaire de diagnostic prénatal lorsque la femme enceinte en fait la demande. C’est actuellement le cas dans 50 % (4-96 %) des cas, d’après la revue de littérature de Taghavi
et al
[
4
].
Plusieurs équipes ont cependant montré que certains fœtus porteurs d’un obstacle sous-vésical présentaient une histologie rénale favorable [
21
,
22
]. Les résultats de l’étude multicentrique de Vinit
et al
réalisée sur 74 fœtus masculins décédés (fœtus issus d’interruptions médicales de grossesse ou de morts fœtales
in utero
) porteurs d’un obstacle sous-vésical sévère (terme médian au diagnostic : 13 SA), révèlent ainsi que 30 % des fœtus avant 18 SA avaient une histologie rénale favorable, définie comme la persistance d’un potentiel de néphronogenèse. Les néphrons sont dérivés du blastème métanéphrique
6,
en périphérie du cortex. Dans les phénomènes d’hypo-dysplasie rénale obstructive, la morphologie du blastème se modifie et on observe une différenciation myofibroblastique des cellules du blastème qui expriment l’actine α, qui peut être détectée par immunohistochimie. Dans leur étude, Vinit
et al
définissent l’histologie rénale favorable comme la persistance d’au moins 50 % de blastème de morphologie normale et la présence de moins de 75 % de positivité à l’actine α détectée par immunohistochimie sur chaque rein. Ces éléments sont en faveur de la persistance d’un potentiel de néphronogenèse chez 30 % des fœtus considérés comme les plus sévèrement atteints. Ils sont également en faveur d’un traitement prénatal des obstacles sous-vésicaux chez ces fœtus [
22
].
Dans une récente étude rétrospective, Kohl
et al
[
23
] ont comparé l’issue néonatale de fœtus porteurs d’un obstacle sous-vésical (LUTO pour
lower urinary tract obstruction
) opérés avant 16 SA (avec la pose d’un drain vésico-amniotique) à celle de fœtus opérés après 16 SA. Leurs résultats suggèrent un risque moindre d’insuffisance rénale en cas de drainage précoce parmi les survivants : 79 % de fonction rénale normale lorsque les fœtus ont été drainés avant 16 SA contre 32 % en cas de drainage après 16 SA (p = 0,003). Cependant, comme l’explique l’urologue pédiatre Marie-Klaire Farrugia (Cromwell Hospital, Londres, Royaume-Uni) dans son commentaire de l’article de Kohl
et al
[
24
], ces résultats sont à interpréter avec précaution dans la mesure où la comparabilité des groupes et l’indication de drainage étaient parfois discutables (inclusion de fœtus de sexe féminin et de fœtus avec mégavessie précoce sans dilatation du haut appareil), le
design
de l’étude n’étant pas adéquat pour comparer ces groupes, et l’évaluation de l’issue (fonction rénale normale à la naissance) ayant été réalisée à très court terme, sans prendre en compte la possible dégradation rapide de la fonction rénale dans les premiers mois/années de vie.
Un des écueils retrouvés dans les revues de la littérature et les méta-analyses, en plus du faible nombre de patients, est l’absence d’homogénéité des patients examinés. Récemment, une conférence de consensus du réseau de référence européen a été publiée sur ce sujet [
25
]. Il s’agit ainsi d’un premier pas vers l’homogénéisation des pratiques, les critères diagnostiques de LUTO étant notamment énoncés, ainsi que les principes de prise en charge recommandés.
|
Le drain vésico-amniotique : une alternative à la cystoscopie fœtale ?
La vésicocentèse n’ayant pas de place pour le traitement des obstacles sous-vésicaux
7,
, la principale alternative à la cystoscopie fœtale est la pose d’un drain vésico-amniotique. Celle-ci est réalisée sous contrôle échographique pur [
26
]. Le drain se présente sous la forme d’une double queue de cochon de 1,7 ou 2,1 mm de diamètre
(
Figure 2
)
. Contrairement à la cystoscopie fœtale, le drain vésico-amniotique permet uniquement de dériver les urines vers la cavité amniotique pour diminuer la pression intra-vésicale et rétablir une quantité de liquide amniotique normale, ce qui est nécessaire au bon développement pulmonaire pour limiter le risque d’hypoplasie pulmonaire (séquence de Potter). Plusieurs études, dont l’essai contrôlé randomisé PLUTO (
percutaneous shunting in lower urinary tract obstruction
), ont montré un bénéfice du drain vésico-amniotique sur la survie périnatale, sans bénéfice sur la fonction rénale postnatale [
27
]. Sur le plan urologique, le drain vésico-amniotique entraîne une dé-fonctionnalisation de la vessie en interrompant le cycle de réplétion/vidange vésicale [
28
]. Peu d’études se sont intéressées aux conséquences urologiques à long terme de la pose d’un tel drain. Néanmoins, il apparaît que 20 à 70 % des enfants survivants présentent une dysfonction vésicale avec des anomalies de vidange [
29
-
31
]. La technique de cystoscopie fœtale semble donc plus prometteuse puisqu’elle permet, théoriquement, de faire le diagnostic étiologique de l’obstacle sous-vésical et de le traiter éventuellement en maintenant le cycle physiologique de réplétion/vidange vésicale. La seule étude ayant pu montrer une tendance à la préservation de la fonction rénale postnatale après cystoscopie fœtale, contrairement au drain vésico-amniotique, est celle de Ruano
et al
: les taux de survie à six mois étant similaires entre les deux techniques [
32
].
 | Figure 2.
Drain vésico-amniotique
, commercialisé par Cook® Medical (J-HFBS-503540, Harrison Fetal Bladder Stent Set, Cook® Medical, Bloomington, États-Unis).
|
|
La technique de cystoscopie fœtale
Même s’il n’existe aucun terme validé pour pratiquer cette intervention, la cystoscopie fœtale est habituellement réalisée entre 18 et 24 SA [
29
,
33
]. Une anesthésie locale maternelle, ou anesthésie locale assistée par une prise de rémifentanil, est effectuée. L’intervention débute par un repérage échographique afin d’évaluer la vitalité fœtale, la quantité de liquide amniotique, la position du fœtus, celle du placenta et du cordon, et celle de la vessie. Une version manuelle pourra être faite après anesthésie et curarisation fœtale pour permettre un trajet direct de l’aiguille de ponction dans la vessie. En cas d’oligo-anamnios
8,
, une amnio-infusion
9
première peut être réalisée.
L’anesthésie fœtale varie selon les protocoles, mais elle est constituée d’un curare (0,5 mg/kg d’atracurium dans notre protocole) et d’un antalgique sédatif (0,5 µg/kg de sufentanil dans notre protocole) administrés par une aiguille de 22G
10
. L’anesthésie fœtale est réalisée en intra-funiculaire (dans la veine ombilicale) (après 20 SA) ou en intramusculaire (quel que soit le terme) et peut être précédée d’une ponction de sang fœtal pour doser la b2-microglobuline plasmatique. Après anesthésie locale maternelle au niveau de la zone de ponction, une aiguille de 18G est insérée dans la vessie du fœtus. Un prélèvement d’urines est réalisé pour doser la b2-microglobuline urinaire et un trocart de 10FR est placé dans la vessie fœtale sur guide. Le fœtoscope, un endoscope utilisé pour les interventions
in utero
(de 2,6 mm de diamètre) est ensuite inséré dans le trocart. L’aide maintien une réplétion vésicale suffisante par instillation répétée de sérum physiologique car la vessie a tendance à se vider par l’orifice ainsi créé.
Le fœtoscope permet d’explorer la vessie du fœtus jusqu’au col vésical et à l’urètre postérieur pour visualiser l’obstacle. La valve de l’urètre postérieur, la sténose urétrale et l’urétérocèle obstructive peuvent faire l’objet d’un traitement endoscopique. L’arsenal thérapeutique comprend des fibres laser permettant de sectionner la valve, des guides (de type «
road runner
») permettant de perforer la valve et des ballons de dilatation endoscopique permettant de dilater l’orifice urétral restant [
29
,
33
,
34
]. Certaines équipes ont également rapporté l’utilisation de l’hydro-ablation
11
[
35
]. Dans le cas où le diagnostic d’atrésie de l’urètre est posé pendant la cystoscopie fœtale, la pose d’un drain vésico-amniotique peut être réalisée dans le même temps opératoire, après discussion avec les parents. Dans le cas d’une urétérocèle obstructive, c’est-à-dire lorsqu’elle fait clapet sur le col vésical et se comporte donc comme un obstacle sous-vésical, un traitement endoscopique peut être proposé. La technique opératoire est identique, l’incision de l’urétérocèle est réalisée à l’aide d’une fibre laser [
36
].
Une fois l’intervention terminée, l’échographie permet de vérifier la vitalité du fœtus. Les principaux éléments de surveillance post-opératoire immédiate sont : la vitalité fœtale (présence de bruits du cœur ou rythme cardiaque fœtal selon le terme) et la présence éventuelle de contractions utérines, de métrorragies et de perte de liquide amniotique. L’hospitalisation est courte, le plus souvent jusqu’au lendemain avec un décubitus dorsal strict pendant les heures suivant la procédure. Un suivi échographique rapproché est poursuivi. |
Les résultats de la cystoscopie fœtale
L’analyse des résultats de la cystoscopie fœtale est limitée par les petits effectifs rapportés par chaque équipe, l’hétérogénéité des fœtus inclus (liée notamment aux difficultés diagnostiques de la cause de l’obstacle avant l’intervention), l’absence de standardisation des critères d’éligibilité des fœtus et des critères de jugement, notamment l’évaluation de la fonction rénale post-natale [
29
].
Dans leur revue de la littérature récente, Saccone
et al
[
37
] ont inclus, à partir de deux études cas/témoins, 45 fœtus ayant eu une cystoscopie fœtale. Les taux de survie périnatale et de fonction rénale normale à six mois étaient plus élevés dans le groupe cystoscopie fœtale par rapport à l’attitude expectative (absence d’intervention) (respectivement, OR = 2,63 [1,07-6,47] et OR = 1,75 [1,05-2,92]). La revue de Morris
et al
[
38
] n’a pas montré de supériorité de la cystoscopie fœtale par rapport au drain vésico-amniotique en termes de survie et de survie avec une fonction rénale normale. Ruano
et al
[
32
] avaient inclus dans leur étude cas/témoin multicentrique, 111 fœtus ayant été traités par cystoscopie fœtale (n = 34), par drain vésico-amniotique (n = 16), ou par attitude expectative (n = 61). Le taux de survie à six mois était similaire entre la cystoscopie fœtale et le drain vésico-amniotique. En analyse multivariée, la cystoscopie fœtale était associée à une amélioration de la survie à six mois comparé au traitement expectatif (AAR = 1,86 [1,01-3,42], p = 0,048) et avait tendance à être associée à une fonction rénale post-natale normale (AAR = 1,73 [0,97-3,08], p = 0,06) contrairement au drain vésico-amniotique (AAR = 1,16 [0,86-1,55], p = 0,33).
Bien que les résultats des différentes études publiées suggèrent un bénéfice sur la survie comparé à l’absence d’interventions, il n’existe aucune preuve du bénéfice de la cystoscopie fœtale sur la fonction rénale post-natale ou de supériorité par rapport au drain vésico-amniotique [
39
].
Dans le cas des urétérocèles obstructives, aucune étude ne rapporte, à ce jour, les résultats néphrologiques et urologiques à moyen et long termes associés à une incision prénatale de l’urétérocèle. |
Les complications de la cystoscopie fœtale Les complications de la cystoscopie fœtale sont peu rapportées dans les études évaluant le traitement prénatal des obstacles sous-vésicaux. Elles peuvent être d’ordres fœtal et obstétrical.
Les principales complications fœtales sont l’éviscération néonatale (l’épiploon
12,
ou plus rarement le tube digestif) à travers l’orifice de trocart utilisé pour la cystoscopie fœtale (3 à 25 % des cas selon les études) [
29
,
33
] et les fistules périnéales ou urinomes péri-urétraux (13 à 25 % des cas) [
29
,
33
,
40
].
Le taux d’échec technique de la cystoscopie fœtale, lorsqu’il est rapporté, varie entre 5 et 60 % des cas [
29
,
35
,
40
]. Ce taux important est expliqué par l’inadéquation du fœtoscope actuellement utilisé. Il en est de même pour les fistules urinaires après fulguration laser de valves de l’urètre postérieur (urétro-cutanée, urétro-rectale, urinome péri-urétral), comme le rapportent notamment Sananes
et al
[
41
]. Ces fistules sont liées à une lésion des tissus adjacents par la fibre laser, favorisées par les difficultés d’exposition et de visualisation de l’obstacle. Dans leur série rétrospective, Welsh
et al
rapportaient une impossibilité de visualiser l’obstacle dans 62 % des cas [
35
].
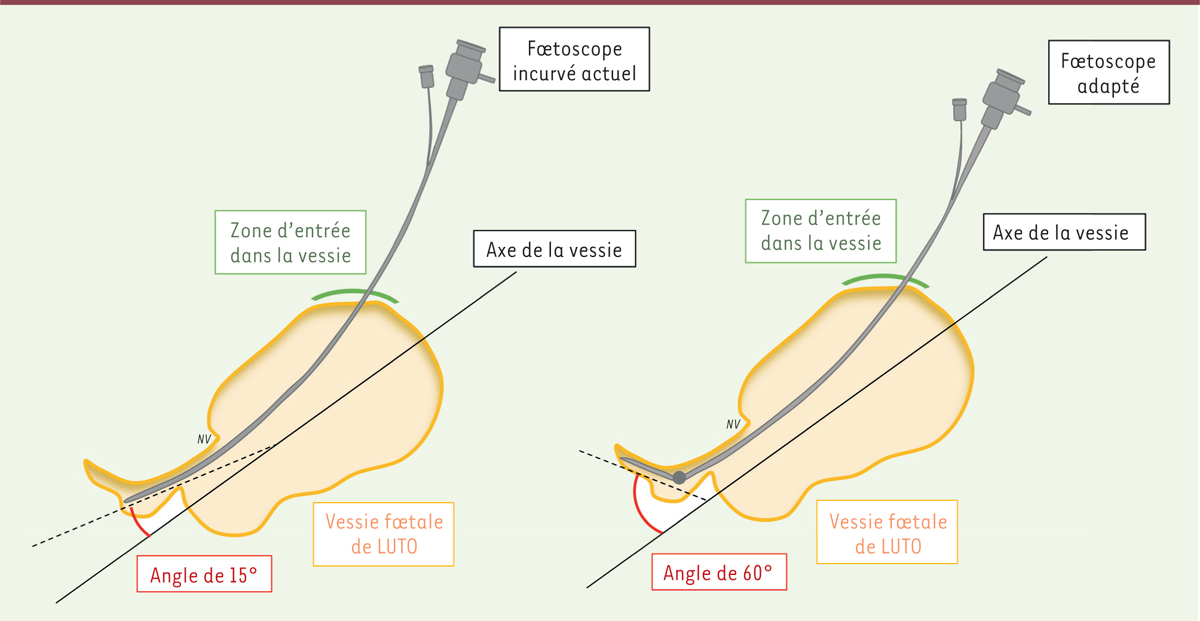
Une étude anatomique de la vessie fœtale en IRM a été réalisée par Vinit
et al
pour mettre au point un cystoscope adapté aux contraintes anatomiques spécifiques de la mégavessie du fœtus. Les caractéristiques décrites par les auteurs sont en particulier une angulation d’environ 60° (contre les 15° avec le fœtoscope actuellement utilisé) afin de permettre la visualisation directe de l’obstacle [
9
]
(
Figure 3
)
.
 | Figure 3.
Schéma de cystoscopie fœtale montrant l’inadéquation du matériel actuellement utilisé avec l’angle de l’urètre postérieur
(d’après [
9
]).
|
Après une cystoscopie fœtale, 21 % en moyenne [10 %-27 %] des grossesses se compliquent d’une rupture prématurée des membranes. La menace d’accouchement prématuré est plus rare (5 % des cas environ) [
29
,
33
,
35
,
40
]. Ces complications sont comparables à celles survenant après la mise en place d’un drain vésico-amniotique. Toutefois, la complication spécifique la plus fréquente du drain vésico-amniotique est sa migration (dans environ 40 % des cas), qui peut nécessiter la réalisation de procédures itératives pour permettre le drainage vésical, majorant ainsi le risque de rupture prématurée des membranes [
29
].
|
Les autres indications de drainage in utero
D’autres indications, plus rares, peuvent faire discuter le drainage prénatal d’une uropathie obstructive. Celui-ci peut être proposé en cas d’hydronéphrose géante isolée (sans mégavessie), liée à un syndrome de la jonction pyélo-urétérale lorsque l’hydronéphrose est compressive (aplatissement de la coupole diaphragmatique homolatérale, hydramnios lié à une compression gastrique) ou bilatérale [
42
,
43
]. Le même cas de figure peut être rencontré dans les volumineux hydrocolpos
13
compressifs. Le même drain que celui utilisé dans le drainage vésico-amniotique sera alors utilisé pour ces deux indications.
|
L’arsenal thérapeutique des uropathies de diagnostic prénatal comprend le drain vésico-amniotique et la cystoscopie fœtale, une technique séduisante et prometteuse pour le traitement prénatal des obstacles sous-vésicaux. Cependant, dans les conditions actuelles, l’utilisation de la cystoscopie fœtale ne semble pas être une option thérapeutique viable. Afin de permettre une évaluation de la fonction rénale et des bénéfices urologiques à long terme pour les enfants traités pour un obstacle sous-vésical, plusieurs éléments restent à développer et à améliorer. Il est en effet nécessaire d’utiliser un instrument chirurgical adapté à la région anatomique à traiter afin de minimiser les complications fœtales et de prévenir la survenue d’échecs techniques. Il est également important de déterminer des critères de sélection en identifiant les fœtus susceptibles de bénéficier de cette intervention. Ceci implique un diagnostic étiologique préopératoire de l’obstacle et une estimation performante et, idéalement, non invasive de la fonction rénale fœtale. Il s’agira ensuite d’étudier les modifications histologiques des reins fœtaux avant et après la levée de l’obstacle. Ces différents points constituent les pistes de recherche actuelles pour améliorer la prise en charge prénatale des fœtus présentant un obstacle sous-vésical. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Sebire
NJ
,
Von
Kaisenberg C
,
Rubio
C
,
et al.
Fetal megacystis at 10–14 weeks of gestation.
.
Ultrasound Obstet Gynecol.
1996;
;
8
:
:387.
–
390
.
2.
Fontanella
F
,
Duin
L
,
Adama van Scheltema
PN
,
et al.
Fetal megacystis: prediction of spontaneous resolution and outcome.
.
Ultrasound Obstet Gynecol.
2017;
;
50
:
:458.
–
463
.
3.
Fontanella
F
,
Maggio
L
,
Verheij
JBGM
,
et al.
Fetal megacystis: a lot more than LUTO.
.
Ultrasound Obstet Gynecol.
2019;
;
53
:
:779.
–
787
.
4.
Taghavi
K
,
Sharpe
C
,
Stringer
MD
Fetal megacystis: A systematic review.
.
J Pediatr Urol.
2017;
;
13
:
:7.
–
15
.
5.
Fontanella
F
,
Duin
LK
,
Adama van Scheltema
PN
,
et al.
Prenatal diagnosis of LUTO: improving diagnostic accuracy.
.
Ultrasound Obstet Gynecol.
2018;
;
52
:
:739.
–
743
.
6.
Bernardes
LS
,
Aksnes
G
,
Saada
J
,
et al.
Keyhole sign: How specific is it for the diagnosis of posterior urethral valves?
.
Ultrasound Obstet Gynecol.
2009;
;
34
:
:419.
–
423
.
7.
Robyr
R
,
Benachi
A
,
Daikha-Dahmane
F
,
et al.
Correlation between ultrasound and anatomical findings in fetuses with lower urinary tract obstruction in the first half of pregnancy.
.
Ultrasound Obstet Gynecol.
2005;
;
25
:
:478.
–
482
.
8.
Fontanella
F
,
Groen
H
,
Duin
LK
,
et al.
Z-scores of fetal bladder distention for the antenatal differential diagnosis of posterior urethral valves and urethral atresia.
.
Ultrasound Obstet Gynecol.
2021;
;
58
:
:875.
–
81
.
9.
Vinit
N
,
Grevent
D
,
Millischer-Bellaiche
A
,
et al.
Biometric and morphological features of the fetal bladder in lower urinary tract obstruction on magnetic resonance imaging: new perspectives for fetal cystoscopy.
.
Ultrasound Obstet Gynecol.
2020;
;
56
:
:86.
–
95
.
10.
Chalouhi
GE
,
Millischer
AÉ
,
Mahallati
H
,
et al.
The use of fetal MRI for renal and urogenital tract anomalies.
.
Prenat Diagn.
2020;
;
40
:
:100.
–
9
.
11.
Farrugia
MK
,
Braun
MC
,
Peters
CA
,
et al.
Report on The Society for Fetal Urology panel discussion on the selection criteria and intervention for fetal bladder outlet obstruction.
.
J Pediatr Urol.
2017;
;
13
:
:345.
–
351
.
12.
Fontanella
F
,
van Scheltema
PNA
,
Duin
L
,
et al.
Antenatal staging of congenital lower urinary tract obstruction.
.
Ultrasound Obstet Gynecol.
2019;
;
53
:
:520.
–
524
.
13.
Ruano
R
,
Sananes
N
,
Wilson
C
,
et al.
Fetal lower urinary tract obstruction: proposal for standardized multidisciplinary prenatal management based on disease severity.
.
Ultrasound Obstet Gynecol.
2016;
;
48
:
:476.
–
482
.
14.
Nguyen
C
,
Dreux
S
,
Heidet
L
,
et al.
Fetal serum α-1 microglobulin for renal function assessment: Comparison with β2-microglobulin and cystatin C.
.
Prenat Diagn.
2013;
;
33
:
:775.
–
781
.
15.
Abdennadher
W
,
Chalouhi
G
,
Dreux
S
,
et al.
Fetal urine biochemistry at 13–23 weeks of gestation in lower urinary tract obstruction: Criteria for in-utero treatment.
.
Ultrasound Obstet Gynecol.
2015;
;
46
:
:306.
–
311
.
16.
Spaggiari
E
,
Faure
G
,
Dreux
S
,
et al.
Sequential fetal serum β2-microglobulin to predict postnatal renal function in bilateral or low urinary tract obstruction.
.
Ultrasound Obstet Gynecol.
2017;
;
49
:
:617.
–
622
.
17.
Buffin-Meyer
B
,
Tkaczyk
M
,
Stańczyk
M
,
et al.
A single-center study to evaluate the efficacy of a fetal urine peptide signature predicting postnatal renal outcome in fetuses with posterior urethral valves.
.
Pediatr Nephrol.
2020;
;
35
:
:469.
–
75
.
18.
Morris
RK
,
Malin
GL
,
Khan
KS
,
et al.
Systematic review of the effectiveness of antenatal intervention for the treatment of congenital lower urinary tract obstruction.
.
BJOG.
2010;
;
117
:
:382.
–
390
.
19.
Stein Bernardes
L
,
Salomon
R
,
Aksnes
G
,
et al.
Ultrasound evaluation of prognosis in fetuses with posterior urethral valves.
.
J Pediatr Surg.
2011;
;
46
:
:1412.
–
8
.
20.
Nassr
AA
,
Koh
CK
,
Shamshirsaz
AA
,
et al.
Are ultrasound renal aspects associated with urinary biochemistry in fetuses with lower urinary tract obstruction?
.
Prenat Diagn.
2016;
;
36
:
:1206.
–
1210
.
21.
Daïkha-Dahmane
F
,
Dommergues
M
,
Muller
F
,
et al.
Development of human fetal kidney in obstructive uropathy: Correlations with ultrasonography and urine biochemistry.
.
Kidney Int.
1997;
;
52
:
:21.
–
32
.
22.
Vinit
N
,
Bessières
B
,
et al.
Pathologic and sonographic review of early isolated severe lower urinary tract obstruction and implications for prenatal treatment: a multicenter retrospective study.
.
Ultrasound Obstet Gynecol.
2022;
;
59
:
:513.
–
21
.
23.
Kohl
T
,
Fimmers
R
,
Axt-Fliedner
R
,
et al.
Vesico-amniotic shunt insertion prior to the completion of 16 weeks results in improved preservation of renal function in surviving fetuses with isolated severe lower urinary tract obstruction (LUTO).
.
J Pediatr Urol.
2022;
;
18
:
:116.
–
26
.
24.
Farrugia
MK
.
Vesico-amniotic shunt insertion prior to the completion of 16 weeks results in improved preservation of renal function in surviving fetuses with isolated severe lower urinary tract obstruction (LUTO).
.
J Pediatr Urol.
2022;
;
18
:
:129.
–
30
.
25.
Capone
V
,
Persico
N
,
Berrettini
A
,
et al.
Definition, diagnosis and management of fetal lower urinary tract obstruction: consensus of the ERKNet CAKUT-Obstructive Uropathy Work Group.
.
Nat Rev Urol.
2022;
;
19
:
:295.
–
303
.
26.
Ruano
R.
Fetal surgery for severe lower urinary tract obstruction.
.
Prenat Diagn.
2011;
;
31
:
:667.
–
674
.
27.
Morris
RK
,
Malin
GL
,
Quinlan-Jones
E
,
et al.
Percutaneous vesicoamniotic shunting versus conservative management for fetal lower urinary tract obstruction (PLUTO): A randomised trial.
.
Lancet.
2013;
;
382
:
:1496.
–
1506
.
28.
Kitagawa
H
,
Pringle
KC
,
Koike
J
,
et al.
Is a vesicoamniotic shunt intrinsically bad? Shunting a normal fetal bladder.
.
J Pediatr Surg.
2007;
;
42
:
:2002.
–
2006
.
29.
Vinit
N
,
Gueneuc
A
,
Bessieres
B
,
et al.
Fetal Cystoscopy and Vesicoamniotic Shunting in Lower Urinary Tract Obstruction: Long-Term Outcome and Current Technical Limitations.
.
Fetal Diagn Ther.
2020;
;
47
:
:74.
–
83
.
30.
Biard
JM
,
Johnson
MP
,
Carr
MC
,
et al.
Long-term outcomes in children treated by prenatal vesicoamniotic shunting for lower urinary tract obstruction.
.
Obstet Gynecol.
2005;
;
106
:
:503.
–
508
.
31.
Freedman
AL
,
Johnson
MP
,
Smith
CA
,
et al.
Long-term outcome in children after antenatal intervention for obstructive uropathies.
.
Lancet.
1999;
;
354
:
:374.
–
377
.
32.
Ruano
R
,
Sananes
N
,
Sangi-Haghpeykar
H
,
et al.
Fetal intervention for severe lower urinary tract obstruction: A multicenter case-control study comparing fetal cystoscopy with vesicoamniotic shunting.
.
Ultrasound Obstet Gynecol.
2015;
;
45
:
:452.
–
458
.
33.
Sananes
N
,
Cruz-Martinez
R
,
Favre
R
,
et al.
Two-year outcomes after diagnostic and therapeutic fetal cystoscopy for lower urinary tract obstruction.
.
Prenat Diagn.
2016;
;
36
:
:297.
–
303
.
34.
Debska
M
,
Koleśnik
A
,
Kretowicz
P
,
et al.
Ultrasound guided balloon catheterisation: A new method of fetal lower urinary tract obstruction management.
.
Ginekol Pol.
2017;
;
88
:
:255.
–
259
.
35.
Welsh
A
,
Agarwal
S
,
Kumar
S
,
et al.
Fetal cystoscopy in the management of fetal obstructive uropathy: Experience in a single European centre.
.
Prenat Diagn.
2003;
;
23
:
:1033.
–
1041
.
36.
Chalouhi
GE
,
Morency
AM
,
De
Vlieger R
,
et al.
Prenatal incision of ureterocele causing bladder outlet obstruction: a multicenter case series.
.
Prenat Diagn.
2017;
;
37
:
:968.
–
974
.
37.
Saccone
G
,
D’Alessandro
P
,
Escolino
M
,
et al.
Antenatal intervention for congenital fetal lower urinary tract obstruction (LUTO): a systematic review and meta-analysis.
.
J Matern Fetal Neonatal Med.
2020;
;
33
:
:2664.
–
70
.
38.
Morris
RK
,
Ruano
R
,
Kilby
MD
Effectiveness of fetal cystoscopy as a diagnostic and therapeutic intervention for lower urinary tract obstruction: a systematic review.
.
Ultrasound Obstet Gynecol.
2011;
;
37
:
:629.
–
637
.
39.
Farrugia
MK
,
Kilby
MD
.
Therapeutic intervention for fetal lower urinary tract obstruction: Current evidence and future strategies.
.
J Pediatr Urol.
2021;
;
17
:
:193.
–
9
.
40.
Martínez
JM
,
Masoller
N
,
Devlieger
R
,
et al.
Laser ablation of posterior urethral valves by fetal cystoscopy.
.
Fetal Diagn Ther.
2015;
;
37
:
:267.
–
273
.
41.
Sananes
N
,
Favre
R
,
Koh
CJ
,
et al.
Urological fistulas after fetal cystoscopic laser ablation of posterior urethral valves: Surgical technical aspects.
.
Ultrasound Obstet Gynecol.
2015;
;
45
:
:183.
–
189
.
42.
Dumez
Y
,
Vallancien
G
,
Aubry
MC
,
et al.
Percutaneous nephrostomy in utero for bilateral foetal hydronephrosis.
.
Nouv Presse Med.
1982;
;
11
:
:1787.
–
1789
.
43.
Vintzileos
AM
,
Nochimson
DJ
,
Walzak
MP
,
et al.
Unilateral fetal hydronephrosis: Successful in utero surgical management.
.
Am J Obstet Gynecol.
1983;
;
145
:
:885.
–
886
.
|