| |
| Med Sci (Paris). 39(3): 219–226. doi: 10.1051/medsci/2023032.Les anomalies du développement rénal Caroline Rousset-Rouvière1* 1Service de pédiatrie multidisciplinaire, Assistance Publique-Hôpitaux de Marseille (AP-HM) Timone-Enfants
,
13385Marseille cedex 05
,
France |
Vignette (© iStock).
Si la plupart des anomalies du développement rénal n’entraînent aucune conséquence clinique et n’engagent pas le pronostic rénal, la gravité potentielle de certaines malformations rend leur dépistage et leur prise en charge précoce essentiels. Les malformations rénales sont la principale cause d’insuffisance rénale chronique chez l’enfant. Le diagnostic se fait fréquemment en période anténatale grâce aux progrès de l’échographie fœtale et à son utilisation en routine. Les étiologies de ces malformations restent mal connues mais la connaissance de l’embryologie fœtale et les progrès de la recherche génétique permettent d’expliquer, en partie, ces anomalies. On distingue généralement les anomalies du développement rénal de celles des voies urinaires mais, en raison de la complexité de l’embryologie rénale, notamment des effets inducteurs réciproques entre le bourgeon urétéral et le blastème métanéphrique
1
, on comprend qu’un défaut d’un de ces composants peut affecter le développement global de l’appareil urinaire et qu’une anomalie du développement rénal est souvent associée à des anomalies de la voie excrétrice. Ces anomalies sont regroupées sous l’acronyme CAKUT (
congenital anomalies of the kideny and urinary tract
). De même, il n’est pas rare de trouver des malformations associées aux anomalies du développement rénal, notamment génitales. Nous aborderons, dans cette revue, les principales anomalies du développement rénal.
|
L’agénésie rénale
L’agénésie rénale peut-être uni- ou bilatérale
(
Figure 1
)
, isolée ou associée à d’autres malformations (dans un quart des cas, elle s’accompagne de malformations génitales). Elle résulte de l’absence de développement du bourgeon urétéral, ayant pour conséquence l’absence d’induction du blastème métanéphrique. Lorsqu’elle est bilatérale, l’agénésie rénale est létale. C’est une malformation rare qui touche une naissance sur 10 000. Le diagnostic se fait par l’échographie fœtale, au cours du deuxième trimestre de grossesse, qui montre un oligo-amnios
2,
, une absence de rein (fosses lombaires libres), et une vessie non visualisable. L’anamnios
2
est responsable d’une hypoplasie pulmonaire et des déformations fœtales (faciès et extrémités) réalisant la séquence de Potter
3,
. L’agénésie rénale unilatérale est beaucoup plus fréquente. Son incidence, difficile à évaluer, est estimée entre 1/500 à 1/1 000 naissances. Elle concerne le plus souvent le rein gauche chez le garçon. Le diagnostic se fait en général sur l’échographie fœtale, mais la découverte d’un rein unique peut se faire en post-natal, de manière fortuite, puisque cette malformation est le plus souvent asymptomatique. Avant d’affirmer le diagnostic, il est nécessaire de rechercher un rein en position ectopique
4,
ou un rein hypo-dysplasique. De plus, l’échographie recherchera une malformation génitale ou urologique qui peut lui être associée, et une hypertrophie compensatrice du rein controlatéral. La réalisation d’une cystographie rétrograde
5
en postnatal, pour éliminer un reflux vésico-urétéral, n’est pas systématique et dépendra de la survenue d’épisode infectieux
(
Figure 2
)
. En l’absence d’anomalies associées, le pronostic rénal n’est pas engagé. On préconise une surveillance régulière de la tension artérielle et de la protéinurie, qui peuvent apparaître à long terme, ainsi que la surveillance de la croissance du rein unique, par échographie durant l’enfance. Plus rarement, l’agénésie rénale unilatérale s’intègre dans un syndrome polymalformatif, et le pronostic général peut alors être différent. En anténatal, si le rein controlatéral est normal, s’il n’existe pas d’atteintes extra-rénales ou d’antécédents familiaux particuliers, on ne réalisera pas d’examen génétique.
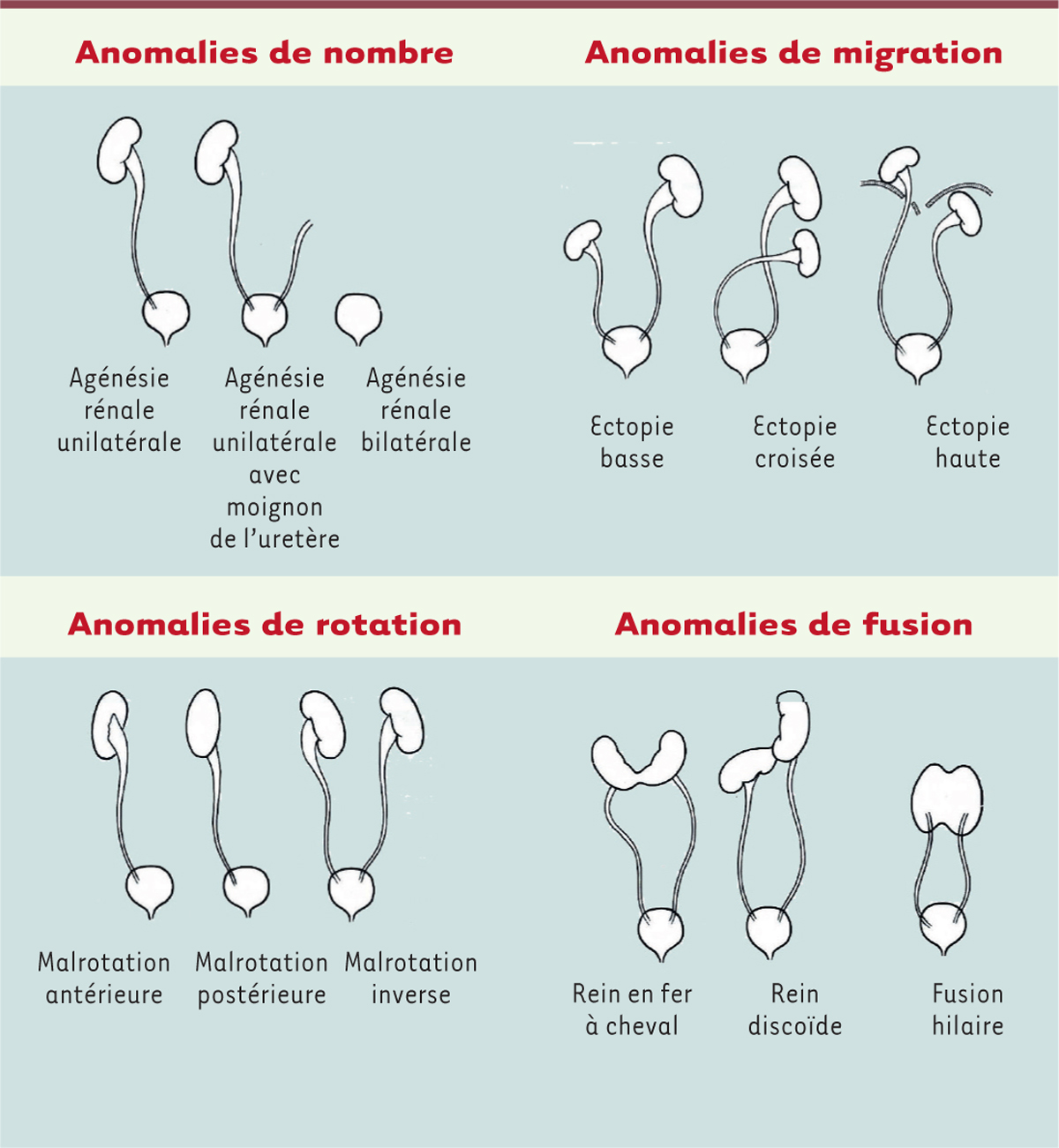
 | Figure 1.
Schéma des malformations rénales
(d’après [
2
]).
|
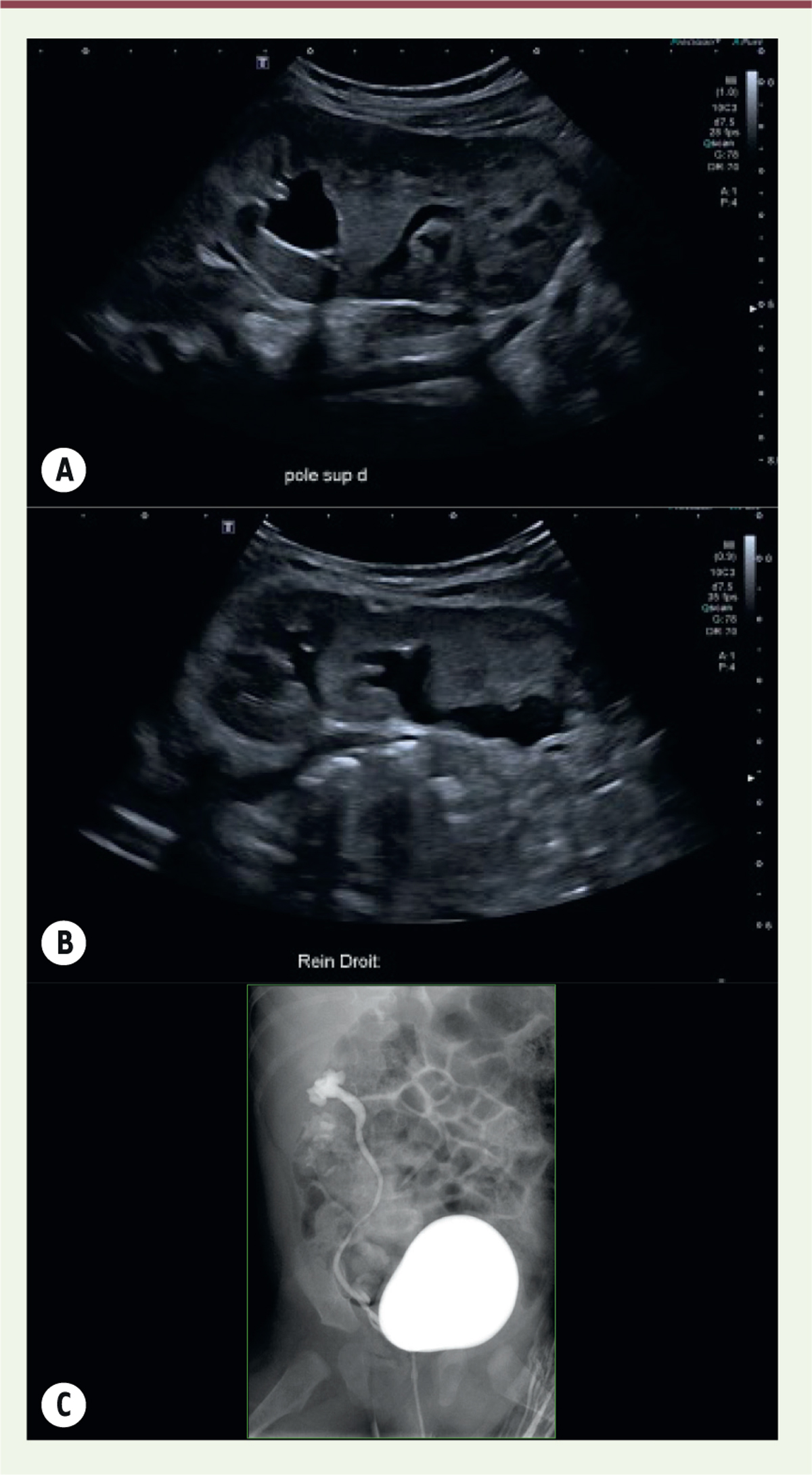
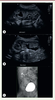 | Figure 2.
Rein unique droit avec duplication rénale, associé à système double et reflux urétéro-vésical. A et B.
Échographie à deux mois de vie : rein droit avec dilatation des cavités pyélocalicielles supérieures et inférieures. Loge rénale gauche vide.
C..
Cystographie rétrograde réalisée six mois après un premier épisode de pyélonéphrite aiguë : reflux vésico-urétéral dans les éléments supérieur et inférieur d’un système double du rein droit de grade III dans l’élément supérieur et de grade II dans l’élément inférieur, avec visibilité des deux uretères jusqu’en arrière de la vessie (© crédit photo P. Petit. Service de radiologie pédiatrique. AP-HM Timone Enfants, Marseille).
|
La duplication rénale
Cette pathologie est due à une duplication prématurée du bourgeon urétéral avant sa pénétration dans le blastème métanéphrique. Si les duplications des voies urinaires sont fréquentes, la duplication du rein reste exceptionnelle. Il s’agit d’un rein surnuméraire indépendant ayant sa propre vascularisation et une voie excrétrice individuelle. Isolée, elle n’entraîne aucune conséquence clinique. En cas de système double collecteur, l’uretère qui draine le pôle supérieur du rein (souvent dysplasique) est fréquemment dilaté. Il peut s’implanter de manière ectopique à la face postérieure de la vessie. Une urétérocèle
6
peut être associée
(
Figure 2
)
.
|
L’ectopie rénale est liée à une anomalie de migration lors de l’embryogenèse. Elle peut être haute, basse ou croisée mais rarement bilatérale
(
Figure 1
)
. Elle n’engage pas le pronostic rénal lorsqu’elle est isolée. Des anomalies urologiques peuvent y être associées, principalement un reflux vésico-urétéral. L’ectopie rénale peut être basse : le plus souvent, il s’agit d’un rein pelvien : l’échographie rénale retrouve un rein dans la région pelvienne, de taille réduite mais normalement fonctionnel. On pourra rechercher l’existence d’une obstruction de la jonction pyélo-urétérale ainsi qu’un reflux vésico-urétéral, qui lui sont fréquemment associés
(
Figure 3
)
. L’ectopie rénale haute est beaucoup plus rare et touche préférentiellement le rein gauche chez le garçon. Elle est due à une migration excessive du rein en position sous-diaphragmatique ou intra-diaphragmatique. Le diagnostic de certitude se fait sur l’échographie, qui doit éliminer une ascension d’un rein normal secondaire à une agénésie diaphragmatique ou post-traumatique. Enfin, on parle d’ectopie rénale croisée lorsque le rein et l’uretère croisent la ligne médiane alors que l’orifice urétéro-vésical reste en position normale. Les reins, qui se retrouvent du même côté, peuvent fusionner leur parenchyme
(
Figure 4
)
. L’incidence de l’ectopie rénale croisée est de 1/7 000 naissances, et elle est asymptomatique dans la plupart des cas. Cependant, elle est fréquemment associée à des malformations urogénitales et squelettiques.
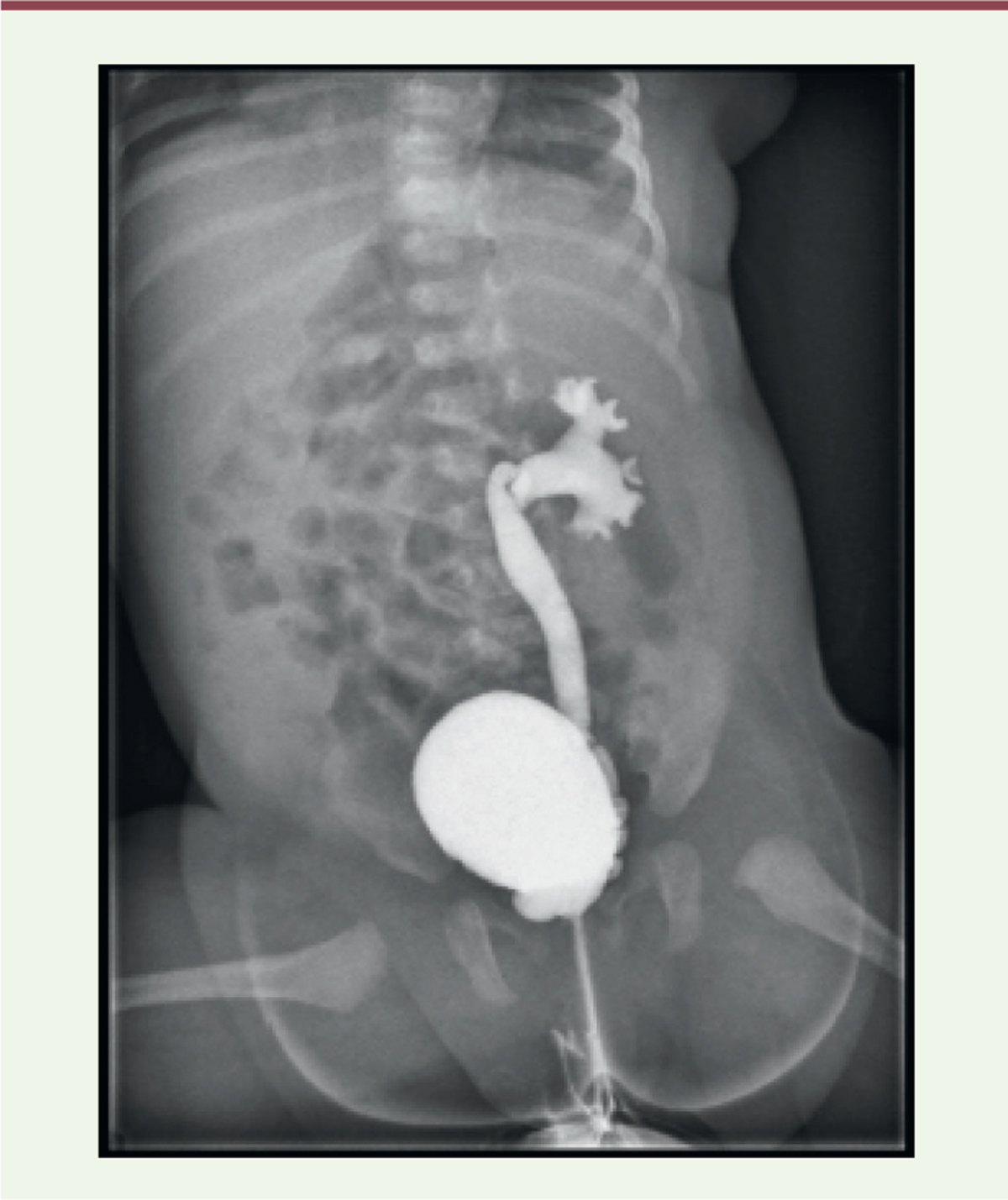
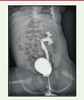 | Figure 3.
Rein pelvien avec reflux vésico-urétéral.
Cystographie rétrograde montrant un reflux urétéro-pyélocaliciel passif de grade IV dans un rein pelvien gauche. Dilatation de l’uretère, du pyélon et des fonds caliciels. Vessie en réplétion complète aux parois régulières (© crédit photo P. Petit. Service de radiologie pédiatrique. AP-HM Timone Enfants, Marseille).
|
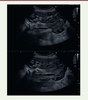 | Figure 4.
Ectopie rénale croisée avec fusion
. Échographie montrant une ectopie rénale croisée avec une fusion du rein droit avec le pôle inférieur du rein gauche, rein « en L inversé » (© crédit photo P. Petit. Service de radiologie pédiatrique. AP-HM Timone Enfants, Marseille).
|
|
Les anomalies de rotation
Il s’agit d’anomalies fréquentes qui peuvent être unies ou bilatérales. On parle de mal rotation lorsque la jonction pyélo-urétérale est orientée en antérieur (absence de rotation), en postérieur (excès de rotation) ou en externe (rotation inverse)
(
Figure 1
)
. La mal rotation antérieure est la plus fréquente, le diagnostic se fait sur la cystographie rétrograde qui montre un bassinet agrandi et déformé se projetant de face sur les groupes caliciels. Le rein et les voies excrétrices sont anatomiquement normaux, mais il n’est pas rare de retrouver une anomalie de la jonction pyélo-urétérale, une ectopie rénale ou une anomalie de fusion.
|
Les anomalies de fusion (symphyses rénales)
Vers la 8
e
semaine du développement embryonnaire, les reins migrent en position lombaire et subissent une rotation. Pendant cette phase, les blastèmes métanéphriques
1
sont très proches dans l’espace et une anomalie survenant à ce stade peut entraîner une absence de séparation et créer ainsi un isthme parenchymateux ou fibreux entre les deux reins
(
Figure 1
)
. L’anomalie de fusion la plus fréquente est le rein en fer à cheval. Son incidence est de 1/600 à 1/500 naissances. Les reins sont fusionnés sur la ligne médiane en avant du rachis, le plus souvent par leurs pôles inférieurs. L’isthme est situé en dessous de l’artère mésentérique inférieure, ce qui empêche la migration caudale complète des reins. Les reins en fer à cheval sont donc situés plus bas que les reins normaux. Les uretères ont un trajet antérieur à l’isthme et ne sont pas malformés
(
Figure 5
)
. Il est conseillé de réaliser une cystographie rétrograde à la recherche d’un reflux vésico-urétéral, qui est présent dans 50 % des cas. Dans 90 % des cas, les reins en fer à cheval sont asymptomatiques, les 10 % restants peuvent se compliquer d’infections urinaires secondaires à un reflux, d’hématurie (sang dans l’urine) ou de douleurs abdominales classiquement lors de l’hyper extension du rachis. L’augmentation de la fréquence de tumeurs rénales (ou tumeurs de Wilms) reste très controversée. Cette anomalie est souvent isolée, mais elle peut s’intégrer dans un syndrome polymalformatif ou dans le cadre d’anomalies chromosomiques (chromosome X avec le syndrome de Turner, trisomie 18). D’autres anomalies de fusion sont possibles, comme le rein discoïde (fusion en galette des deux reins par leurs deux pôles, réalisant ainsi une masse parenchymateuse pelvienne, les deux voies excrétrices restant cependant séparées) ou la fusion hilaire (fusion parenchymateuse et des bassinets qui peut être partielle ou complète, donnant naissance à un uretère unique)
(
Figure 4
)
. Cette malformation est fréquemment associée à des anomalies génitales.
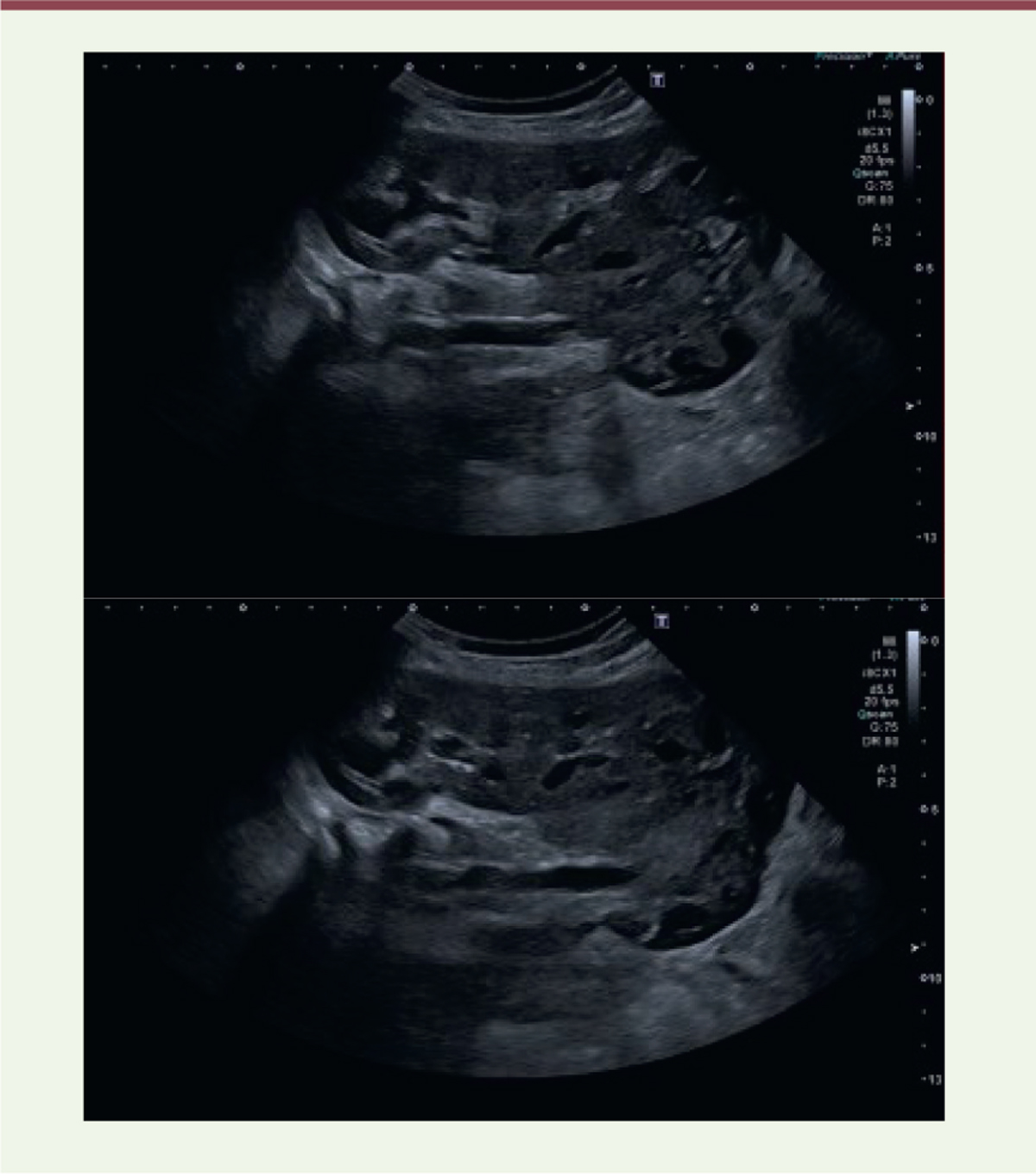
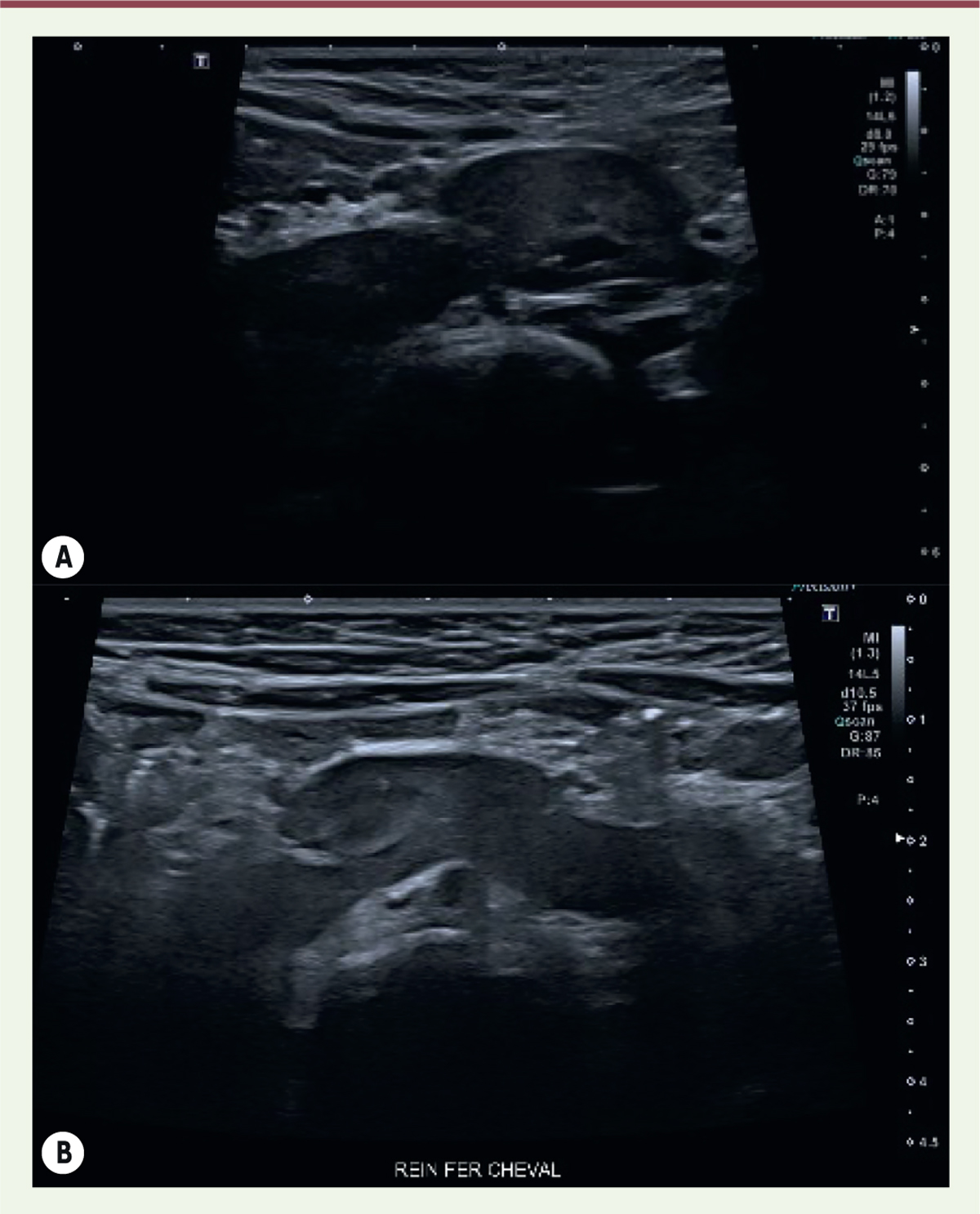
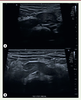 | Figure 5.
Anomalie de fusion ; rein en fer à cheval. A.
Aspect échographique de rein en fer à cheval avec position basse de l’élément droit situé en position pelvienne médiane chez un enfant de deux ans. Aspect discrètement asymétrique de la taille des reins, sans dilatation pyélocalicielle.
B..
Échographie chez un enfant de dix mois retrouvant des reins en fer à cheval reliés par un pont parenchymateux sur la ligne médiane pré-vertébrale (© crédit photo P. Petit. Service de radiologie pédiatrique. AP-HM Timone Enfants, Marseille).
|
|
L’hypoplasie rénale est une malformation congénitale fréquente, avec une incidence de 1/1 000 naissances. Elle correspond à une réduction du nombre de néphrons, le parenchyme rénal étant qualitativement normal. Au niveau embryologique, elle résulte de l’arrêt du développement du blastème métanéphrique dont l’induction par le bourgeon urétéral s’arrêterait entre la 14
e
et 20
e
semaine de la vie fœtale. Les étiologies de l’hypoplasie rénale restent encore discutées, mais les anomalies génétiques jouent un rôle important. Le diagnostic n’est pas toujours aisé en anténatal, car la réduction du volume rénal est difficile à détecter à l’échographie fœtale, surtout si l’hypoplasie est bilatérale en raison de la persistance d’une symétrie entre les deux reins. Le diagnostic peut se faire aussi pendant l’enfance, fortuitement sur une échographie. Lors du diagnostic, il est indispensable d’éliminer un petit rein atrophique secondaire à une affection acquise (comme une pyélonéphrite aiguë
7
). Classiquement, on distingue deux formes d’hypoplasie rénale :
-
L’hypoplasie oligo-méga-néphronique congénitale bilatérale, qui se caractérise par une réduction du nombre de néphrons et une augmentation de leur taille, notamment au dépend des glomérules. L’évolution est marquée par une phase initiale d’hyper-filtration glomérulaire puis d’un déclin de la filtration glomérulaire et une insuffisance rénale chronique secondaire à une glomérulo-sclérose des néphrons restants.
-
L’hypoplasie rénale simple, marquée par un rein présentant une taille réduite en raison d’une diminution du nombre de néphrons, mais avec un parenchyme rénal fonctionnel. L’atteinte est le plus souvent unilatérale et la fonction rénale reste normale, surtout si le rein controlatéral est intact. On retrouvera alors une hypertrophie compensatrice du rein controlatéral. Une cystographie rétrograde pourra être réalisée à la recherche d’un reflux vésico-urétéral qui lui est souvent associé. C’est dans ce contexte que l’on peut retrouver des lésions d’hypoplasie segmentaire (rein d’Ask-Upmark) et que la part primitive ou secondaire de l’hypoplasie devient problématique. Une surveillance à long terme est conseillée car le risque d’apparition d’une protéinurie, d’une hypertension artérielle ou d’une diminution du débit de filtration glomérulaire n’est pas nul.
|
La dysplasie rénale désigne les anomalies de l’architecture du tissu rénal. Dysplasie rénale et hypoplasie rénale sont souvent associées : on parle alors d’hypo-dysplasie rénale.
La dysplasie multikystique rénale (DMKR) est la forme de dysplasie extrême, caractérisée par l’absence complète de néphron. Au cours du développement fœtal, il existe un défaut de pénétration du bourgeon urétéral au centre du blastème métanéphrique associé à une différenciation anormale du tissu néphrogène, aboutissant à la formation de kystes, à une involution de parenchyme rénal et à la constitution de tissu métaplasique et indifférencié
(
Figure 6
)
. Ces anomalies seraient la résultante d’une mauvaise interaction entre les deux structures embryonnaires, mais l’hypothèse d’une obstruction des voies urinaires au niveau de la jonction pyélo-urétérale, ayant pour conséquence une hyperpression rénale entraînant une formation de kystes, ne peut pas être totalement exclue. Au niveau histologique, on trouve la présence de tubes primitifs médullaires et des îlots de cartilages métaplasiques. L’atteinte peut-être corticale ou médullaire, totale ou segmentaire. Il faut différencier la DMKR congénitale des autres formes de dysplasie rénale secondaires à une uropathie obstructive sévère, comme les valves de l’urètre postérieur.
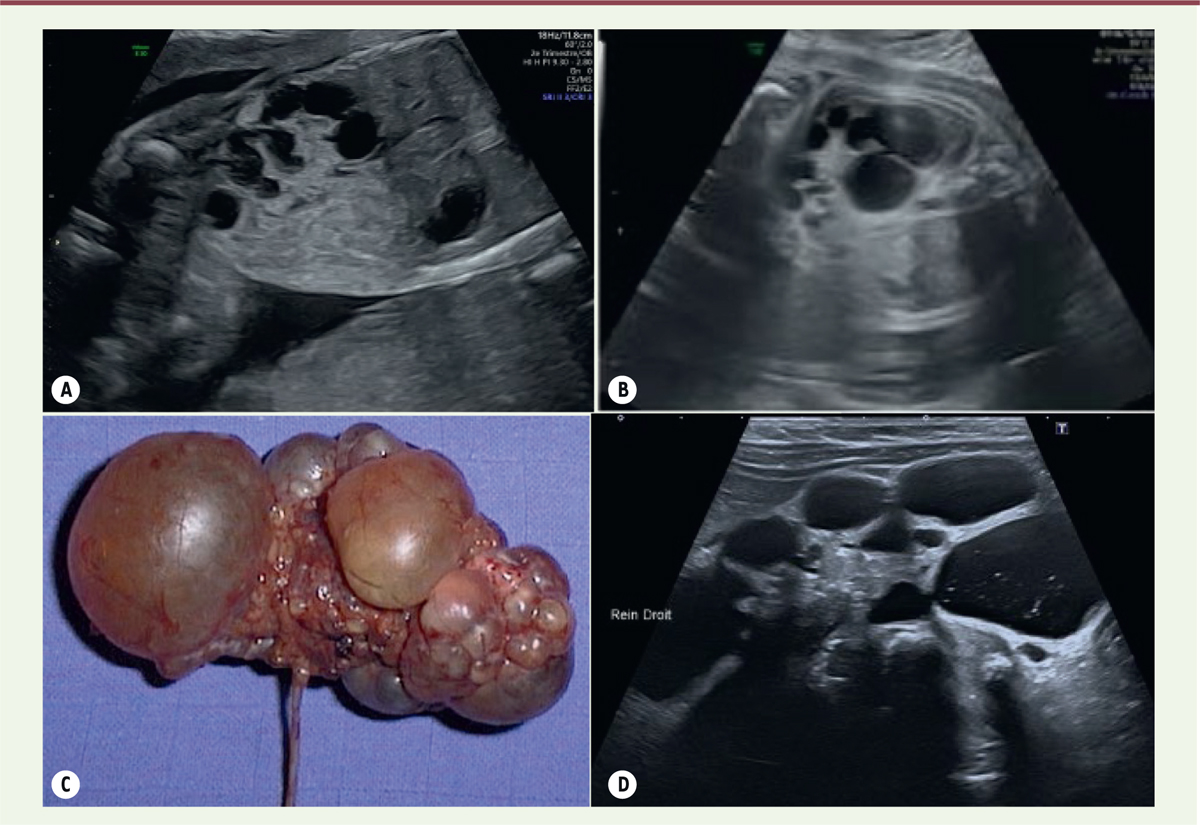
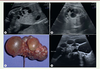 | Figure 6.
Dysplasie multikystique rénale (DMKR). A et B.
Aspect échographique anténatal d’une DMKR (crédit photo P. Petit. Service de radiologie pédiatrique. AP-HM Timone Enfants, Marseille).
C.
Aspect histologique d’une DMKR (crédit photo B. Fremond, clinique chirurgicale infantile, CHU de Rennes, Uropathies malformatives).
D.
Échographie post-natale d’une DMKR montrant des images kystiques liquidiennes non communicantes séparées par des lames tissulaires échogènes fibreuses, sans parenchyme rénal reconnaissable (© crédit photo P. Petit. Service de radiologie pédiatrique. AP-HM Timone Enfants, Marseille).
|
La DMKR congénitale est le plus souvent unilatérale avec un rein controlatéral normal. Elle est fréquente : son incidence est de 1/5 000 naissances. Dans les cas les plus graves, si l’anomalie est bilatérale avec une atteinte majeure du parenchyme rénal, une interruption thérapeutique de grossesse pourra être proposée. La DMKR est fréquemment révélée par l’échographie fœtale qui retrouve, dans la région lombaire, des images kystiques liquidiennes non communicantes (séparées par des lames tissulaires échogènes fibreuses), sans parenchyme rénal reconnaissable. L’uretère est atrétique et les vaisseaux sont grêles. Il existe le plus souvent une hypertrophie compensatrice du rein controlatéral. À la naissance, le diagnostic doit être confirmé par une échographie rénale
(
Figure 6
)
. On pourra compléter les explorations par une scintigraphie rénale au DMSA (acide dimercaptosuccinique), où l’on retrouve une absence de fixation du traceur. La DMKR peut aussi être révélée dans l’enfance de manière fortuite lors d’une échographie abdominale. Dans la plupart des cas, l’évolution de la DMKR se fait spontanément vers l’involution des kystes dans les trois premières années de la vie et une hypertrophie du rein controlatéral. Il n’y a pas de risque de dégénérescence du tissu métaplasique. Dans de rares cas, la taille des kystes augmente et une néphrectomie pourra être discutée en cas de complications (compression, douleur). Il faudra mettre en place des mesures de néphro-protection et une surveillance au long court (mesure de la pression artérielle et dépistage d’une protéinurie, étude de la fonction rénale, croissance rénale du rein controlatéral) pour s’assurer de l’absence de complications. Dans 10 à 15 % des cas, il existe des anomalies du rein controlatéral et des voies urinaires (hypo ou dysplasie rénale, anomalies de position ou de fusion, reflux vésico-urétéral, anomalies urétérales) ou extra-rénale (malformations génitales principalement, cardiaques ou digestives) lorsqu’elles s’intègrent dans un syndrome poly-malformatif.
|
Formes syndromiques d’hypo-dysplasie rénale
Une contribution importante des gènes du développement rénal dans l’apparition des hypo-dysplasies est reconnue depuis de nombreuses années. Des atteintes extra-rénales variées sont associées à l’atteinte rénale. On peut citer le gène
PAX2
(
paired box 2
), responsable du syndrome rein-colobome (hypo-dysplasie rénale associée à un colobome du nerf optique ou une dysplasie papillaire), le gène
EYA1
(
EYA transcriptional coactivator and phosphatase 1
), responsable du syndrome branchio-oto-rénal (hypo-dysplasie rénale associée à une malformation de l’oreille interne responsable d’une surdité, de l’oreille moyenne et externe et des anomalies de fermeture des arcs branchiaux) ou encore le gène
SALL1
(
spalt-like transcription factor 1
), responsable du syndrome de Townes-Brocks (hypo-dysplasie rénale associée à une polydactylie, une imperforation anale et des anomalies de l’oreille externe). Un autre exemple est le gène
TCF2
(
transcription factor-2
ou
HNF1B
pour
hepatocyte nuclear factor-1-beta
), qui est impliqué dans le syndrome reins kystiques-diabète. Le phénotype rénal est variable : hypo-dysplasie rénale, agénésie rénale, kystes, etc. Le diagnostic peut se faire en anténatal devant la découverte de reins hyper échogènes. Les atteintes extra-rénales associées sont principalement un diabète monogénique de type MODY5 (
maturity-onset diabetes of the young type 5
), une hyper-uricémie, une hypo-magnésémie, une augmentation des transaminases, une insuffisance pancréatique exocrine et des anomalies génitales. Des anomalies neurocognitives variables sont décrites. Une liste non exhaustive des gènes impliqués dans les hypo-dysplasies et agénésies rénales est détaillée dans le
Tableau I
. Par ailleurs, ces anomalies rénales peuvent s’intégrer dans des syndromes poly-malfomatifs dans le cadre de désordre chromosomiques
(
Tableau II
)
. Enfin, l’existence de cas familiaux d’hypo-dysplasie isolée suggère une origine génétique dans certains cas d’hypo-dysplasie rénale non syndromiques. La prise en charge anténatale de ces anomalies doit se faire au sein d’un centre pluridisciplinaire de diagnostic prénatal. Il est important de rappeler que d’autres étiologies des anomalies rénales existent comme une néphropathie congénitale obstructive ou des modifications du milieu embryonnaire (carence alimentaire maternelle, exposition à des substances tératogènes).
Tableau I.
| Gène |
Syndrome |
Phénotype rénal |
Phénotype extrarénal |
OMIM |
| PAX2 |
Syndrome rein-colobome |
Hypodysplasie rénale, RVU, JPU |
Colobome, hypoacousie |
167409 |
|
| EYA1 (SIX1, SIX5) |
Syndrome branchio-oto-rénal |
Hypodysplasie rénale, agénésie rénale, anomalies des voies urinaires |
Anomalies de l’oreille externe, surdité, anomalies des arcs branchiaux |
113650 (608389,610896) |
|
| SALL1 |
Syndrome de Townes-Brocks |
Hypodysplasie rénale, agénésie rénale, anomalies des voies urinaires |
Imperforation anale, anomalies de l’oreille externe et des pouces, surdité |
602218 |
|
| TCF2/HNF1B |
Syndrome des reins kystiques et diabète |
Hypodysplasie rénale, kystes rénaux |
Diabète, malformations génitales, hyperuricémie, hypomagnésémie, cytolyse hépatique, anomalies neurocognitives |
137920 |
|
| KAL1 |
Syndrome de Kallmann |
Agénésie rénale, dysplasie rénale |
Anosmie, insuffisance gonadotrope |
308700 |
|
| WNT4 |
Syndrome de Rokitansky |
Agénésie rénale |
Aplasie de l’utérus et du vagin, malformations vertébrales |
277000 |
|
| GATA3 |
Syndrome HDR (syndrome de Barakat) |
Hypodysplasie rénale, agénésie rénale, rein kystique, RVU |
Hypoparathyroidie, surdité neurosensorielle |
14255 |
|
| GREB1L |
|
Agénésie rénale, hypodysplasie rénale, anomalies des voies urinaires |
Malformations utérines, squelettiques et des oreilles |
617805 |
|
| PBX1 |
|
Hypoplasie rénale, anomalies des voies urinaires |
Anomalies des oreilles et des yeux, surdité, retard de croisance et de développement |
176310 |
|
| CREBBP |
Syndrome de Rubinstein-Taybi |
Agénésie rénale, RVU |
Dysmorphie faciale, retard de croissance et de développement, anomalies des extrémités |
600140 |
|
| PEX1 |
Syndrome de Zellweger |
Dysplasie rénale, kystes rénaux |
Atteinte hépatique, du système nerveux central, ophtalmologique et surdité, anomalies craniofaciales |
214100 |
|
| NIPBL |
Syndrome de cornelia de Lange |
Dysplasie rénale |
Dysmorphie faciale, RCIU, anomalies des extrémités, malformations cardiaques |
122470 |
Exemples de gènes impliqués dans les hypo-dysplasies et agénésies rénales
(liste non exhaustive de gènes et syndromes).
|
Tableau II.
| Anomalie chromosomique |
Syndrome |
Phénotype rénal |
Phénotype extrarénal |
| Trisomie 13 |
Syndrome de Patau |
Agénésie rénale |
Holoprosencéphalie, fente labiale, polydactylie, omphalocèle |
|
| Délétion 17g13 |
Syndrome de Miller-Dieker |
Agénésie rénale |
Lissencéphalie, agyrie, dysmorphie faciale |
|
| Trisomie 21 |
Syndrome de Down |
Agénésie rénale |
Dysmorphie faciale, malformations cardiaques, clinodactylie |
|
| Trisomie 18 |
Syndrome d’Edwards |
Agénésie rénale |
RCIU, dolichocéphalie, dysmorphie faciale, anomalies des membres, malformations cardiaques |
|
| 45, X |
Syndrome de Turner |
Agénésie rénale, hypoplasie rénale, anomalies des voies urinaires |
Petite taille, dysgénésie ovarienne, ptérygium colli, malformations cardiaques |
|
| Délétion 22011 |
Syndrome velo-cardio-facial |
Agénésie rénale, hypoplasie rénale |
Dysmorphie faciale, malformations cardiaques, hypoparathyroïdie, hypoplasie thymique |
Exemples d’anomalies chromosomiques impliquées dans les hypo-dysplasies et agénésies rénales. |
|
Les anomalies du développement rénal sont des anomalies fréquentes. Le diagnostic de ces maladies se fait le plus souvent en anténatal sur l’échographie fœtale, ou plus tardivement dans l’enfance de manière fortuite, puisque la plupart d’entre elles restent asymptomatiques. La présence d’atteintes extra-rénales ou d’atteinte de la fonction rénale en modifie le pronostic. L’examen paraclinique de choix dans la surveillance de ces maladies est l’échographie rénale. La prise en charge et le suivi spécialisé des patients sont nécessaires afin de prévenir les séquelles rénales. La recherche d’une étiologie génétique est essentielle dans le bilan de ces malformations. Dans les cas les plus sévères, une approche pluridisciplinaire (généticiens, obstétriciens, néphrologues et urologues pédiatre, néonatologues, radiologues) dans un centre pluridisciplinaire de diagnostic prénatal doit être proposée. |
L’auteure déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Woolf
AS
,
Winyard
PJ
.
Molecular mechanisms of human embryogenesis : developmental pathogenesis of renal tract malformations.
.
Pediatr Dev Pathol.
2002;
;
5
:
:108.
–
129
.
2.
Bruézière
J
,
Lasfargues
G
,
Allouch
G
,
Bensman
A
.
Uropathies malformatives. Encycl Méd Chir.
;
Paris:
.
EMC-Pédiatrie;
, 4083 D10,
:3.
–
1980
.
3.
Dursun
H
,
Bayazit
AK
,
Buyukcelik
M
et al.
Associated anomalies in children with congenital solitary functioning kidney.
.
Pediatr Surg Int.
2005;
;
21
:
:456.
–
459
.
4.
Krzemien
G
,
Roszkowska-Blaim
M
,
Kostro
I
,
et al.
Urological anomalies in children with renal agenesis or multicystic dysplastic kidney.
.
J Appl Genet.
2006;
;
47
:
:171.
–
176
.
5.
Guarino
N
,
Tadini
B
,
Camardi
P
,
et al.
The incidence of associated urological abnormalities in children with renal ectopia.
.
J Urol.
2004;
;
172
:
:1757.
–
9
;
discussion 9.
.
6.
Woolf
AS
.
Unilateral multicystic dysplastic kidney.
.
Kidney Int.
2006;
;
69
:
:190.
–
193
.
7.
Merrot
T
,
Lumenta
DB
,
Tercier
S
,
et al.
Multicystic dysplastic kidney with ipsilateral abnormalities of genitourinary tract : experience in children.
.
Urology.
2006;
;
67
:
:603.
–
607
.
8.
Siqueira Rabelo
EA
,
Oliveira
EA
,
Silva
JM
,
et al.
Ultrasound progression of prenatally detected multicystic dysplastic kidney.
.
Urology.
2006;
;
68
:
:1098.
–
1102
.
9.
Aslam
M
,
Watson
AR
.
Unilateral multicystic dysplastic kidney: Long term outcomes.
.
Arch Dis Child.
2006;
;
91
:
:820.
–
823
.
10.
Rabelo
EA
,
Oliveira
EA
,
Silva
JM
,
et al.
Conservative management of multicystic dysplastic kidney : clinical course and ultrasound outcome.
.
J Pediatr (Rio J).
2005;
;
81
:
:400.
–
404
.
11.
Onal
B
,
Kogan
BA
.
Natural history of patients with multicystic dysplastic kidney-what followup is needed?
.
J Urol.
2006;
;
176
:
:1607.
–
1611
.
12.
Ulinski
T
,
Lescure
S
,
Beaufils
S
,
et al.
Renal phenotypes related to hepatocyte nuclear factor-1beta (TCF2) mutations in a pediatric cohort.
.
J Am Soc Nephrol.
2006;
;
17
:
:497.
–
503
.
13.
Chaumoitre
K
,
Brun
M
,
Cassart
M
,
et al.
Differential diagnosis of fetal hyperechogenic cystic kidneys unrelated to renal tract anomalies : A multicenter study.
.
Ultrasound Obstet Gynecol.
2006;
;
28
:
:911.
–
917
.
14.
Sanna-Cherchi
S
,
Caridi
G
,
Weng
PL
,
et al.
Genetic approaches to human renal agenesis/hypoplasia and dysplasia.
.
Pediatric nephrology (Berlin).
2007;
;
22
:
:1675.
–
1684
.
15.
Decrame
S
,
Parant
O
,
Beaufils
S
,
et al.
Anomalies of the TCF2 gene are the main cause of fetal bilateral hyperechogenic kidneys.
.
J Am Soc Nephrol.
2007;
;
18
:
:923.
–
933
.
16.
Heidet
L
,
Decramer
S
,
Pawtowski
A
,
et al.
Spectrum of HNF1 mutations in a large cohort of patient who harbor renal diseases.
.
Clin J Am Soc Nephrol.
2010;
;
5
:
:1079.
–
1090
.
17.
Sanna-Cherchi
S
,
Caridi
G
,
Weng
PL
,
et al.
Genetic approaches to human renal agenesis/hypoplasia and dysplasia.
.
Pediatr Nephrol.
2007;
;
22
:
:1675.
–
1684
.
18.
Weber
S
,
Morinière
V
,
Knuppel
T
,
et al.
Prevalence of mutations in renal developmental genes in children with renal hypodysplasia : result of the ESCAPE study.
.
J Am Soc Nephrol.
2006;
;
17
:
:2864.
–
2870
.
19.
Abdelhak
S
,
Kalatzis
V
,
Heilig
R
,
et al.
A human homologue of the drosophila eyes absent gene underlies branchio-oto-renal (BOR) syndrome and identifies a novel gene family.
.
Nat Genet.
1997;
;
15
:
:157.
–
164
.
20.
Ruf
RG
,
Xu
PX
,
Silvius
D
,
et al.
SIX1 mutations cause branchio-oto-renal syndrome by disruption of EYA1-SIX1-DNA complexes.
.
Proc Natl Acad Sci USA.
2004;
;
101
:
:8090.
–
8095
.
21.
Kohlhase
J
,
Wischermann
A
,
Reichenbach
H
,
et al.
Mutations in the SALL1 putative transcription factor gene cause Townes-Brocks syndrome.
.
Nat Genet.
1998;
;
18
:
:81.
–
83
.
22.
Bingham
C
,
Bulman
MP
,
Ellard
S
,
et al.
Mutations in the hepatocyte nuclear factor-1beta gene are associated with familial hypoplastic glomerulocystic kidney disease.
.
Am J Hum Genet.
2001;
;
68
:
:219.
–
224
.
23.
Kerecuk
L
,
Sajoo
A
,
McGregor
L
,
et al.
Autosomal dominant inheritance of non-syndromic renal hypoplasia and dysplasia : dramatic variation in clinical severity in a single kindred.
.
Nephrol Dial Transplant.
2007;
;
22
:
:259.
–
263
.
|