| |
| Med Sci (Paris). 39(3): 209–218. doi: 10.1051/medsci/2023027.Épidémiologie des maladies rénales chroniques en pédiatrie Jérôme Harambat1* and Denis Morin2** 1Département de pédiatrie, Centre de référence maladies rénales rares du Sud-Ouest (SORARE), filière de santé ORKiD, CHU de Bordeaux
,
Bordeaux
,
France 2Département de pédiatrie, Centre de référence maladies rénales rares du Sud-Ouest (SORARE), filière de santé ORKiD, CHU de Montpellier
,
Montpellier
,
France |
Vignette (© iStock).
La maladie rénale chronique (MRC) représente un problème majeur de santé publique. Chez l’adulte, on constate une augmentation régulière de la mortalité et de la morbidité mondiales liées à la MRC (
global burden of disease study
) [
1
].
Si la population adulte a fait l’objet de recherches approfondies, les données épidémiologiques concernant la MRC de l’enfant restent limitées [
2
]. Malgré les progrès techniques et scientifiques qui ont permis une amélioration substantielle de la prise en charge des enfants présentant une MRC au cours des trente dernières années, certains évoluent vers une insuffisance rénale terminale (IRT) et nécessitent alors un traitement de suppléance rénale. L’IRT a des conséquences potentiellement sévères pour les enfants. Elle est responsable d’une mortalité et d’une morbidité considérables [
3
], mais aussi de problèmes plus spécifiques, tels que des troubles de la croissance et des difficultés psychosociales et éducatives, qui ont tous un impact significatif sur la qualité de vie des patients. La connaissance de l’épidémiologie de la MRC chez l’enfant est essentielle pour poser un diagnostic précis et précoce de la maladie, identifier les causes évitables ou réversibles, prédire le devenir de la maladie et faciliter les conseils aux patients et à leurs familles.
|
La maladie rénale chronique
L’une des raisons de la rareté des données épidémiologiques sur la maladie rénale chronique (MRC) de l’enfant est l’absence historique d’une définition consensuelle. Par exemple, le projet ItalKid et la cohorte
North American Pediatric Renal Trials and Collaborative Studies
(NAPRTCS) ont défini la MRC pédiatrique comme un débit de filtration glomérulaire (DFG) inférieur à 75 ml/min/1,73 m² [
4
,
5
]. Dans d’autres études, la définition a été fondée non sur ce DFG mais sur les valeurs de créatinine plasmatique ou sur d’autres seuils de DFG [
6
,
7
].
En 2002, la
Kidney Disease Outcomes Quality Initiative
(NKF-K/DOQI) de la
National Kidney Foundation
a publié une classification applicable aux enfants. La MRC y est définie par la présence, depuis plus de trois mois, de marqueurs d’atteinte rénale, qui peuvent être des anomalies morphologiques (à l’échographie ou à d’autres examens), des anomalies histologiques (à la biopsie rénale), des anomalies biologiques (protéinurie, hématurie, leucocyturie), ou encore un DFG inférieur à 60 ml/min/1,73 m² [
8
].
La classification K/DOQI identifie cinq stades de MRC, allant d’une atteinte minime (MRC stade 1) à l’IRT (MRC stade 5). Cette classification a été révisée en 2012 par le groupe
Kidney Disease : Improving Global Outcomes
(KDIGO) [
9
] ; la MRC est désormais classée en stades de gravité croissante en fonction du niveau de DFG et de protéinurie. Cette définition ne s’applique cependant pas aux enfants de moins de deux ans dont le DFG physiologique est inférieur à celui des enfants plus âgés et à celui des adultes. Il n’existe pas de classification pour cette catégorie d’âge (moins de deux ans) pour laquelle la MRC est définie par rapport à des valeurs de créatinine normales pour l’âge, exprimées en écart-type. Une formule d’estimation du DFG (DFGe), l’équation de Schwartz révisée
1
, a été développée et largement adoptée dans la pratique clinique en pédiatrie après sa publication en 2009 [
10
].
|
Étiologie de la maladie rénale chronique chez l’enfant
Les étiologies de la MRC chez l’enfant sont très différentes de celles des adultes, chez lesquels les principales causes sont le diabète et l’hypertension. Les anomalies congénitales du rein et des voies urinaires (CAKUT), correspondant principalement à l’hypodysplasie rénale et aux uropathies obstructives, représentent 50 à 60 % des causes de MRC de l’enfant [
2
]. Les autres principales causes sont les néphropathies glomérulaires (5 à 15 %) et les maladies rénales héréditaires (10 à 20 %). Des études de registres d’Italie, de Belgique, de Serbie, du Japon, du Royaume-Uni ou de cohortes aux États-Unis (NAPRTCS, CKiD), rapportent une distribution globalement similaire des causes de MRC pédiatrique dans les pays à haut niveau de revenu [
4
,
11
-
15
]
(
Tableau I
)
. Si les CAKUT prédominent chez les nourrissons et les jeunes enfants, les néphropathies glomérulaires sont les principales causes de MRC chez les enfants de plus de 12 ans et chez les adolescents. Les causes de MRC varient également en fonction de l’origine ethnique. Par exemple, le syndrome néphrotique corticorésistant, dû à une hyalinose segmentaire et focale, est trois fois plus fréquent chez les Afro-Américains que chez les Caucasiens (19 % contre 6 % selon l’étude NAPRTCS faite aux États-Unis [
16
]). Il existe généralement une prédominance masculine dans la MRC de l’enfant (
sex-ratio
garçons/filles de 1,3 à 3 selon les études), ce qui reflète notamment la plus grande proportion de garçons parmi les patients présentant des CAKUT [
2
].
Tableau I.
|
|
Causes de MRC |
|
|
|
|
|
|
|
| Étude ou pays |
NAPRTCS |
Italie |
|
Belgique |
Nigeria |
Serbie |
Turquie |
Royaume-Uni |
Japon |
|
| Référence |
[
16
]
|
[
5
]
|
|
[
12
]
|
[
18
]
|
[
11
]
|
[
17
]
|
[
14
]
|
[
15
]
|
|
| Population |
MRC 2-5
(DFG < 75) |
MRC 2-5
(DFG < 75) |
MRC 3-5
(DFG < 60) |
|
MRC 3-5 |
MRC 2-5
(DFG < 90) |
MRC 2-5
(DFG < 75) |
MRC 3-5
(DFG < 60) |
MRC 3-5 |
|
| Âge (années) |
0-20 |
0-19 |
0-19 |
|
0-16 |
0-18 |
0-18 |
0-17 |
0-15 |
|
| Patients |
Cohorte 1994-2007 |
Incidents
1990-2000 |
Incidents
2001-2005 |
|
Incidents
2007-2012 |
Incidents
2000-2009 |
Incidents
2005 |
Incidents
2005-2009 |
Prévalents
2010 |
|
| Nombre |
7 037 |
1 197 |
143 |
|
98 |
336 |
282 |
288 |
447 |
|
| Étiologie |
|
|
|
|
|
|
|
|
|
| CAKUT |
3 361 (48 %) |
689 (58 %) |
84 (59 %) |
|
19 (19 %) |
160 (58 %) |
163 (58 %) |
170 (59 %) |
278 (62 %) |
|
| Hypodysplasie ± néphropathie de reflux |
1 907 |
516 |
66 |
|
|
|
120 |
127 |
218 |
|
| Glomérulopathie |
993 (14 %) |
55 (5 %) |
10 (7 %) |
|
56 (57 %) |
40 (12 %) |
41 (15 %) |
36 (13 %) |
21 (5 %) |
|
| SHU |
141 (2 %) |
43 (4 %) |
9 (6 %) |
|
0 |
|
5 (2 %) |
10 (3 %) |
4 (1 %) |
|
| Néphropathie héréditaire |
717 (10 %) |
186 (15 %) |
27 (19 %) |
|
0 |
49 (15 %) |
49 (17 %) |
40 (14 %) |
62 (14 %) |
|
| SN congénital |
75 |
13 |
5 |
|
0 |
|
|
4 |
3 |
|
| Maladie métabolique |
|
|
5 |
|
0 |
|
14 |
16 |
|
|
| Cystinose |
104 |
22 |
2 |
|
0 |
|
4 |
11 |
1 |
|
| Néphropathie kystique |
368 (5 %) |
101 (8 %) |
13 (9 %) |
|
0 |
|
35 (12 %) |
16 (6 %) |
39 (9 %) |
|
| IRA ischémique |
158 (2 %) |
49 (4 %) |
3 (2 %) |
|
0 |
|
|
12 (4 %) |
40 (9 %) |
|
| Divers |
1 485 (21 %) |
122 (10 %) |
10 (7 %) |
|
14 (14 %) |
48 (14 %) |
|
13 (5 %) |
37 (8 %) |
|
| Manquant/inconnue |
182 (3 %) |
40 (3 %) |
|
|
8 (8,2 %) |
6 (2 %) |
22 (8 %) |
7 (2 %) |
5 (1 %) |
Sélection d’études sur les causes de la maladie rénale chronique chez l’enfant.
MRC : maladie rénale chronique ; DFG : débit de filtration glomérulaire (ml/min/1,73 m²) ; CAKUT :
congenital anomalies of the kidney and urinary tract
; IRA : insuffisance rénale aiguë ; SN : syndrome néphrotique ; SHU : syndrome hémolytique et urémique.
|
En raison de l’absence de registres et de cohortes multicentriques dans les pays à faible revenu ou à revenu intermédiaire, l’estimation des causes de MRC pédiatriques y est souvent difficile et repose habituellement sur des études ou des enquêtes d’un seul centre de référence. En Turquie et au Moyen-Orient, les CAKUT sont les principales causes de MRC (50 à 60 %), avec une prédominance des uropathies sur les hypodysplasies, suivies des maladies rénales héréditaires (20 à 30 %) [
7
,
17
]. Cela suggère un possible retard dans le diagnostic et la prise en charge des uropathies. La proportion de maladies héréditaires peut, par ailleurs, refléter un taux de consanguinité plus élevé dans ces pays qu’en Europe ou en Amérique du Nord. À l’inverse, les maladies glomérulaires seraient la cause la plus fréquente de MRC (30 à 60 %) dans diverses régions du monde comme l’Inde, l’Asie du Sud-Est, l’Afrique subsaharienne et l’Amérique latine [
18
]. Cette prévalence peut être liée à la fréquence des infections bactériennes, virales ou parasitaires affectant le rein dans les pays en développement, à l’absence d’outils diagnostiques précis, dont l’imagerie, la biopsie rénale et les tests génétiques, et à une répartition différente de l’âge des patients dans ces études (avec plus d’adolescents).
Au stade d’IRT, la proportion de CAKUT est plus faible et la proportion de maladies glomérulaires est plus élevée qu’aux stades précoces de MRC. Ceci s’explique par des profils de progression différents de la MRC selon une origine glomérulaire ou non glomérulaire [
19
]. Les proportions de CAKUT et de maladies glomérulaires sont chacune de l’ordre de 25 à 35 % au stade d’IRT. Il existe également des spécificités régionales. Par exemple, le syndrome néphrotique congénital de type finlandais est une maladie rare, mais est la principale cause d’IRT pédiatrique en Finlande, ce qui explique la prévalence élevée de l’IRT dans ce pays. Ailleurs, la néphropathie méso-américaine, classée dans les MRC de cause indéterminée, désigne une maladie rénale qui se manifeste chez des adolescents et les jeunes adultes, principalement des travailleurs agricoles, et survenant essentiellement en Amérique centrale, en Inde et au Sri Lanka [
20
].
|
Incidence et prévalence de la maladie rénale chronique chez les enfants Les stades 2 à 5 de la MRC Les données épidémiologiques concernant les stades 2 à 5 de MRC sont rares chez les enfants et reposent principalement sur les registres de traitement de suppléances (MRC stades 5D [dialyse] et 5T [transplantation]). La MRC étant le plus souvent initialement asymptomatique, il est difficile d’obtenir des données fiables sur les premiers stades de la MRC pédiatrique, de sorte que l’incidence et la prévalence sont certainement sous-estimées. Bien que des registres et des cohortes pédiatriques utilisant les classifications K/DOQI ou KDIGO commencent à apparaître, seul un faible nombre d’études sur l’épidémiologie des stades 2 à 5 de MRC sont disponibles. En raison du manque de ressources et de registres, l’incidence et la prévalence de la MRC dans les pays à faible revenu sont encore moins bien connues. Pour ces pays, les données proviennent principalement d’études monocentriques, et la validité de ces données est incertaine.
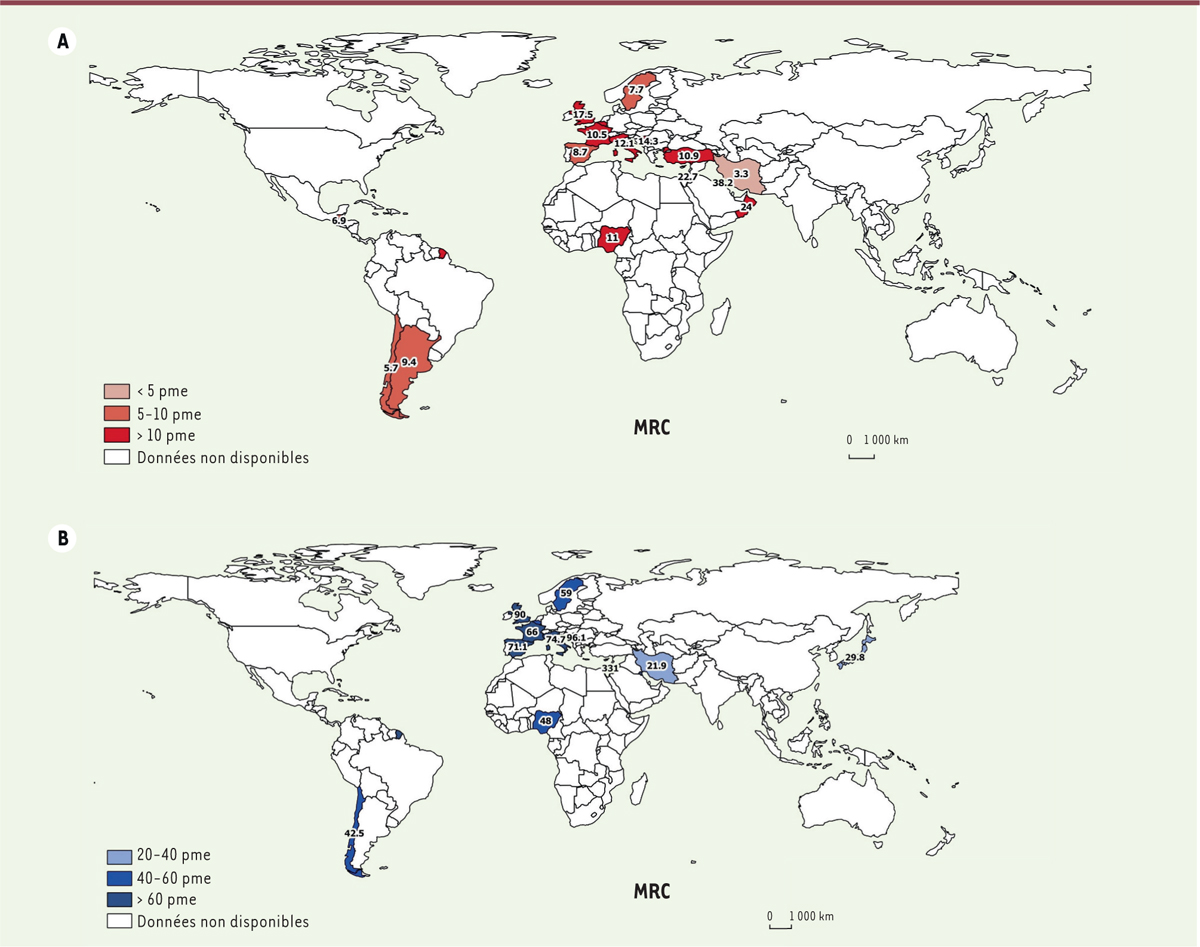
Bien que les critères d’inclusion soient variables, les études épidémiologiques disponibles, dont la plupart sont menées en Europe, estiment l’incidence de la MRC pédiatrique de stades 2 à 5 entre 8 et 17 par million d’enfants du même âge (pme) par an et celle de stades 4 à 5 à environ 8 pme
(
Figure 1A
)
. L’incidence apparaît plus élevée au Royaume-Uni (17,5 pme), mais l’étude qui a permis cette évaluation a été menée en milieu hospitalier, avec une incertitude sur la zone géographique couverte [
14
]. Une incidence de 12 pme a été observée dans une étude turque incluant des enfants ayant un DFG inférieur à 75 ml/min/1,73 m² [
17
]. Au Koweït, une incidence moyenne beaucoup plus élevée, de 38 pme, a été rapportée, entre 1996 et 2003, chez les enfants ayant un DFG inférieur à 50 ml/min/1,73 m² [
7
], ce qui suggère le rôle possible de facteurs génétiques. Dans cette region, le taux d’incidence annuel moyen de MRC de stades 2 à 5, à Oman, était de 24 pme sur une période d’étude de 12 ans [
21
].
Une enquête épidémiologique réalisée en France a rapporté une diminution de l’incidence annuelle moyenne de la MRC stades 4 à 5 de 12,7 à 7,5 pme de 1975-1980 à 1985-1990 [
6
]. Cela pourrait s’expliquer par une amélioration du diagnostic anténatal. Un travail similaire réalisé en Suède sur 16 ans a trouvé une incidence stable de 7,2 pme de 1978-1985 à 1986-1994 [
22
]. Des études en Serbie et au Royaume-Uni ont, quant à elles, suggéré une augmentation de l’incidence sur 10 ans dans les années 2000 [
11
,
14
].
La prévalence de la MRC varie en Europe de 55-60 à 90-95 pme selon les études et la définition utilisée
(
Figure 1B
)
. Une prévalence plus faible de la MRC de stades 3 à 5, d’environ 30 pme, a été rapportée au Japon [
15
]
(
Figure 1B
)
.
Bien qu’en nombre très limité, les études en population chez l’enfant suggèrent une prévalence largement plus élevée de la MRC de stades 2 à 5 non diagnostiquée, de près de 1 % [
23
]. Parmi les adolescents américains âgés de 12 à 18 ans qui ont participé aux enquêtes nationales sur la santé (NHANES), la prévalence d’un DFG inférieur à 60 ml/min/1,73 m² était de 0,3 % en 1988-1994 et de 0,9 % en 2009-2014. La prévalence de l’albuminurie et/ou d’un DFG diminué était de 4 % [
24
].
 | Figure 1.
A. Incidence de la maladie rénale chronique de l’enfant (MRC)
, exprimée par million d’enfants du même âge (pme).
B. Prévalence de la maladie rénale chronique de l’enfant
, exprimée par million d’enfants du même âge (pme). Les âges s’étalent de 0 à 16 ans ou de 0 à 18 ans selon les études.
|
Les stades 5T et 5D de la MRC
Les données épidémiologiques relatives à la MRC pédiatrique de stade 5 (correspondant à une IRT), nécessitant un traitement de suppléance par dialyse (5D) ou par une transplantation rénale (5T), sont généralement plus solides car elles sont fondées sur des registres nationaux ou internationaux. Malheureusement, tous les pays ne disposent pas de tels registres, et tous les registres n’ont pas la même qualité ni la même exhaustivité, et certains ne publient pas de rapports réguliers. En outre, de nombreux pays ne sont pas en mesure de proposer un traitement de suppléance aux patients pédiatriques, de sorte que 80 % des enfants atteints d’IRT et traités vivent en Europe, en Amérique du Nord ou au Japon, tandis que la proportion d’enfants atteints d’IRT ayant accès à un traitement de suppléance dans certains pays en développement reste très faible, voire inexistante [
25
].
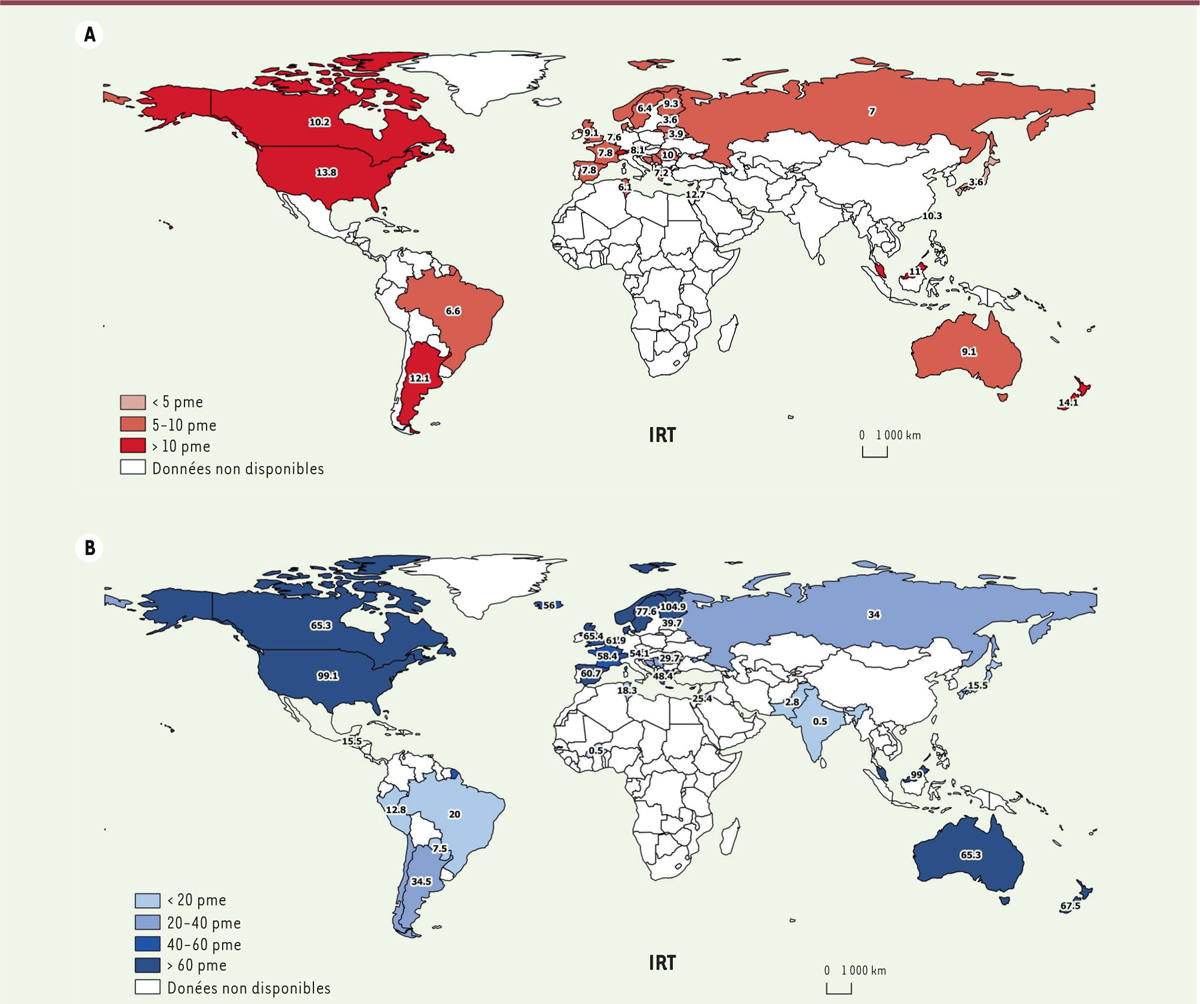
L’incidence des cas d’enfants en situation d’IRT bénéficiant d’un traitement de suppléance varie fortement d’un pays à l’autre mais se situe autour de 5 à 10 nouveaux cas par an chez les patients de moins de 20 ans [
4
]
(
Figure 2A
)
. L’incidence est plus élevée dans certaines régions du monde, notamment aux États-Unis où elle est d’environ 14 pme [
26
]. Il existe des disparités importantes, avec une incidence plus faible dans les pays à faible revenu, comme cela a été montré en Europe [
27
]. Dans ces pays à faible revenu où l’accès au traitement de suppléance n’est possible que pour les populations les plus aisées, l’incidence y est extrêmement faible (moins de 1 pme en Inde ou au Bangladesh, par exemple) [
25
].
 | Figure 2.
A. Incidence de l’IRT (traitement de suppléance rénale) en 2018 par million d’enfants (pme) du même âge
. Données chez les patients pédiatriques âgés de 0 à 19 ans, sauf États-Unis (0-21 ans), Royaume Uni (0-15 ans) et Australie/Nouvelle-Zélande (0-17 ans). Taux d’incidence de 2018, sauf Brésil (2012), Israël (2017), Malaisie (2015), Russie (2017), Taiwan (1998-2009), Tunisie (2017), et États-Unis (2016). Taux d’incidence seulement pour la dialyse en Argentine, Brésil, Israël, Japon, et Singapour.
B. Prévalence de l’IRT (traitement de suppléance rénale) en 2018 par million d’enfants (pme) du même âge.
Données chez les patients pédiatriques âgés de 0 à 19 ans, sauf États-Unis (0-21 ans), Royaume-Uni (0-15 ans) et Australie/Nouvelle-Zélande (0-17 ans). Taux d’incidence de 2018, sauf Brésil (2012), Guatemala (2016), Malaisie (2015), Russie (2017), Tunisie (2017), et États-Unis (2016). Taux de prévalence seulement pour la dialyse en Argentine, Brésil, Guatemala, Japon, et Turquie.
|
Il existe également des différences d’incidence au sein d’un même pays en fonction de l’origine ethnique. Par exemple, les Afro-Américains aux États-Unis, les Aborigènes en Australie, ou les enfants originaires d’Asie du Sud-Est au Royaume-Uni, ont un taux d’incidence plus élevé que les enfants caucasiens [
2
,
26
]. Enfin, l’incidence varie selon l’âge, avec une distribution en forme de U et des incidences standardisées plus élevées chez les enfants de moins de cinq ans et les adolescents. Les registres qui incluent les patients pédiatriques âgés de 0 à 19 ans rapportent, par conséquent, une incidence et une prévalence plus élevées que les registres qui excluent les patients pédiatriques âgés de 15 ans et plus.
Après une augmentation de l’incidence dans les années 1980 et 1990, due aux progrès techniques et à l’inclusion de patients plus jeunes et présentant une maladie la plus complexe dans les programmes pédiatriques de traitement de suppléance, cette incidence est maintenant relativement stable depuis 20 ans. L’incidence des enfants ayant commencé un traitement de suppléance avant l’âge de 15 ans, dans 22 pays européens participant au registre européen ESPN/ERA, est restée stable entre 2007 et 2016, variant entre 5,5 et 6,6 pme [
28
].
La prévalence de l’IRT traitée chez les patients de moins de 20 ans peut varier fortement, de 20 pme au Brésil à environ 100 pme aux États-Unis et en Finlande
(
Figure 2B
)
. En Europe, les chiffres de prévalence sont de l’ordre de 50 à 60 pme dans les pays à revenu élevé et d’environ 40 pme dans les pays à faible revenu
(
Figure 2B
)
.
La prévalence de l’IRT traitée a considérablement augmenté entre les années 1980 et 2000 en raison d’une augmentation de l’incidence, notamment chez les patients les plus jeunes et présentant une maladie plus complexe, et d’une amélioration de la survie des patients. Par exemple, cette prévalence est passée de 23 pme en 1980 à 62 pme en 2000 dans 12 pays d’Europe occidentale, selon un rapport de l’EDTA (
European Dialysis and Transplant Association
) [
29
]. La prévalence a augmenté de 60 à 85 pme aux États-Unis entre 1990 et 2009 [
26
] et de 30 à 50 pme environ en Australie et en Nouvelle-Zélande entre 1970 et 2006 [
30
]. Cette prévalence semble partout relativement stable ou en légère augmentation depuis les années 2000.
|
Modalités de traitement de suppléance rénale
En Europe et aux États-Unis, environ 20 % des patients pédiatriques incidents commencent leur premier traitement de suppléance par une transplantation rénale préemptive. Parmi les autres patients, environ la moitié d’entre eux commencent en dialyse péritonéale (DP) et l’autre moitié en hémodialyse (HD), avec une tendance à la diminution de l’utilisation de la DP au cours du temps, notamment aux États-Unis et au Royaume-Uni [
26
,
28
]. La répartition entre HD et DP est très variable d’un pays à l’autre et d’un centre à l’autre, en fonction des pratiques locales et des politiques de santé [
2
]. Le choix de la modalité de traitement initial dépend également de l’âge, la DP étant le traitement de choix pour les nourrissons et les jeunes enfants, tandis que la proportion d’enfants traités par HD tend à augmenter avec l’âge.
Au cours des dernières années, les régimes d’HD intensives ont suscité de plus en plus d’intérêt, ils comprennent l’HD quotidienne courte, l’hémodialfiltration et l’HD nocturne prolongée. Ces modalités peuvent être réalisées dans un centre ou à domicile, et la possibilité d’effectuer la dialyse à domicile pourrait constituer un bénéfice important pour les enfants et leurs familles. Cependant, les données nord-américaines de l’
US Renal Data System
(USRDS) ont montré que l’HD à domicile ne représente qu’une toute petite proportion des patients âgés de 0 à 17 ans débutant la dialyse. En 2019, le pourcentage d’enfants incidents mis en HD à domicile était inférieur à 0,5 %. Un an après le début de la dialyse, ce pourcentage n’était que de 1 % [
26
]. Le manque de confiance des familles en leur capacité à effectuer le traitement à domicile, la lourdeur du soin pour les parents, les contraintes financières ou socio-économiques, ainsi que les possibilités limitées des équipes soignantes, sont autant d’obstacles au développement de l’HD à domicile.
La transplantation rénale reste le traitement de choix pour les enfants atteints d’IRT. Parmi les patients prévalents, la transplantation rénale est de loin la modalité la plus courante et représente 60 à 80 % des traitements de suppléance dans la plupart des pays industrialisés [
2
]. Pourtant, des disparités majeurs d’accès à la transplantation persistent, du fait notamment de la conjonction de différents facteurs : le statut socio-économique, l’origine ethnique et le sexe. Les aspects socio-culturels jouent également un rôle clé dans les inégalités observées chez les enfants nécessitant un traitement de suppléance. Au Royaume-Uni, les enfants issus des quartiers les plus défavorisés sont moins susceptibles de recevoir une greffe rénale préemptive, ainsi que les enfants d’origine sud-asiatique ou ceux d’origine africaine [
31
]. En France, les enfants issus des zones les plus socialement défavorisées ont un accès réduit à la transplantation préemptive, un moindre recours à la DP, et un démarrage en urgence de la dialyse plus fréquent [
32
]. Aux États-Unis et au Canada, plusieurs études ont révélé que les enfants afro-américains avaient une mortalité plus élevée, un accès plus limité à la transplantation préemptive et une durée d’attente jusqu’à la transplantation après le début de la dialyse plus longue que les enfants blancs.
Les différences entre les pays, notamment en Europe, s’expliquent également par des facteurs tels que le niveau de priorité pédiatrique dans le système d’attribution des organes, le taux de prélèvement de donneurs décédés selon le pays, le taux de transplantation de greffons provenant de donneurs vivants, et le modèle de financement du système de santé [
33
]. Chez près de 7 000 patients de moins de 20 ans ayant initié un traitement de suppléance entre 2007 et 2015 dans 37 pays européens participant au registre ESPN/ERA, la probabilité de recevoir une transplantation rénale à cinq ans était de 49 % dans les pays à faible revenu, de 76 % dans les pays à revenu intermédiaire, et de 92 % dans les pays à revenu élevé, cette variabilité étant fortement associée à des facteurs macroéconomiques [
34
]. Malgré les grandes disparités d’accès à la transplantation, la survie globale du greffon à cinq ans en Europe était de 88 %, avec peu de variations entre les pays [
34
].
|
Dépistage de la maladie rénale chronique chez les enfants
L’objectif du dépistage de la MRC est de prévenir ou de retarder la nécessité d’un traitement de suppléance en permettant un diagnostic précoce et un traitement adapté aux stades les moins avancés de la maladie. Le dépistage peut être effectué en anténatal, avec accès variable à l’interruption médicale de grossesse selon les pays (c’est la cas notamment pour les polykystoses rénales récessives ou certains CAKUT graves), et en post-natal, avec pour objectif la mise en place des mesures de néphroprotection. Les programmes de dépistage de masse de la MRC dans la population pédiatrique (principalement par l’utilisation de bandelettes urinaires) sont toujours en cours dans certains pays asiatiques (Japon, Corée du Sud) mais ont été abandonnés en Europe et aux États-Unis en raison d’un rapport coût-efficacité incertain et d’un bénéfice clinique attendu controversé [
2
].
Les données de dépistage fondées sur le taux de créatinine plasmatique et sur le DFG sont particulièrement limitées dans la population générale pédiatrique. Dans une étude en population réalisée en Turquie, la prévalence de la MRC de stade 2 ou plus, chez des enfants âgés de 5 à 18 ans, était de 3 % et près de 1 % avaient un DFGe inférieur à 75 ml/min/1,73 m² [
23
]. Dans une étude chinoise, la prévalence de la MRC définie par un DFG inférieur à 75 ml/min/1,73 m² chez des enfants âgés de 7 à 18 ans était également de 1 %. Ces données suggèrent qu’une proportion significative d’enfants ont, en fait, une MRC asymptomatique qui pourrait être détectée par un dépistage de masse, mais elles ne prouvent pas pour autant que la détection précoce de la MRC améliorerait le devenir rénal de ces enfants. Toutefois, d’autres données ont montré que des antécédents de maladie rénale dans l’enfance confèrent un risque d’IRT à l’âge adulte. Le dépistage et le suivi à long terme, même d’anomalies rénales légères, pourraient donc s’avérer utiles. Une étude israélienne a évalué le risque d’IRT à très long terme, d’adolescents et de jeunes adultes ayant eu une évaluation néphrologique en vue de leur incorporation dans l’armée (le service militaire obligatoire étant la règle en Israël) entre 1967 et 1997 (âge lors de l’examen : 16-25 ans) [
35
]. Plus de 1,5 million d’individus ont été suivis pendant 30 ans. Parmi eux, 2 500 ont développé une IRT entre 1980 et 2014 et ceux ayant eu des antécédents de maladie rénale dans l’enfance (CAKUT, pyélonéphrite, maladie glomérulaire), avec une récupération apparente complète au moment de l’évaluation médicale (créatinine normale, pas d’hypertension, pas de protéinurie à la bandelette), avaient un risque quatre fois plus élevé de nécessiter un traitement de suppléance à l’âge adulte par rapport à ceux sans antécédents d’anormalie rénale dans l’enfance [
35
].
Un certain nombre d’enfants ont donc une probabilité plus élevée de développer une MRC et pourraient bénéficier d’une évaluation systématique du rapport protéine (ou albumine)/creatinine urinaire, ainsi que d’une mesure de la pression artérielle, et éventuellement d’une estimation du DFG. Ce dépistage concernerait certaines populations à risque : antécédents personnels de CAKUT et toute anomalie des voies urinaires à l’échographie prénatale ; antécédents personnels de néphrectomie partielle ou totale ; petit poids de naissance ; antécédents familiaux au premier degré, de MRC avancée, d’hypertension artérielle, d’obésité, de diabète, de cardiopathie congénitale, de cancer, de maladie systémique, de drépanocytose ; antécédents d’atteinte rénale aiguë, ou traitement prolongé par des médicaments néphrotoxiques. |
Progression de la maladie rénale chronique
La progression de la MRC est très variable et dépend de la maladie rénale initiale, de la sévérité de l’insuffisance rénale et de la présence de facteurs de risque supplémentaires. Les données de la cohorte américaine NAPRTCS, incluant plus de 4 000 enfants aux stades 2 à 4 de MRC, ont montré un taux de progression vers l’IRT de 17 % à 1 an et 39 % à 3 ans après inclusion dans l’étude, la durée médiane estimée pour atteindre le stade d’IRT étant de 4,5 ans [
36
]. Des modèles de prédiction, validés en pédiatrie, pourraint s’avérer utiles pour prédire et anticiper le moment où le démarrage d’un traitement de suppléance sera nécessaire. Il existe deux types de facteurs associés à la progression de la MRC chez les enfants, les facteurs de risque non modifiables et les facteurs de risque modifiables.
Les facteurs de risque non modifiables
Les maladies glomérulaires ont une progression plus rapide que les maladies non glomérulaires [
19
]. La progression de MRC peut s’accélérer au moment de la puberté, et un petit poids de naissance, associé à un certain degré de réduction néphronique, prédispose à la survenue ultérieure d’une hypertension artérielle et d’une MRC [
37
]. Certaines minorités ethniques ont une incidence de MRC plus élevée que les Caucasiens, les différences dans la progression de la MRC selon l’origine ethnique n’ont cependant pas été clairement démontrées jusqu’à présent. Notons enfin que des études d’association pangénomique réalisées chez des adultes et chez des enfants ont mis en évidence des locus génétiques de susceptibilité à la progression de la MRC.
Les facteurs de risque modifiables
L’hypertension artérielle et la protéinurie sont les deux facteurs de risque indépendants les plus importants pour la progression de la MRC chez les adultes mais aussi chez les enfants. L’essai clinique ESCAPE a montré qu’un contrôle strict de la pression artérielle, en dessous du 50
e
percentile, ralentissait la progression de la MRC au cours des cinq années de suivi [
38
]. Dans cet essai, la réponse anti-protéinurique initiale aux inhibiteurs de l’enzyme de conversion de l’angiotensine s’est également révélée être un facteur prédictif de la survie rénale. Bien que les études pédiatriques solides restent limitées, une association entre obésité et progression de la MRC a été mise en évidence [
39
] et l’obésité à l’adolescence a été fortement associée à la survenue de l’IRT à l’âge adulte. Les autres facteurs potentiellement impliqués dans la progression de la MRC sont l’acidose métabolique, l’hyperuricémie, l’anémie, l’albuminémie, les anomalies du métabolisme minéral et osseux, la dyslipidémie et l’inflammation chronique.
|
Mortalité chez les enfants présentant une maladie rénale chronique
Le taux de mortalité dans l’IRT pédiatrique a considérablement diminué au cours des quarante dernières années. Il reste toutefois environ 30 fois supérieur à celui des enfants du même âge dans la population générale [
3
].
Dans une étude du registre ANZDATA, menée en Australie et en Nouvelle-Zélande, incluant 1 634 enfants ayant commencé un traitement de suppléance entre 1963 et 2002, la survie à 10 ans était de 79 % et la survie à 20 ans de 66 %, avec une diminution de la mortalité à chaque décennie entre les années 1970 et 1990 [
40
]. Selon la modalité de traitement de suppléance, le taux de mortalité était de 50 à 60 décès pour 1 000 patients-années. Aux États-Unis, parmi les 23 400 patients pédiatriques de moins de 21 ans du registre USRDS ayant commencé une dialyse entre 1990 et 2010, le taux de mortalité était de 39 décès pour 1 000 patients-années chez les enfants âgés de plus de 5 ans, et de 99 décès pour 1 000 patients-années chez les enfants de moins de 5 ans [
41
]. Les principales causes de décès étaient d’origines cardiovasculaires chez environ 35 % des patients, suivies par les infections. Aux États-Unis, le taux de mortalité chez les enfants transplantés rénaux reste inférieur à celui des patients dialysés (8 décès pour 1 000 patients-années chez les patients avec un greffon fonctionnel, contre 36 décès pour 1 000 patients-années après échec de greffe et retour en dialyse [
42
]). En Europe, le taux de mortalité pédiatrique en dialyse est environ deux fois moins élevé qu’aux États-Unis. Une étude du registre ESPN/ERA-EDTA, portant sur 6 473 enfants dialysés entre 2000 et 2013, a montré un taux de mortalité de 28 décès pour 1 000 patients-années (16 pour 1 000 patients-années chez les enfants de plus de 5 ans et 49 pour 1 000 patients-années chez les moins de 5 ans) [
43
]. Les facteurs associés à un risque de mortalité plus élevé sont le jeune âge, l’HD, par rapport à la DP, la première année de dialyse, le recours tardif à un suivi en néphrologie pédiatrique, et les politiques de dépenses de santé du pays [
43
,
44
]. À l’inverse de ces pays industrialisés, dans les pays à faible revenu où l’accès à un traitement de suppléance rénale est extrêmement limité ou inexistant, la majorité des enfants au stade d’IRT qui débutent une dialyse chronique doivent interrompre le traitement et décèdent rapidement.
|
Qualité de vie chez les enfants présentant une maladie rénale chronique
La qualité de vie des enfants présentant une MRC peut être altérée par différents facteurs, tels que l’âge, le stade de la MRC, le retard de croissance, l’existence d’une anémie, la lourdeur des traitements, des perturbations du schéma corporel (fistule artério-veineuse, gastrostomie, catheter de dialyse pértonéale, etc.). Elle s’est améliorée dans les pays pouvant proposer une prise en charge adaptée. Par exemple, le traitement par hormone de croissance recombinante a permis d’améliorer l’insertion sociale en augmentant sensiblement la taille finale des enfants. De différentes études réalisées, on retiendra en particulier que la qualité de vie des enfants présentant une MRC est significativement diminuée chez les enfants dialysés, par comparaison aux enfants transplantés [
45
]. Chez les proches aidants d’enfants de moins de 8 ans, le score de qualité de vie est par ailleurs diminué, proportionnellement au nombre de traitements nécessaires à la prise en charge et donc à sa lourdeur.
|
Bien que la quantité et la qualité des données épidémiologiques sur la MRC pédiatrique soient en augmentation, elles reposent encore principalement sur les données des registres d’IRT traitée et beaucoup moins sur des études à des stades plus précoces de MRC. Comme le nombre d’enfants présentant une MRC est relativement faible, des travaux collaboratifs nationaux et internationaux sont nécessaires pour mieux comprendre les causes, la progression et les différences régionales, afin d’améliorer le dépistage et la prise en charge de la MRC pédiatrique. L’utilisation d’une classification universelle de la MRC, telle que celle proposée dans les recommandations KDIGO, ainsi que la standardisation de la nomenclature et des catégories d’âge, sont essentielles pour harmoniser la recherche clinique dans le domaine très spécifique de la MRC de l’enfant. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Jager
KJ
,
Fraser
SDS
.
The ascending rank of chronic kidney disease in the global burden of disease study.
.
Nephrol Dial Transplant.
2017;
;
32
:
:ii121.
-
8
.
2.
Harambat
J
,
van Stralen
KJ
,
Kim
JJ
,
Tizard
EJ
.
Epidemiology of chronic kidney disease in children.
.
Pediatr Nephrol.
2012;
;
27
:
:363.
–
373
.
3.
Chesnaye
NC
,
van Stralen
KJ
,
Bonthuis
M
et al.
Survival in children requiring chronic renal replacement therapy.
.
Pediatr Nephrol.
2018;
;
33
:
:585.
–
594
.
4.
Ardissino
G
,
Daccò
V
,
Testa
S
et al.
ItalKid Project. Epidemiology of chronic renal failure in children : data from the ItalKid project.
.
Pediatrics.
2003;
;
111
:
:e382.
–
e387
.
5.
Fivush
BA
,
Jabs
K
,
Neu
AM
,
et al.
Chronic renal insufficiency in children and adolescents : the 1996 annual report of NAPRTCS. North American Pediatric Renal Transplant Cooperative Study.
.
Pediatr Nephrol.
1998;
;
12
:
:328.
–
337
.
6.
Deleau
J
,
Andre
JL
,
Briancon
S
,
Musse
JP
.
Chronic renal failure in children : an epidemiological survey in Lorraine (France) 1975–1990.
.
Pediatr Nephrol.
1994;
;
8
:
:472.
–
476
.
7.
Al-Eisa
A
,
Naseef
M
,
Al-Hamad
N
,
et al.
Chronic renal failure in Kuwaiti children : an eight-year experience.
.
Pediatr Nephrol.
2005;
;
20
:
:1781.
–
1785
.
8.
Hogg
RJ
,
Furth
S
,
Lemley
KV
,
et al.
National Kidney Foundation’s Kidney Disease Outcomes Quality Initiative. clinical practice guidelines for chronic kidney disease in children and adolescents : evaluation, classification, and stratification.
.
Pediatrics.
2003;
;
111
:
:1416.
–
1421
.
9.
Kdigo, CKD Work Group.
.
KDIGO clinical practice guideline for the evaluation and management of chronic kidney disease.
.
Kidney Int.
2012;
;
2013
(
(3)
):
:1.
–
150
.
10.
Schwartz
GJ
,
Munoz
A
,
Schneider
MF
,
et al.
New equations to estimate GFR in children with CKD.
.
J Am Soc Nephrol.
2009;
;
20
:
:629.
–
637
.
11.
Peco-Antic
A
,
Bogdanovic
R
,
Paripovic
D
,
et al.
Serbian Pediatric Registry of Chronic Kidney Disease (SPRECKID). Epidemiology of chronic kidney disease in children in Serbia.
.
Nephrol Dial Transplant.
2012;
;
27
:
:1978.
–
1984
.
12.
Mong Hiep
TT
,
Ismaili
K
,
Collart
F
,
et al.
Clinical characteristics and outcomes of children with stage 3–5 chronic kidney disease.
.
Pediatr Nephrol.
2010;
;
25
:
:935.
–
940
.
13.
Areses Trapote
R
,
Sanahuja
Ibanez MJ
,
Navarro
M
.
Investigadores Centros Participantes en el Repir II. Epidemiology of chronic kidney disease in Spanish pediatric population. REPIR II Project.
.
Nefrologia.
2010;
;
30
:
:508.
–
17
.
14.
Kim
JJ
,
Booth
CJ
,
Waller
S
,
et al.
The demographic characteristics of children with chronic kidney disease stages 3–5 in South East England over a 5-year period.
.
Arch Dis Child.
2013;
;
98
:
:189.
–
194
.
15.
Ishikura
K
,
Uemura
O
,
Ito
S
,
et al.
Pediatric CKD Study Group. Japan Committee of Measures for Pediatric CKD of the Japanese Society of Pediatric Nephrology. Pre-dialysis chronic kidney disease in children : results of a nationwide survey in Japan.
.
Nephrol Dial Transplant.
2013;
;
28
:
:2345.
–
2355
.
16.
The North American Pediatric Renal Trials and Collaborative Studies 2010 Annual Report.
.
www.naprtcs.org2010
.
17.
Bek
K
,
Akman
S
,
Bilge
I
,
et al.
Chronic kidney disease in children in Turkey.
.
Pediatr Nephrol.
2009;
;
24
:
:797.
–
806
.
18.
Kayange
NM
,
Smart
LR
,
Tallman
JE
,
et al.
Kidney disease among children in sub-Saharan Africa : systematic review.
.
Pediatr Res.
2015;
;
77
:
:272.
–
281
.
19.
Warady
BA
,
Abraham
AG
,
Schwartz
GJ
,
et al.
Predictors of rapid progression of glomerular and nonglomerular kidney disease in children and adolescents : The Chronic Kidney Disease in Children (CKiD) Cohort.
.
Am J Kidney Dis.
2015;
;
65
:
:878.
–
888
.
20.
Leibler
JH
,
Ramirez-Rubio
O
,
Velázquez
JJA
,
et al.
Biomarkers of kidney injury among children in a high-risk region for chronic kidney disease of uncertain etiology.
.
Pediatr Nephrol.
2021;
;
36
:
:387.
–
96
.
21.
Al Riyami
MS
,
Al Shehhi
M
,
Al Sulaimi
T
,
et al.
Epidemiology and outcome of CKD in Omani children.
.
Kidney Int Rep.
2019;
;
4
:
:727.
–
732
.
22.
Esbjorner
E
,
Berg
U
,
Hansson
S
.
Epidemiology of chronic renal failure in children : a report from Sweden 1986–1994.
.
Swedish Pediatric Nephrology Association. Pediatr Nephrol.
1997;
;
11
:
:438.
–
442
.
23.
Soylemezoglu
O
,
Duzova
A
,
Yalçinkaya
F
,
et al.
Chronic renal disease in children aged 5–18 years : a population-based survey in Turkey, the CREDIT-C study.
.
Nephrol Dial Transplant.
2012;
;
27
(
(suppl 3)
) :
:iii146.
-
51
.
24.
Saydah
SH
,
Xie
H
,
Imperatore
G
,
et al.
Trends in Albuminuria and GFR Among Adolescents in the United States, 1988–2014.
.
Am J Kidney Dis.
2018;
;
72
:
:644.
–
652
.
25.
Harambat
J
,
Ekulu
PM
.
Inequalities in access to pediatric ESRD care : a global health challenge.
.
Pediatr Nephrol.
2016;
;
31
:
:353.
–
358
.
26.
United States Renal Data System.
USRDS 2019 Annual Data Report : Atlas of Chronic Kidney Disease and End-Stage Renal Disease in the United States.
2019
;
National Institute of Diabetes and Digestive and Kidney Diseases, Bethesda, MD:
National Institutes of Health;
27.
Chesnaye
NC
,
Schaefer
F
,
Groothoff
JW
,
et al.
Disparities in treatment rates of paediatric end-stage renal disease across Europe : insights from the ESPN/ERA-EDTA registry.
.
Nephrol Dial Transplant.
2015;
;
30
:
:1377.
–
1385
.
28.
Bonthuis
M
,
Vidal
E
,
Bjerre
A
,
et al.
Ten-year trends in epidemiology and outcomes of pediatric kidney replacement therapy in Europe : data from the ESPN/ERA-EDTA Registry.
.
Pediatr Nephrol.
2021;
;
36
:
:2337.
–
48
.
29.
van der Heijden
BJ
,
van Dijk
PC
,
Verrier-Jones
K
,
et al.
Renal replacement therapy in children : data from 12 registries in Europe.
.
Pediatr Nephrol.
2004;
;
19
:
:213.
–
221
.
30.
Orr
NI
,
McDonald
SP
,
McTaggart
S
,
et al.
Frequency, etiology and treatment of childhood end-stage kidney disease in Australia and New Zealand.
.
Pediatr Nephrol.
2009;
;
24
:
:1719.
–
1726
.
31.
Plumb
LA
,
Sinha
MD
,
Casula
A
,
et al.
Associations between deprivation, geographic location, and access to pediatric kidney care in the United Kingdom.
.
Clin J Am Soc Nephrol.
2021;
;
16
:
:194.
–
203
.
32.
Driollet
B
,
Bayer
F
,
Kwon
T
,
et al.
Social deprivation is associated with lower access to pre-emptive kidney transplantation and more urgent-start dialysis in the pediatric population.
.
Kidney Int Rep.
2022;
;
7
:
:741.
–
51
.
33.
Harambat
J
,
van Stralen
KJ
,
Schaefer
F
,
et al.
Disparities in policies, practices and rates of pediatric kidney transplantation in Europe.
.
Am J Transplant.
2013;
;
13
:
:2066.
–
2074
.
34.
Bonthuis
M
,
Cuperus
L
,
Chesnaye
NC
,
et al.
Results in the ESPN/ERA-EDTA Registry suggest disparities in access to kidney transplantation but little variation in graft survival of children across Europe.
.
Kidney Int.
2020;
;
98
:
:464.
–
75
.
35.
Calderon-Margalit
R
,
Golan
E
,
Twig
G
,
et al.
History of Childhood Kidney Disease and Risk of Adult End-Stage Renal Disease.
.
N Engl J Med.
2018;
;
378
:
:428.
–
438
.
36.
Staples
AO
,
Greenbaum
LA
,
Smith
JM
,
et al.
Association between clinical risk factors and progression of chronic kidney disease in children.
.
Clin J Am Soc Nephrol.
2010;
;
5
:
:2172.
–
2179
.
37.
Hirano
D
,
Ishikura
K
,
Uemura
O
,
et al.
Pediatric CKD Study Group in Japan in conjunction with the Committee of Measures for Pediatric CKD of the Japanese Society of Pediatric Nephrology. Association between low birth weight and childhood-onset chronic kidney disease in Japan : a combined analysis of a nationwide survey for paediatric chronic kidney disease and the National Vital Statistics Report.
.
Nephrol Dial Transplant.
2016;
;
31
:
:1895.
–
1900
.
38.
ESCAPE Trial Group.
.
Wühl
E
,
Trivelli
A
,
Picca
S
,
et al.
Strict blood-pressure control and progression of renal failure in children.
.
N Engl J Med.
2009;
;
361
:
:1639.
–
1650
.
39.
Kogon
AJ
,
Roem
J
,
Schneider
MF
,
et al.
Associations of body mass index (BMI) and BMI change with progression of chronic kidney disease in children.
.
Pediatr Nephrol.
2022
. doi :
10.1007/s00467-022-05655-6
.
40.
McDonald
SP
,
Craig
JC
.
Australian and New Zealand Paediatric Nephrology Association. Long-term survival of children with end-stage renal disease.
.
N Engl J Med.
2004;
;
350
:
:2654.
–
2662
.
41.
Mitsnefes
MM
,
Laskin
BL
,
Dahhou
M
,
et al.
Mortality risk among children initially treated with dialysis for end-stage kidney disease, 1990–2010.
.
JAMA.
2013;
;
309
:
:1921.
–
1929
.
42.
Laskin
BL
,
Mitsnefes
MM
,
Dahhou
M
,
et al.
The mortality risk with graft function has decreased among children receiving a first kidney transplant in the United States.
.
Kidney Int.
2015;
;
87
:
:575.
–
583
.
43.
Chesnaye
NC
,
Schaefer
F
,
Groothoff
JW
,
et al.
Mortality risk in European children with end-stage renal disease on dialysis.
.
Kidney Int.
2016;
;
89
:
:1355.
–
1362
.
44.
Chesnaye
NC
,
Schaefer
F
,
Bonthuis
M
,
et al.
ESPN/ERA-EDTA Registry Committee. Mortality risk disparities in children receiving chronic renal replacement therapy for the treatment of end-stage renal disease across Europe : an ESPN-ERA/EDTA registry analysis.
.
Lancet.
2017;
;
389
:
:2128.
–
2137
.
45.
Francis
A
,
Didsbury
MS
,
van Zwieten
A
,
et al.
Quality of life of children and adolescents with chronic kidney disease : a cross-sectional study.
.
Arch Dis Child.
2019;
;
104
:
:134.
–
140
.
|