Les monocytes sont des cellules myéloïdes de l’immunité innée, présentes chez la plupart des vertébrés. Ils sont impliqués dans l’inflammation et l’homéostasie tissulaire. Ils proviennent de cellules progénitrices hématopoïétiques de la moelle osseuse et, lorsque c’est nécessaire, migrent dans les tissus par la circulation sanguine. Les monocytes sont classés en trois sous-ensembles (classiques, intermédiaires et non classiques) selon la présence à leur surface de la protéine CD14 chez l’homme, ou Ly6C chez la souris. En conditions homéostatiques, les monocytes Ly6C high quittent la moelle osseuse et se différencient en monocytes Ly6C low et en monocytes Ly6C - (Ly6C négatifs), dits « patrouilleurs », dans le sang circulant. En conditions inflammatoires, les monocytes Ly6C high quittent la moelle osseuse et rejoignent les tissus endommagés, où ils se différencient majoritairement en macrophages. D’autres peuvent se différencier en cellules dendritiques afin de déclencher la réponse immunitaire adaptative et maintenir l’homéostasie tissulaire. Le c olony stimulating factor-1 (CSF-1) est un facteur de croissance hématopoïétique qui contrôle la prolifération, la survie, et la différenciation des monocytes et des macrophages [ 1 ]. Il est sécrété par de nombreux types cellulaires, incluant les cellules hématopoïétiques (cellules progénitrices et cellules plus matures), les macrophages, et les cellules endothéliales.
La souris Op/Op a été décrite comme un modèle murin de l’ostéopétrose congénitale 1 avant que la mutation responsable ne soit identifiée [ 2 ]. Cette souris présente des déformations osseuses et très peu de cavités médullaires en raison d’une réduction de la résorption osseuse par les ostéoclastes. Elle est également déficiente en monocytes, en macrophages et en CSF-1 [ 3 ]. La mutation responsable du phénotype de cette souris a été caractérisée en 1990 : elle introduit un codon stop prématuré dans le gène Csf-1 , conduisant à une déficience de CSF-1 [ 4 ]. La souris Op/Op, renommée Csf1 op/op , a un poids faible, un raccourcissement du tibia, et une diminution du nombre de monocytes des trois classes dans la moelle osseuse et dans le sang.
En 1995, Smith et al . ont découvert que les souris double mutantes Csf1 op/op et Apoe -/- , dépourvues d’apolipoprotéine E, ont une absence quasi-totale de plaques d’athérome, en dépit d’un taux de cholestérol plasmatique plus élevé que celui des souris témoins, révélant ainsi l’implication du CSF-1 dans l’athérosclérose [ 5 ]. Shaposhnik et al. ont ensuite montré que le CSF-1 contrôle la migration des monocytes dans la plaque athéromateuse et favorise le développement de l’athérosclérose expérimentale [ 6 ]. Toutefois, les conclusions de ces études sur le rôle des monocytes dans l’athérosclérose chez la souris Csf1 op/op sont limitées par la présence des anomalies osseuses. La restauration d’une production de CSF-1 chez les souris Csf1 op/op à l’âge adulte ne corrige pas le déficit en monocytes (et en macrophages) [ 7 ], ce qui suggère qu’il est plutôt dû à des anomalies du microenvironnement de ces cellules dans la moelle osseuse hématopoïétique. Par ailleurs, l’administration d’un anticorps anti-CSF-1 à des souriceaux C57BL/6 juste après la naissance reproduit le phénotype osseux et hématopoïétique (déficience en monocytes et en macrophages) des souris Csf1 op/op [ 8 , 9 ]. En revanche, d’autres études utilisant ces anticorps neutralisants chez des souris C57BL/6 adultes ont montré une architecture osseuse normale. Ainsi, les rôles de CSF-1 dans la monocytopoïèse et le développement osseux in vivo restaient à élucider.
Dans l’article de Emoto et al. , les auteurs se sont intéressés au rôle de CSF-1, en fonction de son origine cellulaire et du stade de développement, dans la monocytopoïèse et dans le développement osseux [ 10 ]. Pour cela, ils ont utilisé un modèle murin inductible (souris Ubc-CreERT2 ; Csf1 fl/fl ), qui permet de supprimer la production de CSF-1 à l’âge adulte par l’administration de tamoxifène aux souris porteuses de la mutation inductible. Ce modèle permet donc de s’affranchir du rôle du CSF-1 au cours du développement et de cibler son action sur la monopoïèse à l’âge adulte. Après induction de la mutation par le tamoxifène, ces souris présentaient une architecture osseuse normale, mais une diminution du nombre des macrophages tissulaires, ainsi qu’une réduction des trois classes de monocytes dans la moelle osseuse et dans le sang. L’administration d’un anticorps neutralisant dirigé contre le CSF-1 à des souris adultes reproduisait le même phénotype. L’étude de la prolifération des précurseurs des monocytes par l’administration de BrdU a montré que le CSF-1 était requis pour la sortie des monocytes Ly6C high de la moelle osseuse, mais ne l’était pas pour leur différenciation en monocytes Ly6C low dans le sang. L’analyse transcriptomique des monocytes Ly6C high et Ly6C - issus de la moelle osseuse de souris mutées a montré que leur déficience en CSF-1 induisait une dérégulation des voies associées à l’inflammation, la différenciation myéloïde, l’adhérence et l’activation des leucocytes (notamment des monocytes Ly6C high et Ly6C - ), et à l’apoptose (notamment des monocytes Ly6C high ). Ces résultats indiquaient donc que le CSF-1 contrôle la survie et la prolifération des monocytes de la moelle osseuse, ainsi que leur programmation transcriptionnelle, indépendamment de leur rôle dans le développement osseux.
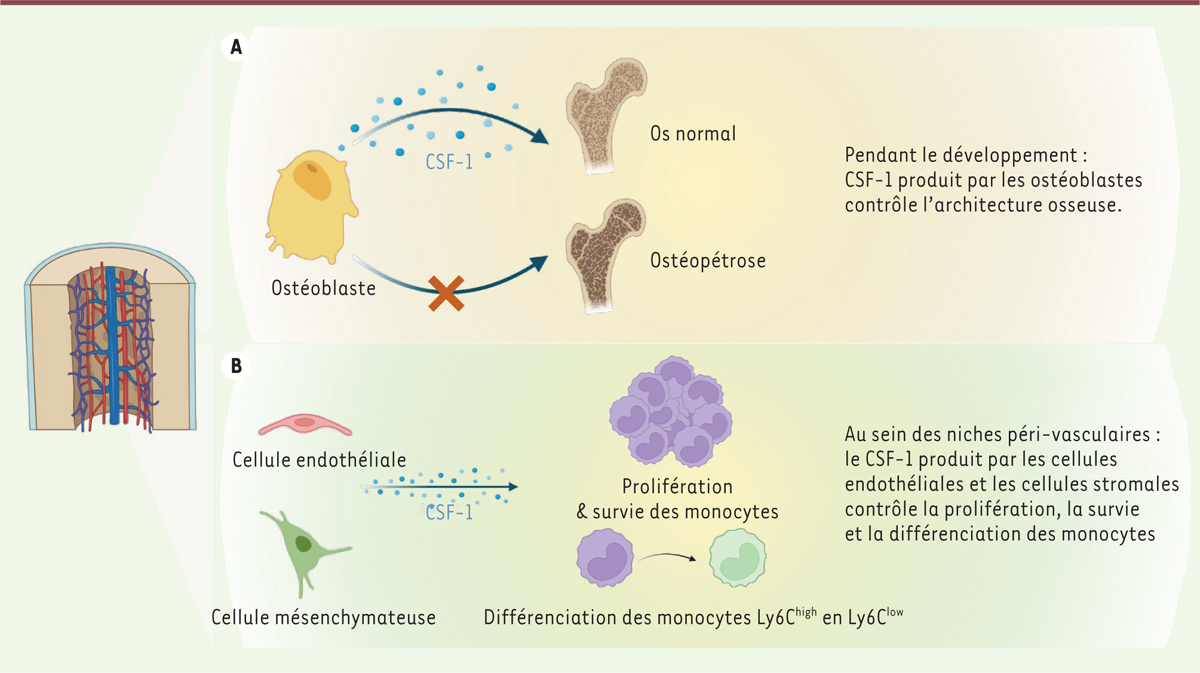
L’étude du microenvironnement médullaire des monocytes par microscopie confocale a révélé une localisation préférentielle de ces cellules dans des niches péri-vasculaires. Les monocytes se situent à proximité (à environ 5 mm) des cellules endothéliales des capillaires sinusoïdes de la moelle osseuse, dans des niches enrichies en cellules stromales ( mesenchymal stromal cells ) exprimant le récepteur de la leptine. Des études complémentaires ont montré que ces cellules stromales, les cellules endothéliales, et les ostéoblastes issus de la moelle osseuse sont des sources importantes de CSF-1.
Afin d’identifier la source de CSF-1 nécessaire à la monopoïèse ou au développement osseux, les auteurs ont utilisé des souris mutantes Osx1-Cre ; Csf1 fl/fl (chez lesquelles la production de la recombinase Cre est contrôlée par l’administration de doxycycline aux souris) afin de supprimer la production de CSF-1 spécifiquement dans les ostéoblastes et dans les cellules stromales. Lorsque la mutation était induite dès les premiers stades du développement osseux in utero et au cours de la croissance post-natale, les souris présentaient des anomalies de l’architecture osseuse, ainsi qu’une diminution du nombre des monocytes de la moelle osseuse, du sang, et de la rate. En revanche, si la mutation était induite à l’âge adulte, les souris avaient un poids, une architecture osseuse, un taux plasmatique de CSF-1, et un nombre de monocytes circulants et médullaires normaux. Ces résultats suggèrent que la source ostéoblastique de CSF-1 est nécessaire au développement de l’os aux premiers stades de la vie (in utero ainsi qu’au cours de la croissance post-natale ) , et que l’existence d’une anomalie architecturale osseuse a un impact sur la monocytopoïèse. L’étude complémentaire d’un autre modèle murin, Dmp1-Cre ; Csf1 fl/fl , a permis d’explorer le rôle du CSF-1 produit par les ostéoblastes à l’âge adulte. Ces souris ne présentaient pas d’anomalie osseuse, et leur taux plasmatique de CSF-1 était normal, de même que le nombre de monocytes dans la moelle osseuse et dans le sang, ce qui indique que la contribution des ostéoblastes à la production de CSF-1 et au contrôle de la monocytopoïèse à l’âge adulte est mineure.
Dans ce travail, les auteurs ont exploré d’autres sources cellulaires potentielles de CSF-1. Les cellules hématopoïétiques ne semblent pas être une source importante de CSF-1, car l’inactivation spécifique du gène Csf1 dans ces cellules n’induit pas de changement du taux plasmatique de CSF-1. Le nombre des monocytes est également normal dans les différents tissus. La localisation préférentielle des monocytes à proximité des vaisseaux sinusoïdaux de la moelle osseuse et la production de CSF-1 par les cellules endothéliales de ces vaisseaux a conduit les auteurs à explorer leur rôle dans la monocytopoïèse. L’utilisation des modèles murins Cdh5(PAC)-CreERT2 ; Csf1 fl/fl (inactivation de Csf1 dans toutes les cellules endothéliales) et Bmx(PAC)-CreERT2 ; Csf1 fl/fl (inactivation de Csf1 dans les cellules endothéliales artérielles) a permis de déterminer que la production de CSF-1 par les cellules endothéliales des capillaires sinusoïdaux de la niche péri-vasculaire de la moelle osseuse est requise pour la prolifération et la survie des monocytes Ly6C - (mais pas des monocytes Ly6C high ) dans la moelle osseuse, le sang et la rate. Cette étude montre également que la production de CSF-1 par des cellules endothéliales sinusoïdales est directement associée à la différenciation des monocytes Ly6C high en monocytes Ly6C low . L’inactivation du gène Csf1 à la fois dans les cellules endothéliales et les cellules stromales exprimant le récepteur de la leptine induisait en revanche une diminution du nombre de monocytes Ly6C high dans la moelle osseuse et dans le sang. Les cellules endothéliales sont donc nécessaires à la survie et à la prolifération des monocytes Ly6C low , tandis que les cellules stromales exprimant le récepteur de la leptine sont davantage nécessaires à la survie et à la prolifération des monocytes Ly6C high .