© INCa
La perte progressive de la fonction musculaire chez les patients atteints d’une maladie neuromusculaire lentement évolutive peut altérer la déglutition, la toux et la ventilation. Ceci peut ainsi entraîner des complications respiratoires graves responsables d’une augmentation de la morbidité et de la mortalité. Une assistance respiratoire adaptée peut restituer une expectoration et une ventilation efficaces et donc prévenir ces complications. Elle est maintenant envisagée dès les stades précoces de la maladie. Par exemple, dans des recommandations récentes, une ventilation non invasive nocturne au masque (VNI) est proposée dès qu’une hypoventilation nocturne est détectée, avant même que les gaz du sang diurnes soient altérés [ 1 ].
Malgré une gestion optimale de la ventilation assistée, la progression de la maladie peut entraîner une augmentation du recours à la ventilation mécanique durant la journée et lorsque la durée de VNI diurne devient conséquente (c’est-à-dire plus longue qu’une sieste). L’utilisation d’une pipette (aussi appelée pièce buccale) à la place du masque est, du fait de son caractère non invasif, de plus en plus proposée alors qu’auparavant une trachéotomie se discutait [ 2 , 3 ]. La VNI par masque la nuit avec un relais pris le jour par une pièce buccale permet de maintenir les patients devenus de plus en plus dépendants de la ventilation mécanique, dans quasiment les mêmes conditions et lieux de vie. Elle permet d’éviter les complications liées à la trachéotomie que sont les lésions trachéales et laryngées, l’infection des voies respiratoires, les barotraumatismes, sans compter la lourdeur et le coût des soins liés à cette technique invasive.
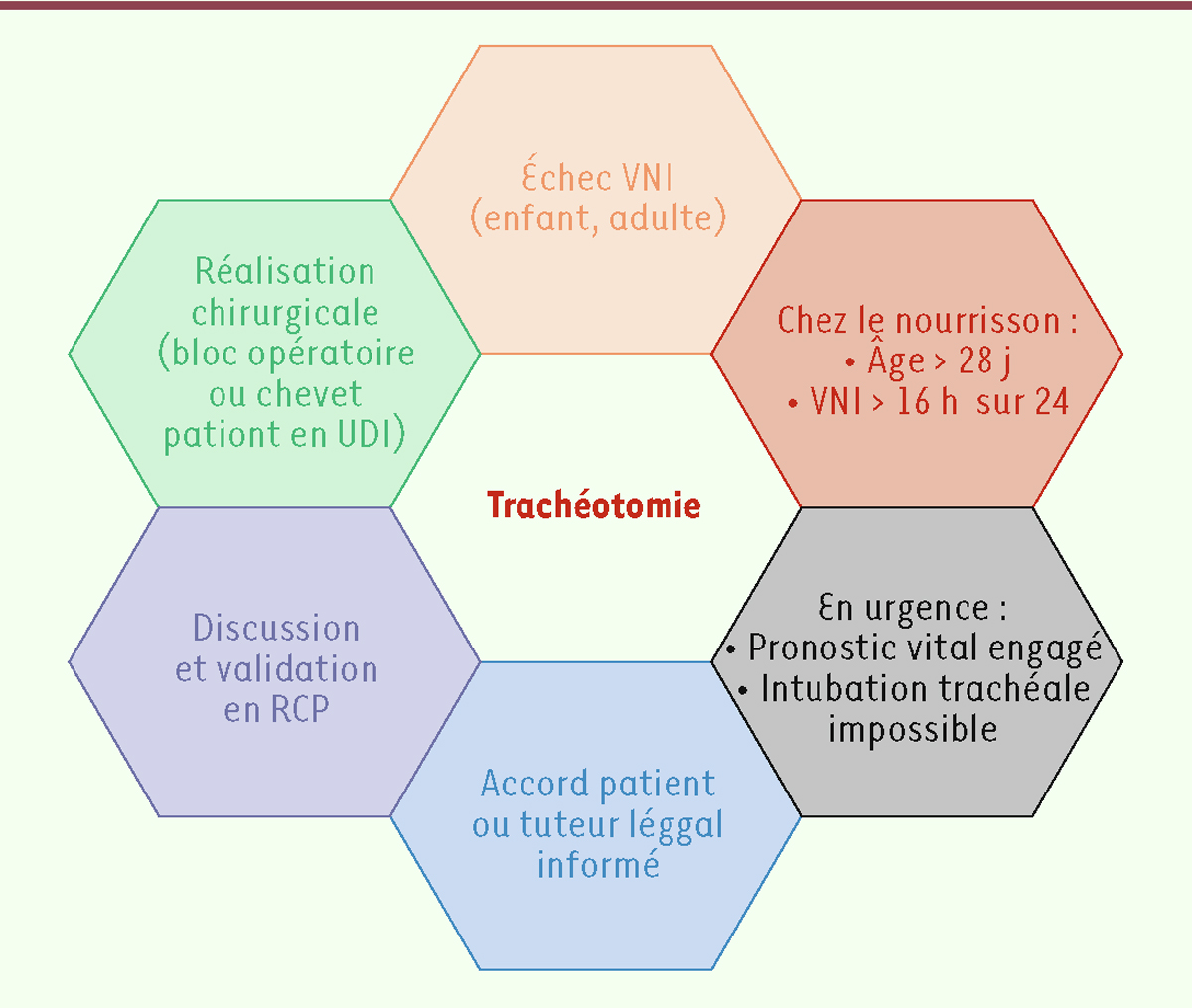
Les contraintes imposées par la trachéotomie font que la ventilation invasive n’est proposée que lorsque l’insuffisance respiratoire ne peut plus être gérée par les seules approches non-invasives ou lorsque les techniques d’assistance à la toux ne sont pas suffisamment efficaces [ 2 , 3 ]. À ce stade évolutif de la maladie, le patient peut choisir d’accepter une trachéotomie ou de ne pas en bénéficier. Dans certains pays ou centres médicaux, de nombreux patients refusent la trachéotomie considérant qu’il s’agit là d’une intervention agressive n’améliorant pas nécessairement le pronostic du fait des complications associées à celle-ci, sans compter les éventuels problèmes de ressources financières qu’elle engendre et/ou les conséquences négatives qu’elle peut entraîner sur la qualité de vie. Les médecins contribuent parfois à cette perception négative de la ventilation mécanique invasive. La fréquence des complications de la trachéotomie est un argument souvent cité en défaveur de ce mode de ventilation assistée.
Ces complications ont été décrites il y a plus de vingt ans et reposent essentiellement sur des études dans lesquelles la trachéotomie était effectuée en situation d’urgence ou aiguë plutôt qu’à froid [ 4 ]. Parmi les effets secondaires à long terme de la trachéotomie, on peut citer l’augmentation des sécrétions et infections respiratoires, les troubles de la déglutition (dysphagie), les difficultés d’élocution et de communication (perte de la parole), la formation dans la trachée de granulomes voire de véritables fistules trachéo-artérielles à l’origine d’un risque accru d’hémorragie létale, et enfin une détérioration de la qualité de vie. Ces complications sont bien sûr possibles, mais elles peuvent être en grande partie prévenues par une prise en charge optimisée. Comme pour la VNI, la gestion de la ventilation invasive par trachéotomie en période péri-opératoire d’une part, et par les établissements de soins de longue durée d’autre part, s’est améliorée au cours des trente dernières années. Les complications précoces et intermédiaires peuvent être réduites par la réalisation d’une imagerie préopératoire systématique fournissant des informations utiles au choix de la voie d’abord chirurgicale et de la canule de trachéotomie. La trachéotomie, lorsqu’elle est programmée, doit être effectuée par un chirurgien expert et doit bénéficier de soins postopératoires prolongés effectués par des équipes expérimentées. Les lésions trachéales observées lors du suivi des patients sont le plus souvent provoquées par des aspirations trachéales traumatiques, un gonflement excessif du ballonnet de la canule ou par un contact entre la trachée et l’extrémité distale de la canule. Toutes ces complications peuvent être évitées par des bonnes pratiques de soins. La trachéomalacie, par exemple, peut être évitée en utilisant dès que possible des canules sans ballonnet (ce qui facilite également la phonation). Pour prévenir l’irritation des muqueuses et la formation de granulomes, un protocole qui définit les techniques d’aspiration doit tenir compte du fait que l’aspiration ne doit jamais dépasser 0,5 cm au-delà de l’extrémité du tube endotrachéal. De plus, il faut encourager les soignants et les aidants à utiliser une technique d’aspiration stérile et à ne pas aspirer les voies respiratoires de manière systématique mais uniquement lorsque cela devient nécessaire. On minimise ainsi l’introduction d’agents pathogènes. Plus généralement, les suites d’une trachéotomie doivent être prises en charge par une équipe multidisciplinaire comprenant des médecins de différentes spécialités (spécialiste en soins intensifs, otorhinolaryngologiste), des infirmières spécialisées, des kinésithérapeutes respiratoires, des orthophonistes et des diététiciens. Cette équipe doit initier les soins et éduquer le patient, la famille, les aidants et les soignants intervenant à domicile.
Finalement, une meilleure prise en charge à long terme de la ventilation invasive couplée aux avancées technologiques du domaine ont considérablement amélioré la situation de handicap vécue par les patients ventilo-dépendants et trachéotomisés. Lorsque l’indication est bien posée, la trachéotomie ne complique pas outre mesure la phonation [ 5 ], la déglutition [ 6 ] et la gêne respiratoire [ 7 ] chez ces patients. Elle aurait même tendance à les améliorer. Un travail récent fait en collaboration avec l’Association Française contre les Myopathies (AFM-Téléthon) montre que la qualité de vie des patients neuromusculaires trachéotomisés est bonne, voire meilleure sur certains points, chez les patients atteints de pathologies neuromusculaires ventilo-dépendant trachéotomisés comparés à ceux en ventilation non-invasive [ 7 ].
Pour toutes ces raisons, l’AFM-Téléthon, en accord avec la filière de santé neuromusculaire FILNEMUS regroupant les centres de référence et de compétences éponymes, a demandé à la Haute Autorité de Santé (HAS) d’établir des lignes directrices sur la « place et la gestion de la trachéotomie dans la prise en charge de la dépendance ventilatoire des patients atteints de maladies neuromusculaires lentement évolutives » [ 8 ].
Ces lignes directrices ne concernent pas seulement les indications de trachéotomie et ne sont pas non plus en contradiction avec d’autres recommandations internationales précédemment publiées [ 2 , 3 ]. Elles visent également à améliorer la prise en charge des patients, la qualité et la sécurité de leurs soins, ainsi que leur qualité de vie ; tout en gardant à l’esprit que la trachéotomie augmente le coût des soins et limite le nombre d’établissements en aval capables d’accueillir ces patients. De plus, il s’agit d’un enjeu éthique important dans la mesure où le choix du traitement influe sur la qualité de vie et sur le pronostic de survie de ces patients.
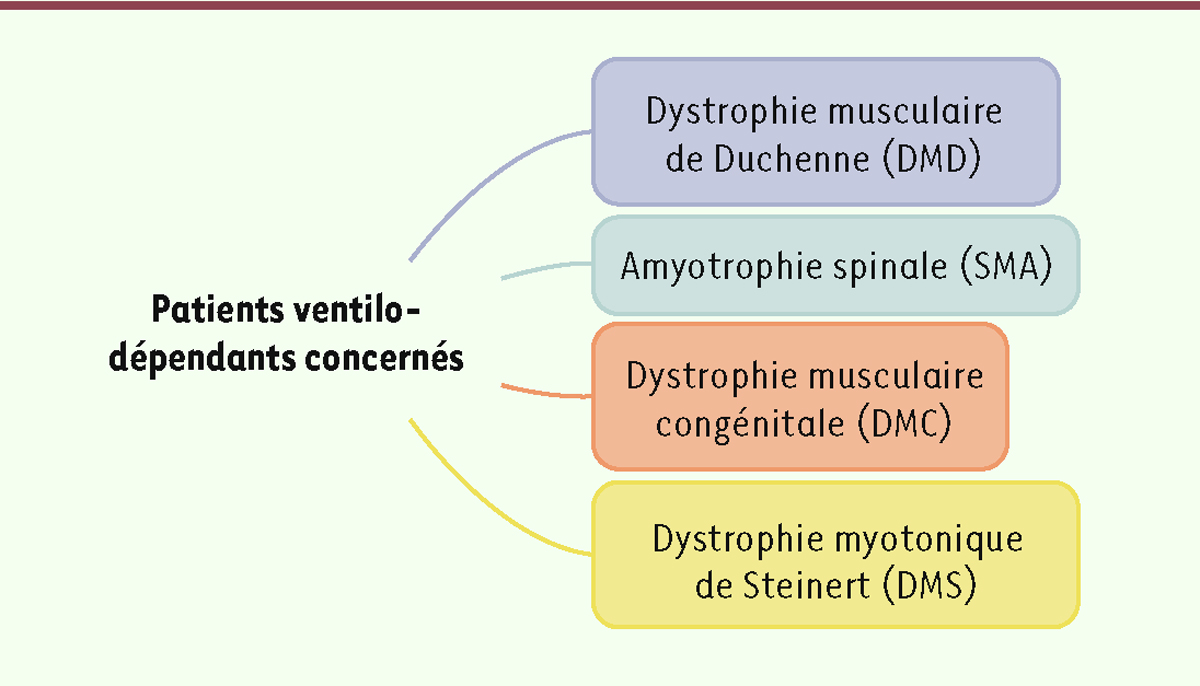
Ces nouvelles recommandations de bonnes pratiques concernent toute personne atteinte d’une insuffisance respiratoire consécutive à une maladie neuromusculaire lentement évolutive.
Les raisons majeures de cette révision sont donc :
1. Les progrès réalisés dans l’assistance ou la suppléance respiratoire par la ventilation non invasive, notamment de nouveaux modes de ventilations et le recours à la ventilation par pipette (pièce buccale) ; les progrès dans le traitement des données issues des études de sommeil, dans les techniques de toux assistée, avec ou sans aide instrumentale et les avancées obtenues par les études cliniques consacrées aux problèmes de phonation et de déglutition et proposant de nouvelles stratégies de prise en charge [ 9 ].
2. Les progrès liés aux thérapies innovantes qui sont en train de bouleverser l’histoire naturelle des pathologies neuromusculaires et qui amènent à de nouvelles réflexions diagnostiques et éthiques.
3. La réévaluation de l’équilibre bénéfices-risques avec les risques importants rapportés, suite à une enquête nationale diligentée par l’AFM-Téléthon, à des hémorragies trachéales survenues en période post chirurgicale et qui ont pu entraîner le décès du patient.