| |
| Med Sci (Paris). 38: 17–28. doi: 10.1051/medsci/2022173.Biopsie musculaire en période néonatale et périnatale Une évaluation rétrospective de 535 cas Norma Beatriz Romero1* and Mai Thao Bui1 1Unité de Morphologie Neuromusculaire, Institut de Myologie, Groupe Hospitalier-Universitaire Pitié-Salpêtrière
,
75013
,
Paris
,
France MeSH keywords: Nouveau-né, Grossesse, Femelle, Humains, Études rétrospectives, Maladies neuromusculaires, Biopsie, Muscles, diagnostic, anatomopathologie |
Les maladies neuromusculaires à début néonatal ou périnatal sont généralement très sévères. Leur diagnostic requiert une méthodologie rigoureuse afin de déterminer le plus rapidement possible la cause de la maladie et contribuer ainsi à établir le pronostic vital qui en découle. Les myopathies congénitales sévères associées ou non à une akinésie, à des malformations ou à une arthrogrypose, sont des pathologies très hétérogènes, le plus souvent avec des symptômes qui apparaissent généralement avant la naissance (hydramnios, hypomobilité fœtale, etc.). De nombreux gènes appartenant à plusieurs groupes de maladies neuromusculaires sont à l’origine de ces myopathies sévères à révélation très précoce. L’étude de la biopsie musculaire en période néonatale est souvent motivée par la gravité extrême du tableau clinique et par les renseignements, plus ou moins spécifiques, qu’elle est en mesure d’apporter. En effet, cette analyse a pour but de rechercher ou de valider un diagnostic précis, voire une étiologie moléculaire donnée. Les résultats de cette étude aident également à envisager l’évolution prévisible de la maladie au cours de cette période néonatale et immédiatement après. Dans le cadre d’une étude rétrospective, nous avons repris l’ensemble des biopsies musculaires réalisées en période néonatale élargie et analysées dans un même centre du GHU Pitié-Salpêtrière à Paris (d’abord dans les unités Inserm 153 et 523 du Pr Michel Fardeau, puis dans l’Unité de Morphologie Neuromusculaire de l’Institut de Myologie du Dr Norma B. Romero) de 1970 à 2021 inclus (soit sur une période de cinquante-deux ans). Les objectifs assignés à l’étude étaient les suivants :
-
Estimer la fréquence des différentes maladies neuromusculaires rencontrées chez les patients en période néonatale.
-
Évaluer la pertinence de l’analyse d’une biopsie musculaire chez ces nourrissons pour établir un diagnostic précis de la maladie, ainsi qu’une orientation sur les investigations complémentaires à effectuer, le pronostic et la prise en charge.
-
Apprécier l’importance et l’intérêt de l’étude « systématique » en microscopie électronique, en particulier pour les myopathies congénitales.
-
Déterminer la pertinence et la justesse des analyses morphologiques dans l’orientation des études moléculaires.
-
Apprécier la contribution apportée par les études morphologiques dans la validation ou la rectification de ces étiologies.
|
Sur plus de 600 biopsies musculaires de nourrissons âgés de 0 à 6 mois de vie reçues pour analyses, 535 ont été sélectionnées pour cette étude. Les nouveau-nés avaient au minimum un âge gestationnel de 21 semaines. Les autres cas n’ont pas été retenus du fait de l’absence d’informations complémentaires et/ou de mauvaises conditions de prélèvement ne permettant pas d’effectuer des analyses pertinentes.
Toutes les biopsies musculaires étaient chirurgicales, requérant des gestes très précis et délicats accomplis par des professionnels expérimentés. Elles ont été prélevées, pour la plupart, sur les muscles quadriceps et deltoïde. Il s’agissait plus rarement d’autres sites de prélèvement comme les muscles biceps brachial, jambier antérieur ou grand droit. L’interprétation des anomalies musculaires sur les échantillons de ces nourrissons tenait bien évidemment en compte de l’âge gestationnel du bébé. Ceci a permis d’avoir une évaluation précise du développement musculaire du patient au moment de la biopsie, comme la présence de centralisations nucléaires et/ou la persistance de fibres B de Wohlfart [
1
].
La cohorte de 535 nourrissons est composée de 54 % de garçons et de 46 % de filles. Les cas ont été classés en tenant compte des différents domaines/tableaux cliniques afin de faciliter l’interprétation des résultats et leur corroboration avec les hypothèses diagnostiques formulées avant la biopsie musculaire. Les données cliniques, biologiques et moléculaires ont été rétrospectivement analysées.
Deux groupes ont été constitués : le premier groupe correspond à des patients étudiés entre 1970 et 1999, le deuxième groupe comprend ceux analysés entre 2000 et 2021. Le choix de deux périodes distinctes est justifié par l’évolution des techniques de biologie moléculaire à visée diagnostique, soit par séquençage Sanger, soit en NGS (
next-generation-sequencing)
sous forme de panels de gènes ou d’exome entier.
Pour quelques cas appartenant au premier groupe, l’identification du défaut moléculaire a pu être réalisée rétrospectivement. En revanche, pour les cas plus récents (deuxième groupe), l’étude moléculaire a été réalisée chaque fois que cela était possible. Cette démarche d’analyse des deux groupes consécutifs nous a permis de réaliser de façon plus fiable, la confirmation ou l’infirmation des hypothèses diagnostiques formulées au moment de la biopsie musculaire. Les patients ont été ensuite classés selon deux critères :
-
Un critère clinique reprenant les principaux éléments du tableau clinique.
-
Un critère morphologique établi lors de l’étude histoenzymologique.
Pour le premier critère, nous avons proposé une classification selon le phénotype clinique des différents patients. Cette classification a été établie pour faciliter l’interprétation des résultats des analyses de la biopsie musculaire et effectuer une corroboration avec les hypothèses diagnostiques initiales. Critère clinique Tous les patients présentaient une hypotonie majeure généralisée comme symptôme principal, le plus souvent en association avec une amyotrophie. La notion d’une atteinte respiratoire et/ou d’une dépendance à une assistance respiratoire a également été prise en compte. Cinq groupes, avec deux sous-groupes pour le premier d’entre eux, ont ainsi été définis :
-
Groupe 1 : hypotonie globale majeure et amyotrophie, comprenant un sous-groupe 1A (avec ou sans assistance respiratoire) et un sous-groupe 1B (avec arthrogrypose et/ou dysmorphie/malformations - avec ou sans assistance respiratoire)
-
Groupe 2 : hypotonie globale et amyotrophie avec atteinte multi-systémique (hyperlactacidémie, cytolyse hépatique…)
-
Groupe 3 : hypotonie globale et amyotrophie avec cardiomyopathie
-
Groupe 4 : hypotonie globale et amyotrophie avec élévation des créatines-phosphokinases (CPK)
-
Groupe 5 : hypotonie globale et amyotrophie avec atteinte du système nerveux central au premier plan
Critère morphologique
La classification morphologique a été établie à partir des observations de la biopsie musculaire. Nous avons étudié les prélèvements musculaires de façon assez homogène avec la réalisation systématique d’un large panel de techniques histologiques et histo-enzymologiques (
Figure 1
).
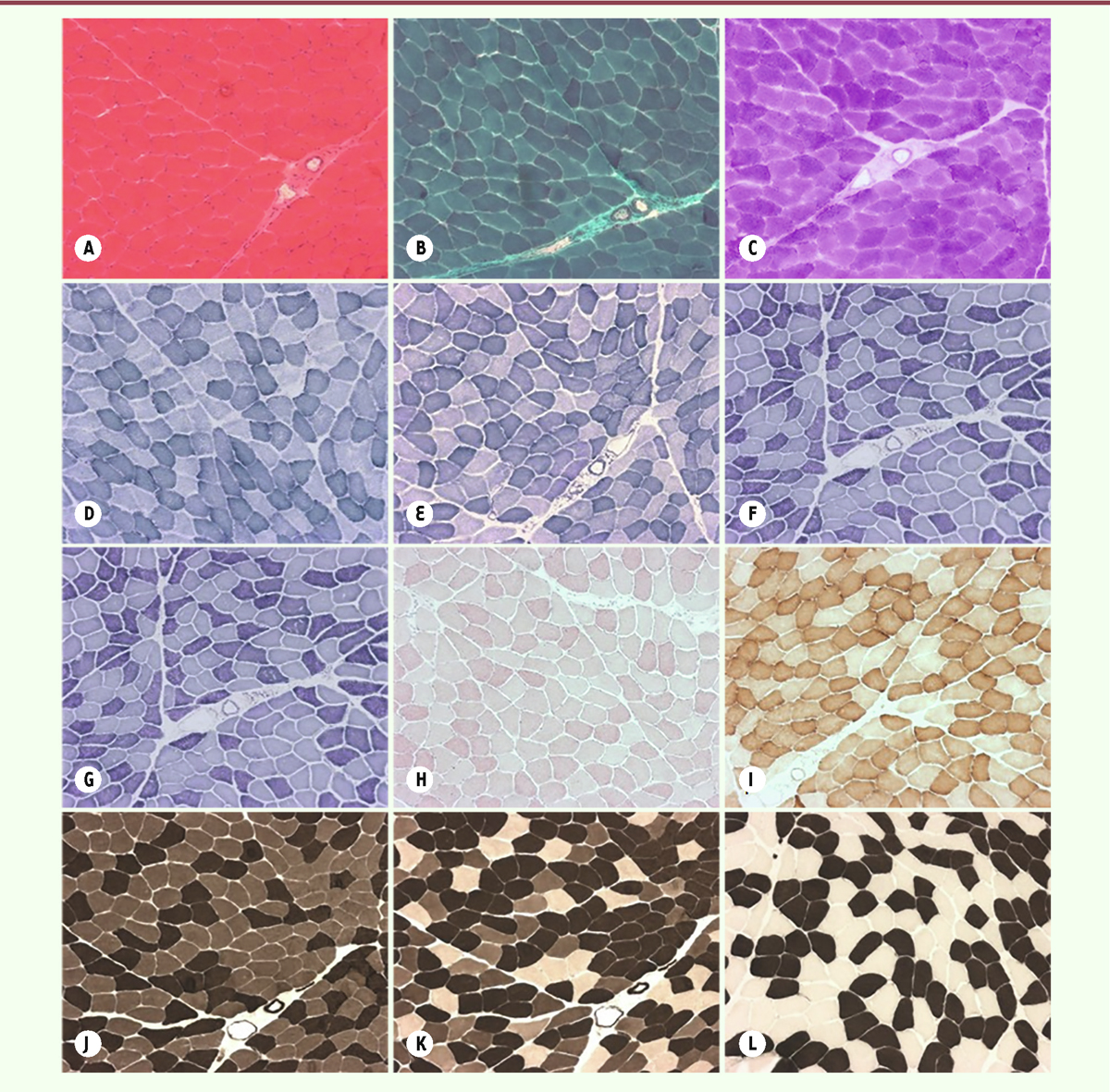
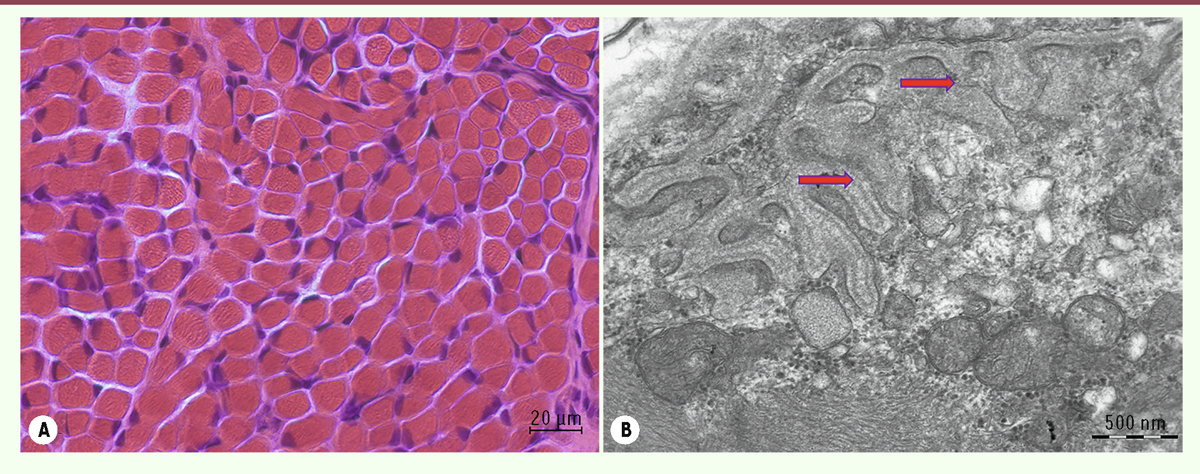
 | Figure 1.
Panel de techniques cytochimiques et histo-enzymologiques effectué à partir d’un prélèvement de muscle chez un patient contrôle âgé de 1 mois. A
: La coloration Haematoxyline - éosine (HE) permet d’observer la structure générale de la biopsie : taille et bord des fibres, position des noyaux. Il peut être observé de la fibrose, de l’inflammation, du nerf et des vaisseaux sanguins.
B
: Le Trichrome de Gomori (TG) permet de visualiser le contingent mitochondrial dans les fibres. Il peut être observé des fibres de type Ragged Red Fiber, des vacuoles bordées, des inclusions telles que des bâtonnets, corps cytoplasmiques, corps réducteurs et des agrégats tubulaires.
C
: Le PAS montre la distribution du glycogène dans les fibres musculaires.
D
: La SDH montre l’activité du complexe 2 de la chaîne respiratoire mitochondriale.
E
: La NADH-TR (enzyme présente dans les mitochondries, le réticulum sarcoplasmique et les tubules T) permet d’apprécier l’aspect du réseau intermyofibrillaire.
F
: La MENAD montre l’aspect du réseau intermyofibrillaire. Il peut être observé des inclusions granulaires et des corps réducteurs.
G
: La phosphorylase avec ou sans AMP permet de voir la présence ou l’absence d’activité liée aux maladies glycogéniques.
H
: L’ORO met en évidence la distribution des lipides à l’intérieur des fibres musculaires.
I.
: La COX montre l’activité du complexe 4 de la chaîne respiratoire mitochondriale, partiellement codée par l’ADN mitochondrial.
J
: L’ATPase à pH 9,4 permet d’observer les fibres musculaires de type 1 (fibres de type lent et résistant, de couleur claire) et de type 2 (fibres de type rapide, de couleur foncée).
K
: L’ATPase à pH 4,63 permet de voir les fibres musculaires de type 1 (de couleur foncée), de type 2a (fibres de type rapide et résistant, de couleur intermédiaire) et de type 2b (fibres de type rapide et peu résistant, de couleur claire).
L
: L’ATPase à pH 4,35 permet de distinguer les fibres de type 1 (de couleur foncée), de type 2 (de couleur claire) et parfois de type 2c (fibres en régénération, de couleur intermédiaire).
|
Une étude en microscopie électronique a pu être envisagée chaque fois que l’on disposait d’un prélèvement spécifique fixé dans de bonnes conditions. À la suite de ces études morphologiques, plusieurs groupes de maladies musculaires ou d’anomalies ont été identifiés :
-
Myopathies congénitales (myopathie congénitale structurales et myopathies congénitales sans anomalies spécifiques).
-
Maladies musculaires métaboliques.
-
Maladies du nerf périphérique, du motoneurone et de la jonction neuromusculaire (JNM).
-
Dystrophies musculaires (BM : DM Congénitale & DM Progressive).
-
Lésions inflammatoires.
-
Anomalies peu significatives.
-
Muscles sans anomalies morphologiques.
|
Un recensement de la totalité des 535 cas a été effectué en fonction du tableau clinique prévalant au moment de la demande de la biopsie musculaire, et en fonction des critères morphologiques identifiés. Un pourcentage a été calculé pour chaque présentation clinique et pour chaque critère morphologique. Ces données sont représentées dans les
Figures 2 et
3
.
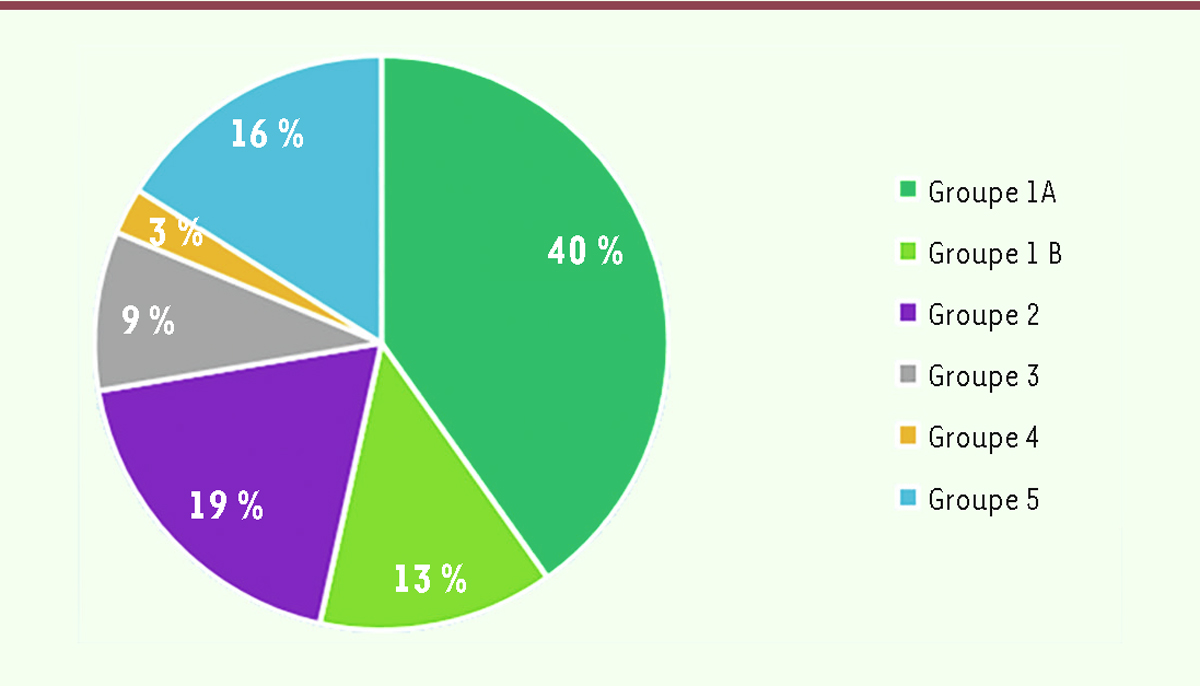
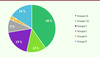 | Figure 2.
Distribution (en %) des présentations cliniques des 535 cas selon les cinq groupes définis.
|
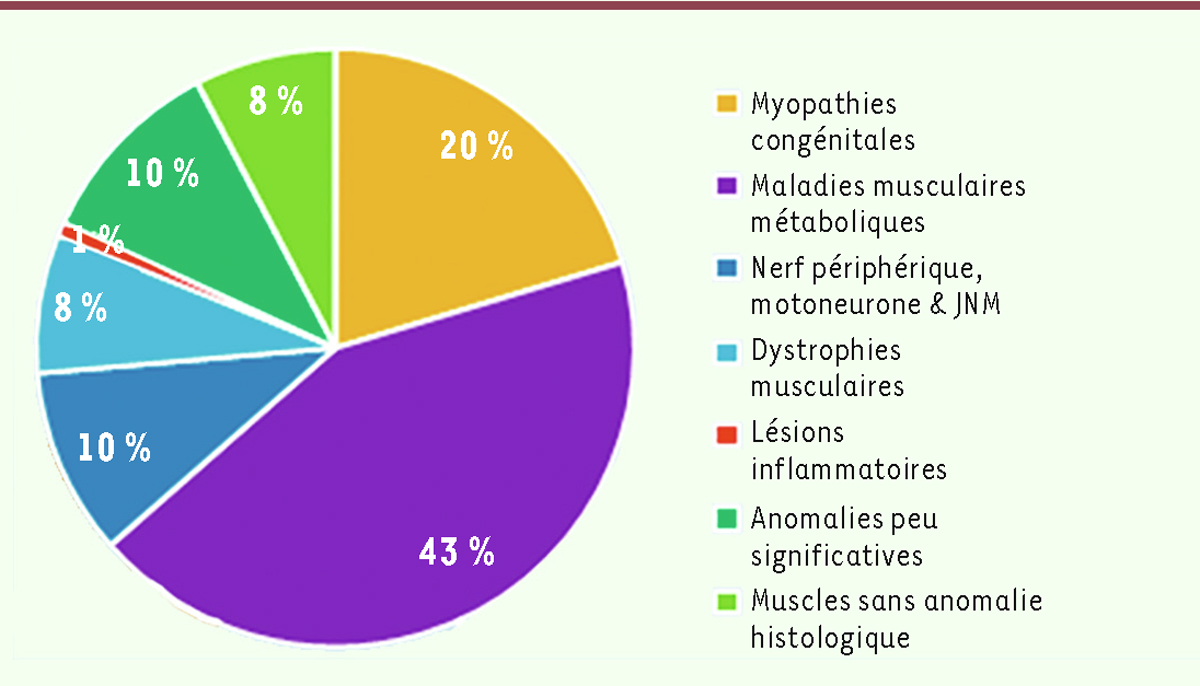
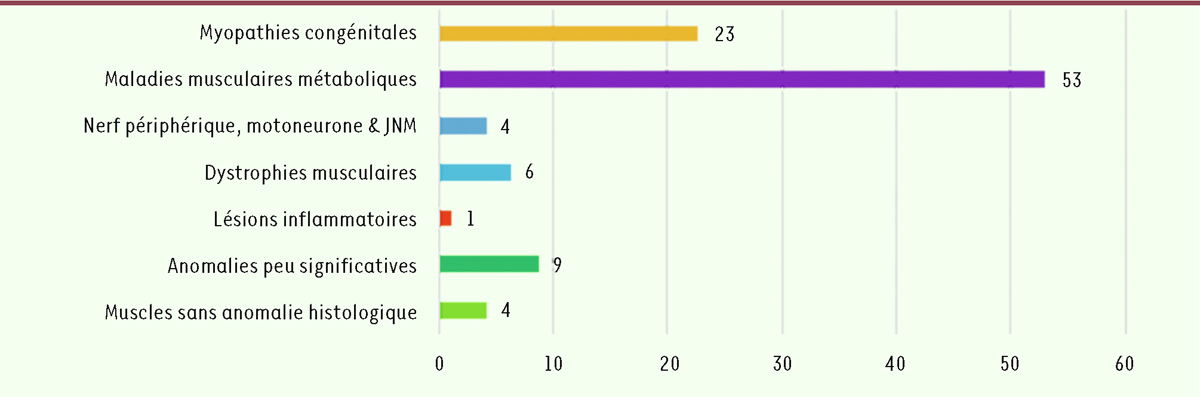
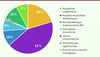 | Figure 3.
Distribution (en %) des 535 cas étudiés selon les groupes de pathologies ou d’anomalies retrouvées.
|
Environ 43 % des biopsies analysées correspondaient à un pattern morphologique évoquant des erreurs innées du métabolisme. On trouve ensuite, par ordre de fréquence, les myopathies congénitales puis les lésions musculaires par atteinte du nerf périphérique, du motoneurone ou de la JNM. Dans le groupe des myopathies congénitales qui représente environ 20 % des cas, 17 % correspondent aux myopathies congénitales structurales et 3 % s’apparentent à des myopathies congénitales plus rares, sans lésions spécifiques, mais dont le tableau pouvait parfois faire évoquer des anomalies du développement. Les autres groupes étaient moins représentés : 8 % correspondaient à des dystrophies musculaires, dont des DM progressives ou congénitales et 1 % seulement à des lésions inflammatoires importantes. Deux autres groupes ressortent du lot : l’un correspondant à celui où les anomalies observées sont peu évocatrices d’un diagnostic morphologique particulier (10 %), et l’autre regroupant des cas de biopsies de muscle sans anomalie histologique ou histoenzymologique observée au moment de l’analyse (8 %), ce qui correspondrait à des muscles considérés comme « normaux » et pouvant être utilisés comme contrôle.
La répartition des aspects histologiques de cette grande cohorte en fonction des deux périodes étudiées (248 cas pour la période 1970-1999 et 287 cas pour la période 2000-2021) est représentée dans les
Figures 4 et
5
.
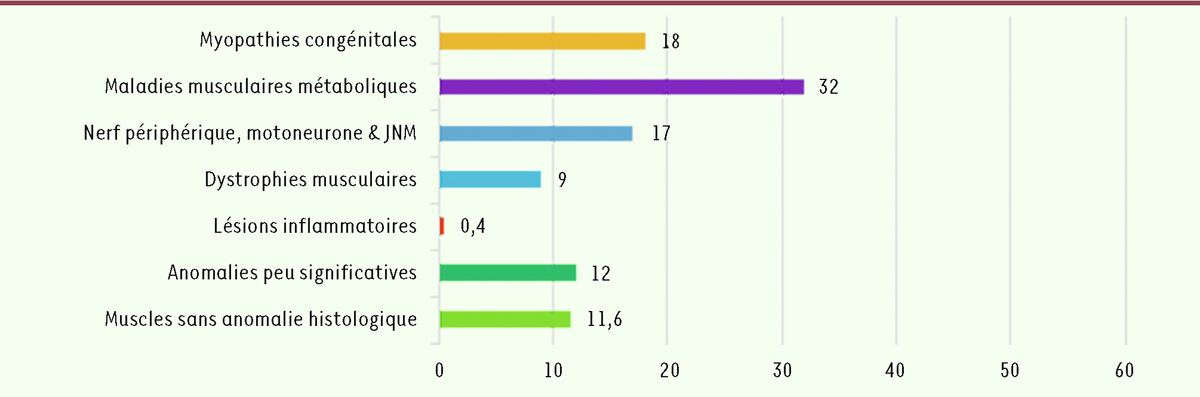
 | Figure 4.
Distribution (en %) des maladies ou lésions histologiques correspondant à la période 1970-1999 (248 cas).
|
 | Figure 5.
Distribution (en %) des maladies ou lésions histologiques correspondant à la période 2000-2021 (287 cas).
|
Pour la première période, il existe un pourcentage de 32 % correspondant aux anomalies liées aux maladies musculaires métaboliques, contre environ 18 % de lésions avec une myopathie congénitale et 17 % des lésions compatibles à une atteinte du nerf périphérique, du motoneurone ou de la JNM. Dans la seconde période, la prépondérance des maladies musculaires métaboliques pourrait être en partie expliquée par l’étroite collaboration que le laboratoire avait établie à l’époque avec les équipes parisiennes dédiées à l’étude des erreurs innées du métabolisme, en l’occurrence celle de l’hôpital Necker Enfants malades et celle de l’hôpital Robert Debré. Ces différents hôpitaux nous ont confié systématiquement les échantillons musculaires de l’ensemble des patients qu’ils avaient étudiés, dans un premier temps pour les analyses enzymatiques du muscle et dans un second temps pour les analyses moléculaires complémentaires. Cette étude morphologique systématique de la biopsie musculaire de patients avec atteinte métabolique s’est interrompue en 2017. Actuellement, de telles demandes restent sporadiques, les investigations moléculaires ayant pris le pas sur la biopsie musculaire, celle-ci étant prescrite plutôt en seconde intention et si nécessaire.
Les biopsies en faveur d’une atteinte du nerf périphérique ou du motoneurone ont été beaucoup plus fréquentes dans la première période, environ 17 % contre 4 % dans la seconde. Ceci est en rapport direct avec la mise en place de l’étude moléculaire du gène
SMN1
qui a bouleversé l’ordre de priorité des examens complémentaires pour le diagnostic positif de l’amyotrophie spinale infantile. Le diagnostic moléculaire de cette pathologie génétique est facilement réalisable dans la plupart des différents établissements hospitaliers et la biopsie musculaire n’est plus demandée en première intention dans cette indication. On observe le même phénomène pour les dystrophies musculaires : le nombre de cas de patients présentant une dystrophie musculaire et pour lesquels une biopsie musculaire a été demandée était moindre durant la seconde période de l’étude.
On constate également une importante différence du nombre de cas dans les deux périodes, dans le groupe « sans anomalie histologique » dont l’étude morphologique n’a pas apporté d’élément évocateur d’un diagnostic. En effet, au cours de la première période environ trois fois plus de biopsies étaient normales par rapport à la seconde période (12 %
versus
4 %).
Les informations des différents groupes cliniques avec celles de patterns morphologiques ont été croisées a posteriori (
Figure 6
).
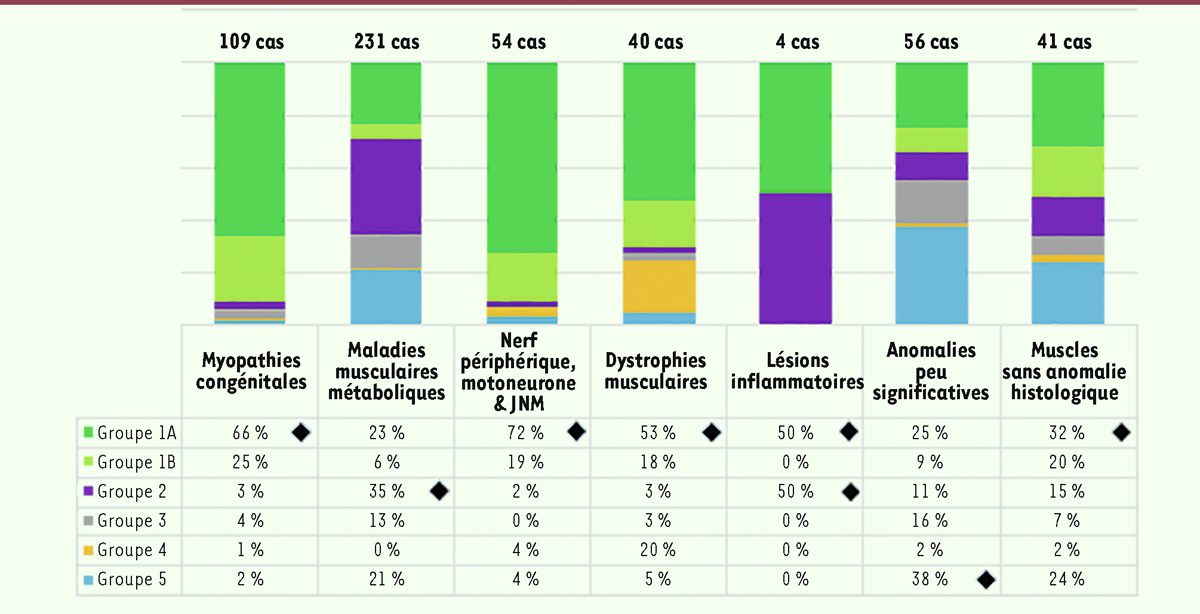
 | Figure 6.
Répartition (en %) des tableaux cliniques en fonction des groupes morphologiques (sur la totalité des 535 cas étudiés).
|
Les tableaux cliniques classés 1A et 1B se sont révélés majoritaires dans plusieurs groupes morphologiques. En effet, l’hypotonie majeure et l’amyotrophie avec ou sans atteinte respiratoire, associées ou non à une arthrogrypose, sont des symptômes observés plus particulièrement dans les myopathies congénitales, les atteintes du motoneurone, les dystrophies musculaires et les biopsies sans anomalie histologique. Par ailleurs, nous avons observé que dans le cadre des maladies musculaires métaboliques, la présentation clinique avec des atteintes multisystémiques était la plus fréquente. Néanmoins, les tableaux cliniques sont assez variés dans ce groupe : par exemple, une atteinte du système nerveux central et éventuellement une atteinte hypotonique seule. Concernant le groupe des dystrophies musculaires, il était attendu que le tableau clinique 4, dont les symptômes sont l’hypotonie générale et l’amyotrophie avec élévation des CPK, soit majoritaire. Malheureusement, nous n’avons pas obtenu dans nos archives l’information du taux des CPK pour tous les patients. Toutefois, on remarque que pour les cas avec augmentation du taux des CPK, la présentation clinique se complète en général des tableaux cliniques 1A et 1B. Les analyses obtenues montrent que les patients avec une hypotonie et une atteinte prédominante du système nerveux central (tableau clinique 5) sont classés soit dans le groupe où les anomalies morphologiques sont peu significatives sur la biopsie musculaire, soit dans celui où aucune anomalie morphologique n’est observée. Quant aux myopathies avec présence de lésions inflammatoires, elles sont très peu fréquentes.
Nous avons effectué le même type d’analyse pour les deux périodes de l’étude. Les croisements entre données cliniques et données morphologiques sont représentés dans les
Figures 7 et
8
.
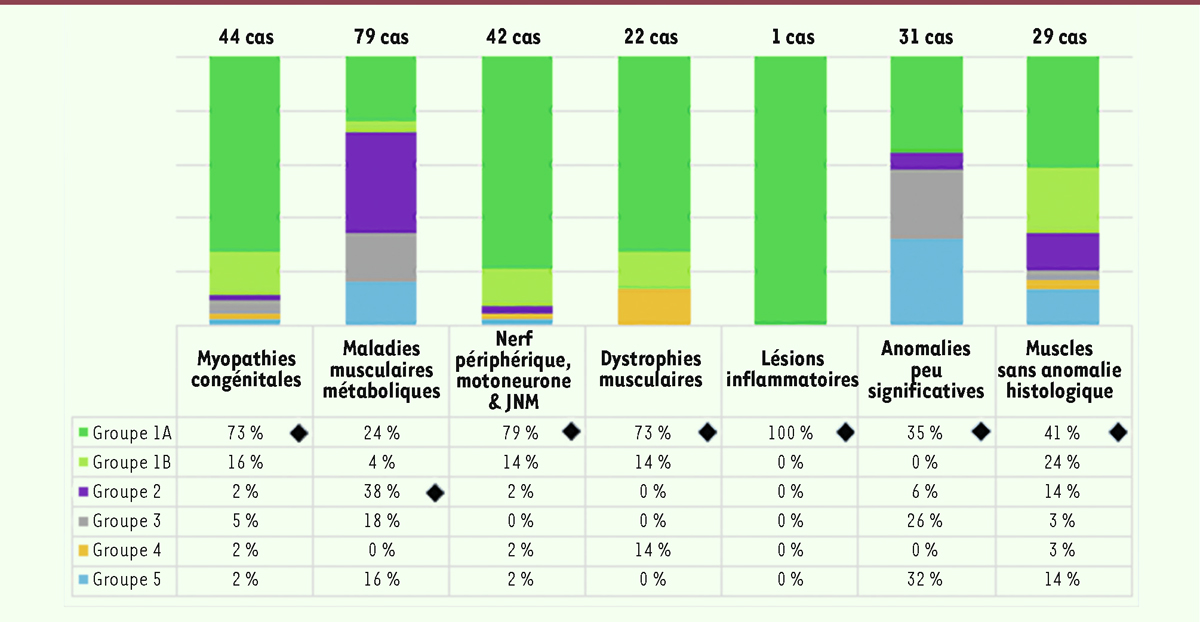
 | Figure 7.
Répartition (en %) des tableaux cliniques en fonction des groupes morphologiques sur la période 1970-1999 (248 cas).
|
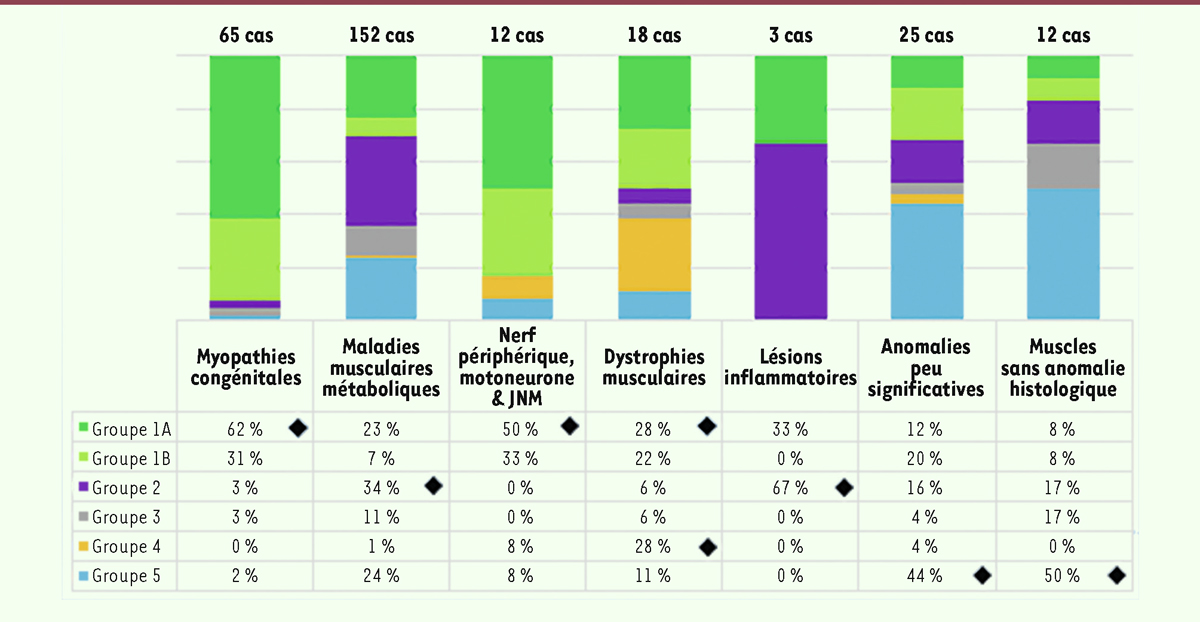
 | Figure 8.
Répartition (en %) des tableaux cliniques en fonction des groupes morphologiques sur la période 2000-2021 (287 cas).
|
Les patients des tableaux cliniques 1A et 1B, présentant une hypotonie majeure et généralisée avec arthrogrypose avec ou sans assistance ventilatoire, correspondent réellement à un nombre très important. Ce tableau clinique est représenté surtout dans le contexte des myopathies congénitales, des myopathies avec atteintes neuropathiques du motoneurone ou éventuellement dans les rares cas présentant des lésions inflammatoires ou éventuellement des dystrophies. Cependant, l’atteinte multisystémique est toujours majoritaire dans le cadre des maladies musculaires métaboliques. Nous avons observé des anomalies peu significatives soit avec une atteinte centrale très importante soit éventuellement avec des hypotonies presque isolées. Les analyses obtenues pour les patients évalués après l’année 2000 mettent en évidence encore une fois, une présentation clinique majoritaire des groupes 1A et 1B. Ces tableaux sont majoritaires dans les myopathies congénitales comme pour les atteintes du nerf périphérique ou du motoneurone et dans plusieurs formes de dystrophie musculaire. En outre, on observe toujours l’atteinte multisystémique en particulier dans le cadre des maladies musculaires métaboliques. Pour cette période, cette atteinte multisystémique est notée également pour deux cas présentant une atteinte inflammatoire. En général, les atteintes du système nerveux central sont plus observées dans le groupe d’anomalies peu significatives ou celui des biopsies sans anomalie histologique. |
Analyse des données des biopsies musculaires étudiées en microscopie électronique Parmi les 535 biopsies musculaires étudiées, 120 (22 %) ont été analysées en microscopie électronique (ME). Dans les cas restants, soit nous n’avons pas reçu d’échantillon spécifique destiné à cet effet (19 %), soit il a été décidé de ne pas procéder, de principe, à cet examen (58 %).
Dans la cohorte exclusive des « myopathies congénitales structurales » (MC) représentant 94 patients au total, 74 cas (79 %) ont bénéficié d’une investigation ultrastructurale [
2
]. En revanche, pour 14 cas (15 %), le laboratoire n’a pas reçu de prélèvement pour les études en ME et pour 6 cas (6 %), cette étude n’a pas été complétée. Pour ces derniers, il s’agit en général des enfants d’une même fratrie pour lesquels un seul cas a été caractérisé en ME, ou, pour certains, une absence complète de fibres musculaires sur l’échantillon concerné.
Nous avons classé les apports de l’étude en ME selon la pertinence de ces investigations pour le diagnostic définitif du patient et/ou pour l’orientation des études moléculaires et des prises en charge cliniques. Nous avons ainsi évalué que certaines analyses ultrastructurales ont pu être soit « décisives » pour l’orientation définitive du diagnostic, soit « contributives », soit « confirmatives ». Les données sont regroupées dans le
Tableau I
.
Tableau I.
| Myopathies congénitales structurales en ME |
Nombre de cas classés décisifs |
Nombre de cas classés contributifs |
Nombre de cas classés confirmatifs |
Ininterprétable |
|
Total de Myopathies Congénitales (74 cas)
|
28
|
37
|
8
|
1
|
| MC entre 1970-1999 (21 cas) |
9 |
6 |
6 |
0 |
| MC entre 2000-2021 (53 cas) |
19 |
31 |
2 |
1 |
Pertinence de l’étude ultrastructurale en fonction des deux périodes étudiées et pour le seul groupe des myopathies congénitales (MC).
|
L’apport de l’étude en ME a été considéré « décisif » lorsque l’investigation a apporté des éléments majeurs qui n’avaient pas pu être observés lors de l’étude histoenzymologique simple. Des éléments primordiaux ont ainsi été fournis pour orienter l’étude moléculaire qui s’en est suivie. Ceci correspond par exemple, à la découverte de lésions de type
cap
, corps cytoplasmique ou bâtonnets, des anomalies de la jonction neuromusculaire et des anomalies des noyaux, ou d’autres lésions plus rares (autophagie, inclusions autres, etc.).
L’apport de l’étude en ME a été jugé « contributif » lorsque l’exploration a pu apporter des éléments d’analyses complémentaires et confirmer les anomalies observées avec les techniques d’histo-enzymologie. L’apport de l’étude en microscopie électronique a été considéré « confirmatif » lorsque l’analyse ultrastructurale (ME) a mis en évidence ou a confirmé les mêmes types d’anomalies déjà observées en optique. L’étude en microscopie électronique a pu valider les analyses observées au préalable mais n’a pas apporté d’éléments supplémentaires pour l’orientation ou pour la définition du diagnostic ou pour d’autres apports.
Les
Figures 9
à 14
montrent des exemples de myopathies néonatales sévères liées respectivement aux gènes
RYR1, NEB, STAC3, DNM2, CNTNAP1
, pour lesquelles les investigations en ME ont été décisives pour orienter le diagnostic [
3
-
7
].
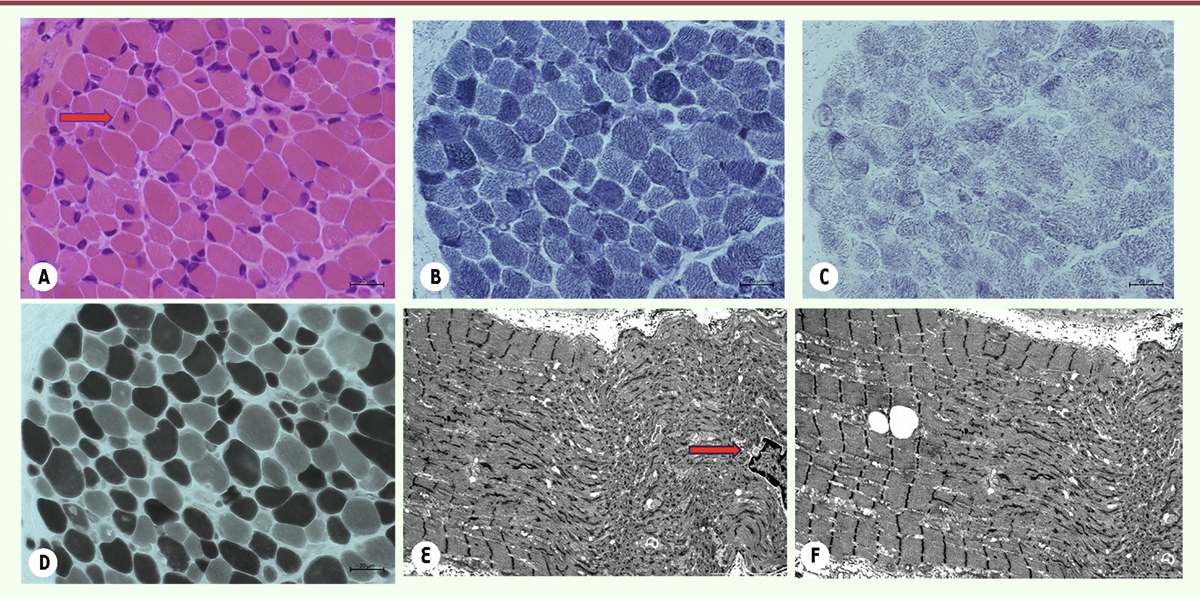
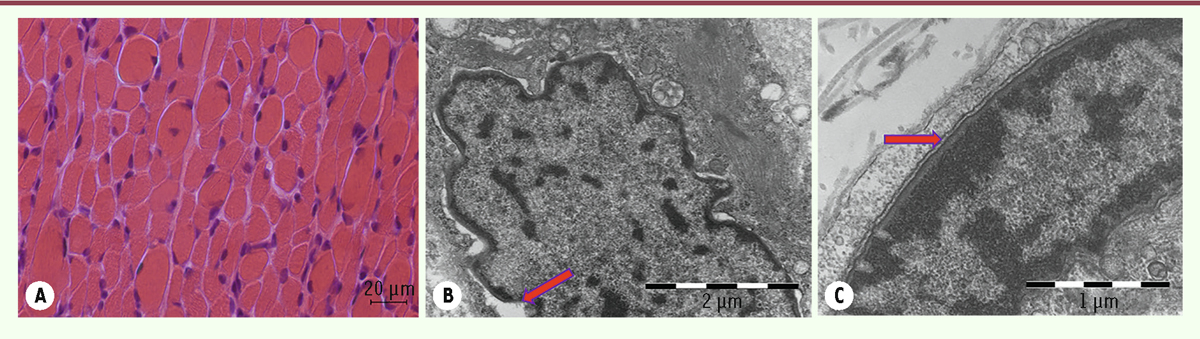
 | Figure 9.
Coupes sériées de la biopsie musculaire d’un patient de 20 jours, atteint d’une myopathie congénitale liée au gène RYR1
: HE
(A)
, NADH
(B)
, SDH
(C)
, ATP 9,40
(D)
montrent une importante inégalité de la taille de fibres musculaires avec de nombreux noyaux centralisés/internalisés (flèche) et des désorganisations de la structure interne des fibres musculaires. Les coupes observées en microscopie électronique
(E, F)
révèlent de larges zones de désorganisation, le plus souvent uniques dans une fibre, d’étendues variables évoquant des « cores » non structurés. Présence également de noyaux internalisés
(E)
(flèche) [
3
].
|
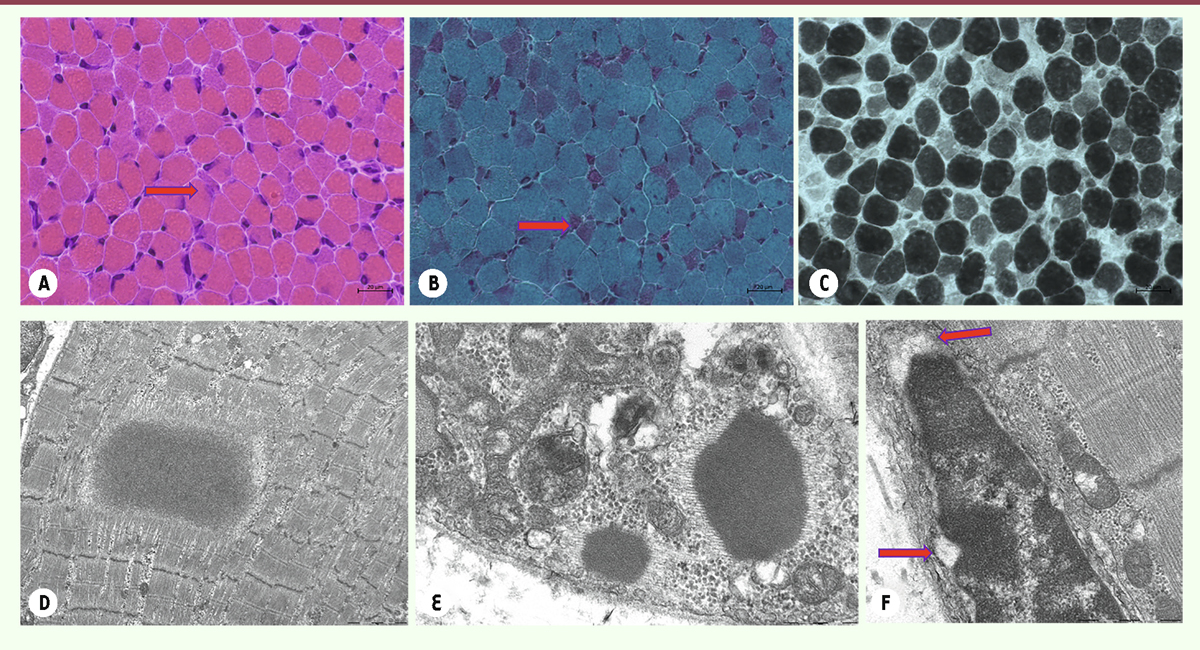
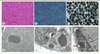 | Figure 10.
Coupes sériées de la biopsie musculaire d’un patient de 1 mois atteint d’une myopathie congénitale liée au gène NEB
: HE
(A)
, TG
(B)
, ATP 9,40
(C)
montrent une importante inégalité de la taille de fibres musculaires avec petitesse des fibres de type 1, associée à la présence de mini-inclusions notamment en périphérie de petites fibres (flèches). Les coupes observées en microscopie électronique décèlent des inclusions de type « cytoplasmic bodies »
(D)
, « rods »
(E)
et des noyaux avec élargissement de l’espace entre les deux membranes de l’enveloppe nucléaire
(F)
(flèches).
|
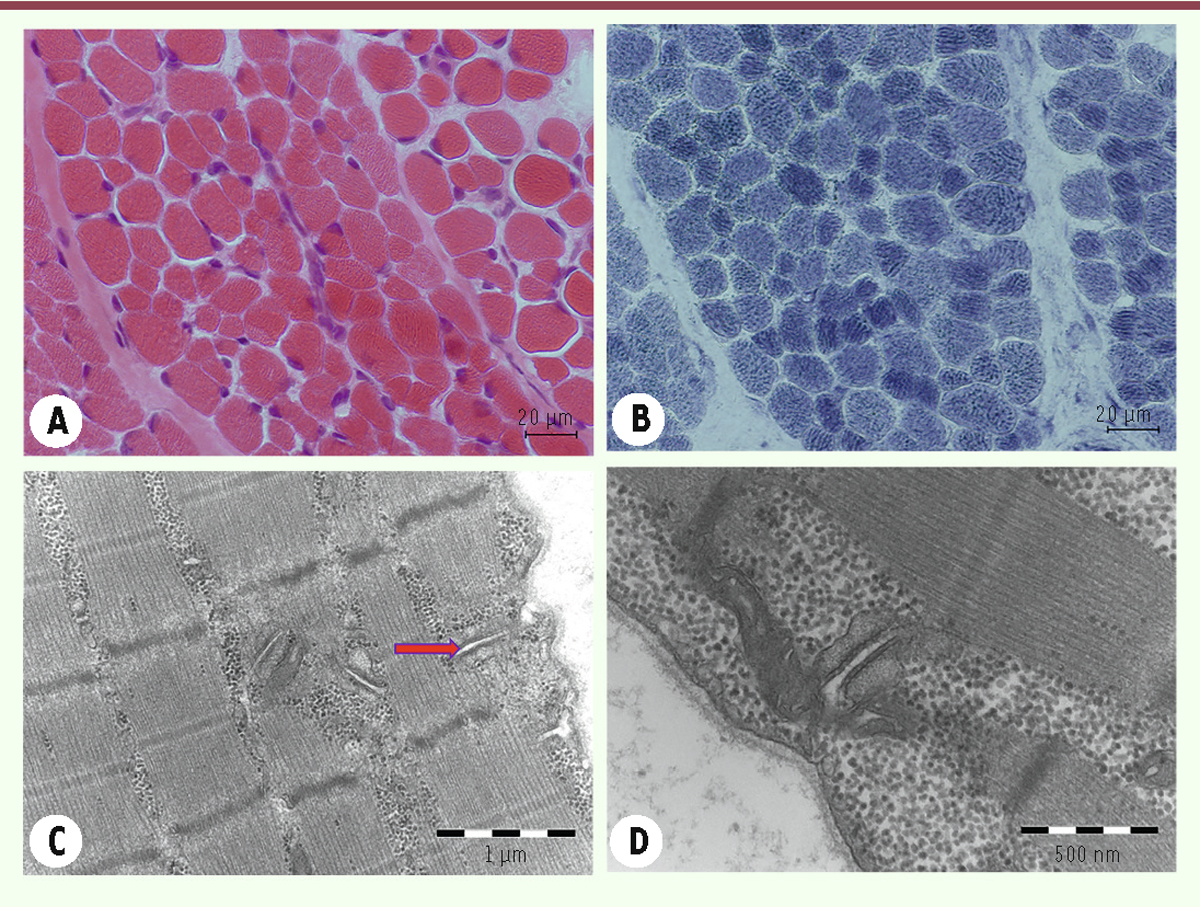
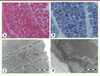 | Figure 11.
Coupes sériées de la biopsie musculaire d’un patient de 11 jours atteint d’une myopathie congénitale liée au gène STAC3
: HE
(A)
, NADH-TR
(B)
montrent une importante inégalité de la taille de fibres musculaires avec atrophie de fibres de type 1, évoquant une CFTD, sans anomalies de la maille du réseau intermyofibrillaire ni la présence d’inclusions. Cependant, les coupes observées en microscopie électronique remarquent de nombreuses citernes dilatées correspondant à des triades
(C, D)
(flèche).
|
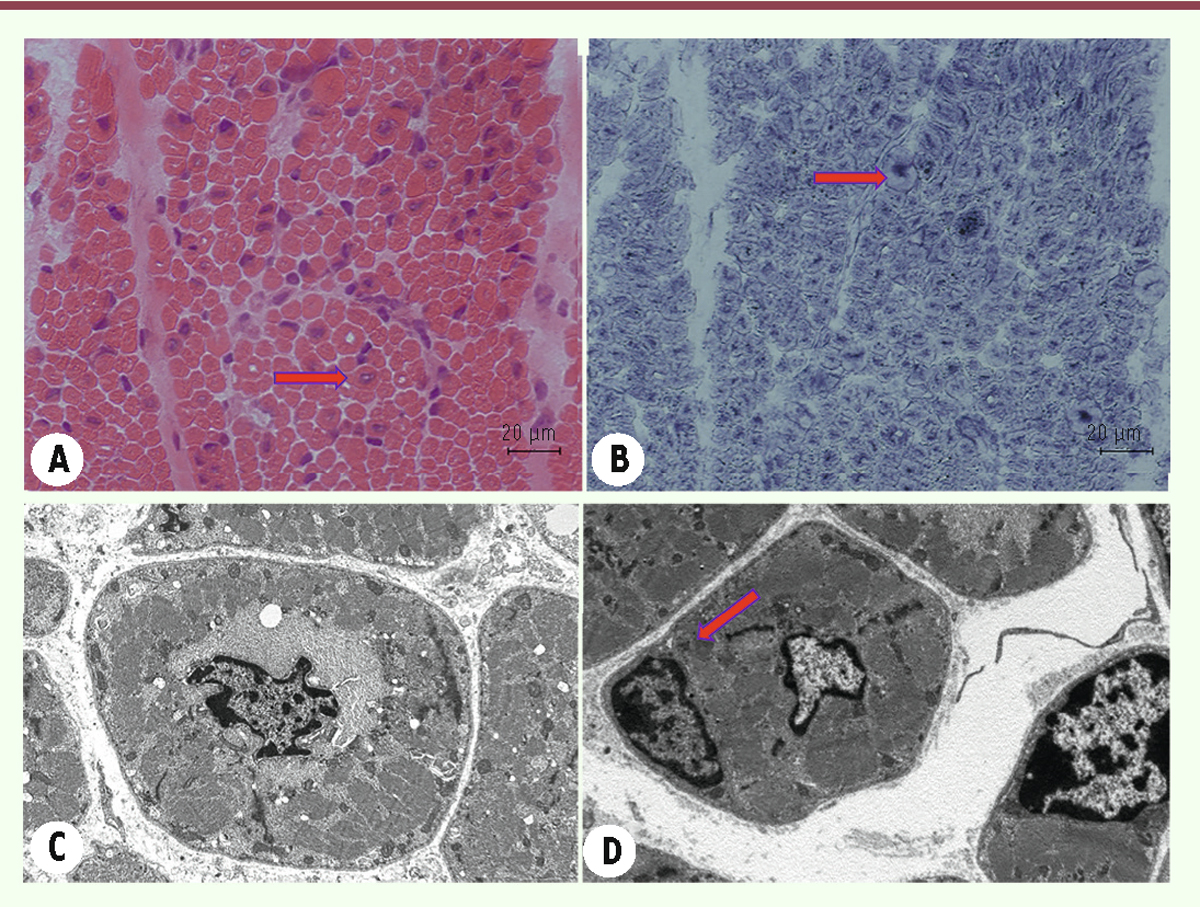
 | Figure 12.
Coupes en HE (A) et NADH (B) de la biopsie musculaire d’un patient de 1 mois
(âge gestationnel 29 semaines) atteint d’une myopathie congénitale liée au gène
DNM2
qui montrent un nombre important de fibres musculaires avec des noyaux centralisés ressemblant à des myotubes, avec un remaniement de la structure laissant un halo clair autour de la fibre (flèches). Les coupes observées en microscopie électronique
(C et D)
montrent de nombreux myotubes avec la particularité de présenter un nombre préservé de cellules satellites pour l’âge de l’enfant [
4
]. Cette caractéristique la différencie des myopathies congénitales myotubulaires liées au gène
MTM1
car celles-ci ont comme spécificité un nombre réduit de cellules satellites (flèche) [
7
].
|
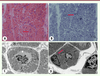
 | Figure 13.
Coupe en HE (A) de la biopsie musculaire d’un patient de 14 jours
(âge gestationnel 34 SA), atteint d’une myopathie liée au gène
CNTNAP1
qui montre une variabilité de la taille des fibres musculaires, mais dans l’ensemble aucune anomalie spécifique d’une myopathie particulière. En revanche, les coupes observées en microscopie électronique discernent de nombreuses jonctions neuromusculaires anormales avec un appauvrissement de crêtes (
B)
(flèches).
|
 | Figure 14.
Coupe en HE (A) de la biopsie musculaire d’un patient de 1 mois
, atteint d’une myopathie congénitale avec des anomalies des noyaux sans caractérisation moléculaire (
LMNA, EMD, SYNE1, SYNE2, FHL1, SUN1, SUN2, and TTN
ont été exclus et une étude complémentaire en exome est en cours), qui montre une variabilité de la taille des fibres musculaires, mais dans l’ensemble aucune anomalie spécifique d’une myopathie particulière. Toutefois, les coupes observées en microscopie électronique discernent d’importantes anomalies des noyaux en particulier un élargissement de l’espace de l’enveloppe périnucléaire
(B)
et un épaississement anormal de la lamina
(C)
(flèches).
|
Parmi les 94 cas classés myopathies congénitales structurales, pour 56 d’entre eux (60 %) l’étude moléculaire a permis d’identifier un gène causal (
MTM1, ACTA1, RYR1, NEB, ASCC1, EXOSC3, STAC3, TTN, DNM2, KLHL40, LMOD, MYO18B
). Pour les autres, soit les analyses moléculaires effectuées jusqu’à ce jour n’ont pas permis d’identifier le gène en cause, soit ce sont des cas très anciens qui n’ont pas pu être étudiés génétiquement, par manque d’échantillon d’ADN.
Parmi les gènes identifiés pour les différents cas de MC, les plus fréquemment rencontrés sont les gènes
MTM1, ACTA1, RYR1
et
NEB
(
Tableau II
) [
3
,
5
-
7
]. On remarque également que dans la période néonatale stricte (, 2 mois de vie), l’étude moléculaire s’est montrée plus pertinente.
Tableau II.
| Myopathies congénitales identifiées |
Nombre total de cas |
Nombre de cas , 2 mois |
Nombre de cas entre 2 et 6 mois |
|
Myopathie congénitale (
MTM1
)
|
17 |
13 |
4 |
|
Myopathie congénitale (
ACTA1
)
|
10 |
6 |
4 |
|
Myopathie congénitale (
RYR1
)
|
10 |
8 |
2 |
|
Myopathie congénitale (
NEB
)
|
7 |
4 |
3 |
|
Myopathie congénitale (
ASCC1
)
|
2 |
2 |
0 |
|
Myopathie congénitale (
EXOSC3
)
|
2 |
1 |
1 |
|
Myopathie congénitale (
STAC3
)
|
2 |
1 |
1 |
|
Myopathie congénitale (
TTN
)
|
2 |
2 |
0 |
|
Myopathie congénitale (
DNM2
)
|
1 |
1 |
0 |
|
Myopathie congénitale (
KLHL40
)
|
1 |
1 |
0 |
|
Myopathie congénitale (
LMOD3
)
|
1 |
1 |
0 |
|
Myopathie congénitale (
MYO18B
)
|
1 |
1 |
0 |
| Total des MC identifiées |
56 |
41 |
15 |
Répartition des gènes incriminés dans l’ensemble des cas de myopathies congénitales et en fonction de l’âge de l’enfant
(, 2 mois, ou 2-6 mois).
|
En dehors des myopathies congénitales structurales, les études moléculaires ont pu être réalisées dans d’autres groupes de maladies ; ainsi un certain nombre de gènes ont pu être identifiés tels que
LAMA2, SMN1, DM1, DMD, CNTNAP1,
etc.
Dans le contexte des erreurs innées du métabolisme, les dosages enzymatiques étaient réalisés régulièrement par les services respectifs, en particulier les complexes de la chaîne respiratoire mitochondriale. Plus tard, les études moléculaires étaient effectuées en systématique aussi bien en utilisant de l’ADN génomique ou de l’ADN mitochondrial. Malheureusement, nous n’avons pas forcément toutes les informations génétiques pour ces cohortes de maladies musculaires métaboliques mais plusieurs anomalies moléculaires ont été constatées, par exemple, dans les gènes
NARP, GFM1, MTO1
.
|
Cette étude rétrospective a permis d’une part de constituer une casuistique d’un important nombre de biopsies musculaires analysées durant la période néonatale et périnatale, et d’autre part, de faire une revue précise des entités pathologiques observées dans cette période ainsi que leur fréquence respective. Sur les 535 cas révisés :
-
82 % des cas ont montré des anomalies spécifiques ou hautement suggestives d’un diagnostic particulier dans la biopsie musculaire ;
-
18 % des cas n’ont pas montré d’anomalie histologique ou ont présenté des anomalies peu significatives.
Nous avons également démontré avec précision la pertinence de l’apport de l’étude en microscopie électronique (décisif, contributif, confirmatif) pour valider un diagnostic définitif, conduire les études moléculaires et orienter la prise en charge des patients. Nous avons réalisé une corrélation directe avec les résultats des études moléculaires effectuées pour chaque cohorte de patients. De plus, cela a permis également d’affirmer ou de confirmer le diagnostic.
Dans le cadre de myopathies congénitales structurales, la fréquence de gènes en cause s’établit comme suit :
MTM1, ACTA1, RYR1, NEB, ASCC1, EXOSC3, STAC3, TTN, DNM2, KLHL40, LMOD, MYO18B
, même s’il reste encore de nombreux cas en cours de caractérisation.
|
Cette étude portant sur la révision des biopsies musculaires effectuées en période néonatale sur une durée de cinquante-deux ans a été possible grâce à l’implication de nombreux autres professionnels. Tout au long de ces années, les travaux des médecins, des chercheurs, des techniciens, des ingénieurs, des étudiants, qui se sont succédée au laboratoire ont contribué aussi bien au diagnostic qu’à la recherche sur les maladies neuromusculaires.
Nous remercions singulièrement le Professeur Michel Fardeau qui a initié en France l’étude des biopsies musculaires chez le tout-petit dans les années 1970 et qui a toujours été « porteur » de nombreuses recherches dans ce domaine. La rigueur de son travail et son enthousiasme communicatif ont été d’une grande impulsion pour nous permettre de poursuivre et de développer ces investigations à ce jour. Nous remercions aussi chaleureusement le Docteur Fernando Tomé qui nous a toujours soutenu dans cette tâche.
Nous sommes particulièrement reconnaissants aux innombrables collègues médecins et chercheurs, qui nous ont confié les biopsies musculaires pour analyse, durant toutes ces années. Merci pour leur confiance, nous nous sommes toujours acharnés afin d’apporter une contribution importante à l’étude de leurs patients.
Les études complémentaires qui ont été faites sur ces patients néonataux, en particulier les analyses moléculaires, ont été réalisées grâce à la collaboration des différentes équipes de génétique moléculaire en France et à l’étranger, particulièrement : les équipes de Jocelyn Laporte, Johann Böhm et Valérie Biancalana à Strasbourg, de Pascale Richard, Corinne Métay et Anne Lombès au GHU-Pitié-Salpêtrière à Paris, de France Leturcq et Jean Claude Kaplan à l’Hôpital Cochin à Paris, de Pascale De Lonlay et Arnold Munnich à l’hôpital Necker-Enfants Malades à Paris, et de Joël Lunardi, Nicole Monnier et John Rendu à Grenoble ; Nigel Laing (Perth, Australie), Carina Wallgren-Pettersson (Finlande).
Nous remercions également l’AFM-Téléthon et l’Association Institut de Myologie pour leur soutien financier.
Nos remerciements vont en priorité à toute l’équipe de l’Unité de Morphologie Neuromusculaire de l’Institut de Myologie située au Pavillon Risler du CHU de la Salpêtrière : Teresinha Evangelista, Emmanuelle Lacène, Clémence Labasse, Anaïs Chanut, Angéline Madelaine, Maud Beuvin, Guy Brochier, et Favienne Borsato-Levy.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Romero
NB
,
Mezmezian
M
,
Fidziańska
A
.
Main steps of skeletal muscle development in the human: Morphological analysis and ultrastructural characteristics of developing human muscle.
.
Handb Clin Neurol.
2013;
;
113
:
:1299.
–
1310
.
2.
Romero
NB
,
Clarke
NF
.
Congenital myopathies.
.
Handb Clin Neurol.
2013;
;
113
:
:1321.
–
1336
.
3.
Böhm
J
,
Vasli
N
,
Malfatti
E
et al.
An Integrated Diagnosis Strategy for Congenital Myopathies.
.
PLoS One.
2013;
;
8
:
:e67527.
.
4.
Biancalana
V
,
Romero
NB
,
Thuestad
IJ
et al.
Some DNM2 mutations cause extremely severe congenital myopathy and phenocopy myotubular myopathy.
.
Acta Neuropathol Commun.
2018;
;
6
:
:93.
.
5.
Hernandez-Lain
A.
,
Husson
I.
,
Monnier
N
et al.
De novo RYR1 heterozygous mutation (I4898T) causing lethal core-rod myopathy in twins.
.
Eur J Med Genet.
2011;
;
54
:
:29.
–
33
.
6.
Labasse
C
,
Brochier
G
,
Taratuto
AL
,
et al.
Severe ACTA1-related nemaline myopathy: intranuclear rods, cytoplasmic bodies, and enlarged perinuclear space as characteristic pathological features on muscle biopsies.
.
Acta Neuropathol Commun.
2022;
;
10
:
:101.0.
.
7.
Shichiji
M
,
Biancalana
V
,
Fardeau
M
et al.
Extensive morphological and immunohistochemical characterization in myotubular myopathy.
.
Brain and Behavior.
2013;
;
3
:
:476.
–
486
.
|