Dans le monde viral, le genre Flavivirus comprend plus de cinquante espèces, dont certaines sont pathogènes pour l’homme, telles que les virus de la fièvre jaune (YFV), de l’encéphalite japonaise (JEV), de la dengue (DENV), ou encore le virus Zika (ZIKV). La plupart sont transmis à l’homme par des arthropodes hématophages, notamment les moustiques, les tiques et les phlébotomes. De nombreuses épidémies dues à un flavivirus sont survenues ces dernières années [ 1 ].
L’aire de répartition du moustique tigre, principal vecteur de DENV et ZIKV, s’étend par l’effet combiné du changement climatique et de la globalisation. Aujourd’hui, ce moustique est présent dans 67 départements de la France métropolitaine et d’outre-mer, ce qui laisse entrevoir la possibilité de futures épidémies de grande ampleur, pouvant atteindre des régions jusque-là épargnées [ 1 ]. À titre d’exemple, 65 cas autochtones d’infection par le DENV ont déjà été enregistrés en métropole en 2022 par Santé Publique France.
Quelques vaccins efficaces sont disponibles pour prévenir les infections par le YFV et le JEV. En revanche, le développement de vaccins contre le DENV est freiné par la réactivité croisée des anticorps dirigés contre les quatre différents sérotypes du virus : les anticorps dirigés contre un sérotype donné inhibent l’infection par les virus du même sérotype, mais pourraient faciliter l’infection par les virus d’autres sérotypes. Enfin, pour de nombreux flavivirus pathogènes, notamment le ZIKV, on ne dispose à ce jour d’aucun moyen de prophylaxie. Il convient donc de développer d’autres stratégies thérapeutiques permettant d’inhiber l’infection par les flavivirus, et si possible d’identifier des molécules à large spectre, capables d’inhiber plusieurs, voire tous les flavivirus émergents ou ré-émergents.
Nous nous sommes intéressés au ZIKV. À la suite des épidémies dues à ce virus dans les îles du Pacifique et en Amérique en 2015, il a été montré que l’infection par le ZIKV peut entraîner une microcéphalie chez le fœtus, ou conduire au développement de maladies neurologiques, telles que le syndrome de Guillain-Barré, conséquences de la capacité du virus à franchir la barrière hémato-encéphalique et à pénétrer dans le système nerveux central [ 2 ] ( → ).
(→) Voir la Synthèse de F. Gosselet, m/s n° 4, avril 2017, page 423
Nous avions précédemment montré que la claudine-7, une protéine des jonctions intercellulaires serrées, favorise l’infection par le ZIKV des cellules endothéliales des vaisseaux cérébraux et périphériques in vitro [ 3 ]. L’implication des claudines dans l’infection par d’autres Flaviviridae avait d’ailleurs été rapportée auparavant [ 4 , 5 ]. Nous avons synthétisé des peptides dérivés de la séquence de différentes claudines [ 5 ], et avons montré que deux peptides dérivés des domaines N-terminaux de la claudine-1 (CL1.1) et de la claudine-7 (CL7.1) ont un potentiel antiviral [ 6 ]. Cet effet est d’autant plus intéressant que ces peptides sont capables d’inhiber l’infection par le ZIKV sans distinction du type cellulaire (cellules épithéliales ou endothéliales, d’origine humaine ou animale) ou du lignage du virus (ZIKV africain ou asiatique). Le peptide CL1.1 inhibe également l’infection par d’autres flavivirus, comme le JEV et le YFV, in vitro ( Figure 1A ), et avait précédemment été décrit comme inhibant partiellement l’infection par le virus de l’hépatite C [ 5 ], un autre membre de la famille des Flaviviridae . Nous avons vérifié que l’inhibition par CL1.1 était spécifique des flavivirus : le peptide est inefficace contre l’infection par d’autres virus phylogénétiquement distants, tels que le VIH-1 (virus de l’immunodéficience humaine de type 1) ou le SARS-CoV-2 ( severe acute respiratory syndrome-related coronavirus-2 ) [ 6 ]. Nous avons alors cherché à comprendre le mécanisme de l’effet inhibiteur de ce peptide.
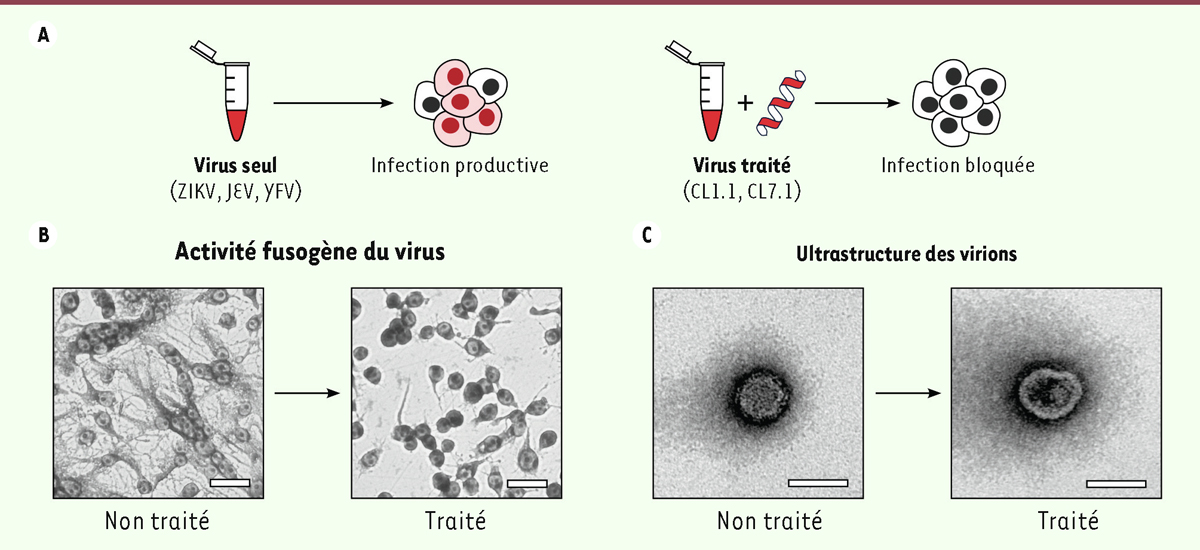
| Figure 1.
Effet du traitement d’un flavivirus par des peptides dérivés des claudines. A.
Le traitement d’un inoculum d’un flavivirus, comme le ZIKV, avec le peptide CL1.1 (dérivé de la claudine-1) ou CL7.1 (dérivé de la claudine-7) inhibe l’infection par ce virus.
B.
La capacité du ZIKV traité par le peptide à induire la fusion de cellules d’
Aedes albopictus
de la lignée C6/36 a été testée : le traitement bloque l’activité fusogène du virus dépendante du pH. Barre d’échelle : 25 µm.
C.
L’analyse de la structure de virions de ZIKV par microscopie électronique à transmission révèle un changement de densité électronique de l’enveloppe ainsi qu’une perte de la sphéricité des particules virales. Barre d’échelle : 50 nm.
|
Le peptide CL1.1 n’agit pas sur la cellule cible : le prétraitement d’un tapis cellulaire avec ce peptide ne permet pas d’inhiber l’infection par le ZIKV. Le peptide n’a également aucun effet sur l’attachement du ZIKV à la membrane de la cellule cible ou sur l’internalisation du virus par cette dernière, ce qui suggérait une action du peptide à une étape tardive de l’entrée des virions. Nous avons supposé que le peptide agit en inhibant la fusion du virus à sa cellule cible, ce qui expliquerait l’efficacité inhibitrice du peptide quelle que soit la cible cellulaire considérée. Nous avons utilisé des cellules de moustique Aedes albopictus de la lignée C6/36 pour étudier cette étape de fusion, grâce à un système qui avait précédemment permis de découvrir des molécules inhibant la fusion viro-induite [ 7 ]. Du fait de sa composition moléculaire, la membrane plasmique des cellules d’insectes est plus fluide que celle des cellules de mammifères [ 8 ] ; ainsi, si une particule virale est au contact de deux cellules adjacentes, l’activation des protéines de fusion virale sous l’effet d’un pH acide permet la fusion des deux cellules et la formation d’un syncytium. Nous avons montré qu’en présence du peptide CL1.1, la fusion virale dépendante du pH était fortement réduite ( Figure 1B ).
Une analyse par microscopie électronique à transmission a montré que le traitement des particules de ZIKV avec le peptide CL1.1 induit un changement structurel des virions. Nous avons notamment observé une perte de l’aspect sphérique et lisse des particules virales, ainsi qu’une baisse de la densité électronique de l’enveloppe virale ( Figure 1C ). Néanmoins, ce changement de structure ne s’accompagne pas d’une perte de l’intégrité du virion : un traitement à la RNAse A a montré que l’ARN viral reste protégé par l’enveloppe virale.
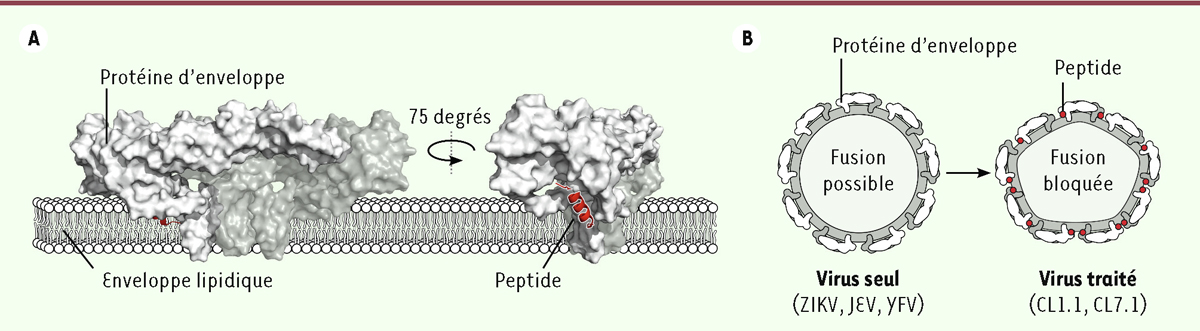
Cela nous a conduits à proposer que les peptides dérivés de la claudine interagissent avec la protéine d’enveloppe virale et bloquent ainsi la fusion. La modélisation de l’interaction entre le peptide CL1.1 et la protéine d’enveloppe du ZIKV en utilisant un logiciel de docking détermine une interaction entre le peptide et la tige d’ancrage de la protéine d’enveloppe, dans une poche située à proximité des phospholipides de l’enveloppe lipidique ( Figure 2A ). Le modèle suggère que CL1.1, qui forme une hélice α présentant une face hydrophobe et une face hydrophile (peptide amphiphile), forme ainsi un « pont » entre la protéine d’enveloppe et l’enveloppe lipidique du virus, ce qui inhiberait le changement conformationnel de la protéine d’enveloppe ou le changement de courbure de l’enveloppe lipidique ( Figure 2B ), deux phénomènes clés de la fusion virale, et précédemment ciblés dans le développement de molécules antivirales [ 9 ]. Étant donné la conservation de la structure de la protéine d’enveloppe entre les différents flavivirus, ce modèle concorde avec le large spectre antiviral du peptide.
| Figure 2.
Modèle d’interaction entre les peptides dérivés des claudines et les flavivirus. A.
La protéine d’enveloppe du ZIKV (en blanc) est organisée en dimères disposés tête-bêche (un des monomères est représenté en pleine couleur et le second est semi-transparent). L’interaction entre le peptide (en rouge) et la protéine d’enveloppe du ZIKV a été prédite à l’aide d’un logiciel de
docking
. Les peptides dérivés des claudines interagiraient au niveau d’une poche de la tige d’ancrage de la protéine, à proximité de l’enveloppe lipidique. Deux angles de vue du modèle sont présentés.
B.
Modèle de l’interaction entre les peptides dérivés des claudines et les flavivirus.
|
Des peptides amphiphiles dérivés de la séquence des claudines ont donc une action antivirale contre plusieurs flavivirus in vitro . Le peptide CL1.1 ne pourra vraisemblablement pas être utilisé tel quel à des fins thérapeutiques à cause de son instabilité in vivo , bien que nous ayons montré que son énantiomère constitué d’acides aminés de série D, moins sensible à l’action des protéases in vivo [ 10 ], possède la même capacité antivirale que le peptide « naturel » ( i.e. de série L). Néanmoins, le mécanisme de « forçage conformationnel » que nous avons décrit peut servir de base au développement de nouvelles stratégies thérapeutiques ciblant les flavivirus, et d’autres molécules possédant une telle propriété pourraient contribuer à l’arsenal thérapeutique en prévision d’une future épidémie.