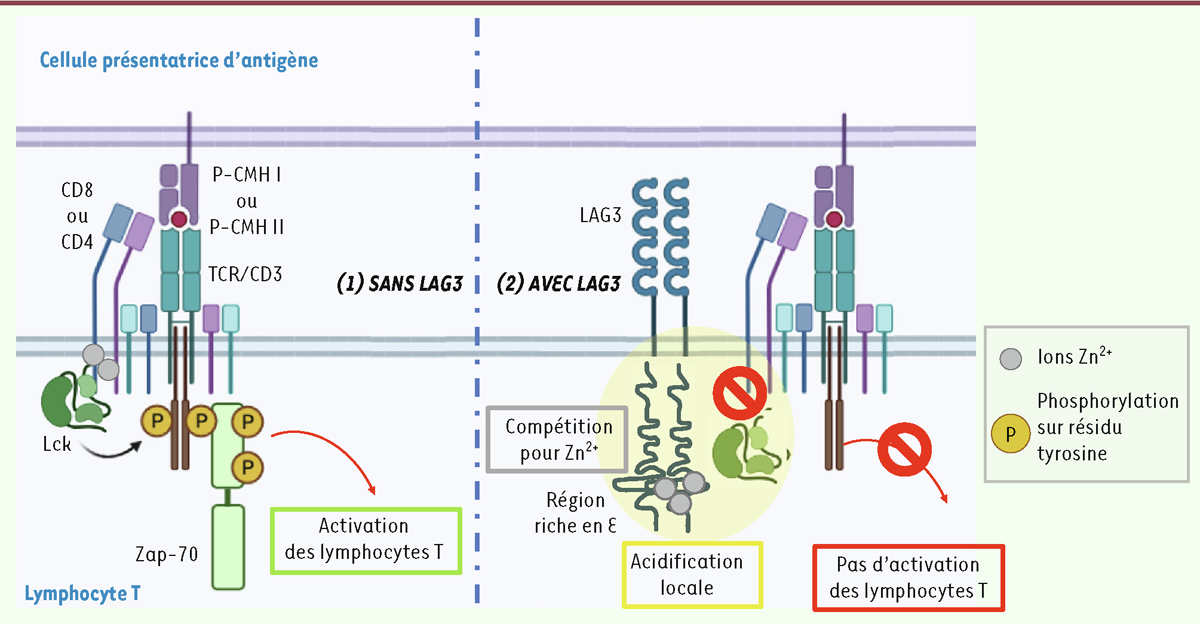
La protéine transmembranaire LAG3 ( lymphocyte activation gene 3 , ou CD223), identifiée en 1990 [ 1 ], inhibe l’activation des lymphocytes T [ 2 ]. Elle est exprimée par les lymphocytes T CD4 + et CD8 + conventionnels, les lymphocytes T régulateurs activés, les lymphocytes Natural Killer (NK) et NK invariants, ainsi que d’autres cellules immunitaires ou non immunitaires. L’expression de LAG3 est induite par l’activation chronique des lymphocytes T, et, en cas de cancer, son expression par les lymphocytes infiltrant la tumeur est souvent associée à un mauvais pronostic. Comme les protéines PD-1 ( programmed cell death 1 ) et CTLA-4 ( cytolytic T-lymphocyte-associated protein 4 ), LAG3 est répertorié comme inhibiteur de point de contrôle immunitaire et constitue une cible thérapeutique pour l’immunothérapie du cancer [ 3 , 4 ]. Une étude récente apporte un éclairage sur les mécanismes moléculaires, jusqu’ici énigmatiques, à l’origine des effets inhibiteurs de LAG3 sur l’activation des lymphocytes T [ 5 ]. Les auteurs montrent que ces effets ne nécessitent pas la liaison de LAG3 aux molécules du complexe majeur d’histocompatibilité de classe II (CMH II), l’un de ses ligands connus, et mettent en évidence le rôle d’un domaine intracytoplasmique de LAG3, phylogénétiquement conservé, enrichi en acide glutamique, dans l’activité inhibitrice de la protéine. Ce domaine est responsable d’une diminution locale du pH à proximité du TCR ( T cell receptor ), mais aussi d’une séquestration des ions zinc (Zn 2+ ) : ces deux évènements induisent la dissociation de la kinase Lck ( lymphocyte-specific protein tyrosine kinase ) des corécepteurs CD8 et CD4 du TCR, empêchant ainsi le déclenchement de la signalisation par le TCR. Les auteurs suggèrent également la possibilité que ce domaine de LAG3 séquestre les cations Zn 2+ essentiels à la liaison de Lck à CD8 ou à CD4. Ainsi, les effets inhibiteurs de LAG3 sur l’activation des lymphocytes T ne seraient pas directement liés à un signal inhibiteur intrinsèque de la molécule, mais plutôt à la perturbation, par cette protéine, du signal déclenché par le TCR et ses co-récepteurs ( Figure 1 ).
| Figure 1.
À gauche :
en l’absence de LAG3, l’association de Lck avec les co-récepteurs CD4 et CD8 du TCR (
T cell receptor
) permet la phosphorylation des motifs ITAM (
immunoreceptor tyrosine-based activation motif
) des complexes CD3/ζ. Cela induit le recrutement de la tyrosine kinase ZAP-70 et le déclenchement de la cascade de signalisation conduisant à l’activation des lymphocytes T.
À droite :
lorsque la molécule LAG3 est exprimée par les lymphocytes T, sa présence à proximité des co-récepteurs CD4 et CD8, qui ne dépend pas de la liaison de LAG3 aux molécules du complexe majeur d’histocompatibilité de classe II (CMH II), induit une dissociation de Lck des co-récepteurs. Elle conduit à l’absence d’activation de la cascade de signalisation, donc à l’absence d’activation des lymphocytes T. Cette dissociation dépend du domaine intracytoplasmique de LAG3, riche en acide glutamique (E), qui induit une acidification locale à proximité des co-récepteurs CD4 et CD8. Cette région C-terminale riche en E, à laquelle se lie également l’ion Zn
2+
, peut entrer en compétition avec Lck pour la liaison de ce cation divalent, perturbant l’association de Lck aux co-récepteurs. P-CMH I, P-CMH II : complexes moléculaires entre peptides et molécules du CMH de classe I ou de classe II (figure élaborée avec BioRender et adaptée de [
13
]).
|
Le gène Lag3 est proche du gène Cd4 dans le génome de la plupart des espèces et a probablement évolué par duplication génique. Les domaines extracellulaires de LAG3 et de CD4 ont une homologie, alors que leurs domaines intracytoplasmiques ne présentent aucune similitude. LAG3 est dépourvu du motif (contenant deux résidus cystéine) responsable de l’association de CD4 avec Lck. Comme CD4, LAG3 se lie aux protéines du CMH II et, plus précisément, à des complexes stables entre peptides et CMH II [ 6 ]. Cependant, comme l’illustrent les effets inhibiteurs de LAG3 sur les lymphocytes T CD8 + , ces effets inhibiteurs ne semblent pas dus à une compétition entre LAG3 et CD4 pour la liaison aux protéines du CMH II.
Les mécanismes impliqués dans l’inhibition de l’activation des lymphocytes T par LAG3 étaient inconnus jusqu’à présent. Guy et al. montrent que les lymphocytes T CD4 + et les lymphocytes T CD8 + isolés de souris mutantes dépourvues de LAG3 (souris Lag3 -/- ) et exposés à des anticorps anti-CD3+CD28 activateurs en l’absence de cellules présentatrices d’antigène CMH II + , prolifèrent davantage que les lymphocytes T provenant de souris non mutantes [ 5 ]. Ces lymphocytes T Lag3 -/- présentent également une signalisation accrue en aval du TCR, comme l’indiquent un flux d’ions Ca 2+ plus élevé et la phosphorylation de protéines de signalisation clés. Ces résultats confirment que les effets inhibiteurs de LAG3 sur l’activation des lymphocytes T ne passent pas par sa liaison aux molécules du CMH II. Cependant, ils n’excluent pas la possibilité que d’autres ligands de LAG3, tels que FGL1 ( fibrinogen-like protein 1 ), LSECtin ( liver and lymph node sinusoidal endothelial cell C-type lectin ) ou la galectine-3, qui sont potentiellement présents dans le milieu de culture des cellules, soient impliqués. Une analyse des effets inhibiteurs de molécules chimériques comportant les domaines transmembranaire et intracellulaire de LAG3 associés à un domaine extracellulaire non apparenté, dans des lymphocytes T Lag3 -/- , pourrait permettre de répondre à cette question.
Le domaine intracellulaire de LAG3, bien qu’essentiel pour sa fonction inhibitrice, est dépourvu de motifs inhibiteurs typiques. Cependant, il contient plusieurs séquences d’acides aminés phylogénétiquement conservées qui ne sont pas partagées par d’autres co-récepteurs inhibiteurs : une séquence FSAL (Phe-Ser-Ala-Leu) dans la région juxtamembranaire, une séquence KIEELE (Lys-Ileu-Glu-Glu-Leu-Glu) dans la région centrale, et dix à quinze répétitions en tandem d’acide glutamique (E) dans la région C-terminale de la protéine. Le rôle du motif KIEELE dans la fonction inhibitrice de LAG3 a été rapporté [ 7 ]. Dans une autre étude, ce motif ne semblait pas impliqué, mais c’est le rôle de la séquence FSAL qui était mis en avant [ 8 ]. En revanche, les deux études montraient que la région C-terminale riche en E était nécessaire aux effets inhibiteurs de LAG3 [ 7 , 8 ]. Dans leur récente étude, Guy et al . élucident les mécanismes de l’implication de cette région [ 5 ]. En utilisant la microscopie de super résolution, ces auteurs montrent que LAG3 s’associe aux complexes TCR-CD3 à la synapse immunitaire, avec une stœchiométrie de plus de dix molécules LAG3 pour un complexe TCR-CD3. Cette association a été mise en évidence dans des lymphocytes T activés. Il reste à déterminer si cette association existe aussi dans les lymphocytes T quiescents, et si ce n’est pas le cas, quels sont les mécanismes à l’origine de cette association : modification post-traductionnelle de LAG3, remodelage du cytosquelette, recrutement de la réserve intracellulaire de LAG3, ou autres facteurs.
En utilisant des bi-couches lipidiques présentant les molécules nécessaires à la formation de la synapse immunitaire, les auteurs montrent que le domaine intracytoplasmique de LAG3 interagit étroitement avec les co-récepteurs CD4 et CD8, et induit leur regroupement [ 5 ]. Cette interaction dépend de la région C-terminale riche en E de LAG3. Cette région est également responsable de la dissociation de la tyrosine kinase Lck des co-récepteurs, comme le montrent l’association accrue de Lck avec les co-récepteurs dans les lymphocytes T CD4 + et CD8 + Lag3 -/- ainsi que l’induction, par des peptides identiques à la région riche en E de LAG3, d’une dissociation de Lck de complexes CD4-Lck préformés. Ainsi, en induisant localement la dissociation de Lck des co-récepteurs du TCR, LAG3 limite la phosphorylation de substrats clés, tels que les ITAM ( immunoreceptor tyrosine-based activation motif ) des complexes CD3/ζ et la tyrosine kinase ZAP70, et interrompt très tôt la cascade de signalisation induite par le TCR ( Figure 1 ). Comme les complexes TCR-CD3 se lient à Lck [ 9 ] et que LAG3 est plus proche de ces complexes que des co-récepteurs du TCR [ 4 ], LAG3 pourrait également perturber l’association de Lck avec les complexes TCR-CD3. Il est important d’explorer cette possibilité, car si elle est confirmée, elle pourrait aider à concevoir des récepteurs antigéniques chimériques (CAR) insensibles aux signaux inhibiteurs de LAG3.
Une indication sur la façon dont le domaine intracytoplasmique de LAG3 induit la dissociation de Lck des co-récepteurs CD4 et CD8 est venue du constat que l’addition de cations divalents, notamment Zn 2+ , bloquait la dissociation de Lck induite par LAG3, et que les ions Zn 2+ peuvent se lier, bien que faiblement, à la région C-terminale de LAG3 riche en résidus E. L’association de Lck avec les co-récepteurs CD4 et CD8 du TCR étant dépendante de l’ion Zn 2+ [ 10 ], ces résultats suggèrent que la région C-terminale de LAG3, lorsqu’elle est proche de ces co-récepteurs, entre en compétition avec eux pour la liaison de Zn 2+ , ce qui induirait une dissociation du complexe Lck-co-récepteurs et l’inhibition des lymphocytes T. De plus, les auteurs notent que les nombreux résidus E de la partie C-terminale de LAG3 lui confèrent un point isoélectrique faible et font l’hypothèse que cette caractéristique abaisse le pH dans l’environnement direct de la protéine. En utilisant la spectroscopie par résonance magnétique nucléaire bidimensionnelle, les auteurs ont montré qu’une diminution du pH induisait une dissociation des complexes CD4-Lck [ 5 ]. Ils ont également montré que le pH est diminué à la synapse immunitaire, que cette diminution est réduite dans des lymphocytes T Lag3 -/- ainsi que dans des lymphocytes T exprimant un variant de LAG3 dépourvu du domaine riche en résidus E [ 5 ]. Ainsi, ils concluent que le domaine de LAG3 riche en résidus E, en diminuant le pH dans l’environnement des co-récepteurs CD4 et CD8, induit la dissociation de Lck de ces co-récepteurs. Cependant, une autre interprétation des résultats peut être proposée. Les domaines intracellulaires riches en résidus E sont connus pour contrôler le trafic intracellulaire des protéines des endosomes vers les lysosomes. Le transport de LAG3 vers des compartiments lysosomiques, où sa présence a été rapportée [ 11 ], pourrait dépendre de son domaine riche en E. Le recrutement, à la membrane synaptique, de LAG3 contenu dans des lysosomes, dont le pH est faible, pourrait alors contribuer à l’acidification des membranes synaptiques et à la séparation de Lck des co-récepteurs du TCR. En l’absence du domaine de LAG3 riche en E, ces lysosomes ne seraient pas recrutés, et le pH à proximité du TCR et de ses co-récepteurs CD4 et CD8 ne serait pas modifié.
Dans tous les cas, une acidification locale de la membrane synaptique, dépendante de LAG3, pourrait également modifier l’association de Lck à d’autres molécules. Par exemple, les molécules CD38 et LAT ( linker for activation of T cells ), qui s’associent à Lck, sont présentes à la synapse immunitaire et jouent un rôle dans l’activation des lymphocytes T. Il conviendrait aussi de rechercher si d’autres protéines contenant des domaines riches en résidus E ont des effets inhibiteurs similaires à ceux de LAG3. Cela permettrait de caractériser de nouveaux acteurs dans le contrôle de l’activation des lymphocytes T.
Enfin, ces résultats sont particulièrement pertinents car la protéine LAG3 est une cible « chaude » pour l’immunothérapie anticancéreuse. Actuellement, plus de cent essais cliniques sont en cours, et la plupart d’entre eux utilisent des anticorps monoclonaux antagonistes qui bloquent l’interaction de LAG3 avec les molécules du CMH II [ 12 ]. De nouvelles stratégies reposant sur la découverte rapportée dans l’article de Guy et al. [ 5 ] pourraient conduire à une meilleure efficacité de l’immunothérapie ciblant LAG3.