| |
| Med Sci (Paris). 38(12): 1065–1068. doi: 10.1051/medsci/2022156.Le canal ionique Piezo1 est le capteur des forces mécaniques dans les vaisseaux capillaires cérébraux Daniel Henrion1* 1Université d’Angers, laboratoire MITOVASC (équipe CarMe), Inserm U1083, CNRS UMR 6015
,
Angers
,
France MeSH keywords: Humains, Canaux ioniques, Système cardiovasculaire, Encéphale, Mécanotransduction cellulaire, métabolisme |
Mécanotransduction cellulaire Les cellules vivantes sont en lien direct avec leur environnement et en particulier avec les forces mécaniques induites, directement ou non, par la gravité. Les forces physiques sont détectées par la cellule aux points d’adhérence avec son environnement, puis transmises au milieu intracellulaire, où elles sont traduites en signaux biochimiques. La réponse de la cellule à ces signaux modifie son fonctionnement et éventuellement sa structure selon la durée et l’intensité du stimulus mécanique. Pression et flux liquidiens sont à l’origine des principales forces mécaniques agissant sur la paroi des vaisseaux sanguins. Alors que la pression agit sur toute la paroi vasculaire, le flux sanguin produit une force de cisaillement à la surface des cellules endothéliales qui tapissent la face interne de la paroi des vaisseaux. La signalisation cellulaire induite par cette force contribue au fonctionnement normal de la cellule endothéliale, garantissant le bon écoulement du sang dans le vaisseau. En présence d’un flux sanguin physiologique, la cellule endothéliale a un phénotype vasodilatateur, anti-inflammatoire, anti-oxydant et anticoagulant.
Les forces de cisaillement sont « ressenties » par des mécanosenseurs qui restent mal connus. Le glycocalyx, qui recouvre la cellule endothéliale, est un complexe de glycosaminoglycanes et protéoglycanes qui transmettent la force de cisaillement aux mécanosenseurs de la membrane plasmique qui, à leur tour, transmettent le signal vers des voies de vasodilatation pour une réponse immédiate, et vers des voies de signalisation nucléaire pour un changement de structure de la cellule endothéliale et, éventuellement, de la paroi vasculaire. On savait que des canaux ioniques jouent un rôle majeur dans cette mécanotransduction : de nombreux canaux directement mécanosensibles ou activés par d’autres mécanosenseurs ont en effet été décrits. Il s’agit de canaux cationiques non sélectifs ou de canaux calciques, qui permettent d’activer la réponse cellulaire [
1
]. La découverte des canaux Piezo a constitué une étape majeure pour la compréhension du processus de mécanotransduction.
|
Les canaux ioniques Piezo
Les canaux Piezo1 et Piezo2 ont été découverts en 2010 par Bertrand Coste [
2
,
10
] (
→
) sous la direction de Ardem Patapoutian (prix Nobel de physiologie ou médecine en 2021) [
11
] (
→
) au
Scripps Research Institute
(États-Unis). Ces chercheurs ont montré que la probabilité d’ouverture de ces canaux est augmentée par la déformation de la membrane plasmique provoquée par des changements de pression. Piezo1 est présent dans les cellules des tissus périphériques, comme les cellules endothéliales, alors que Piezo2 est surtout exprimé dans les neurones mécanosensoriels [
3
]. Il s’agit de canaux cationiques mixtes permettant l’entrée d’ions sodium (Na
+
) et d’ions calcium (Ca
2+
). Depuis leur découverte, de nombreux travaux ont montré leur importance dans la plupart des organes [
4
]. Piezo1 est de première importance dans le contrôle de l’homéostasie vasculaire. L’équipe d’Ardem Patapoutian a aussi montré qu’il était indispensable à la mécanotransduction des forces de cisaillement par les cellules endothéliales [
5
]. Dans ces cellules, le flux sanguin active l’entrée d’ions Ca
2+
par le canal Piezo1, ce qui active l’oxyde nitrique (NO) synthase qui produit le NO, un vasodilatateur rapide et puissant (
Figure 1A
). Piezo1 a une structure caractéristique en forme d’hélice, dont les pales seraient des domaines mécanosensibles [
6
]. La transfection de Piezo1 dans des cellules non vasculaires (les cellules HEK 293
1,
) les rend sensibles aux forces de cisaillement, ce qui suggère que Piezo1 est directement mécanosensible. À l’opposé, chez des souris mutantes rendues déficientes en Piezo1 dans les cellules endothéliales, ces dernières perdent leur capacité à détecter le flux sanguin, ce qui provoque la mort de l’embryon dès que l’arbre vasculaire se développe [
3
]. Plusieurs mutations dans le gène codant Piezo1 sont associées à des maladies humaines, dont une dysplasie lymphatique congénitale [
4
]. Au cours de la dernière décennie, plusieurs études ont montré le rôle clé du canal Piezo1 dans les cellules endothéliales des artères périphériques, et ce canal serait impliqué dans le développement de l’athérosclérose et dans l’hypertension artérielle [
4
].
(→) Voir la Nouvelle de B. Coste,
m/s
n° 12, décembre 2012, page 1056
(→) Voir le Repères de B. Coste,
m/s
n° 1, janvier 2022, page 96
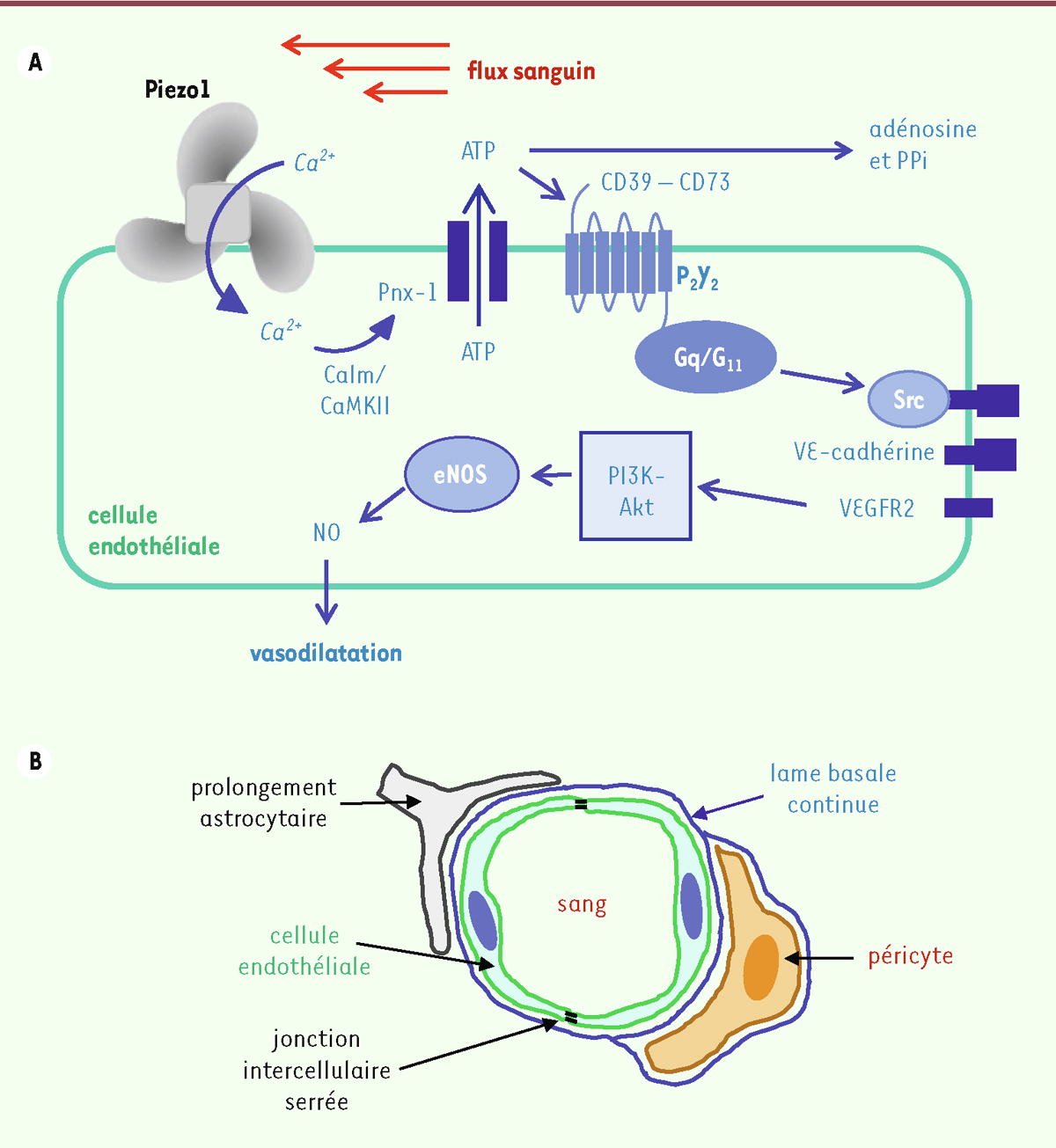
 | Figure 1.
Implication du canal ionique Piezo1 dans la réponse des cellules endothéliales au flux sanguin. A.
Le flux sanguin produit, à la surface de la cellule endothéliale, une force de cisaillement, qui active Piezo1 et provoque une entrée d’ions calcium (Ca
2+
) dans la cellule. L’entrée de Ca
2+
entraîne,
via
la calmoduline (Calm) et sa kinase (Calm/CaMKII), une sortie d’ATP par des canaux constitués de panexine-1 (Pnx-1). L’ATP active un récepteur purinergique (P
2
Y
2
), avant d’être dégradé en adénosine et en pyrophosphate inorganique (PPi), tous deux vasculoprotecteurs. P
2
Y
2
active,
via
les protéines Gq et G11, la protéine tyrosine kinase Src, la VE (
vascular endothelial
)-cadhérine et le récepteur VEGFR2 du VEGF (
vascular endothelial growth factor
), puis la phosphorylation de la NO synthase (eNOS) par la voie des kinases PI3K (
phosphatidylinositol 3-kinase
) et Akt (
protein kinase B
), et donc la production d’oxyde nitrique (NO), qui induit une relaxation du muscle lisse vasculaire.
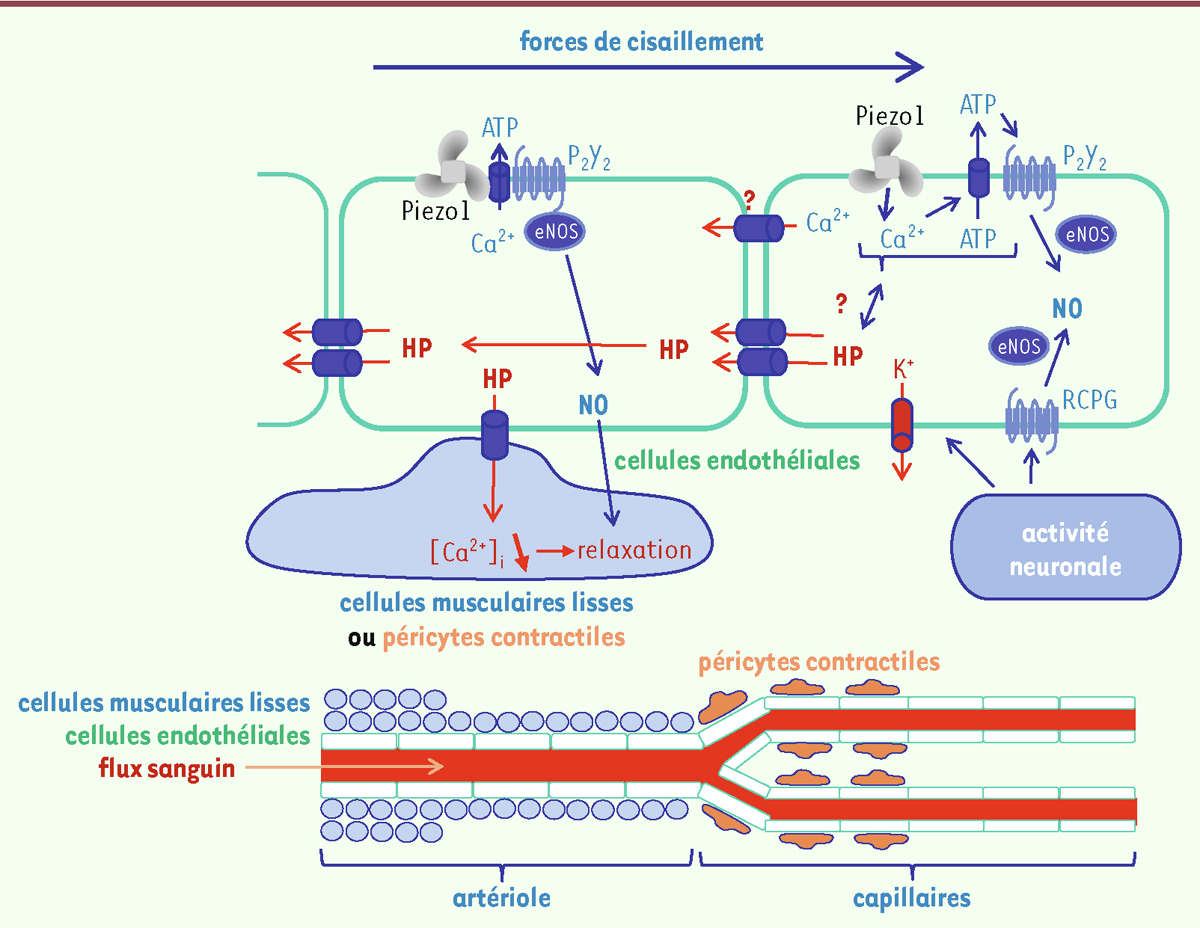
B. Structure des capillaires cérébraux.
La paroi des capillaires cérébraux est composée d’un endothélium entouré d’une lame basale continue. Les cellules endothéliales sont unies par des jonctions intercellulaires serrées. Les péricytes, nombreux dans les capillaires cérébraux, entourent l’endothélium. Ils contrôlent les échanges entre le sang et les tissus et participent, grâce à leur appareil contractile simple, au contrôle du débit sanguin dans les capillaires. Les astrocytes émettent des prolongements cellulaires entourant les capillaires cérébraux. Ils participent aux échanges avec le tissu cérébral et au contrôle de la barrière hémato-encéphalique.
|
|
Piezo1 dans le système vasculaire cérébral
Néanmoins, on ne savait toujours pas si Piezo1 était présent et fonctionnel dans les vaisseaux du système nerveux central, en particulier dans les capillaires. Le cerveau utilise un réseau vasculaire superficiel interconnecté, qui permet d’orienter le flux sanguin vers chaque région cérébrale en profondeur en fonction de ses besoins métaboliques. Les artérioles pénètrent orthogonalement dans le cerveau pour se ramifier, jusqu’à former les vaisseaux capillaires (
Figure 1B
). On savait que la demande métabolique des neurones orientait le débit sanguin, mais on ne savait pas si la mécanotransduction décrite dans les cellules endothéliales des vaisseaux périphériques existait aussi dans la microcirculation cérébrale, et on en connaissait mal les acteurs.
L’étude issue du laboratoire de Mark Nelson à l’université du Vermont (États-Unis) montre que le canal Piezo1 est présent et fonctionnel dans les cellules endothéliales des artères, des capillaires et des veines du cerveau [
7
]. Elle montre aussi qu’une augmentation de pression et de débit intravasculaires provoque une augmentation de la concentration intracellulaire d’ions Ca
2+
dans les cellules endothéliales des capillaires de la rétine. Les auteurs suggèrent qu’à côté de la vasodilatation induite par l’activité neuronale, il pourrait exister, dans les capillaires cérébraux, un mécanisme similaire à la dilatation dépendante du flux sanguin qui avait été auparavant mise en évidence dans les vaisseaux périphériques, avec l’activation de Piezo1 et une entrée d’ions Ca
2+
conduisant à la production de NO vasodilatateur (
Figure 2
). Cependant, les cellules endothéliales des capillaires ne sont pas toutes proches de cellules musculaires lisses ou de péricytes contractiles, et la molécule NO est très instable. Bien sûr, le signal calcique pourrait être transmis de façon rétrograde vers d’autres cellules endothéliales situées en amont, mais cela reste à montrer. De plus, l’activation de Piezo1 provoque l’entrée d’ions Ca
2+
et d’ions Na
+
dans les cellules endothéliales puisqu’il s’agit d’un canal cationique non sélectif, ce qui conduit à une dépolarisation de ces cellules. Or, il a été montré que l’activité neuronale provoque une hyperpolarisation de ces cellules, transmise aux cellules endothéliales situées en amont, puis aux péricytes et cellules musculaires lisses, qui se relâchent alors, ce qui induit une augmentation du débit sanguin [
1
] (
Figure 2
). On peut faire l’hypothèse que cette hyperpolarisation provoquant à distance une vasodilatation et une augmentation du flux sanguin qui active Piezo1, donc une entrée de cations dépolarisante, qui contrecarrerait l’augmentation de flux sanguin induite par l’activité neuronale. L’activation de Piezo1 exercerait ainsi un rétrocontrôle sur l’hyperpolarisation induite par l’activité neuronale. Il reste beaucoup à faire pour préciser le rôle de Piezo1 dans le contrôle du débit sanguin cérébral, notamment la mesure des courants ioniques et de la production de NO spécifiquement dans les capillaires cérébraux, ainsi que celle des débits sanguins locaux dans le cerveau des souris mutantes rendues déficientes en Piezo1 dans les cellules endothéliales.
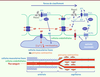 | Figure 2.
Piezo1 dans le contrôle du débit sanguin capillaire.
L’activité neurale produit, d’une part, des agents vasodilatateurs activant des récepteurs couplés aux protéines G (RCPG) qui induisent une production d’oxyde nitrique (NO), et, d’autre part, une hyperpolarisation (HP)
via
la sortie d’ions potassium (K
+
) dans le milieu extracellulaire. Cette hyperpolarisation, transmise aux cellules endothéliales situées en amont, par les jonctions intercellulaires communicantes, peut induire, à distance, la relaxation des péricytes contractiles entourant les capillaires proximaux, et celle des cellules musculaires lisses entourant les artérioles (le schéma du bas représente la circulation pré-capillaire et capillaire).
Par ailleurs, le débit sanguin,
via
les forces de cisaillement qu’il provoque, active le canal Piezo1 des cellules endothéliales (voir
Figure 1
), produisant une entrée d’ions Ca
2+
et la production de NO. Ce dernier peut directement induire la relaxation des péricytes contractiles entourant les capillaires proximaux et celle des cellules musculaires lisses entourant les artérioles. Comment interagissent la voie de signalisation activée par le flux sanguin et celle activée par l’activité neuronale ? Il pourrait exister une transmission du signal calcique vers les cellules endothéliales situées en amont, ou une interaction entre la dépolarisation (par l’entrée d’ions Ca
2+
et Na
+
) et l’hyperpolarisation (par la sortie d’ions K
+
), deux phénomènes
a priori
antagonistes.
|
|
Dans les cellules endothéliales de l’aorte humaine, Piezo1 active des voies de signalisation protectrices contre l’athérome ou athérogènes, selon que le flux est laminaire ou turbulent [
8
]. Dans la circulation cérébrale, Piezo1 pourrait détecter des diminutions soutenues du débit sanguin, des à-coups, ou même des inversions de flux, comme cela se produit dans certaines maladies telles que la maladie d’Alzheimer. Par ailleurs, compte tenu de la présence de Piezo1 dans les vaisseaux rétiniens, il conviendra de déterminer son interaction avec les voies de signalisation activées par la lumière. Enfin, les dysfonctionnements mitochondriaux qui engendrent des troubles neurologiques ou une cécité sont eux aussi associés à une déficience de la mécanotransduction dépendante du flux sanguin [
9
]. La compréhension du rôle de Piezo1 dans ces maladies devrait en améliorer l’approche thérapeutique.
La découverte du rôle de Piezo1 dans les capillaires cérébraux constitue une avancée majeure pour la compréhension du couplage neuro-vasculaire et la physiopathologie cérébro-vasculaire. Cependant, les agents pharmacologiques pouvant cibler Piezo1 ont une faible affinité et sont aussi peu solubles qu’instables, ce qui les rend inutilisables
in vivo
[
3
]. En attendant de disposer des bons outils pharmacologiques, les multiples études en cours devraient permettre d’améliorer nos connaissances sur le rôle de Piezo1 dans de nombreux types cellulaires. Cette histoire ne fait que commencer…
|
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Jackson
WF
.
Endothelial ion channels and cell-cell communication in the microcirculation.
.
Front Physiol.
2022;
;
13
:
:805149.
.
2.
Coste
B
,
Mathur
J
,
Schmidt
M
et al.
Piezo1 and Piezo2 are essential components of distinct mechanically activated cation channels.
.
Science.
2010;
;
330
:
:55.
–
60
.
3.
Douguet
D
,
Patel
A
,
Xu
A
et al.
Piezo ion channels in cardiovascular mechanobiology.
.
Trends Pharmacol Sci.
2019;
;
40
:
:956.
–
970
.
4.
Song
S
,
Zhang
H
,
Wang
X
,
et al
.
The role of mechanosensitive Piezo1 channel in diseases.
.
Prog Biophys Mol Biol.
2022;
;
172
:
:39.
–
49
.
5.
Ranade
SS
,
Qiu
Z
,
Woo
SH
et al.
Piezo1, a mechanically activated ion channel, is required for vascular development in mice.
.
Proc Natl Acad Sci USA.
2014;
;
111
:
:10347.
–
10352
.
6.
Zhao
Q
,
Zhou
H
,
Chi
S
et al.
Structure and mechanogating mechanism of the Piezo1 channel.
.
Nature.
2018;
;
554
:
:487.
–
492
.
7.
Harraz
OF
,
Klug
NR
,
Senatore
AJ
,
et al.
Piezo1 is a mechanosensor channel in central nervous system capillaries.
.
Circ Res.
2022;
;
130
:
:1531.
–
46
.
8.
Albarran-Juarez
J
,
Iring
A
,
Wang
S
et al.
Piezo1 and Gq/G11 promote endothelial inflammation depending on flow pattern and integrin activation.
.
J Exp Med.
2018;
;
215
:
:2655.
–
2672
.
9.
Chehaitly
A
,
Guihot
AL
,
Proux
C
,
et al.
Altered mitochondrial Opa1-related fusion in mouse promotes endothelial cell dysfunction and atherosclerosis.
.
Antioxidants (Basel).
2022;
;
11
.
10.
Coste
B.
Les protéines Piezo forment une nouvelle famille de canaux ioniques activés mécaniquement.
.
Med Sci (Paris).
2012;
;
28
:
:1056.
–
1057
.
11.
Coste
B
.
Prix Nobel de physiologie ou médecine 2021 – Les senseurs de la température et du toucher.
.
Med Sci (Paris).
2022;
;
38
:
:96.
–
8
.
|