| |
| Med Sci (Paris). 38(12): 1052–1060. doi: 10.1051/medsci/2022168.Les virus au service de la santé : la vaccination Frédéric Tangy1* and Jean-Nicolas Tournier1,2,3 1Laboratoire d’innovation vaccinale, Université de Paris, Institut Pasteur
,
28 rue du Dr Roux
,
75724Paris cedex 15
,
France 2Département Microbiologie et maladies infectieuses, Institut de recherche biomédicale des armées (IRBA)
,
1 place général Valérie André
,
91220Brétigny-sur-Orge
,
France 3École du Val-de-Grâce
,
1 place Alphonse Laveran
,
75005Paris
,
France |
Vignette (© Philippe Roingeard).
Le biologiste britannique Peter Medawar (1915-1987) définissait un virus comme «
un morceau de mauvaise nouvelle enveloppée dans une protéine
». Pas si faux car en latin,
virus
désigne le poison. Mais les virus sont aussi devenus des remèdes préventifs contre les maladies infectieuses, ou des thérapies contre le cancer.
Depuis son apparition, il y a environ 300 000 ans,
Homo sapiens
a vécu sous la pression des maladies infectieuses, en particulier des maladies virales. Pendant des millénaires, le cours des guerres et l’avenir des nations ont été bouleversés par les épidémies et les pandémies [
1
]. Ces maladies ont été des facteurs essentiels de sélection naturelle des populations humaines. Les multiples composants du système immunitaire, qui nous permettent de résister aux infections, sont inscrits dans notre génome et la pression exercée par les virus et autres microbes a permis, au cours des générations, la sélection naturelle de mutations qui nous sont favorables et nous permettent de répondre aux agressions de pathogènes. Pendant des siècles, l’espérance de vie moyenne de l’homme avoisinait 25 ans. Elle n’a commencé à augmenter qu’à la fin du
xviii
e
siècle, pour bondir au
xx
e
siècle de façon explosive, malgré plusieurs grands conflits mondiaux. Ce progrès vertigineux a été le fait d’améliorations de l’hygiène et de l’assainissement, mais surtout de découvertes réalisées en microbiologie et en vaccinologie, et de la mise au point des antibiotiques.
Il a fallu attendre le siècle dernier pour observer les virus au microscope, et ainsi définir ce qu’ils sont réellement, pour comprendre les mécanismes de pathogenèse et d’immunité, et découvrir qu’on pouvait utiliser les virus eux-mêmes pour prévenir les maladies. Inactivés, atténués, modifiés, ou découpés en sous-parties, les virus sont ainsi passés de l’état de pathogènes à celui de serviteurs de la santé, en se faisant vaccins. Des fléaux comme la variole, la rage, la fièvre jaune, la poliomyélite, ou des grands prédateurs d’enfants, comme la rougeole, ont été contrôlés grâce à la vaccination par des virus modifiés.
Les vaccins sont utilisés depuis près de deux siècles avec un succès impressionnant. Ce sont les médicaments qui ont sauvé le plus de vies au monde [
2
,
3
]. Administrés de manière préventive, ils n’ont pas d’effet direct sur les agents infectieux. Leur principe est d’activer à l’avance le système immunitaire pour lui permettre de réagir lors d’une infection future. Le rapport coût-efficacité des vaccins en termes de santé publique est inégalé. Ce sont des médicaments très peu coûteux (certains vaccins sont produits pour seulement quelques centimes d’euros). Ils sont utilisés à très grande échelle dans des campagnes mondiales de santé publique et tiennent une place centrale, à la fois comme médicaments anti-infectieux, mais aussi comme outils de santé publique.
La pandémie de Covid-19 (
coronavirus disease 2019
), due au SARS-CoV-2 (
severe acute respiratory syndrome-coronavirus 2
), qui sévit depuis trois ans dans le monde, a entraîné une révolution des vaccins viraux [
4
–
6
]. En effet, face à cette pandémie, deux types de vaccin, complétement nouveaux, ont été développés en seulement quelques mois : les vaccins à ARN messager et les vaccins à vecteur viral de type adénovirus. Ces vaccins n’avaient jamais été autorisés avant la pandémie, et la Covid-19 leur a fourni l’opportunité de prouver leur intérêt. L’utilisation de ces vaccins a en effet permis de sauver de très nombreuses vies, de sortir des confinements infligés par les autorités, seules armes contre la propagation virale en attente de leur distribution, et sont, pour l’instant, les seuls médicaments qui protègent contre les formes graves de la maladie [
7
].
|
Quand les virus se sont faits vaccins La variolisation
Depuis le
xvi
e
siècle, au moins, les médecins chinois pratiquaient la « variolisation ». La variole a longtemps été l’un des pires fléaux infectieux, emportant des centaines de millions d’individus au cours des siècles. La maladie se caractérisait par une éruption cutanée impressionnante, dont les survivants gardaient les cicatrices à vie. Cette maladie virale sévissait par épidémies, touchant les personnes naïves (c’est-à-dire celles qui n’avaient encore jamais contracté la maladie, les adultes étant le plus souvent protégés par un contact lors des épidémies précédentes ; la maladie affectait donc principalement les enfants). L’individu infecté était contagieux un jour avant l’apparition des pustules. Il le restait jusqu’à la chute des croûtes, formées à la cicatrisation de ces pustules. La mortalité était effroyable, de l’ordre de 30 à 50 % des malades. Les survivants étaient cependant protégés à vie et ne développaient jamais de deuxième variole : c’est cette observation qui est à l’origine de l’invention de la variolisation en Chine.
Méthode rudimentaire mais efficace, la variolisation consistait à inoculer à une personne saine du pus prélevé chez une personne variolique mais faiblement malade. Cette technique risquée aboutissait néanmoins à une variole virulente chez la personne receveuse et à la mort des individus dans 2 à 3 % des cas. Le pus contenait le virus de la variole, virus à ADN très transmissible, une entité inconnue des médecins chinois de l’époque.
Malgré ces risques, cette méthode d’immunisation innovante s’est néanmoins colportée le long de la route de la soie vers l’Occident. Elle a été introduite en Angleterre au
xviii
e
siècle par Lady Mary Montagu, épouse de l’ambassadeur d’Angleterre à Constantinople, où la variolisation se pratiquait déjà lors des épidémies de variole. Convaincue de l’utilité de la technique qu’elle avait testée sur son fils âgé de cinq ans, elle fit, dès son retour en Angleterre, grande publicité de cette méthode révolutionnaire qui fut ensuite validée sur des détenus à Londres en 1720. Ce succès suscita l’intérêt de la famille royale et facilita la diffusion de la technique dans les milieux populaires.
Le premier vaccin, un virus sans le savoir
À la fin du
xviii
e
siècle, Edward Jenner, médecin de famille installé dans la campagne de Berkeley, pratiquait la variolisation introduite en Angleterre. Toutefois, cette méthode ne pouvait être pratiquée qu’en période d’épidémie car le matériel utilisé pour l’inoculation provenait de malades varioleux.
Jenner avait observé que les personnes qui trayaient les vaches présentaient des pustules aux mains semblables à celles des pis des vaches atteintes d’une maladie appelée
cowpox
(variole de la vache) qui se propageait dans les troupeaux. Ces pustules disparaissaient rapidement, sans entraîner d’autres symptômes. Curieusement, elles ressemblaient à celles de la variole humaine, et il semblait bien que les trayeuses pustuleuses étaient protégées de la variole humaine. L’idée de Jenner fut d’utiliser la variole de la vache pour protéger de la variole humaine. Il tenta son expérience au printemps 1796. Il préleva de la lymphe sur les mains couvertes de pustules d’une paysanne et l’inocula par deux incisions superficielles sur l’épaule d’un jeune garçon de huit ans qui n’avait jamais eu la variole. Jenner savait qu’il n’injectait pas la variole humaine mais ce qu’il pensait être le
cowpox
de la vache qu’il savait inoffensif. Quelques mois plus tard, Jenner revint à la ferme et injecta à l’enfant du pus infectieux de varioleux. L’enfant ne montra aucun signe de variole. Il était immunisé. Jenner venait de démontrer qu’on pouvait protéger de la variole humaine en inoculant un virus issu de la vache, beaucoup moins virulent. Il baptisera ce virus « virus de la vaccine ». Cette découverte était totalement empirique, Jenner ne connaissant, pas plus que les médecins chinois, l’existence du virus responsable de la variole.
Très rapidement, la vaccination de Jenner sera pratiquée dans les capitales européennes et aux États-Unis, une expansion mondiale. En 1840, l’Angleterre est le premier pays à rendre le vaccin antivariolique obligatoire pour les nouveau-nés (en France, il faudra attendre 1902). Ce vaccin allait révolutionner l’histoire de l’humanité. Au début du
xx
e
siècle, la variole tuait encore près de quatre millions de personnes par an, principalement des jeunes. Par comparaison, la Covid-19 a tué, en 2020-2021, plus de 6,5 millions de personnes
1
, dont une majorité de personnes âgées [
8
].
Après l’introduction de la vaccination jennérienne, dès le premier quart du
xix
e
siècle, l’espérance de vie a doublé, premier grand succès de santé publique mondiale. Deux siècles après les travaux pionniers d’Edward Jenner, le 26 octobre 1977, le dernier cas de variole était identifié en Somalie, au terme de vingt ans d’une campagne mondiale acharnée organisée par l’Organisation mondiale de la santé (OMS). Le virus était donc définitivement éradiqué de la surface de la terre et l’humanité débarrassée de ce fléau millénaire, une étape fondatrice dans l’histoire de la santé humaine globale et de la vaccination.
Le fameux virus de la vaccine, celui de Jenner, depuis cultivé maintes et maintes fois sur différents supports cellulaires, est aujourd’hui ressorti des congélateurs pour lutter contre l’épidémie de
Monkeypox
, le virus de la variole du singe qui sévit depuis quelques mois.
Louis Pasteur : la révolution de l’atténuation
Tandis que le médecin Jenner a protégé ses patients de la variole en leur injectant le virus de la vaccine de façon très empirique, Louis Pasteur (1822-1895), chimiste talentueux, fonde, un siècle plus tard, les bases de la microbiologie. Il défait la théorie de la génération spontanée, identifie les virus comme des agents transmissibles filtrables, résout le problème de la « maladie du vin » par pasteurisation
2
, résout les épidémies décimant les vers à soie. Il découvre une méthode d’atténuation de la virulence du choléra des poules, causé par la bactérie
Pasteurella multocida
, ce qui permet d’obtenir un vaccin, puis utilise la même méthode avec une efficacité spectaculaire contre la maladie du charbon du bétail également due à une bactérie, « l’anthrax » ou
Bacillus anthracis
. Il s’intéresse ensuite à la rage. Avec le médecin Émile Roux (1853-1933), ils tentent d’isoler le virus à partir de moelle épinière de chiens enragés et mettent au point un modèle d’infection chez le lapin. Ils développent ensuite l’atténuation des moelles épinières de lapin en les exposant à l’air dans des tubes de verre : en quinze jours, les moelles sont totalement non-virulentes. Pasteur vaccinera des chiens avec succès.
Début 1885, Pasteur est prêt à passer à l’expérimentation sur l’homme, comme Jenner un siècle plus tôt. Avec le docteur Grancher, il se risque sur le jeune Joseph Meister, mordu par un chien enragé, et lui injecte une solution de moelle de lapin atténuée par sa nouvelle méthode. Quelques jours plus tard, il réinjecte le virus de la rage au petit Joseph qui ne développe aucun symptôme. Pasteur répétera son expérience avec un autre enfant infecté. Nouveau succès. Rapidement, les patients arrivent de France, d’Amérique, de Russie ; le laboratoire de la rue d’Ulm est vite débordé. En un an, Pasteur va traiter efficacement plus de 350 personnes. Aujourd’hui, le vaccin courant antirabique est toujours fondé sur un virus rabique mais il est désormais inactivé.
Une multitude de vaccins découverts au xx
e
siècle
Au début du
xx
e
siècle, il n’existe que deux vaccins humains : le vaccin antivariolique de Jenner et le vaccin historique contre la rage de Pasteur. Deux virus atténués. Or, à cette époque, les nourrissons meurent encore de nombreuses maladies infectieuses et la mortalité infantile est effroyable. Poursuivant la révolution de la microbiologie et confirmant les découvertes de Pasteur, les chercheurs et les médecins vont inventer au cours du
xx
e
siècle une multitude de nouveaux vaccins qui contribueront à améliorer la santé publique.
La découverte des toxines bactériennes permet de mettre au point des sérums et des vaccins contre la diphtérie et le tétanos. Elle permet aussi de comprendre que le corps humain se protège des toxines en produisant des anticorps. Pour améliorer la préparation des sérums anti-diphtériques chez les chevaux, le vétérinaire Gaston Ramon (1886-1963) développe le premier adjuvant en 1920. Suivront les vaccins antibactériens contre la typhoïde et la tuberculose, le fameux BCG (bacille de Calmette et Guérin) découvert à l’Institut Pasteur de Lille en 1921. Dans les années 1940-1960, les Américains élaborent les vaccins contre la poliomyélite, la fièvre jaune, la grippe, la rougeole, les oreillons, la rubéole, tous des vaccins vivants atténués ou inactivés composés de virus.
La mise au point des vaccins a longtemps été un processus de longue durée, qu’il s’agisse de vaccins inactivés ou vivants. L’histoire du vaccin grippal montre qu’entre la démonstration à l’Institut Pasteur en 1918 de l’existence d’un « virus filtrant » à l’origine de la grippe, l’isolement du premier virus grippal humain de type A en Grande-Bretagne en 1933, la culture du virus sur œuf de poule embryonné pour préparer les premiers vaccins inactivés aux États-Unis, et l’élaboration par le biologiste Jonas Salk (1914-1995), en 1944, du premier vaccin efficace à grande échelle pour vacciner le corps expéditionnaire américain en Europe, il aura fallu 26 ans. Le précepte de Pasteur « isoler l’agent et l’inactiver » ne se réalise donc pas, à cette époque, en un claquement de doigts. Au cours de la dernière partie du
xx
e
siècle, le développement des techniques du génie génétique, de la virologie moléculaire, la génétique inverse permettant la manipulation des génomes viraux, le séquençage des génomes à haut débit, leur synthèse chimique, la maîtrise de la culture cellulaire et des méthodes de purification, ont considérablement bénéficié au développement des vaccins. Les vaccins contre le virus de l’hépatite B (HBV) et le papillomavirus humain (HPV), tous deux responsables de cancers, ont été les premiers vaccins issus du génie génétique. Ils utilisent la propriété d’un gène viral exprimant une protéine capable de s’auto-assembler en particules virales très immunogènes et non infectieuses, les VLP (
virus-like particles
). Il s’agit pour la première fois ni d’un virus inactivé ni d’un virus atténué, mais de particules virales vides, recombinantes, entièrement synthétiques et produites en bio-fermenteur. Une révolution dans l’industrie du vaccin [
9
].
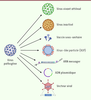 | Figure 1.
Les principales méthodes pour transformer un virus en vaccin.
|
Il était temps de créer des vaccins plutôt que de laisser la nature nous guider. Ainsi, les vecteurs viraux de vaccination ont été mis au point, une nouvelle utilisation des virus comme outils de médecine : des virus recombinants, à ARN ou à ADN, non pathogènes ou d’une autre espèce, parfois synthétiques, réplicatifs ou non, enveloppés ou non, construits pour véhiculer des antigènes additionnels. L’identification des antigènes efficaces s’est améliorée avec le développement de la vaccinologie réverse [
10
] et de la vaccinologie structurale [
11
] qui consistent à identifier les antigènes à partir de leur efficacité
in vivo
: la découverte à haut débit d’anticorps humains protecteurs, le séquençage du répertoire des lymphocytes B et la caractérisation structurale des antigènes et épitopes protecteurs permettent aujourd’hui de concevoir de nouveaux vaccins qui étaient auparavant impossibles à fabriquer. Pour exprimer ces antigènes, les vecteurs viraux et les vaccins entièrement géniques ne contenant pas de protéines virales, les vaccins à ADN et à ARN, ont été largement utilisés [
12
].
Il aura fallu attendre la pandémie de Covid-19, due au SARS-CoV-2, en 2020, pour que les premiers vaccins géniques à ARN ou à vecteur adénoviral soient commercialisés avec une efficacité démontrée contre la Covid-19 [
13
,
14
]. En moins d’un an, grâce à une recherche accélérée et des moyens financiers colossaux, plusieurs vaccins ont été développés contre la Covid-19, permettant une vaccination de masse en réponse rapide à la pandémie.
|
Les grands types de vaccins viraux
Il existe aujourd’hui des vaccins préventifs commerciaux essentiellement contre 19 maladies virales : la variole, le virus
Monkeypox
, la fièvre jaune, les virus de la poliomyélite, la rougeole, les oreillons, la rubéole, la varicelle, la dengue, le rotavirus, la rage, les virus de la grippe A et B, l’hépatite A, l’encéphalite japonaise, l’encéphalite à tiques, le virus de l’hépatite B, les papillomavirus humains, le virus Ebola, le SARS-CoV-2. Les dix premiers sont des virus vivants atténués, les cinq suivants sont des virus inactivés (à noter que le vaccin contre la poliomyélite des pays développés est aussi un virus inactivé) et les quatre derniers sont issus du génie génétique.
Un vaccin est une préparation biologique issue d’un microorganisme, conçue pour stimuler spécifiquement le système immunitaire avant l’infection naturelle. L’évolution des espèces et leur cohabitation avec les microbes ont mis en place un système immunitaire de plus en plus complexe, depuis les invertébrés jusqu’aux mammifères, et des mécanismes très performants pour identifier les éléments biologiques qui composent les microbes et n’existent pas dans nos propres cellules. Ces éléments, appelés antigènes, sont des molécules biologiques, des protéines, des sucres, des acides nucléiques, dont la composition ou l’enchaînement sont propres aux micro-organismes et contre lesquels les réponses multiples de l’immunité s’enclenchent. Les antigènes sont donc les composants principaux des vaccins. Contrairement à la plupart des médicaments qui sont des produits chimiques naturels ou de synthèse, les vaccins sont composés de produits biologiques naturels modifiés. Les virus vivants atténués Utiliser un virus vivant atténué est la façon la plus simple de produire un vaccin. Il s’agit du principe de la variolisation, celui de Jenner : utiliser un virus vivant non pathogène pour l’homme, dans ce cas, la vaccine, un virus bovin proche de celui de la variole humaine, qui induit des réponses immunitaires protectrices contre la variole humaine. Dès qu’elles ont pu être isolées, les souches virulentes de nombreux autres virus ont été atténuées expérimentalement pour les transformer en vaccins vivants contre la fièvre jaune, la poliomyélite, la rougeole, les oreillons, la rubéole, la varicelle ou le rotavirus. L’atténuation d’un virus est obtenue par sa culture sériée, au cours d’un grand nombre de passages, sur des cellules primaires, des cellules de lignées ou sur des œufs embryonnés. Les virus, isolés chez des patients, sont cultivés ainsi jusqu’à ce qu’ils perdent naturellement leur caractère pathogène. La pathogénicité est perdue par accumulation de mutations dans les génomes viraux. Sans la transmission naturelle qui sélectionne les espèces virulentes, et en l’absence de la pression du système immunitaire, le virus accumule en effet des mutations qui favorisent sa croissance en culture et atténuent son pouvoir pathogène et sa transmissibilité. Les souches obtenues sont alors incapables de développer la maladie qu’elles causaient auparavant, mais conservent néanmoins leurs antigènes et leur capacité à induire des réponses immunitaires. Le grand nombre de mutations accumulées empêche virtuellement le retour à la pathogénicité. Le virus vaccinal atténué de la rougeole, par exemple, a acquis une cinquantaine de mutations par rapport au virus original, réparties tout le long du génome qui contient 16 000 nucléotides. Ces mutations affectent autant les gènes structuraux que les gènes non structuraux, les épitopes antigéniques, la polymérase ou les facteurs de virulence, privant ainsi le virus de sa pathogénicité et de sa transmissibilité au profit d’une grande capacité réplicative en culture cellulaire. Ces vaccins sont donc très sûrs et très peu toxiques. L’absence de virulence est contrôlée dans des modèles animaux et lors d’essais cliniques. Les vaccins vivants possèdent de nombreuses qualités. Ils sont plus efficaces que les autres vaccins et leur effet est plus durable. Puisqu’ils sont réplicatifs, les virus inoculés lors de la vaccination se propagent dans l’organisme. Bien qu’à un très faible niveau du fait de l’atténuation, cette virémie induit une immunité générale. Les réponses aux vaccins vivants sont à la fois de type cellulaire et humoral. Un vaccin vivant mime une infection, ce qui permet d’installer une mémoire de très long terme, à vie dans certains cas, dont les effecteurs résident dans les organes lymphoïdes secondaires et les muqueuses. Une ou deux administrations à faible dose sont suffisantes. Ces vaccins ne nécessitent pas d’adjuvants tant leur immunité naturelle est efficace. Enfin, un atout majeur pour des vaccins destinés à la vaccination de masse, leur dose active est faible car ils se multiplient dans l’organisme, ce qui permet des niveaux de fabrication industrielle très élevés pour des coûts faibles. En revanche, la viabilité des virus devant être maintenue, les vaccins vivants nécessitent d’être conservés au froid. Par précaution, ils sont contre-indiqués chez la femme enceinte et chez les personnes immunodéprimées. Les vaccins vivants peuvent être combinés, comme le vaccin ROR, qui protège contre la rougeole, la rubéole et les oreillons, et auquel peut s’ajouter le vaccin vivant contre la varicelle. Néanmoins, les combinaisons de virus vivants atténués peuvent se confronter au problème d’interférence virale, qui a pu être observé avec certains mélanges de vaccins vivants atténués contre les quatre sérotypes du virus de la dengue. Si l’un des virus du mélange est un peu moins atténué ou qu’il se réplique plus vite que les autres, il établit une immunité innée précoce qui bloque la réplication des autres virus. Enfin, les atténuations naturelles générées par passages sériés sont infiniment plus stables génétiquement que les atténuations obtenues par mutagenèse, qui n’impliquent que quelques nucléotides qui peuvent réverter, ou entraîner des recombinaisons avec des virus voisins circulant, comme cela peut être le cas avec le vaccin vivant contre la poliomyélite.
De nouvelles méthodes d’atténuation des virus par mutagenèse ou synthèse de génomes entiers infectieux ont été développées récemment. Elles consistent à muter un grand nombre de positions du génome viral pour éviter la réversion génétique [
15
]. La génération de génomes viraux rationnellement atténués par de multiples remplacements de codons synonymes, ou par la sélection de mutants de fidélité de la polymérase virale des virus à ARN, a permis d’obtenir des vaccins atténués prometteurs, mais qui n’ont pas encore été développés industriellement [
16
].
Les virus inactivés Ces vaccins contiennent des virus infectieux tués ou inactivés par un traitement chimique ou par la chaleur. Historiquement, ils sont issus des observations de Louis Pasteur qui a utilisé cette méthode pour développer des vaccins contre le choléra des poules, l’anthrax et la rage (bien que ces trois vaccins n’étaient probablement qu’atténués). Les microbes inactivés sont totalement inoffensifs mais restent capables de susciter de bonnes réponses immunitaires. Le vaccin injectable contre la poliomyélite, les vaccins contre la grippe, l’hépatite A, le choléra, la peste, l’encéphalite japonaise, l’encéphalite à tiques d’Europe centrale, le vaccin antirabique sont des vaccins inactivés. La plupart des vaccins humains inactivés contre des virus entiers sont produits par culture en fermenteur. Les virus obtenus sont inactivés par exposition au formaldéhyde ou à la bêta-propiolactone. Les vaccins à virus fragmenté sont produits quant à eux, en utilisant un détergent pour perturber leur enveloppe, une technique utilisée dans le développement de nombreux vaccins antigrippaux.
Ces vaccins ont plusieurs avantages. Tout d’abord, le risque de voir se multiplier le virus vaccinal inoculé est nul. Ensuite, la réponse immunitaire aux vaccins inactivés est plus homogène que celle aux vaccins vivants, en particulier la réponse immunitaire humorale avec la production d’anticorps circulants. Enfin, les vaccins tués demandent des conditions de stockage et de conservation beaucoup moins strictes, et leur durée de validité est plus grande que celle des vaccins vivants. Étant donné qu’ils ne contiennent pas de germes infectieux, les vaccins inactivés peuvent être combinés plus facilement : les interférences virales qui peuvent se produire quand on administre ensemble certains vaccins vivants n’existent pas avec les vaccins tués. Ainsi, le célèbre mélange « tétracoque » qui contient les vaccins inactivés contre la diphtérie, le tétanos, la poliomyélite, et la coqueluche, se trouve maintenant sous forme hexavalente, associé aux nouveaux vaccins contre les méningites à
Hæmophilus influenzae
de type b, et contre l’hépatite B.
Les vaccins inactivés sont néanmoins plus coûteux à produire. Ne se multipliant pas dans l’organisme, la charge antigénique de la préparation vaccinale doit être plus importante pour obtenir une réponse immunitaire satisfaisante, ce qui nécessite de plus importantes doses de vaccin et plusieurs administrations successives. L’ajout d’adjuvants dans certains vaccins inactivés entraîne également une augmentation de leur coût, ainsi que l’inquiétude du public quant à leur utilisation. Les vaccins sous-unitaires Les vaccins sous-unitaires sont composés de sous-parties antigéniques qui sont synthétisées en laboratoire : des sous-unités protéiques, des polysaccharides ou des peptides. C’est le principe des vaccins contre le tétanos, la diphtérie, la coqueluche, la méningite à méningocoque ou encore le virus de l’hépatite B et celui des papillomavirus humains, des vaccins qui sont administrés par milliards de doses aux nourrissons dans le monde. Les premiers vaccins sous-unitaires ont été développés contre des toxines bactériennes. La toxine diphtérique, découverte en 1888 par le médecin bactériologiste Alexandre Yersin (1863-1943) et Émile Roux à l’Institut Pasteur, a permis le premier développement de ce type de vaccin. À la même époque, le médecin allemand Emil Von Behring (1854-1917) qui travaillait à Berlin avec Robert Koch (1843-1910), découvre avec le médecin bactériologiste japonais Kitasato Shibasaburo (1853-1931), l’antitoxine dans le sérum des animaux immunisés par la toxine diphtérique. L’antitoxine sera ensuite obtenue en grandes quantités par l’immunisation de chevaux, pour la sérothérapie des patients diphtériques, une technique efficace mais dont l’action est de courte durée. C’est en 1921, à l’Institut Pasteur, que Gaston Ramon observe que l’inactivation de la toxine diphtérique par un traitement au formol, ou par la chaleur, donne un dérivé inoffensif mais qui conserve intact son pouvoir vaccinant. Il lui donnera le nom d’anatoxine diphtérique. Après quelques essais, la vaccination par l’anatoxine diphtérique entrera dans la pratique clinique.
Les vaccins sous-unitaires antiviraux sont fabriqués par génie génétique. Les premiers d’entre eux, les vaccins contre l’hépatite B et contre les papillomavirus humains, ont été produits à partir d’un gène viral, exprimé par des cellules en culture, qui génère des particules virales vides. Les antigènes ainsi produits et purifiés sont naturellement immunogènes, du fait de leur assemblage multimérique qui constitue un puissant stimulant de l’immunité innée et de l’immunité adaptative. D’autres vaccins sous-unitaires contre des virus ont été plus récemment développés, contre la grippe ou le SARS-CoV-2. Celui contre la grippe est produit par l’expression du gène codant l’hémagglutinine du virus dans des cellules d’insectes infectées par un vecteur de type baculovirus [
17
]. Les vaccins développés contre le SARS-CoV-2 sont fondés, quant à eux, sur l’expression de la protéine d’enveloppe
Spike
du virus, sous sa forme la plus immunogène possible, dans des systèmes variés de culture cellulaire, y compris des plantes [
18
].
Les vaccins sous-unitaires sont totalement inoffensifs, du moins concernant l’antigène produit en fermenteur dans des cultures de bactéries, de levures ou de cellules de mammifères. Ils sont sans risque pour les immunodéprimés. Leur technique de production est parfaitement maîtrisée. Cependant, la recherche de la bonne combinaison de fragments antigéniques exige du temps. Leur fabrication est plus complexe que celle des autres vaccins, y compris certains vaccins à ARN. Enfin, ils nécessitent l’ajout d’adjuvants et des doses de rappel. |
Les vecteurs viraux et les virus synthétiques
Les vecteurs viraux sont nés de l’idée de bénéficier des avantages connus d’un certain nombre de virus manipulables génétiquement pour construire de nouveaux vaccins. Ce sont des virus recombinants non pathogènes, à ARN ou à ADN, synthétiques, réplicatifs ou non, qui sont construits pour véhiculer un ou plusieurs antigènes additionnels [
19
]. Ces vecteurs utilisent des virus connus qui ont un palmarès fiable en matière de manufacture, de sécurité et d’efficacité. Les propriétés avantageuses des virus vecteurs eux-mêmes bénéficient ainsi aux antigènes additionnels, tant pour l’immunogénicité que pour la fabrication industrielle.
De nombreuses plateformes de vecteurs viraux ont été développées à partir de poxvirus (vaccine, MVA [
modified vaccinia virus Ankara
], ALVAC [
cannarypoxvirus
]) [
20
], d’adénovirus (Ad5, Ad26, ChAd [
chimpanzee adenovirus
]) [
21
], des virus vaccinaux de la rougeole [
22
] ou de la fièvre jaune [
23
]. Les plateformes à adénovirus ChAd et Ad26 ont été utilisées pour développer des vaccins contre la Covid-19. Des vaccins commerciaux, qui utilisent des vecteurs viraux dérivés du virus vaccinal de la fièvre jaune (YF17D) ou du virus de la stomatite vésiculaire (VSV), ont également été développés contre la dengue, l’encéphalite japonaise ou le virus Ebola [
24
].
Ces vaccins délivrent les antigènes hétérologues qu’ils présentent aux cellules présentatrices d’antigènes. Ils induisent des réponses immunitaires complètes (réponses innée, humorale et adaptative avec la production de lymphocytes CD4
+
et CD8
+
mémoires). Ils ont des propriétés adjuvantes intrinsèques, et sont aujourd’hui faciles à construire par génomique virale et génétique inverse.
|
Les vaccins génétiques reposent sur l’expression d’antigènes viraux directement par les cellules de l’individu vacciné, après injection de leurs séquences génétiques portées par des molécules d’ADN ou d’ARN messager (ARNm) [
6
]. Ces vaccins sont en développement pour différentes applications depuis plusieurs décennies. Si les vaccins à ADN n’ont, à ce jour, pas montré une grande efficacité en clinique, les vaccins à ARN se sont révélés être très performants pendant la pandémie de Covid-19 et ont été utilisés massivement du fait de leur rapidité de fabrication.
Les vaccins à ARN consistent en molécules d’ARNm, portant les séquences virales, qui sont encapsulées dans des nanoparticules lipidiques qui sont littéralement transfectées par fusion lipidique dans les cellules musculaires et les cellules présentatrices d’antigènes résidentes, lors de leur injection intramusculaire. L’antigène codé par l’ARNm est alors traduit directement dans les cellules immunitaires, les cellules dendritiques résidentes. Des modifications sont apportées à l’ARNm pour le stabiliser et augmenter la synthèse protéique : l’ajout d’une coiffe synthétique en 5’, l’ajout de séquences régulatrices cis-actives en 5’ et 3’, l’ajout de séquences polyadénylées en 3’, l’optimisation des codons, l’utilisation de nucléosides modifiés pour réduire l’activation de la réponse interféron. Les formulations lipidiques sont propres à chaque vaccin et protégées par des brevets. Elles sont fondées sur l’utilisation de nano-émulsions ou de polymères cationiques, de nanoparticules lipidiques cationiques ou de particules polysaccharidiques. La traduction de l’antigène à partir de l’ARNm transfecté dans les cellules dendritiques résidentes entraîne leur activation et leur maturation. Elles migrent vers les ganglions lymphatiques pour présenter l’antigène dans le contexte du complexe majeur d’histocompatibilité (CMH) et activer les lymphocytes T et B.
Les vaccins à ARNm contre le SARS-CoV-2 induisent de très bonnes réponses humorales et de bonnes réponses cellulaires après deux ou trois administrations. Ces réponses sont suffisantes pour protéger des formes graves de la maladie, mais l’immunité induite n’étant pas stérilisante, la protection contre une réinfection n’est pas totale [
25
]. Malheureusement, la mémoire vaccinale contre l’antigène ne semble pas maintenue au-delà de quelques mois.
Ces vaccins nécessitent d’être conservés à très basse température, et donc une chaîne du froid rigoureuse, ce qui limite leur utilisation massive. Leur coût de fabrication est relativement élevé. Néanmoins, suite aux succès enregistrés avec les vaccins à ARNm contre la Covid-19, de nombreux autres vaccins sont en cours de développement, contre d’autres maladies virales ou contre le cancer. |
La virothérapie contre le cancer
Le cancer est la deuxième cause de décès dans le monde occidental. D’ici 2040, il devrait affecter 27 millions de personnes et entraîner 16 millions de décès annuels dans le monde [
26
]. Malgré les progrès de la chirurgie, de la radiothérapie, de la chimiothérapie et de l’immunothérapie, chez les patients à un stade avancé, la plupart des tumeurs solides échappent encore aux traitements existants et s’avèrent fatales une fois métastatiques.
Un cancer sur six est causé par un virus, en particulier, des cancers anogénitaux dus aux HPV ; des carcinomes hépatiques dus aux virus de l’hépatite B et C (HBV et HCV) ; du lymphome de Burkitt et de la maladie de Hodgkin causés par le virus d’Epstein-Barr (EBV) ; de la leucémie-lymphome T de l’adulte due au HTLV-1 (
human T cell leukemia/lymphoma virus type 1
) ; le syndrome de Kaposi dû au HHV8 (herpèsvirus humain de type 8). Certains virus sont néanmoins capables de détruire spécifiquement les cellules cancéreuses, les virus immuno-oncolytiques, et peuvent être utilisés en oncologie thérapeutique [
27
].
Depuis les premières observations cliniques de résolution naturelle de cancers au cours de certaines infections virales, de nombreux virus oncolytiques ont été conçus, étudiés, testés dans des essais cliniques. Certains sont déjà disponibles sur le marché. Ce sont des virus dérivés en particulier du virus herpès, des adénovirus, du virus de la vaccine, du virus vaccinal de la rougeole, du virus VSV, etc. Ces virus ciblent et se répliquent spécifiquement dans les cellules tumorales, soit naturellement, soit parce qu’ils ont été modifiés génétiquement. Ces traitements entraînent la mort des cellules tumorales ainsi qu’une réponse immunitaire dirigée contre le virus mais également contre les antigènes de la tumeur. Le système immunitaire joue un rôle central dans le contrôle de la multiplication des tumeurs, et les cancers installés depuis des années lui ont en général échappé. Il est donc nécessaire de restaurer son efficacité. Les virus oncolytiques jouent ce rôle : ils réactivent le microenvironnement tumoral en induisant l’apoptose et l’inflammation. Selon les virus, les administrations peuvent être réalisées soit par voie intra-tumorale, soit par voie générale. L’association des virus oncolytiques avec des traitements immunothérapeutiques par anticorps anti-points de contrôle immunitaire peut s’avérer très efficace. Mais ces traitements, malgré de nombreux essais cliniques en cours, ne sont pas encore répandus en médecine humaine. Assez faciles à produire industriellement, ces virus ne sont pas toxiques et sont très bien supportés par les patients, ce qui en fait des traitements anticancéreux prometteurs. L’industrie pharmaceutique n’est cependant pas encore convaincue de leur utilité. |
Début août 2022, le bilan de la Covid-19, dans le monde, est de près de 600 millions de cas et 6,5 millions de décès, mais ces chiffres officiels sont largement sous-représentatifs de la réalité. À la même date, en France, la Covid-19 avait touché plus de 33 millions de personnes et tué un peu plus de 150 000 personnes. Face à ce bilan très lourd, environ dix milliards de doses de vaccin anti-Covid-19 ont été administrées à travers le monde. Sachant que trois doses en moyenne sont administrées par personne, cela représente un peu plus de trois milliards de personnes vaccinées, sur une population mondiale de presque huit milliards d’individus. Jamais une campagne aussi massive de vaccination n’avait été entreprise dans l’histoire de l’humanité. Les nouveaux vaccins à ARNm et à vecteur adénoviral ont joué un rôle majeur dans ce succès. Ils sont le fruit de décennies de recherche virologique depuis les premières tentatives de vaccination de Jenner et de Pasteur, et les premiers vaccins atténués ou inactivés du siècle dernier.
Les virologistes sont aux avant-postes de la recherche vaccinale. Ils sont en alerte sur l’état de la santé publique mondiale, de sorte que, lorsqu’une épidémie se déclenche, l’ensemble des chercheurs se mobilisent dans le monde pour identifier le virus, les symptômes de la maladie, sa transmission et les réponses immunitaires, en association avec les immunologistes quant à ce dernier point. Louis Pasteur disait : «
Il ne faut pas distinguer la recherche fondamentale de la recherche appliquée, il n’y a que la recherche et ses applications
». Le but de la recherche vaccinale est d’apporter des solutions médicales et techniques aux problèmes de santé publique, et de mettre au point des produits qui peuvent sauver des millions de vies.
Mais il reste encore un long chemin à parcourir : quarante ans après son émergence, il n’existe toujours pas de vaccin contre le VIH. Le paludisme continue encore de tuer de nombreux enfants en zone intertropicale, malgré la récente mise au point d’un premier vaccin qui ne protège qu’à 30 %. La tuberculose fait toujours des ravages dans un certain nombre de pays. Depuis quelques décennies, chaque année voit l’émergence ou la réémergence d’une nouvelle maladie virale, des arboviroses menaçantes, des fièvres hémorragiques de plus en plus variées et fréquentes, des nouvelles maladies respiratoires hautement transmissibles. Ces épidémies et ces pandémies sont rapides et coûteuses en vies humaines et de nouveaux vaccins doivent être développés en un temps record pour y répondre, comme ce fut le cas pour les précédentes épidémies de grippe H1N1, d’Ebola, de chikungunya, de Zika, de Lassa ou de SARS-CoV-2. Les techniques vaccinales doivent également s’adapter pour résoudre de nombreux défis, tels que l’imprévisibilité de l’émergence, la grande variabilité génétique des nouveaux virus, ou leur statut de biosécurité. Depuis les millions d’années qu’ils cohabitent avec les autres espèces, les virus ont établi des liens intimes avec leurs hôtes et ont laissé leurs traces dans nos génomes, en même temps que leurs hôtes se sont adaptés à leur présence, en particulier en développant un répertoire immunitaire prêt à faire face à la diversité microbienne quasi infinie, et dont nous héritons à notre naissance, mais également en utilisant des mécanismes innés bien plus anciens, capables de détecter tout type de virus. C’est la connaissance détaillée des relations virus-hôtes et des mécanismes physiologiques précis de l’immunité antivirale qui façonne aujourd’hui la recherche vaccinale. L’utilisation des virus comme remèdes médicaux est pratiquée depuis deux siècles dans le monde. Aujourd’hui, les virus peuvent être domptés sous des formes variées et transformés en outils de médecine préventive ou thérapeutique. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Tangy
F
,
Tournier
JN
.
L’homme façonné par les virus.
.
Paris:
:
Édition Odile Jacob;
,
2021
.
2.
Tournier
JN
,
Tangy
F
.
Les vaccins pour les nuls.
Paris:
:
Édition First;
,
2017
.
3.
Tangy
F
,
Tournier
JN
.
Le petit livre des vaccins.
.
Paris:
:
Édition First;
,
2022
.
4.
Chaudhary
N
,
Weissman
D
,
Whitehead
KA
.
mRNA Vaccines for Infectious Diseases: Principles, Delivery and Clinical Translation.
.
Nat Rev Drug Discov.
2021;
;
20
:
:817.
–
38
.
5.
Jackson
NAC
,
Kester
KE
,
Casimiro
D
,
et al.
The Promise of mRNA Vaccines: A Biotech and Industrial Perspective.
.
NPJ Vaccines.
2020;
;
5
:
:11.
.
6.
Pardi
N
,
Hogan
MJ
,
Porter
FW
et al.
mRNA vaccines – a new era in vaccinology.
.
Nat Rev Drug Discov.
2018;
;
17
:
:261.
–
279
.
7.
Meslé
MM
,
Brown
J
,
Mook
P
,
et al.
Estimated Number of Deaths Directly Averted in People 60 Years and Older as a Result of COVID-19 Vaccination in the WHO European Region, December 2020 to November 2021.
.
Eurosurveillance.
2021;
;
26
:
:2101021.
.
9.
Roldão
A
,
Mellado
MCM
,
Castilho
LR
et al.
Virus-like particles in vaccine development.
.
Expert Rev Vaccines.
2010;
;
9
:
:1149.
–
1176
.
10.
Rappuoli
R
,
Bottomley
MJ
,
D’Oro
U
et al.
Reverse vaccinology 2.0: Human immunology instructs vaccine antigen design.
.
J Exp Med.
2016;
;
213
:
:469.
–
481
.
11.
Dormitzer
PR
,
Grandi
G
,
Rappuoli
R
.
Structural vaccinology starts to deliver.
.
Nat Rev Microbiol.
2012;
;
10
:
:807.
–
813
.
12.
Travieso
T
,
Li
J
,
Mahesh
S
,
et al.
The use of viral vectors in vaccine development.
.
NPJ Vaccines.
2022;
;
7
:
:75.
.
13.
Polack
FP
,
Thomas
SJ
,
Kitchin
N
,
et al
.
Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine.
.
N Engl J Med.
2020;
;
383
:
:2603.
–
15
.
14.
Falsey
AR
,
Sobieszczyk
ME
,
Hirsch
I
,
et al
.
Phase 3 Safety and Efficacy of AZD1222 (ChAdOx1 nCoV-19) Covid-19 Vaccine.
.
N Engl J Med.
2021;
;
385
:
:2348.
–
60
.
15.
Lauring
AS
,
Jones
JO
,
Andino
R
.
Rationalizing the development of live attenuated virus vaccines.
.
Nat Biotechnol.
2010;
;
28
:
:573.
–
579
.
16.
Moratorio
G
,
Henningsson
R
,
Barbezange
C
et al.
Attenuation of RNA viruses by redirecting their evolution in sequence space.
.
Nat Microbiol.
2017;
;
2
:
:17088.
.
17.
He
F
,
Madhan
S
,
Kwang
J
.
Baculovirus vector as a delivery vehicle for influenza vaccines.
.
Expert Rev Vaccines.
2009;
;
8
:
:455.
–
467
.
18.
Maharjan
PM
,
Choe
S
.
Plant-Based COVID-19 Vaccines: Current Status, Design, and Development Strategies of Candidate Vaccines.
.
Vaccines.
2021;
;
9
:
:992.
.
19.
Robert-Guroff
M.
.
Replicating and non-replicating viral vectors for vaccine development.
.
Curr Opin Biotechnol.
2007;
;
18
:
:546.
–
556
.
20.
Prow
NA
,
Jimenez Martinez
R
,
Hayball
JD
et al.
Poxvirus-based vector systems and the potential for multi-valent and multi-pathogen vaccines.
.
Expert Rev Vaccines.
2018;
;
17
:
:925.
–
934
.
21.
Coughlan
L
,
Kremer
EJ
,
Shayakhmetov
DM
.
Adenovirus-based vaccines-a platform for pandemic preparedness against emerging viral pathogens.
.
Mol Ther.
2022;
;
30
:
:1822.
–
49
.
22.
Frantz
PN
,
Teeravechyan
S
,
Tangy
F
.
Measles-derived vaccines to prevent emerging viral diseases.
.
Microbes Infect.
2018;
;
20
:
:493.
–
500
.
23.
Monath
TP
,
Seligman
SJ
,
Robertson
JS
et al.
Live virus vaccines based on a yellow fever vaccine backbone: standardized template with key considerations for a risk/benefit assessment.
.
Vaccine.
2015;
;
33
:
:62.
–
72
.
24.
Henao-Restrepo
AM
,
Camacho
A
,
Longini
IM
et al.
Efficacy and effectiveness of an rVSV-vectored vaccine in preventing Ebola virus disease: final results from the Guinea ring vaccination, open-label, cluster-randomised trial (Ebola Ça Suffit !).
.
Lancet.
2017;
;
389
:
:505.
–
518
.
25.
Sette
A
,
Crotty
S
.
Immunological memory to SARS-CoV-2 infection and COVID-19 vaccines.
.
Immunol Rev.
2022
Jun 22. DOI:
10.1111/imr.13089
.
27.
Lauer
UM
,
Beil
J
.
Oncolytic viruses: challenges and considerations in an evolving clinical landscape.
.
Future Oncol.
2022
Jul 12. DOI:
10.2217/fon-2022-0440
.
|