| |
| Med Sci (Paris). 38(12): 1028–1038. doi: 10.1051/medsci/2022161.Ces virus qui nous habitent et qui nous visitent : le virome humain Michèle Ottmann1* 1Centre international de recherche en infectiologie (CIRI), université Claude Bernard-Lyon 1, université de Lyon, Inserm U1111 – CNRS UMR 5308 – ENS, Laboratoire de virologie et pathologies humaines, Faculté de médecine RTH Laennec
,
7 rue Guillaume Paradin
,
69372Lyon cedex 08
,
France |
Vignette (© Philippe Roingeard).
La médecine et la science ont longtemps été focalisées sur les maladies infectieuses visibles. Le projet du Microbiome Humain (HMP pour
Human Microbiome Project
), qui a vu le jour en 2008, s’était donné comme mission d’identifier et de caractériser l’ensemble des micro-organismes présents dans et sur le corps humain [
1
]. Les résultats obtenus grâce aux nouvelles techniques de séquençage haut débit (ou NGS,
next-generation sequencing
) obligent désormais à repenser l’être humain comme un holobionte
2
, c’est-à-dire comme étant la somme de ses propres cellules et de tous les micro-organismes qu’il héberge. Ces micro-organismes sont regroupés sous le terme de microbiome qui est l’addition du bactériome, de l’archéome, du mycobiome et du virome [
2
,
3
]. Il est ainsi estimé que pour une cellule humaine, on dénombre une bactérie, cinq à dix virus et 0,1 champignon [
4
]. Pour le virome, cela représente pour un individu en bonne santé, plus de 10
13
particules virales très diverses [
5
]. D’un point de vue écologique, l’être humain est un écosystème en homéostase : un habitat peuplé de virus et de micro-organismes avec leurs viromes associés, en interactions entre eux et avec les cellules de l’hôte, qui se maintient à l’équilibre.
Le virome humain est personnalisé, spécifique de chaque individu et dynamique au cours de la vie. Il est composé de différents virus : virus endogènes, virus procaryotes, et virus eucaryotes, mais ce sont les virus infectant les bactéries, les bactériophages, qui sont dominants. Le virome endogène, inné, est transmis génétiquement. Le virome exogène est acquis avant et après la naissance selon les virus eucaryotes rencontrés et les communautés procaryotes qui constituent le microbiome. Il s’enrichit au cours des premières années de la vie et se modifie selon l’environnement et les épisodes infectieux. Les principaux facteurs qui influencent le virome sont la génétique, la voie d’accouchement, le lieu d’habitation, l’âge, le régime alimentaire (notamment au cours des premiers mois de la vie), les médicaments prescrits, le(s) partenaire(s), la présence d’une maladie innée ou acquise [
5
-
7
].
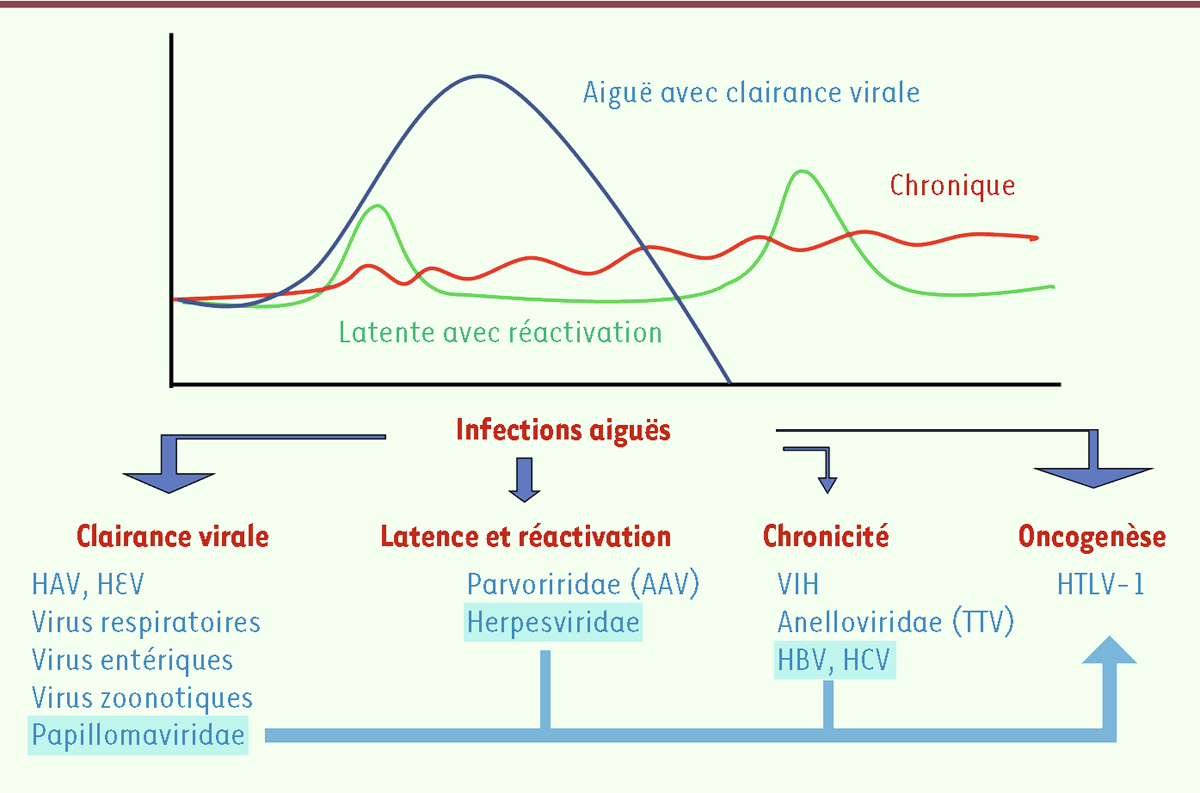
Les virus les plus étudiés sont ceux à l’origine d’une infection aiguë, symptomatique, qui provoquent une maladie grave ou le décès de l’hôte, ou qui sont éliminés par le système immunitaire (
Figure 1
). Dans de nombreux autres cas, les virus sont symbiotiques
3
; ils coexistent avec l’hôte, soit temporairement, soit tout au long de la vie. Les relations entre virus et hôte sont donc très diversifiées, allant du parasitisme agressif au mutualisme symbiotique.
 | Figure 1.
Le devenir des infections virales humaines à virus eucaryotes.
L’infection, lorsqu’elle n’est pas abortive, débute toujours par une phase aiguë plus ou moins symptomatique. Quatre scénarios sont ensuite possibles : 1) une clairance virale : le virus disparaît complétement de l’organisme, laissant une trace immunologique de son passage ; 2) une infection avec des phases de latence et de réactivation : le virus devient latent et se réactive avec une production virale infectant de nouvelles cellules cibles ; 3) une infection chronique : le virus est constamment produit ; et 4) une infection conduisant à une oncogenèse virale. Les familles virales et virus impliqués dans des processus d’oncogenèse sont surlignés en bleu (voir détails dans le
Tableau II
). HAV, HEV, HBV, HCV : virus des hépatites A, E, B et C ; AAV : virus adéno-associé ; VIH : virus de l’immunodéficience humaine, TTV : virus Torque Teno ; HTLV-1 : Virus T lymphotrope humain.
|
Nous présentons dans cette revue les connaissances actuelles concernant la composition et la diversité du virome humain dans un contexte physiologique, c’est-à-dire en homéostase, sur la base des études métagénomiques récentes, en apportant quelques éléments sur le pathovirome (l’ensemble des virus induisant une maladie chez l’hôte). Nous décrivons ensuite les connaissances et les hypothèses sur la façon dont les virus peuvent interagir et se réguler entre eux et contribuer au maintien d’un équilibre. |
Le virome humain en homéostase Les éléments viraux endogènes (EVE)
Le génome humain est composé de 90 % d’ADN non codant, dont 8 % sont des vestiges de rétrovirus. Certains gènes et fragments de gènes sont également dérivés des rétrovirus endogènes humains (HERV,
human endogenous retroviruses
), comme les LINE (
long interspersed nuclear elements
) et les SINE (
short interspersed nuclear element
). La composante virale représente environ 43 % de l’ADN humain [
8
]. L’intégration des HERV dans le génome humain date de plusieurs millions d’années [
9
], mais une endogénisation, c’est-à-dire une intégration dans la lignée germinale de l’hôte, plus récente, il y a 150 000 ans, a également été décrite [
8
]. Le phénomène d’endogénisation nécessite l’intégration du génome rétroviral dans les cellules gonadiques (ovogonies ou spermatogonies) ; il sera ensuite transmis à la descendance de manière mendélienne [
9
]. L’expression de la plupart des HERV est fortement réprimée par un mécanisme épigénétique, la méthylation de l’ADN, mais il est néanmoins possible de détecter des transcrits dans de nombreux types cellulaires [
10
].
Les protéines d’enveloppe de deux rétrovirus endogènes ont eu un rôle crucial dans la formation du placenta des mammifères : la syncytine 1, codée par HERV-W, et la syncytine 2, codée par HERV-FRD [
11
]. Ces protéines d’origine virale sont exprimées à la surface des cytotrophoblastes, ce qui leur permet de fusionner pour former le syncytiotrophoblaste
4,
. Ce tissu d’origine embryonnaire participe aux échanges materno-fœtaux et remplit des fonctions physiologiques primordiales. La placentation des mammifères euthériens (ou placentaires) est donc le résultat d’une infection rétrovirale originelle des cellules gonadiques. Le génome humain peut ainsi également être qualifié d’holobionte : somme de ses propres gènes et des séquences virales endogénisées [
8
].
Le virome procaryote Le virome bactérien
De nombreuses analyses métagénomiques de microbiomes humains montrent que les bactériophages, les virus de bactéries, sont généralement présents en quantité bien supérieure à celle des virus eucaryotes [
12
]. Les bactériophages, qui constituent le phagéome, sont retrouvés essentiellement dans l’intestin, également habité par des virus eucaryotes mais en nombre plus faible. Ce phagéome est constitué de 10
12
phages. Ils sont présents dans les selles humaines : on retrouve en effet entre 10
9
et 10
10
phages par gramme de selles [
6
]. Les phages majoritaires hébergés dans l’intestin d’individus adultes en bonne santé sont des bactériophages à ADN double brin appartenant à l’ordre des
Caudovirales
(familles
Podoviridae
,
Siphoviridae
et
Myoviridae
), des bactériophages à ADN simple brin appartenant aux
Microviridae
et aux
Inoviridae
[
6
,
7
], et des bactériophages à ARN, encore très peu étudiés. Les virus procaryotes ne sont pas l’apanage du bactériome intestinal. Ils sont également présents dans les autres bactériomes du corps humain : les bactériomes de la cavité buccale [
13
], du tractus respiratoire [
14
], de la peau, des muqueuses génitales (
Figure 2
). Outre leur rôle régulateur de la population bactérienne, une coopération locale entre les tissus et le système immunitaire de l’hôte permet aux bactériophages d’éliminer les bactéries pathogènes, leur attribuant un rôle symbiotique pour le maintien de l’homéostasie sur une durée de plus d’un an [
5
,
15
].
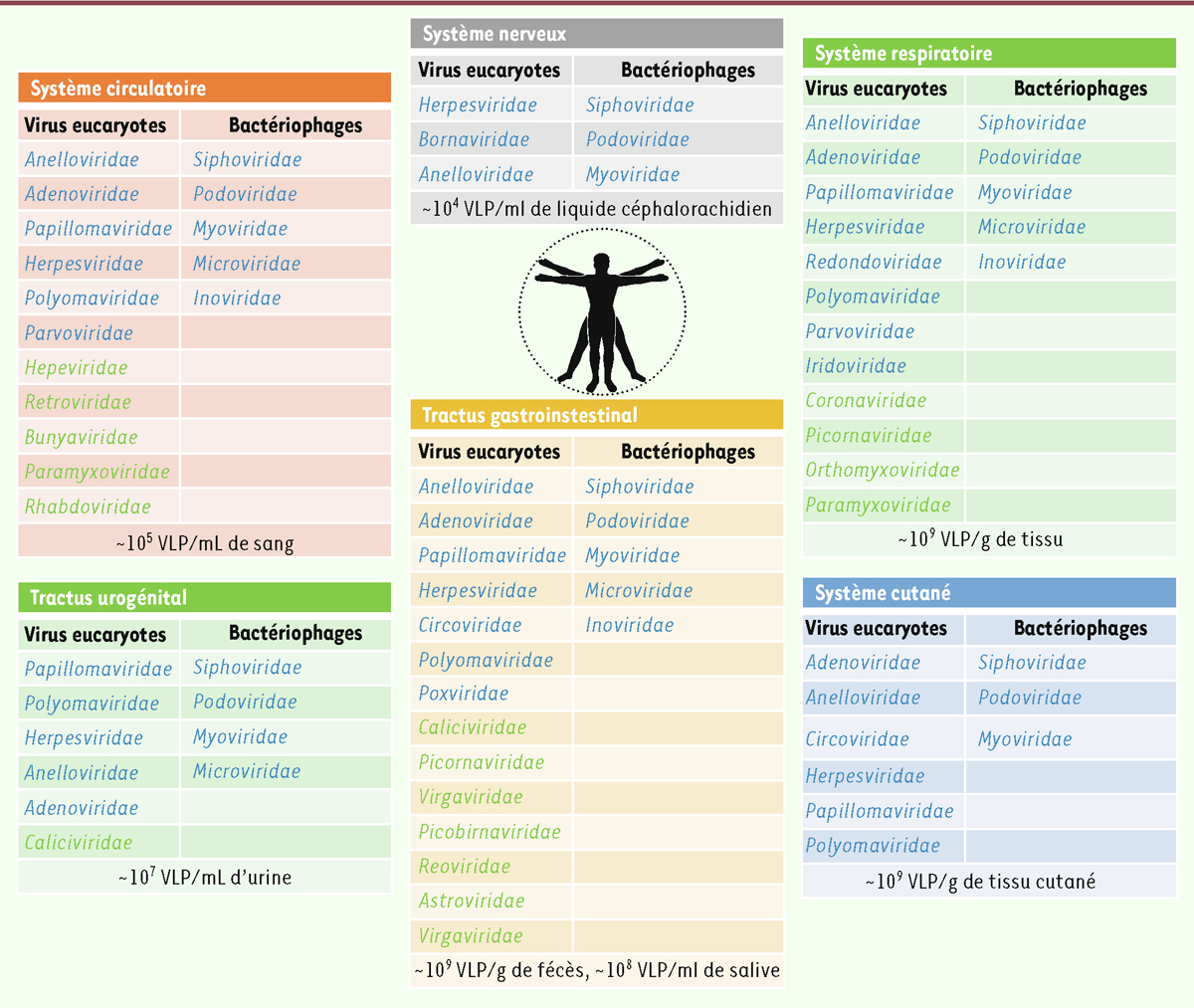
 | Figure 2.
Le virome humain dans six compartiments de l’organisme.
Répertoire des familles virales identifié dans les systèmes nerveux, respiratoire, circulatoire, cutané, dans le tractus gastro-intestinal et la sphère urogénitale. Cette cartographie représente l’état actuel de nos connaissances sur le virome humain. Certaines familles virales n’ont pas été mentionnées car elles n’ont pas fait l’objet de confirmation scientifique de leur présence dans l’organisme. Il s’agit des Marseilleviridae, des Mimiviridae, des Phycodnaviridae, des Flaviviridae, des Poxviridae et des Baculoviridae. Les VLP (
virus-like particles
, ou particules de type viral) ou particules pseudo-virales sont dénombrées dans chaque compartiment sans qu’elles soient attribuées à une famille virale. En bleu, les virus à ADN, en vert, les virus à ARN (d’après [
70
], [
5
] et [
71
]).
|
Le virome archéen
Les archées sont des micro-organismes unicellulaires procaryotes découverts il y a une quarantaine d’années. Avec les eucaryotes et les bactéries, les archées constituent la troisième branche de l’arbre du vivant. Bien que de nombreuses archées soient extrêmophiles (halophiles, acidophiles, thermophiles) et donc capables de vivre dans des environnements hostiles, elles font également partie de la plupart des microbiomes des eucaryotes. Chez l’être humain, les archées sont principalement localisées sur la peau, dans les voies respiratoires et dans le tractus gastro-intestinal [
3
], avec, dans ce dernier, la souche méthanogène la plus abondante
Methanobrevibacter smithii
. La majorité des virus présents dans les archées identifiés jusqu’à présent ont un génome à ADN double brin et appartiennent à l’ordre des
Ligamenvirales
, à l’ordre des
Caudovirales
, ainsi qu’à douze familles virales spécifiques identifiées chez des archées extrêmophiles [
16
,
17
]. La virosphère de l’archéome humain est encore inconnue et reste un champ de recherche entièrement à défricher.
Le virome eucaryote Diversité et caractéristiques des virus eucaryotes
Des virus eucaryotes ont été détectés dans tous les compartiments du corps humain, notamment le système nerveux, le tractus gastro-intestinal [
7
,
18
], le système pulmonaire [
2
], le système circulatoire [
19
], le système cutané et la sphère urogénitale [
20
] (
Figure 2
). Le virome eucaryote humain est composé de virus nus ou enveloppés dont le génome segmenté ou non, est très diversifié. Ils appartiennent à tous les groupes de la classification de Baltimore
5
: virus à ADN simple brin ou double brin, virus à ARN double brin ou simple brin, de polarité positive ou négative. Les virus étant très dépendants de la machinerie nucléaire de leur hôte pour leur réplication, le génome de certains d’entre eux se localise dans le noyau des cellules qu’ils infectent, où ils peuvent soit persister sous forme épisomale (
Herpesviridae
,
AAV
, etc.), soit s’intégrer dans le génome de la cellule hôte (Rétrovirus). À l’issue de la réplication du génome et de la néosynthèse des protéines virales, l’infection virale, si elle est productive, peut conduire à la mort cellulaire lors de la libération des particules virales. Bien que la cellule possède un arsenal de défenses anti-virales, celui-là n’est toutefois pas toujours suffisant pour contrer les nombreuses stratégies de contournement des défenses cellulaires élaborées par les virus. Si, néanmoins, les défenses de la cellule s’avèrent efficaces, l’infection virale sera dite abortive, avec pour conséquence soit la survie de la cellule (avec l’élimination du virus), soit sa mort par induction de l’apoptose (afin d’empêcher la propagation du virus). À l’échelle de l’organisme, les réponses des systèmes immunitaires inné puis adaptatif conduisent, lors d’une infection transitoire, à l’élimination des cellules infectées et à la neutralisation/destruction des agents infectieux.
La pathogénicité de tous les virus eucaryotes n’est pas encore totalement établie. Le devenir d’une infection virale après la phase aiguë de primo-infection dépend en effet des caractéristiques du virus, de sa relation avec son hôte, de la qualité de la réponse du système immunitaire, de l’environnement et de l’état général de l’hôte. Alors que la majorité des infections ont pour issue, sur une période allant de quelques jours à plusieurs mois, la disparition du virus de l’organisme (on parle de clairance virale), certaines infections persistent pendant toute la vie de l’hôte, avec des périodes de latence et de réactivation. D’autres infections seront chroniques avec, pour les virus à potentiel oncogène, une issue possible vers un processus de cancérisation des cellules infectées. Les frontières entre ces catégories d’infection sont fluctuantes : par exemple, l’infection par le virus de l’hépatite C (HCV) conduit à une clairance virale dans 20 % des cas, une infection chronique dans 80 % des cas et à environ 5 % d’hépatocarcinomes (
Figure 1
).
En particulier, le génome de nombreux virus à ADN (
Herpesvirus
,
polyomavirus
, etc.) peut persister sous forme épisomale dans le noyau de la cellule infectée, sous une forme latente sans aucune production virale. Le virus peut néanmoins être ensuite réactivé au décours d’une perturbation de l’homéostase, induisant une production virale temporaire qui peut se traduire par des symptômes passagers. L’infection productive sera alors contrôlée par le système immunitaire, et les virus produits ayant infecté de nouvelles cellules redeviendront latents. Pour les
Herpesviridae
, la latence clinique correspond à une véritable latence biologique, ce qui n’est pas le cas des virus des hépatites B et C et des rétrovirus, plus particulièrement du VIH (virus de l’immunodéficience humaine). En effet, la réplication du VIH est continue au cours de la latence clinique, même si, à l’échelle d’une cellule non activée, le génome rétroviral intégré peut rester latent.
Les virus eucaryotes persistants L’observation d’une nouvelle maladie infectieuse peut être à l’origine de la découverte d’un nouveau virus qui pourra s’avérer, après des études de séroprévalence, être très répandu dans la population. C’est le cas de plusieurs familles virales qui sont transmises de manière horizontale (entre individus) et qui vont persister pendant toute la vie de l’individu. Certains de ces virus ne sont à l’origine d’aucune manifestation clinique identifiée. Le virus Torque Teno
Le virus
Torque Teno
(du latin
torqueo
tordre et
tenuis
ténu) (TTV, de la famille des
Anelloviridae
) a été identifié en 1997 chez un patient atteint d’une hépatite post-transfusionnelle [
21
]. Ce petit virus icosaédrique non enveloppé de 40 nm de diamètre, constitué d’un petit génome d’ADN simple brin d’environ 3,8 kilobases (kb), a été décrit, depuis, comme étant le virus le plus abondant du virome humain [
22
], avec une prévalence de près de 100 % dès la première année de vie, sans jamais, à ce jour, avoir été impliqué dans une maladie spécifique [
23
]. Chez les personnes transplantées sous traitements immunosuppresseurs, il représente l’espèce virale majoritaire de leur virome sanguin [
24
]. Il pourrait ainsi constituer un nouveau marqueur de diagnostic d’immunosuppression [
22
].
Le virus adéno-associé
À l’instar du virus
Torque Teno
, le virus adéno-associé (
AAV
) est également un virus non pathogène. Ce virus, dont plus de treize sérotypes sont connus, est de la famille des
Parvoviridae
. C’est un petit virus nu d’environ 25 nm de diamètre constitué d’un génome à ADN simple brin de 5 kb. Pour répliquer efficacement son ADN, l’
AAV
nécessite un virus à ADN auxiliaire dont les mieux caractérisés sont l’Adénovirus et le virus Herpès Simplex de type 1 (HSV-1).
Les Herpesviridae humains
La famille des
Herpesviridae
humains (HHV) comprend huit membres (
Tableau I
). Après une primo-infection, survenue le plus souvent au cours de la petite enfance, ces grands virus enveloppés de 180 à 200 nm de diamètre constitué d’un génome à ADN double brin compris entre 180 et 230 kilopaires de bases (kpb), persistent sous forme d’épisomes dans le noyau de la cellule qu’ils ont infectée. Ils peuvent rester à l’état latent tout au long de la vie, ou être réactivés et provoquer des maladies telles que la mononucléose, pour le virus d’Epstein-Barr [EBV] ou le cytomégalovirus [CMV], ou le zona, pour le virus varicelle-zona [VZV].
Tableau I.
| Nomenclature |
|
Maladie |
Séroprévalence chez l’adulte |
Localisation |
Références |
| HHV-1 |
HSV-1 |
Herpès buccal |
74,4 % |
Europe |
[
72
,
73
]
|
|
| HHV-2 |
HSV-2 |
Herpès génital et buccal |
17,2 % |
Europe |
[
73
]
|
|
| HHV-3 |
VZV |
Varicelle/zona |
> 90 % |
Europe |
[
74
]
|
|
| HHV-4 |
EBV |
Mononucléose |
90 à 95 % |
Mondiale |
[
75
,
76
]
|
|
| HHV-5 |
CMV |
Mononucléose |
41,9 % |
France |
[
77
]
|
|
| HHV-6 |
HHV-6A/B |
Exanthème subi ou sixième maladie |
> 90 % |
Mondiale |
[
29
]
|
|
| HHV-7 |
HHV-7 |
Pas de maladie associée |
> 90 % |
Pays développés |
[
78
]
|
|
| HHV-8 |
KSHV |
Sarcome de Kaposi |
6 % à 50 % |
Selon zone géographique |
[
79
]
|
Les Herpesvirus humains.
Les huit virus humains de la famille des Herpesviridae. Les maladies respectives qu’ils provoquent lors de la primo-infection ou de leur réactivation, ainsi que leur séroprévalence dans la population humaine selon les régions sont montrés. EBV : virus d’Epstein-Barr ; VZV :
varicella zoster virus
, ou virus de la varicelle et du zona ; CMV : Cytomégalovirus.
|
Le virus d’Epstein-Barr est un virus ubiquitaire présent de manière asymptomatique dans environ 95 % de la population adulte mondiale. Isolé en 1964, il est le premier virus oncogène humain à avoir été identifié [
25
]. L’EBV infecte principalement les lymphocytes B et les cellules épithéliales oropharyngées. Il est associé à différents types cancers (
Tableau II
). Ces maladies sont cependant extrêmement rares au regard du nombre de personnes qui portent le virus. Notons que deux études récentes ont rapporté avoir identifié un lien de causalité entre l’EBV et la sclérose en plaques [
26
-
28
]. La séroprévalence des virus HHV6 et HHV7 est supérieure à 90 % dans la population humaine adulte mondiale. La primo-infection survient chez les enfants de moins de trois ans et se présente généralement sous une forme bégnine [
29
].
Tableau II.
| Virus |
Organe cible |
Type de cancer |
| HPV à haut risque
HPV16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 |
Oropharynx |
Carcinome |
| Col de l’utérus |
| Vagin |
| Vulve |
| Pénis |
|
| HBV |
Foie |
Carcinome |
|
| HCV |
Foie |
Carcinome |
| Système hématopoïétique |
Lymphome |
|
| EBV |
Estomac |
Carcinome |
| Nasopharynx |
Carcinome |
| Système hématopoïétique |
Lymphome |
| Tissu mou |
Tumeur |
|
| KSHV |
Tissu mou |
Tumeur (sarcome de Kaposi) |
| Système hématopoïétique |
Lymphome |
|
| MCV (virus de Merkel) |
Peau |
Carcinome |
|
| HTLV-1 |
Système hématopoïétique |
Leucémie/lymphome |
Virus à potentiel oncogène pour l’homme.
D’après [
44
].
|
Les polyomavirus
Les deux premiers polyomavirus humains ont été découverts en 1971 dans des prélèvements cliniques de patients qui ont donné leurs initiales au nom de ces virus : BK et JC. L’infection par les polyomavirus intervient pendant l’enfance avec une séroprévalence de 60 à 80 % chez des enfants âgés de cinq ans. Très majoritairement, ces infections à polyomavirus sont à l’origine d’un portage asymptomatique à vie [
30
]. La famille des
Polyomaviridae
regroupe des virus de 50 nm de diamètre non enveloppés, constitués d’un génome à ADN double brin circulaire de 5 kpb. Cette famille de virus compte, actuellement, 14 membres dont quatre sont associés à des maladies, surtout chez les personnes immunodéprimées : les virus BKV et JCV, le virus de la trichodysplasie spinulosa (TSPyV), isolé en 2007, et le virus du carcinome de Merkel (MCV), découvert en 2008 (
Tableau II
). Le TSPyV et le MCV sont responsables de maladies cutanées. Le virus BK est, quant à lui, l’agent étiologique de deux maladies rénales et le virus JC est responsable de la leucoencéphalopathie multifocale progressive [
31
].
|
Déséquilibre de l’homéostase et pathovirome Nous avons évoqué jusqu’ici quelques maladies associées à des virus persistants dont le portage est asymptomatique pour la majorité de la population humaine. Une infection virale peut cependant être asymptomatique pour certains individus et fatale pour d’autres. Cette iniquité entre individus dépend de facteurs qui sont soit intrinsèques à l’hôte (mutation génétique dans l’un des gènes gouvernant l’immunité innée, épigénétique, passé immunologique), soit extrinsèques (liés à l’environnement). Le pathovirome endogène
Alors que certains rétrovirus endogènes ont joué un rôle essentiel dans l’émergence des mammifères placentaires, avec, par exemple, les syncytines, d’autres rétrovirus endogènes peuvent avoir un effet délétère sur la reproduction. C’est le cas de l’HERV15, qui est présent en deux exemplaires sur le chromosome Y. En effet, un évènement rare de recombinaison homologue entre chromatides sœurs conduit à la délétion d’une région de 800 kpb du chromosome Y dans la lignée germinale paternelle, soit au cours des divisions mitotiques des spermatogonies, soit au cours de la méiose. La région manquante, nommée AZFa (
azoospermia factor a
), contient des gènes indispensables à la spermatogenèse ; cette délétion conduit à l’infertilité de l’individu [
32
,
33
].
Les rétrovirus endogènes présents dans le génome humain sont donc impliqués dans des processus physiologiques mais aussi pathologiques. De même, de nombreuses études ont rapporté l’implication probable des HERV dans diverses maladies, comme la schizophrénie, le diabète de type 1, la sclérose en plaque, la sclérose latérale amyotrophique, les troubles du spectre de l’autisme et des maladies autoimmunes [
33
,
34
]. D’autres études ont révélé la présence de transcrits ou de protéines rétrovirales de HERV-K, HERV-H ou HERV-E dans certaines cellules cancéreuses. Toutefois, les connaissances actuelles ne permettent pas de savoir si l’expression du génome de ces rétrovirus est une cause ou une conséquence du processus oncogénique [
35
].
Le pathovirome procaryote
Les perturbations/modulations du microbiote et du microbiome
6,
intestinal (ou dysbiose) qui ont pour origine de multiple facteurs intrinsèques ou extrinsèques ont été et sont encore le sujet de nombreuses études, mais peu se sont intéressées aux modifications touchant le virome procaryote, les phages infectant les bactéries présentes dans le tube digestif. Pourtant, les phages peuvent modifier la structure du microbiote, en tuant les bactéries hébergées ou en modifiant leur phénotype, et ainsi soit maintenir, soit rompre l’homéostasie du microbiote intestinal et, dans ce dernier cas, entraîner une dysbiose. Cette dysbiose intestinale associée à une modification du virome est fréquemment observée chez des personnes atteintes de maladies inflammatoires chroniques de l’intestin (MICI), telles que la maladie de Crohn, ou chez les personnes infectées par le VIH [
7
].
Certains phages peuvent également être à l’origine des facteurs de virulence de bactéries responsables d’infections graves. C’est le cas du choléra, une maladie diarrhéique aiguë causée par la souche bactérienne
Vibrio cholerae
, générée par lysogénisation (intégration du génome viral dans le génome bactérien) du phage filamenteux CTXΦ qui apporte à la bactérie les deux gènes codant la toxine cholérique responsable de la maladie [
36
]. De même, la souche
Staphylococcus aureus
résistante à la méticilline (SARM) produit la leucocidine de Panton-Valentine (PVL). Ce facteur de virulence bactérien est une association de deux protéines virales, codées par les prophages Luk-L et Luk-S, qui forment des pores à la surface des cellules proches de la bactérie, provoquant leur mort. Les infections à
S. aureus
produisant la PVL sont associées à des abcès cutanés, des troubles ostéo-articulaires et des pneumopathies sévères [
37
].
Le pathovirome de protistes
7
Comme c’est le cas des bactéries, l’infection de protozoaires
8
par des virus peut augmenter leur pathogénicité pour l’homme. Ainsi, le parasite
Leishmania Viannia guyanensis
, est naturellement infecté par le virus endosymbiotique LRV1 (
Leishmania RNA virus 1
). Infecté, ce parasite est à l’origine d’une forme particulièrement agressive de leishmaniose mucocutanée sud-américaine, responsable d’ulcération de la zone oropharyngée [
38
]. En effet, la leishmanie et son virus combinent leurs facteurs de virulence afin de manipuler la réponse immunitaire de l’hôte : le virus LRV1 réprime les senseurs d’ARN et l’inflammasome NLRP3 (
NOD-, LRR – and pyrin domain-containing protein 3
), responsable de la réponse inflammatoire des cellules (
via
la production des interleukines 1β et 18) avec, pour conséquence, une exacerbation de la maladie due au parasite lui-même [
39
].
Le pathovirome eucaryote
Sur les 10 434 espèces virales répertoriées à ce jour [
40
], environ 260 virus ont été identifiés pour être pathogènes pour l’homme [
41
]. L’Organisation mondiale de la santé animale (OIE) estime que 60 % des agents pathogènes qui causent des maladies humaines proviennent d’animaux domestiques et de la faune sauvage, et que 75 % des maladies émergentes décrites chez l’être humain sont d’origine zoonotique [
42
]. Sans décrire toutes les maladies virales infectieuses, nous développerons ici quelques exemples de virus qui participent temporairement au virome humain.
Les virus des hépatites
Les virus oncogènes sont responsables d’environ 13 à 20 % des cancers humains. Dans les pays à faible revenu ou à revenu intermédiaire, 30 % des cancers sont imputables à des infections par les virus des hépatites B et C (HBV et HCV) et par les papillomavirus [
35
,
43
,
44
].
Les virus des hépatites appartiennent à des familles virales distinctes. Leurs modes de transmission et les répercussions cliniques sont différents, mais ils partagent le même organe cible, le foie. Il s’agit du virus de l’hépatite A (HAV), du HBV, du HCV, du virus de l’hépatite Delta (HDV), ce dernier virus étant toujours associé au HBV, et du virus de l’hépatite E (HEV). Alors que les virus HAV et HEV sont responsables d’infections transitoires, les autres virus hépatiques peuvent persister et conduire à un portage chronique, pouvant, après plusieurs années, être responsables de cirrhose et d’hépatocarcinome (
Figure 1
,
Tableau II
) [
45
].
Intégration de génomes viraux dans les chromosomes de cellules somatiques
Des génomes ou parties de génome viraux peuvent s’intégrer dans le génome de certaines cellules somatiques, sans donc être transmis de manière mendélienne à la descendance. Ces intégrations sont susceptibles de conduire à des processus délétères pour l’hôte, mais cela n’est pas systématique. Parmi ces virus, on retrouve en particulier des rétrovirus, comme le VIH ou le virus lymphotrope de cellules T humain de type 1 (HTLV-1). Bien que majoritairement présents dans le noyau des cellules sous forme d’épisomes, certains virus de la famille des
Herpesviridae
peuvent également s’intégrer dans le génome de la cellule hôte. C’est le cas du virus d’Epstein-Barr, de l’HHV-6 [
46
], de certains papillomavirus (HPV16, HPV18), du virus adéno-associé (AAV) [
47
], et de certains bornavirus [
48
].
Les infections rétrovirales (dues au VIH, au HTLV-1 et aux virus apparentés), en raison de l’intégration des génomes viraux dans le génome des cellules, persistent pendant toute la vie des personnes infectées. Cette famille de virus enveloppés, appelée
Retroviridae
, possède un génome à ARN d’environ 10 kb. Après un processus de transcription inverse, permettant au génome ARN d’être copié en ADN, il s’intègre dans le génome de la cellule hôte. En 2020, l’OMS estimait à 37,7 millions le nombre de personnes vivant avec le VIH ; 73 % d’entre elles bénéficiaient d’une thérapie antirétrovirale [
49
].
HTLV-1 a été le premier rétrovirus humain découvert en 1980. Depuis, quatre types de HTLV ont été isolés chez l’homme et ont été associés phylogénétiquement aux virus simiens STLV (
simian-T-lymphotropic viruses
). Au moins 20 millions de personnes sont infectés par le HTLV dans le monde et, contrairement au VIH, aucune thérapie efficace n’est encore disponible. Après une période asymptomatique de plusieurs années, certaines personnes infectées (2,5 %) développent une leucémie à lymphocytes T de l’adulte, dont l’issue est fatale à court terme. Certaines autres (3 à 5 %) développent des maladies liées à une hypersensibilité immunitaire, telles que l’arthrite, l’uvéite et, surtout, une myélopathie associée au HTLV-1, la paraparésie spastique tropicale, un trouble neurologique inflammatoire chronique létal. La grande majorité des personnes infectées restent néanmoins asymptomatiques toute leur vie [
50
].
Les virus à clairance virale tardive
La famille des
Papillomaviridae
humains (HPV) est une grande famille regroupant des petits virus à ADN simple brin non enveloppés, qui compte actuellement 225 membres classés en cinq genres (alpha, bêta, gamma, mu et nu), selon leur tropisme tissulaire et la maladie qu’ils provoquent. Les virus HPV du genre alpha sont les plus étudiés. Ils provoquent une maladie à la fois cutanée et muqueuse. Les autres genres de HPV ne ciblent que la peau [
30
]. En fonction de leur capacité oncogénique, ces virus sont classés en HPV à haut risque cancérogène et en HPV à faible risque (
Tableau II
). Parmi les douze types de HPV à haut risque cancérogène, les plus connus sont les HPV16 et HPV18, qui sont associés aux lésions malpighiennes intra-épithéliales de haut grade. Les types de HPV à faible risque, HPV6 et HPV11, sont, quant à eux, associés le plus souvent à des verrues anogénitales bénignes. Les verrues vulgaires (
verrucae vulgaris
) sont provoquées majoritairement par les virus HPV1, 2, 4 et 7. Ces infections disparaissent en général spontanément en quelques mois (dans 90 % des cas, le virus n’est plus retrouvé 2 ans après la primo-infection). Les infections génitales à HPV sont directement liées à l’activité sexuelle. Plusieurs infections consécutives peuvent survenir au cours de la vie sexuelle. Les HPV à haut risque peuvent provoquer des lésions précancéreuses pouvant évoluer, après plusieurs années, en cancers de l’oropharynx, de la vulve, du pénis, de l’anus, ou du col utérin. Ces infections sont désormais évitables avec la prévention vaccinale des jeunes garçons et des jeunes filles [
51
].
Les virus respiratoires
Les infections respiratoires aiguës sont la principale cause de morbidité et de mortalité dans le monde [
52
]. Les grandes familles de virus impliquées dans les épidémies saisonnières et les pandémies sont les
Picornaviridae
(Rhinovirus, Enterovirus, Parechovirus), les
Coronaviridae
(HCoV-229E, HCoV-NL63, HCoV-OC43, HCoV-HKU1, SARS-CoV-1, MERS-CoV et SARS-CoV-2), les
Orthomyxoviridae
(
Influenza A
: H1N1, H3N2, et
B
), les
Paramyxoviridae
(VRS : virus respiratoire syncytial, Parainfluenzavirus, Métapneumovirus), les
Adenoviridae
, et les
Parvoviridae
(Bocavirus) [
53
]. Alors que les infections virales du tractus respiratoire supérieur (nez, sinus, bouche, pharynx et larynx) sont bégnines, les atteintes du tractus respiratoire inférieur (trachée, bronches, bronchioles, et alvéoles) provoquent des maladies plus sérieuses, pouvant compromettre la qualité des échanges gazeux et conduire à des syndromes de détresse respiratoire aiguë, comme ceux décrits pour les SARS-CoV.
Les facteurs de perturbation de l’homéostase virale
En cas d’infection bactérienne, la prise d’antibiotiques est à l’origine d’une perturbation du microbiome, en particulier des viromes procaryote et eucaryote. En effet, dans la cavité buccale de personnes traitées par antibiotiques, une quantité plus importante de Papillomavirus a été observée, suggérant une régulation de cette famille de virus par le microbiome/virome procaryote à l’homéostase [
54
]. La prise d’antiviraux a, évidemment, une incidence sur le virome, mais d’autres molécules à visée thérapeutique pourraient également avoir un impact non négligeable sur celui-ci. Cela pourrait expliquer les effets secondaires de certaines molécules.
|
Contribution et écologie du virome à l’homéostase Des coinfections bénéfiques pour l’hôte
Lors d’une coinfection, des interactions moléculaires entre virus peuvent moduler l’expression de l’un d’eux. C’est le cas des protéines
rep
d’AAV qui répriment la réplication de ses virus auxiliaires (Herpesvirus et Adénovirus, entre autres). Ce rôle inhibiteur pourrait s’étendre à d’autres virus, comme le VIH [
55
]. L’AAV pourrait donc contribuer à l’homéostase du virome humain en réprimant la réplication de certains virus. Il a par ailleurs été montré
in vitro
que la protéine APH-2 (
antisense protein of HTLV-2
) codée par HTLV-2 réprime l’expression du précurseur
gag
de VIH-1 et réduit la production de virions VIH-1 [
56
].
Un autre exemple de relation symbiotique concerne le pegivirus humain 1 (HPgV-1), un virus enveloppé à ARN simple brin positif de 9,4 kb, découvert en 1995, et membre de la famille des
Flaviviridae
. Ce virus lymphotrope T et B n’est associé à aucune maladie humaine connue, il est transmis par voies parentérale, sexuelle et verticale. Sa prévalence est de moins de 20 % au niveau mondial, avec des taux variables selon les régions, allant jusqu’à 50 % dans les pays en voie de développement. Une clairance virale est généralement observée dans les deux ans qui suivent la primo-infection, mais le virus peut persister plus longtemps. Un lien entre l’infection chronique par le HPgV-1 et un bénéfice clinique de patients coinfectés par le HPgV-1 et le VIH-1, ou le HCV ou le virus Ebola a été rapporté. En effet, la glycoprotéine E2 du HPgV-1 joue un important rôle immunomodulateur, en réduisant l’expression par les cellules immunitaires de certaines chimiokines et de leurs récepteurs, et la production de certaines cytokines pro-inflammatoires. Cette glycoprotéine virale agit également sur la réplication du second virus (VIH-1, HCV ou Ebola), en inhibant la maturation du précurseur
gag
du VIH, par exemple [
57
].
Le virome murin pour comprendre le virome humain
Des modèles murins ont été utilisés pour comprendre l’impact d’un virus sur une surinfection bactérienne ou virale, ou sur le microbiote intestinal. Des études ont ainsi montré chez la souris, que des infections par les Herpesvirus, les Norovirus et les Astrovirus étaient associées, lors de surinfections bactériennes ou virales, à une réponse immunitaire protectrice accrue, avec la synthèse d’interférons, une meilleure réponse anticorps et une meilleure réactivité des lymphocytes T CD8
+
[
58
-
63
]. Bien que ces études présentent des limites d’interprétation liées au modèle animal utilisé et à son propre virome, il apparaît que ces virus pourraient entretenir une relation symbiotique, avec des avantages immunitaires pour l’hôte.
Du symbiotique au pathologique, et vice-versa Il n’y a pas de frontière entre virus symbiotiques et virus pathogènes. Un virus pathogène lors d’une primo-infection peut en effet devenir symbiotique, comme c’est le cas pour les Herpesvirus. De même, des virus constitutifs du virome à l’état homéostasique peuvent devenir pathogènes lorsque les conditions leur deviennent favorables (ou défavorables, pour l’hôte !).
Une nouvelle infection virale peut ainsi déclencher une cascade de déséquilibres qui conduit à la réactivation de virus jusqu’alors latents ou à l’apparition de nouvelles maladies. Le VIH en est un exemple bien documenté car l’immunosuppression qu’il induit lors de l’infection réactive tous les Herpesvirus, EBV, CMV, VZV, entre autres [
64
]. Les Entérovirus en sont un autre exemple avec des preuves moléculaires qui s’accumulent concernant leur participation à la survenue d’une auto-immunité ciblant les îlots de Langerhans du pancréas, à l’origine d’un diabète de type 1. Cependant, les génotypes viraux précis responsables n’ont pas encore été identifiés [
65
].
Le couple virome/hôte : adaptation et évolution
Le virome est le résultat d’une adaptation et d’une coévolution entre les microorganismes et leur hôte. Prenons l’exemple des virus de l’immunodéficience acquise simienne (SIV). L’introduction de ces virus dans la lignée simienne date de plus de dix millions d’années et chaque couple SIV-primate a co-évolué spécifiquement [
66
]. Ces virus provoquent une infection qui reste asymptomatique chez les couples virus-singe dans lesquels ils se sont développés : SIVcpz et chimpanzé, SIVsmg et mangabey fumé. Par contre, l’infection d’un chimpanzé par un virus de mangabey fumé, SIVsmg, provoque une immunodéficience.
Chez l’homme, l’introduction du VIH date d’environ une centaine d’années. Plusieurs millions d’années d’évolution seraient nécessaires pour que le VIH réduise sa virulence et devienne apathogène pour l’homme. C’est probablement ce mécanisme d’introduction virale très ancienne qui peut expliquer l’absence ou la faible pathogénicité des Herpesvirus dans la population humaine. Comme c’est le cas pour les couples primate-SIV, les chauve-souris sont le réservoir de nombreux virus zoonotiques (rage, Ebola, Nipah, etc.) qui sont apathogènes pour elles-mêmes. Les infections humaines par ces virus zoonotiques sont ainsi des « erreurs de casting » entraînant des réponses inappropriées et exacerbées chez l’hôte nouvellement infecté. La pathogénicité virale peut alors être vue comme une inadaptation du couple virus-hôte. Une écologie du virome humain
Les virus sont des acteurs du vivant, ubiquitaires et essentiels à tout écosystème. À l’échelle planétaire, ils représentent des moteurs pour l’évolution et une source de biodiversité. En influençant le taux de croissance, le cycle nutritif, les échanges génétiques de leurs hôtes, ils jouent un rôle essentiel dans la régulation des populations. Ils sont également une source de nouveaux gènes et sont d’excellents véhicules de transfert génétique. Ils contribuent ainsi à la diversité biologique, à l’adaptation et à l’évolution du monde vivant [
67
]. L’infectiologie, qui traite des maladies infectieuses, est une des composantes de cette écologie. L’holobionte humain est un écosystème qui héberge plus de virus amis (commensaux ou mutualistes) que de virus ennemis (pathogènes). Le philosophe et historien des sciences Michel Serres (1930-2019) écrivait «
Le parasite prend et ne donne rien. L’hôte donne et ne reçoit rien
» [
68
]. Or, le pathogène peut donner certains de ses gènes, et l’hôte recevoir une leçon d’éducation
via
son système immunitaire.
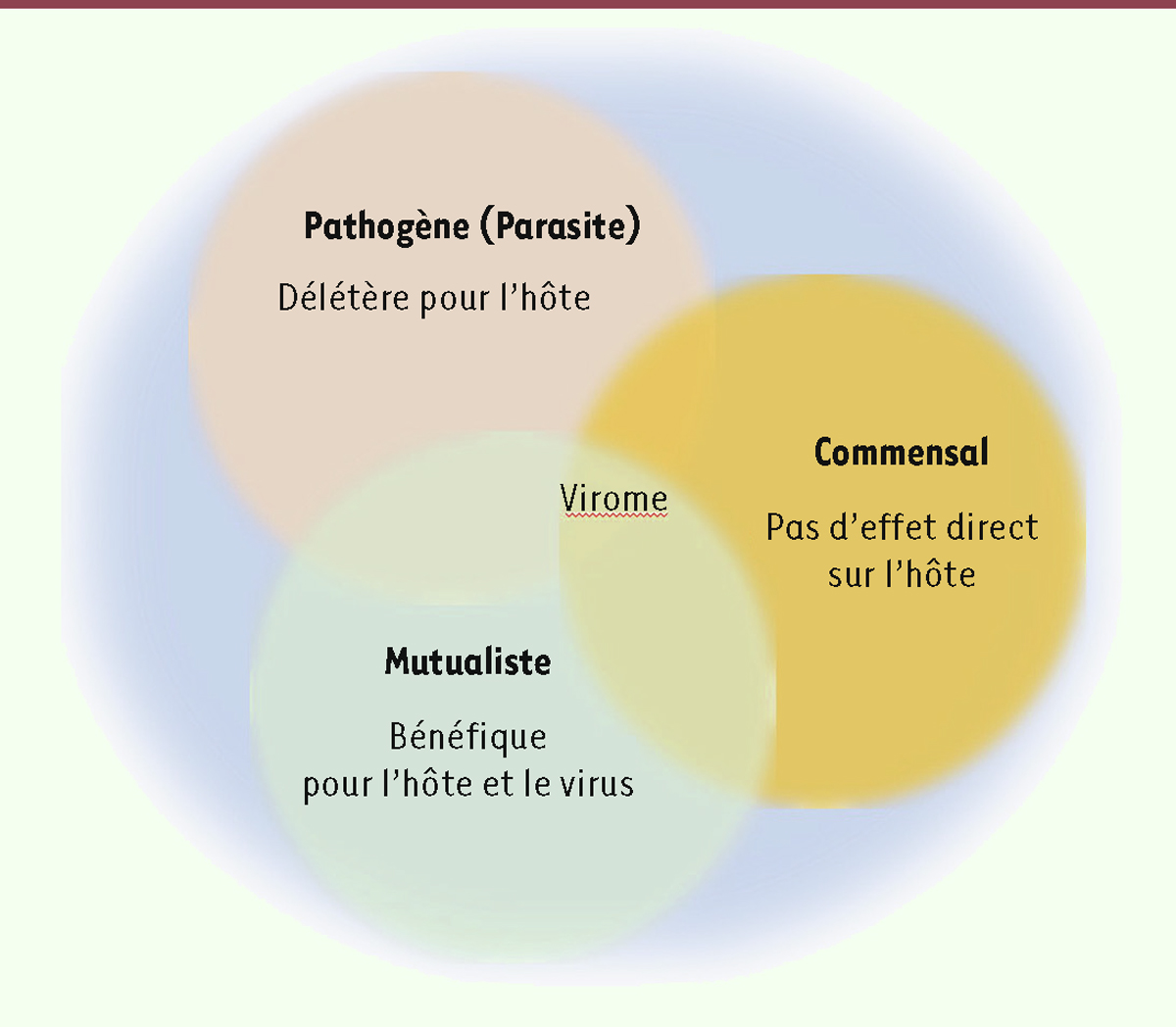
Le dogme qui lie le virus au parasitisme et à son caractère pathogène est à nuancer au regard des nombreux virus qui constituent la virosphère humaine. Pris sous l’angle d’un écosystème, le virome humain est composé de virus qui peuvent être parasites et donc non adaptés et pathogènes pour leur hôte – c’est le cas de tous les virus zoonotiques – mais il est également constitué de virus mutualistes qui auront un effet bénéfique, comme c’est le cas des bactériophages et de virus commensaux comme le TTV, qui n’auront aucun effet sur l’hôte (
Figure 3
) [
69
].
 | Figure 3.
Le virome humain.
Le virome humain sous l’angle de l’écologie virale du parasitisme, du commensalisme et du mutualisme. Ces trois classifications ne sont pas statiques car un déséquilibre de l’homéostasie peut entraîner une maladie associée au virome commensal ou mutualiste, ou attribuer des avantages à des virus pathogènes. Les trois viromes ont des modes de transmission soit horizontaux soit verticaux (d’après [
69
]).
|
|
Conclusion et perspectives
Le virome humain compte aujourd’hui 320 espèces virales [
14
]. Il s’est étoffé grâce à la métagénomique. Les prochaines années apporteront encore de nouvelles données pour l’enrichir et pour qu’il ne soit plus cette « matière noire » (
dark matter
) de la métagénomique. Notre connaissance du virome humain reste encore très fragmentaire. La métagénomique virale de l’intestin humain produit en effet entre 75 % et 99 % de séquences qui ne s’alignent pas de manière significative avec des séquences de génomes viraux connus [
6
]. Beaucoup de données sont manquantes pour les virus à ARN procaryotes, les virus du mycobiome ou de l’archéome. Le virome humain n’est pas statique, il évolue tout au long de la vie, il fluctue selon le régime alimentaire, l’âge, l’état physiologique, le mode de vie et le milieu environnant. Sa diversité semble dépendre du genre, de la génétique et de l’épigénétique individuelle. C’est dans l’étude des situations de déséquilibre de la relation homéostasique du triplet hôte-microbiome-virome, que nous comprendrons mieux les contributions du virome humain aux équilibres métabolique, physiologique, immunologique et probablement psychologique. Les verrous techniques se sont levés ces deux dernières décennies, mais le virome humain reste encore un vaste champ exploratoire pour la recherche et l’innovation thérapeutique pour les années à venir.
|
L’auteure déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
L’auteure remercie chaleureusement Audrey Page-Blasquez pour la relecture du manuscrit.
|
Footnotes |
1.
Human Microbiome Project – Home 2013.
2.
Marsland
BJ
,
Gollwitzer
ES
.
Host-microorganism interactions in lung diseases.
.
Nat Rev Immunol.
2014;
;
14
:
:827.
–
835
.
3.
Borrel
G
,
Brugère
J-F
,
Gribaldo
S
,
et al.
The host-associated archaeome.
.
Nat Rev Microbiol.
2020;
;
18
:
:622.
–
36
.
4.
Sender
R
,
Fuchs
S
,
Milo
R
.
Revised Estimates for the Number of Human and Bacteria Cells in the Body.
.
PLoS Biol.
2016;
;
14
:
:e1002533.
.
5.
Liang
G
,
Bushman
FD
.
The human virome: assembly, composition and host interactions.
.
Nat Rev Microbiol.
2021;
;
19
:
:514.
–
27
.
6.
Shkoporov
AN
,
Hill
C
.
Bacteriophages of the Human Gut: The “Known Unknown” of the Microbiome.
.
Cell Host Microbe.
2019;
;
25
:
:195.
–
209
.
7.
Carding
SR
,
Davis
N
,
Hoyles
L
.
Review article: the human intestinal virome in health and disease.
.
Aliment Pharmacol Ther.
2017;
;
46
:
:800.
–
815
.
8.
Ryan
FP
.
An alternative approach to medical genetics based on modern evolutionary biology. Part 2: retroviral symbiosis.
.
J R Soc Med.
2009;
;
102
:
:324.
–
331
.
9.
Lavialle
C
,
Cornelis
G
,
Dupressoir
A
et al.
Paleovirology of ’syncytins’, retroviral env genes exapted for a role in placentation.
.
Philos Trans R Soc Lond B Biol Sci.
2013;
;
368
:
:20120507.
.
10.
Mager
DL
,
Stoye
JP
.
Mammalian Endogenous Retroviruses.
.
Microbiol Spectr.
2015;
;
3
:
MDNA3-0009-2014.
.
11.
Dupressoir
A
,
Heidmann
T
.
Les syncytines: Des protéines d’enveloppe rétrovirales capturées au profit du développement placentaire.
.
Med Sci (Paris).
2011;
;
27
:
:163.
–
169
.
12.
Navarro
F
,
Muniesa
M
.
Phages in the Human Body.
.
Front Microbiol.
2017;
;
8
:
:566.
.
13.
Li
X
,
Liu
Y
,
Yang
X
,
et al.
The Oral Microbiota: Community Composition, Influencing Factors, Pathogenesis, and Interventions.
.
Front Microbiol.
2022;
;
13
:
:895537.
.
14.
Porto
BN
.
Insights Into the Role of the Lung Virome During Respiratory Viral Infections.
.
Front Immunol.
2022;
;
13
:
:885341.
.
15.
Vitetta
L
,
Vitetta
G
,
Hall
S
.
Immunological Tolerance and Function: Associations Between Intestinal Bacteria, Probiotics, Prebiotics, and Phages.
.
Front Immunol.
2018;
;
9
:
:2240.
.
16.
Prangishvili
D
,
Bamford
DH
,
Forterre
P
et al.
The enigmatic archaeal virosphere.
.
Nat Rev Microbiol.
2017;
;
15
:
:724.
–
739
.
17.
Krupovic
M
,
Cvirkaite-Krupovic
V
,
Iranzo
J
et al.
Viruses of archaea: Structural, functional, environmental and evolutionary genomics.
.
Virus Res.
2018;
;
244
:
:181.
–
193
.
18.
Henrot
C
,
Kuksin
M
.
Le virobiote intestinal, nouvelle composante des interactions entre le microbiote et le système immunitaire.
.
Med Sci (Paris).
2019;
;
35
:
:578.
–
580
.
19.
Moustafa
A
,
Xie
C
,
Kirkness
E
et al.
The blood DNA virome in 8,000 humans.
.
PLoS Pathog.
2017;
;
13
:
:e1006292.
.
20.
Happel
A-U
,
Varsani
A
,
Balle
C
,
et al.
The Vaginal Virome-Balancing Female Genital Tract Bacteriome, Mucosal Immunity, and Sexual and Reproductive Health Outcomes?
Viruses.
2020;
;
12
:
:832.
.
21.
Nishizawa
T
,
Okamoto
H
,
Konishi
K
et al.
A Novel DNA Virus (TTV) Associated with Elevated Transaminase Levels in Posttransfusion Hepatitis of Unknown Etiology.
.
Biochem Biophys Res Comm.
1997;
;
241
:
:92.
–
97
.
22.
Focosi
D
,
Antonelli
G
,
Pistello
M
et al.
Torquetenovirus: the human virome from bench to bedside.
.
Clin Microbiol Infec.
2016;
;
22
:
:589.
–
593
.
23.
Lolomadze
EA
,
Rebrikov
DV
.
Constant companion: clinical and developmental aspects of torque teno virus infections.
.
Arch Virol.
2020;
;
165
:
:2749.
–
57
.
24.
De Vlaminck
I
,
Khush
KK
,
Strehl
C
et al.
Temporal Response of the Human Virome to Immunosuppression and Antiviral Therapy.
.
Cell.
2013;
;
155
:
:1178.
–
1187
.
25.
Yin
H
,
Qu
J
,
Peng
Q
et al.
Molecular mechanisms of EBV-driven cell cycle progression and oncogenesis.
.
Med Microbiol Immunol.
2019;
;
208
:
:573.
–
583
.
26.
Lanz
TV
,
Brewer
RC
,
Ho
PP
,
et al.
Clonally expanded B cells in multiple sclerosis bind EBV EBNA1 and GlialCAM.
.
Nature.
2022;
;
603
:
:321.
–
7
.
27.
Bjornevik
K
,
Cortese
M
,
Healy
BC
,
et al.
Longitudinal analysis reveals high prevalence of Epstein-Barr virus associated with multiple sclerosis.
.
Science.
2022;
;
375
:
:296.
–
301
.
28.
Manet
E
,
Gruffat
H
.
Le virus d’Epstein-Barr : Un acteur clé dans le développement de la sclérose en plaques.
.
Med Sci (Paris).
2022;
;
38
:
:422.
–
4
.
29.
Aswad
A
,
Aimola
G
,
Wight
D
,
et al.
Evolutionary History of Endogenous Human Herpesvirus 6 Reflects Human Migration out of Africa.
.
Mol Biol Evol.
2021;
;
38
:
:96.
–
107
.
30.
Haley
CT
,
Mui
UN
,
Vangipuram
R
et al.
Human oncoviruses: Mucocutaneous manifestations, pathogenesis, therapeutics, and prevention: Papillomaviruses and Merkel cell polyomavirus.
.
J Am Acad Dermatol.
2019;
;
81
:
:1.
–
21
.
31.
Solis
M
,
Gallais
F
,
Velay
A
et al.
BK-virus and pathophysiology of associated diseases.
.
Virologie (Montrouge).
2019;
;
23
:
:7.
–
22
.
32.
Sun
C
,
Skaletsky
H
,
Rozen
S
et al.
Deletion of azoospermia factor a (AZFa) region of human Y chromosome caused by recombination between HERV15 proviruses.
.
Hum Mol Genet.
2000;
;
9
:
:2291.
–
2296
.
33.
Ryan
FP
.
An alternative approach to medical genetics based on modern evolutionary biology. Part 3: HERVs in diseases.
.
J R Soc Med.
2009;
;
102
:
:415.
–
424
.
34.
Medina
J
,
Charvet
B
,
Leblanc
P
et al.
Des séquences rétrovirales endogènes dans le génome humain peuvent jouer un rôle physiologique oupathologique.
.
Med Sci (Paris).
2017;
;
33
:
:397.
–
403
.
35.
Ryan
FP
.
An alternative approach to medical genetics based on modern evolutionary biology. Part 4: HERVs in cancer.
.
J R Soc Med.
2009;
;
102
:
:474.
–
480
.
36.
Pant
A
,
Das
B
,
Bhadra
RK
.
CTX phage of Vibrio cholerae: Genomics and applications.
.
Vaccine.
2020;
;
38
:
:A7.
–
12
.
37.
Melles
DC
,
van Leeuwen
WB
,
Boelens
HAM
et al.
Panton-Valentine Leukocidin Genes in Staphylococcus aureus.
.
Emerg Infect Dis.
2006;
;
12
:
:1174.
–
1175
.
38.
Ives
A
,
Ronet
C
,
Prevel
F
et al.
Leishmania RNA Virus Controls the Severity of Mucocutaneous Leishmaniasis.
.
Science.
2011;
;
331
:
:775.
–
778
.
39.
Olivier
M
,
Zamboni
DS
.
Leishmania Viannia guyanensis, LRV1 virus and extracellular vesicles: a dangerous trio influencing the faith of immune response during muco-cutaneous leishmaniasis.
.
Curr Opin Immunol.
2020;
;
66
:
:108.
–
13
.
44.
Hatano
Y
,
Ideta
T
,
Hirata
A
,
et al.
Virus-Driven Carcinogenesis.
.
Cancers (Basel).
2021;
;
13
:
:2625.
.
45.
Pisano
MB
,
Giadans
CG
,
Flichman
DM
,
et al.
Viral hepatitis update: Progress and perspectives.
.
World J Gastroenterol.
2021;
;
27
:
:4018.
–
44
.
46.
Wight
DJ
,
Aimola
G
,
Aswad
A
,
et al.
Unbiased optical mapping of telomere-integrated endogenous human herpesvirus 6.
.
Proc Natl Acad Sci USA.
2020;
;
117
:
:31410.
–
6
.
47.
Rossi
A
,
Salvetti
A
.
Intégration des vecteurs AAV et mutagenèse insertionnelle.
.
Med Sci (Paris).
2016;
;
32
:
:167.
–
174
.
48.
Horie
M
,
Honda
T
,
Suzuki
Y
et al.
Endogenous non-retroviral RNA virus elements in mammalian genomes.
.
Nature.
2010;
;
463
:
:84.
–
87
.
50.
Forlani
G
,
Shallak
M
,
Accolla
RS
,
et al.
HTLV-1 Infection and Pathogenesis: New Insights from Cellular and Animal Models.
.
Int J Mol Sci.
2021;
;
22
:
:8001.
.
52.
Thi Kha Tu
N
,
Thi Thu Hong
N
,
Thi Han Ny
N
,
et al.
The Virome of Acute Respiratory Diseases in Individuals at Risk of Zoonotic Infections.
.
Viruses.
2020;
;
12
:
:960.
.
53.
Wylie
KM
.
The Virome of the Human Respiratory Tract.
.
Clin Chest Med.
2017;
;
38
:
:11.
–
19
.
54.
Abeles
SR
,
Ly
M
,
Santiago-Rodriguez
TM
et al.
Effects of Long Term Antibiotic Therapy on Human Oral and Fecal Viromes.
.
PLoS One.
2015;
;
10
:
:e0134941.
.
55.
Meier
AF
,
Fraefel
C
,
Seyffert
M
.
The Interplay between Adeno-Associated Virus and Its Helper Viruses.
.
Viruses.
2020;
;
12
:
:662.
.
56.
Londhe
R
,
Kulkarni
S
.
HTLV-2 Encoded Antisense Protein APH-2 Suppresses HIV-1 Replication.
.
Viruses.
2021;
;
13
:
:1432.
.
57.
Yu
Y
,
Wan
Z
,
Wang
J-H
,
et al.
Review of human pegivirus: Prevalence, transmission, pathogenesis, and clinical implication.
.
Virulence.
;
13
:
:324.
–
1
.
58.
Barton
ES
,
White
DW
,
Cathelyn
JS
et al.
Herpesvirus latency confers symbiotic protection from bacterial infection.
.
Nature.
2007;
;
447
:
:326.
–
329
.
59.
Furman
D
,
Jojic
V
,
Sharma
S
et al.
Cytomegalovirus infection enhances the immune response to influenza.
.
Sci Transl Med.
2015;
;
7
:
:281.
.
60.
Kernbauer
E
,
Ding
Y
,
Cadwell
K
.
An enteric virus can replace the beneficial function of commensal bacteria.
.
Nature.
2014;
;
516
:
:94.
–
98
.
61.
Neil
JA
,
Matsuzawa-Ishimoto
Y
,
Kernbauer-Hölzl
E
et al.
IFN-I and IL-22 mediate protective effects of intestinal viral infection.
.
Nat Microbiol.
2019;
;
4
:
:1737.
–
1749
.
62.
Ingle
H
,
Lee
S
,
Ai
T
et al.
Viral complementation of immunodeficiency confers protection against enteric pathogens via interferon-λ.
.
Nat Microbiol.
2019;
;
4
:
:1120.
–
1128
.
63.
Cortez
V
,
Boyd
DF
,
Crawford
JC
,
et al.
Astrovirus infects actively secreting goblet cells and alters the gut mucus barrier.
.
Nat Commun.
2020;
;
11
:
:2097.
.
64.
Stewart
JA
,
Reef
SE
,
Pellett
PE
et al.
Herpesvirus infections in persons infected with human immunodeficiency virus.
.
Clin Infect Dis.
1995;
;
21
:
:S114.
–
S120
.
65.
Isaacs
SR
,
Foskett
DB
,
Maxwell
AJ
,
et al.
Viruses and Type 1 Diabetes: From Enteroviruses to the Virome.
.
Microorganisms.
2021;
;
9
:
:1519.
.
66.
Compton
AA
,
Malik
HS
,
Emerman
M
.
Host gene evolution traces the evolutionary history of ancient primate lentiviruses.
.
Philos Trans R Soc Lond B Biol Sci.
2013;
;
368
:
:20120496.
.
67.
Suttle
CA
.
Marine viruses–major players in the global ecosystem.
.
Nat Rev Microbiol.
2007;
;
5
:
:801.
–
812
.
68.
Michel
Serres
.
Le Parasite.
.
Paris:
:
Hachette;
.
Pluriel, numéro 862 1980.
.
69.
Parker
MT
.
An Ecological Framework of the Human Virome Provides Classification of Current Knowledge and Identifies Areas of Forthcoming Discovery.
.
Yale J Biol Med.
2016;
;
89
:
:339.
–
351
.
70.
Popgeorgiev
N
,
Temmam
S
,
Raoult
D
et al.
Describing the Silent Human Virome with an Emphasis on Giant Viruses.
.
INT.
2013;
;
56
:
:395.
–
412
.
71.
Rascovan
N
,
Duraisamy
R
,
Desnues
C
.
Metagenomics and the Human Virome in Asymptomatic Individuals.
.
Annu Rev Microbiol.
2016;
;
70
:
:125.
–
141
.
72.
Yousuf
W
,
Ibrahim
H
,
Harfouche
M
,
et al.
Herpes simplex virus type 1 in Europe: systematic review, meta-analyses and meta-regressions.
.
BMJ Global Health.
2020;
;
5
:
:e002388.
.
73.
Malkin
J-E
,
Morand
P
,
Malvy
D
et al.
Seroprevalence of HSV-1 and HSV-2 infection in the general French population.
.
Sex Transm Infect.
2002;
;
78
:
:201.
–
203
.
74.
Bollaerts
K
,
Riera-Montes
M
,
Heininger
U
et al.
A systematic review of varicella seroprevalence in European countries before universal childhood immunization: deriving incidence from seroprevalence data.
.
Epidemiol Infect.
2017;
;
145
:
:2666.
–
2677
.
75.
Fourcade
G
,
Germi
R
,
Guerber
F
et al.
Evolution of EBV seroprevalence and primary infection age in a French hospital and a city laboratory network, 2000–2016.
.
PLoS One.
2017;
;
12
:
:e0175574.
.
76.
Nowalk
A
,
Green
M
Epstein-Barr Virus. Microbiol Spectr.
2016
;
:4.
.
77.
Antona
D
,
Lepoutre
A
,
Fonteneau
L
et al.
Seroprevalence of cytomegalovirus infection in France in 2010.
.
Epidemiol Infect.
2017;
;
145
:
:1471.
–
1478
.
78.
Agut
H
,
Bonnafous
P
,
Gautheret-Dejean
A
.
Human Herpesviruses 6A, 6B, and 7.
.
Microbiol Spectr.
2016
;
:4.
.
79.
Rohner
E
,
Wyss
N
,
Trelle
S
et al.
HHV-8 seroprevalence: a global view.
.
Syst Rev.
2014;
;
3
:
:11.
.
|