| |
| Med Sci (Paris). 38(11): 963–965. doi: 10.1051/medsci/2022143.Le microbiote intestinal Un acteur de la réponse aux immunothérapies dans le cancer pulmonaire ? Marion Pronost,1a Isabelle Duflot,1b and Anelyse Motte1c 11
Master 2 Infectiologie, Immunité, Vaccinologie et Biomédicaments, université de Tours
,
37000Tours
,
France MeSH keywords: Humains, Microbiome gastro-intestinal, Immunothérapie, Facteurs immunologiques, Tumeurs du poumon, thérapie |
Le cancer pulmonaire est la première cause de mortalité par cancer en France et dans le monde. En 2020, il a été responsable de 1,8 million de morts, soit 18 % des décès par cancer dans le monde et son incidence a atteint 2,21 millions de nouveaux cas diagnostiqués [
1
]. Alors que des moyens considérables sont investis pour lutter contre cette maladie, le cancer bronchique, représenté dans 85 % des cas par le type histologique non à petites cellules (CBNPC), constitue toujours un problème majeur de santé publique. Du fait d’un diagnostic fréquemment tardif, à un stade métastatique, celui-ci est responsable d’une forte morbi-mortalité pour les patients.
Au cours de ces dernières années, la meilleure compréhension des voies de signalisation impliquées dans la progression tumorale et des mécanismes immunitaires anti-tumoraux a permis la découverte révolutionnaire de nouvelles cibles moléculaires telles que les points de contrôle immunitaire. Dans un contexte tumoral tel que le CBNPC, cet ensemble de récepteurs et de ligands, en particulier la voie PD-1/PD-L1 (
programmed cell death protein
1
/programmed death-ligand
1), constitue un mécanisme d’échappement permettant à la tumeur de bloquer la réponse immunitaire [
2
]. L’arrivée d’inhibiteurs des points de contrôle immunitaire (ICI,
immune checkpoint inhibitors
) a permis de restaurer l’immunosurveillance. En effet, ces anticorps (Ac) thérapeutiques agissent en bloquant les interactions inhibitrices entre cellules tumorales et lymphocytes, permettant ainsi de réactiver l’immunité anti-cancéreuse [
2
]. Si la pertinence clinique des ICI est aujourd’hui clairement démontrée dans le traitement de plusieurs types de cancer, en association ou non à de la chimiothérapie [
3
4
], une question demeure : pourquoi seulement 20 % des patients présentant un CBNPC répondent aux ICI alors que d’autres sont réfractaires [
2
] ? Encore mal identifiés, les mécanismes de résistance sont complexes avec des variations de réponses inter- et intra-individuelles [
5
].
Plusieurs éléments influencent la réponse aux ICI, incluant des facteurs liés à l’immunité du patient, mais également des facteurs extrinsèques à la tumeur et à son microenvironnement. Parmi ces derniers, le microbiote fait l’objet d’une recherche intensive. Chaque organe possède son propre microbiote, dont la composition en bactéries, champignons, levures, virus, varie selon la localisation anatomique. Le microbiote bactérien intestinal (MI) est le mieux connu et le plus abondant, avec environ dix milliards de bactéries. Propre à chaque individu, bien qu’il semble exister un socle commun de 15 à 20 espèces, le MI a des fonctions essentielles pour le maintien de la santé de l’hôte. L’engouement de ces dernières années pour l’analyse du microbiote a permis de mieux appréhender son rôle physiologique et son implication dans la réponse immunitaire anti-tumorale [
6
].
|
Le microbiote module la réponse aux immunothérapies
En 2021, Liu
et al.
[
7
] ont publié une revue dans
Frontiers in Oncology
rapportant un nombre croissant d’études montrant une influence du MI sur l’homéostasie pulmonaire, par modulation de l’immunité innée et de l’immunité adaptative. Les mécanismes précis de ces interactions n’étant pas encore élucidés, Liu
et al.
ont émis l’hypothèse d’une reconnaissance du MI et de ses métabolites par les cellules présentatrices d’antigènes, migrant vers les poumons grâce à un recrutement induit par les chimiokines. Les situations de dysbiose dans le MI peuvent avoir un impact sur la représentativité des lymphocytes T (LT) CD8
+
activés dans la tumeur et donc sur la progression tumorale. La flore intestinale de patients présentant un cancer pulmonaire peut également être modifiée dans sa composition et sa fonction par rapport à celle d’individus ne présentant pas de pathologie pulmonaire [
7
]. Notamment, une diminution du nombre de protéobactéries, telles qu’
Escherichia-Shigella
,
Kluyvera
,
Enterobacter
, et de firmicutes, telles que
Fecalibacterium,
a été observée chez ces patients. Vingt-quatre voies métaboliques du MI sont également altérées. Une augmentation du nombre de
Bacteroides
,
Veillonella
et
Fusobacterium
a parallèlement été observée. L’ensemble de ces perturbations ont pour conséquence un dérèglement de la barrière intestinale, entraînant l’induction d’acteurs de l’inflammation, comme les interleukines (IL) 1β, 6 et 8, aussi bien au niveau digestif que pulmonaire. L’inflammation générale chronique engendrée par la perturbation des microbes et des métabolites intestinaux pourrait donc favoriser une réponse immunitaire pro-tumorale [
7
].
L’influence du MI sur les immunothérapies anti-cancéreuses a été abordée dans de nombreux travaux [
8
–
10
] (
→
).
(→) Voir la Synthèse de M. Vétizou
et al
.,
m/s
n° 11, novembre 2016, page 974
Certaines signatures de MI ont été associées à une meilleure réponse de patients présentant des cancers au traitement par immunothérapies. Par exemple, l’enrichissement en
Bifidobacterium longum, Alistipes putredinis
et
Prevotella copri
a permis une amélioration des effets du traitement par Ac anti-PD-1 [
8
]. De même,
Akkermansia muciniphila
(
A. muciniphila
) est également liée à une efficacité accrue des Ac anti-PD-1 et à une augmentation des lymphocytes T infiltrant la tumeur [
9
]. Au contraire, le déséquilibre du microbiote induit par les antibiotiques chez des patients présentant un cancer du poumon a été corrélé à une réduction de la survie [
9
]. Ces résultats suggèrent que la modulation du MI pourrait améliorer l’efficacité des immunothérapies.
|
Microbiote intestinal et réponse aux ICI : le cas particulier du CBNPC
Des travaux récents menés par He
et al
., publiés dans
Oncology and Therapy
en 2021, ont corrélé la réponse aux ICI chez 16 patients atteints de CBNPC à la composition de leur MI [
11
]. Afin d’étudier la diversité du microbiote, les selles des patients recueillies avant, puis au cours du traitement, ont été analysées par ARN 16S. La diversité et la composition du microbiote se sont avérées être différentes entre les patients dont la maladie restait stable sous traitement (
stable disease
, SD) et ceux chez qui une progression tumorale était observée (
progressive disease
, PD). En effet, 628 espèces bactériennes ont été retrouvées dans le MI des SD contre 513 dans le groupe PD. Avec 425 espèces bactériennes communes aux deux groupes, le groupe SD se distingue donc avec deux fois plus de bactéries spécifiques. Dans ce dernier groupe, une étroite corrélation a été établie entre, d’une part, la présence de
Escherichia-Shigella
et une production accrue d’IL-12 et d’interféron-
γ
(IFN-γ)
via
la stimulation des cellules dendritiques, et, d’autre part, la présence de
A. muciniphila
et une augmentation des monocytes. De ces observations, les auteurs en ont déduit que l’augmentation du nombre de
Escherichia-Shigella
et
A. muciniphila
était associée à une stabilité de la maladie et une survie plus longue des patients SD.
Ces résultats font écho à une précédente étude de 2018, dans laquelle Routy
et al
. ont montré que certaines bactéries, dont
Escherichia-Shigella
,
A. muciniphila
et
Enterococcus hirae
(
E. hirae
)
,
étaient plus abondantes chez les patients répondeurs aux ICI [
8
]. Connaissant l’influence du microbiote sur la réponse immunitaire, les auteurs se sont attachés à montrer que la modulation du MI permettait d’augmenter l’effet anti-tumoral des ICI. Dans un premier temps, Routy
et al.
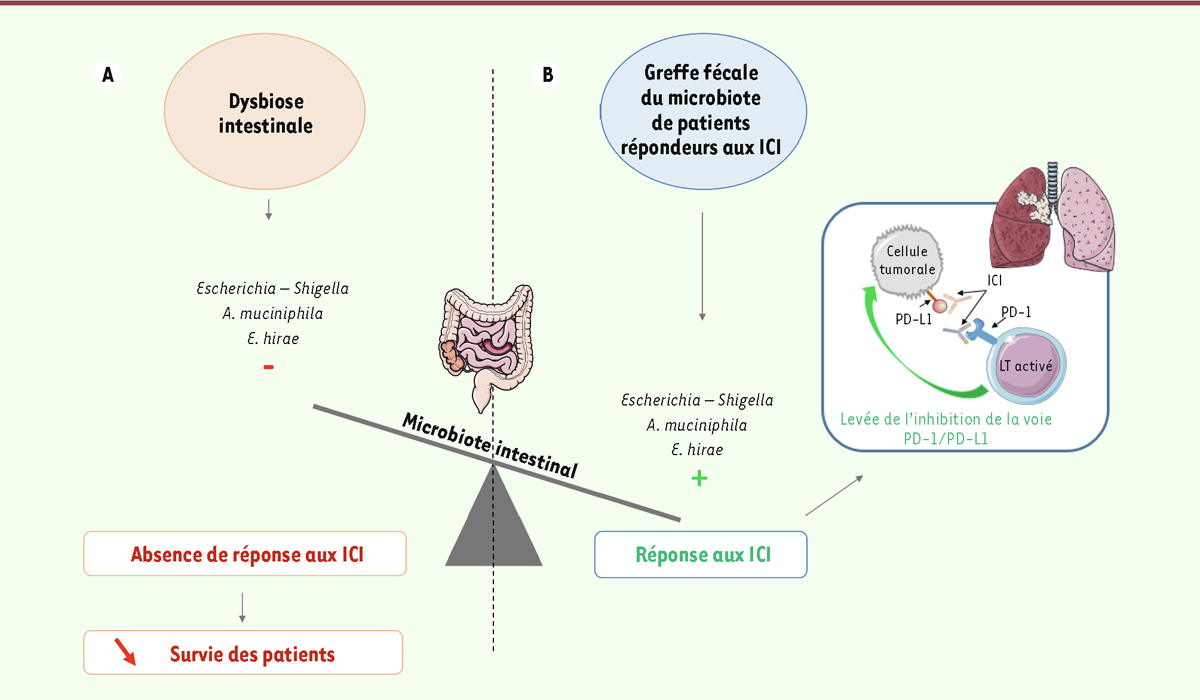
ont étudié les effets d’une prise d’antibiotiques dans les deux mois précédents ou le mois suivant l’injection d’ICI sur la survie de 249 patients présentant soit un CBNPC, soit un cancer colorectal, soit un carcinome urothélial. L’analyse statistique a mis en évidence une survie globale significativement inférieure chez les patients ayant reçu des antibiotiques, faisant ainsi de l’antibiothérapie un facteur prédictif de résistance à l’immunothérapie
via
la création d’une dysbiose intestinale (
Figure 1A
). Afin d’établir le lien entre l’efficacité des ICI et la présence de certaines espèces bactériennes, Routy
et al.
ont traité des souris avec une combinaison d’antibiotiques à large spectre afin d’éliminer le MI, puis les ont colonisées avec la souche
A. muciniphila
seule ou en association avec la souche
E. hirae
. Dans les deux groupes de souris, l’effet antitumoral des ICI a été restauré par la présence des souches bactériennes. Ces dernières, en induisant la sécrétion d’IL-12 par les cellules dendritiques au niveau des ganglions mésentériques, déclenchent une réponse pro-inflammatoire. Dans une autre série d’expériences, des souris traitées avec des antibiotiques ont reçu une greffe fécale de patients répondeurs ou non aux ICI. Remarquablement, la transplantation de microbiote fécal (TMF) des patients répondeurs a permis une inhibition de la croissance tumorale, une stimulation de l’immunité locale, ainsi qu’une levée de l’inhibition des LT (
Figure 1B
).
 | Figure 1.
Schéma illustrant l’impact de la modulation du microbiote intestinal sur la réponse aux immunothérapies dans le cancer pulmonaire.
Le microbiote intestinal voit sa composition modifiée en fonction de facteurs intrinsèques et extrinsèques.
A.
L’apparition d’une dysbiose intestinale pouvant être induite par un traitement avec des antibiotiques est à l’origine d’un déséquilibre au sein de la flore intestinale. Ce phénomène est corrélé à une moindre réponse aux ICI et à une diminution de la survie des patients.
B..
Dans le cas du cancer pulmonaire, il a été montré que le microbiote intestinal de patients répondeurs aux ICI était enrichi en
Escherichia-Shigella
,
A. muciniphila
et
E. hirae
. Une transplantation de ce microbiote fécal permet de stimuler la réponse immunitaire anticancéreuse chez la souris. Cette greffe fécale, associée à l’inhibition des points de contrôle immunitaire, permet d’optimiser la réponse aux ICI en améliorant la levée de l’inhibition de la voie PD-1/PD-L1 et de réactiver l’immunité anti-cancéreuse.
A. muciniphila : Akkermansia muciniphila ; E. hirae : Enterococcus hirae ;
ICI : Inhibiteurs de points de contrôle immunitaire
;
PD-1 :
programmed cell death protein-1 ; PD-L1
:
programmed death-ligand 1 ; LT
: lymphocyte T (figure réalisée avec Servier Medical Art).
|
Ces différentes études laissent présager une optimisation de la réponse thérapeutique aux ICI dans certains cancers au pronostic sévère grâce à la modulation du MI. Par ailleurs, le MI pourrait constituer un candidat prometteur comme biomarqueur de cette efficacité. Pour confirmer cette potentielle fonction attribuée au MI, l’étude METABO-ICI porte sur une signature prédictive du microbiote propice à une réponse aux traitements par les ICI [
12
]. En parallèle, le rétablissement de l’homéostasie du MI peut promouvoir une réponse immunitaire anti-tumorale générale et pulmonaire via l’axe intestin-poumon. Ainsi, certaines équipes de recherche s’appliquent actuellement à utiliser en pratique clinique la TMF dans la prise en charge de certains cancers, avec des résultats prometteurs dans le mélanome réfractaire aux ICI [
13
].
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Sung
H
,
Ferlay
J
,
Siegel
RL
,
et al.
Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries.
.
CA: A Cancer Journal for Clinicians.
2021;
;
71
:
:209.
–
49
.
2.
Doroshow
DB
,
Sanmamed
MF
,
Hastings
K
,
et al.
Immunotherapy in Non-Small Cell Lung Cancer: Facts and Hopes.
.
Clin Cancer Res.
2019;
;
25
:
:4592.
–
4602
.
3.
West
H
,
McCleod
M
,
Hussein
M
,
et al.
Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer (IMpower130): a multicentre, randomised, open-label, phase 3 trial.
.
Lancet Oncol.
2019;
;
20
:
:924.
–
937
.
4.
Paz-Ares
L
,
Luft
A
,
Vicente
D
,
et al.
Pembrolizumab plus Chemotherapy for Squamous Non-Small-Cell Lung Cancer.
.
N Engl J Med.
2018;
;
379
:
:2040.
–
2051
.
5.
Lei
Q
,
Wang
D
,
Sun
K
,
et al.
Resistance Mechanisms of Anti-PD1/PDL1 Therapy in Solid Tumors.
.
Front Cell Dev Biol.
2020;
;
8
.
6.
Zhao
Y
,
Liu
Y
,
Li
S
,
et al.
Role of lung and gut microbiota on lung cancer pathogenesis.
.
J Cancer Res Clin Oncol.
2021;
;
147
:
:2177.
–
86
.
7.
Liu
X
,
Cheng
Y
,
Zang
D
,
et al.
The Role of Gut Microbiota in Lung Cancer: From Carcinogenesis to Immunotherapy.
.
Front Oncol.
2021;
;
11
.
8.
Routy
B
,
Le Chatelier
E
,
Derosa
L
,
et al.
Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors.
.
Science.
2018;
;
359
:
:91.
–
97
.
9.
Elkrief
A
,
Derosa
L
,
Zitvogel
L
,
et al.
The intimate relationship between gut microbiota and cancer immunotherapy.
.
Gut Microbes.
2019;
;
10
:
:424.
–
428
.
10.
Vétizou
M
,
Daillère
R
,
Zitvogel
L
.
Microbiote intestinal et réponses aux thérapies anti-tumorales.
.
Med Sci (Paris).
2016;
;
32
:
:974.
–
982
.
11.
He
D
,
Li
X
,
An
R
,
et al.
Response to PD-1-Based Immunotherapy for Non-Small Cell Lung Cancer Altered by Gut Microbiota.
.
Oncol Ther.
2021;
;
9
:
:647.
–
57
.
12.
Sannicolo
S
,
Giaj Levra
M
,
Le Gouellec
A
,
et al.
Identification of a predictive metabolic signature of response to immune checkpoint inhibitors in non-small cell lung cancer: METABO-ICI clinical study protocol.
.
Respir Med Res.
2021;
;
80
:
:100845.
.
13.
Hindson
J
.
FMT for immunotherapy-refractory melanoma.
.
Nat Rev Gastroenterol Hepatol.
2021;
;
18
:
:82.
.
|