| |
| Med Sci (Paris). 38(11): 960–962. doi: 10.1051/medsci/2022142.Et pour quelques mitochondries de plus Quand l’utilisation des nanotubes favorise la prolifération cancéreuse Mélanie Laboria1* and Romain Lozano1** 1M2 Infectiologie, Immunité, Vaccinologie et Biomédicaments, université de Tours
,
37000Tours
,
France MeSH keywords: Humains, Nanotubes, Mitochondries, Tumeurs, Prolifération cellulaire |
Les nanotubes : des autoroutes de communication entre les cellules
La communication de cellule à cellule est cruciale pour le développement et le maintien des organismes multicellulaires. En 2004, la formation de canaux membranaires minces s’établissant entre les cellules a été découverte chez les mammifères [
1
]. Ces nanotubes ou
tunneling nanotubes
(TNT) connectent différents types de cellules, assurant la continuité membranaire et permettant ainsi le transfert intercellulaire direct de divers composants. Contrairement aux jonctions communicantes, les TNT permettent une communication dirigée à longue distance entre des cellules éloignées. Les nanotubes sont constitués d’éléments du cytosquelette, tels que les protéines d’actine et de tubuline, ainsi que la protéine moteur myosine V, connue comme étant un transporteur agissant le long des filaments d’actine [
2
].
Ces moyens de communication entre cellules saines peuvent être détournés par des agents pathogènes pour leur propagation de cellule en cellule. Par exemple, le VIH (virus de l’immunodéficience humaine) utilise les TNT pour se propager au sein des lymphocytes T [
3
], tandis que les prions peuvent être transférés entre différents neurones ou entre cellules dendritiques et neurones
via
ces nanotubes [
4
].
De plus, il a été démontré que des nanotubes participent à la communication et à la coopération entre des cellules issues de tumeurs cérébrales, induisant une progression de la tumeur ainsi qu’une résistance aux dommages causés par la radiothérapie [
5
].
|
Nanotubes entre cellules cancéreuses et cellules immunitaires : un hold-up énergétique pour la survie de la tumeur Un trafic mitochondrial médié par les nanotubes
Dans l’article de Saha
et al
. publié en 2022 [
6
], les chercheurs ont mis en place des expériences de co-cultures de différentes cellules tumorales mammaires, d’origine murine ou humaine, avec des cellules immunitaires effectrices, telles que des cellules NKT
(natural killer T
) ou des lymphocytes T CD3
+
/CD8
+
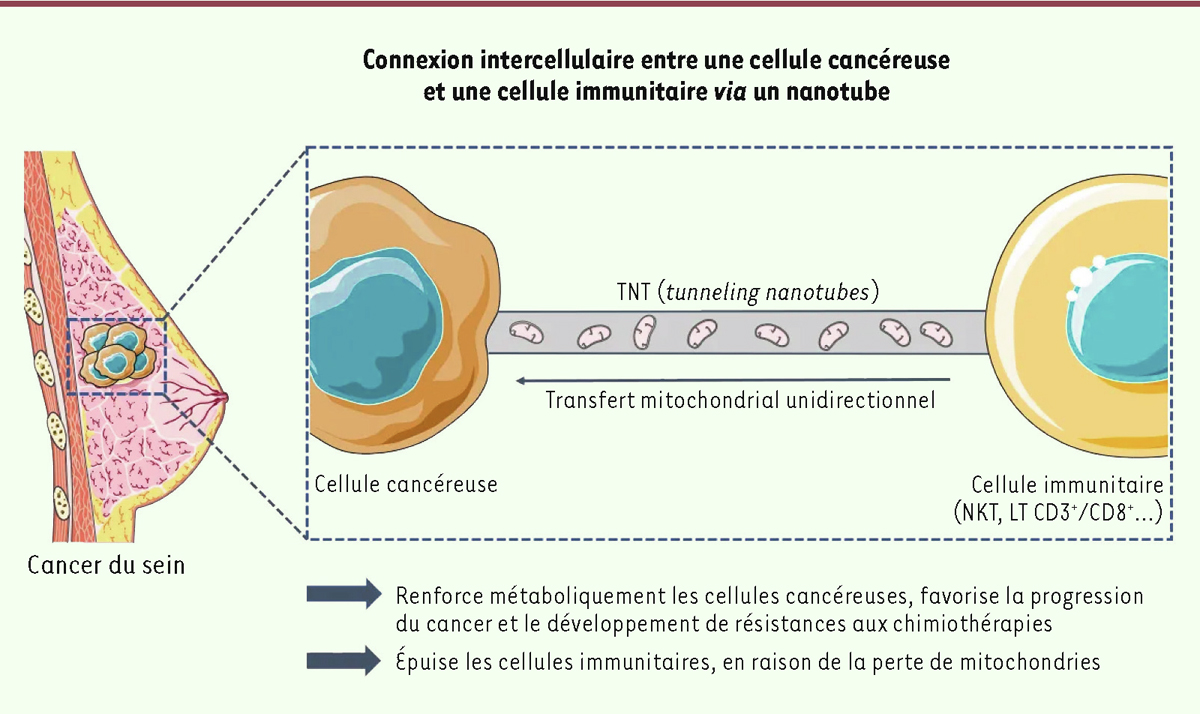
. En utilisant la microscopie électronique à balayage, ils ont observé des cellules cancéreuses et des cellules immunitaires physiquement connectées par des structures tubulaires mesurant entre 50 nm et 2 µm de large et entre 3 et 100 µm de long. Dans certains cas, un seul nanotube provenant d’une cellule cancéreuse se connectait à plusieurs cellules immunitaires en série et formait des contacts multiples avec la membrane de la cellule immunitaire (
Figure 1
).
 | Figure 1.
Proposition d’un modèle de transfert mitochondrial
, illustrant le passage des mitochondries d’une cellule immunitaire effectrice vers une cellule tumorale dérivée d’un cancer du sein via un nanotube (
figure réalisée avec Servier Médical Art).
|
Puisque les nanotubes permettent le trafic intercellulaire des organites, les auteurs ont utilisé, dans les cellules immunitaires, un marqueur fluorescent qui se lie spécifiquement aux protéines mitochondriales afin de visualiser le transfert de mitochondries passant par les nanotubes entre ces cellules et les cellules cancéreuses. Après 16 heures de co-culture, les cellules cancéreuses sont devenues ponctuellement fluorescentes, suggérant le transfert de mitochondries à partir des cellules immunitaires. Des mitochondries ont été, de plus, observées dans les nanotubes, confirmant leur passage par cette voie. Par la suite, les auteurs ont marqué différemment les mitochondries des deux types cellulaires, ce qui a permis de mettre en évidence un trafic unidirectionnel des cellules immunitaires vers les cellules cancéreuses. En effet, après co-culture, 41% des cellules cancéreuses avaient capturé des mitochondries provenant de cellules NK et seulement 0,99% des cellules NK détenaient des mitochondries d’origine tumorale. Le trafic mitochondrial modifie l’état métabolique
Les chercheurs ont souhaité étudier l’impact du transfert mitochondrial sur les cellules cancéreuses et les cellules immunitaires par profilage métabolique. Les cellules cancéreuses ont été cultivées seules ou co-cultivées avec des cellules immunitaires dans le même milieu mais sans contact physique (en chambre de Boyden). Les cellules cancéreuses en co-culture avec les cellules immunitaires présentaient une respiration basale ainsi qu’une capacité respiratoire plus élevées que les cellules cancéreuses mises en culture seules. En revanche, une réduction significative de la respiration basale et de la capacité respiratoire a été observée dans les cellules immunitaires co-cultivées avec les cellules cancéreuses. Pour vérifier que l’augmentation métabolique observée dans les cellules cancéreuses était bien due au gain de mitochondries, ces dernières ont été partiellement endommagées dans les cellules immunitaires avant la co-culture avec les cellules cancéreuses par l’ajout d’antimycine A et de roténone, des inhibiteurs de la chaine respiratoire mitochondriale
1
[
7
8
]. Comme attendu, dans ces conditions, aucun gain de fonctions métaboliques n’était observé dans les cellules cancéreuses, validant le fait que celui–ci était bien dû au détournement des mitochondries des cellules immunitaires.
L’exocyste est impliqué dans le transfert des mitochondries
Des études antérieures ont démontré l’implication de l’exocyste (ou complexe Sec6/8) dans la formation des nanotubes [
9
]. Ce complexe protéique hétéro-octamérique est composé des produits des gènes
SEC
(Sec3, Sec5, Sec6, Sec8, Sec10, Sec15), et des protéines Exo70 et Exo84 [
10
], et interagit avec la famille des Ras/Rho GTPases afin de remodeler l’actine lors de la formation des nanotubes. Des expériences d’immunofluorescence dans les cellules cancéreuses ont révélé une localisation des protéines Sec au site de recrutement du cytosquelette d’actine dans le nanotube. Remarquablement, une invalidation des gènes codant les protéines Sec3 et Sec5 réduit le trafic des mitochondries entre cellules immunitaires et cellules cancéreuses.
Les marquages fluorescents ont également révélé une co-localisation des mitochondries avec une Rho GTPase mitochondriale, appelée Miro1, dans les nanotubes et l’invalidation du gène codant cette protéine réduit significativement le transfert mitochondrial vers les cellules cancéreuses. Ces résultats sont en accord avec un transport mitochondrial actif
via
Miro1 des cellules immunitaires vers les cellules cancéreuses
via
des nanotubes. L’inhibition
in vivo
de la machinerie d’assemblage de ces nanotubes diminue considérablement le transfert unidirectionnel mitochondrial des cellules immunitaires vers les cellules cancéreuses, et contrecarre le phénotype « d’épuisement » des cellules de l’immunité induit par ce transfert.
L’ensemble de ces observations démontrent que les nanotubes sont formés via des réarrangements de cytosquelette activés par le complexe Ras GTPase-exocyste, et que Miro1 est impliqué dans le transport actif des mitochondries vers les cellules cancéreuses
via
des nanotubes.
|
Inhibition du transfert mitochondrial : une nouvelle voie thérapeutique
À ce jour, beaucoup d’immunothérapies anti-cancéreuses se fondent sur le blocage de points de contrôle de l’immunité comme, par exemple, les anticorps anti-PD-1. Cependant, bien que ces traitements puissent induire des réponses cliniques significatives et durables, un nombre important de patients ne répondent pas à ce type d’immunothérapies. Il a été montré dans un modèle de souris porteuses de tumeurs que l’efficacité anti-tumorale et la survie sont supérieures chez les animaux recevant un traitement combinant le L-778123, molécule inhibant la farnésyltransférase, et la géranyltransférase de type 1 [
6
] (deux protéines jouant un rôle crucial dans la modification post-traductionnelle de la GTPase Ras/Rho [
11
]), avec un inhibiteur de PD-1 par rapport à celles ayant reçu les mêmes traitements en monothérapie [
6
]. La combinaison des deux traitements augmente également le nombre total de lymphocytes T CD8
+
dans la tumeur. Les traitements sont bien tolérés et aucun changement de poids corporel n’a été observé. Ces deux types de traitement, un inhibiteur de point de contrôle immunitaire et un agent pharmacologique perturbant le détournement mitochondrial par l’intermédiaire des nanotubes, pourraient donc avoir des effets anti-tumoraux synergiques.
|
Conclusion et perspectives
Les travaux de Saha
et al
. ont mis en évidence un « braquage » des cellules immunitaires par les cellules tumorales, leur permettant de proliférer et de développer des résistances. Cette stratégie consiste à utiliser des nanotubes membranaires pour subtiliser des mitochondries. La perte de la fonction mitochondriale impacte la production de cytokines, l’expansion des cellules NK et des lymphocytes T CD8
+
spécifiques d’antigènes tumoraux, et la réponse mémoire, tandis que l’augmentation de la phosphorylation oxydante (des mitochondries) dans les cellules tumorales permet la progression du cancer et le développement de résistances aux chimiothérapies.
Aujourd’hui, certains agents d’immunothérapie voient leur efficacité limitée lorsque les cellules immunitaires présentent un métabolisme dérégulé. Ainsi, l’inhibition du détournement mitochondrial médié par les nanotubes pourrait conduire à une efficacité anti-cancéreuse significative et devenir une immunothérapie de nouvelle génération, en ciblant, par exemple, le complexe exocyste et la GTPase Miro1 ou les transférases. Toutefois, certaines questions restent encore en suspens, en particulier les mécanismes conduisant à la formation de ces nanotubes spécifiquement vers des cellules NK et des lymphocytes T, ou au déplacement unidirectionnel des mitochondries des cellules immunitaires vers les cellules cancéreuses. Des études plus approfondies sur les nanotubes et les mécanismes sous-jacents du processus d’évasion des cellules cancéreuses sont nécessaires pour développer une nouvelle génération d’immunothérapies. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Rustom
A
,
Saffrich
R
,
Markovic
I
,
et al.
Nanotubular highways for intercellular organelle transport.
.
Science.
2004;
;
303
:
:1007.
–
1010
.
2.
Connor
Y
,
Tekleab
S
,
Nandakumar
S
,
et al.
Physical nanoscale conduit-mediated communication between tumour cells and the endothelium modulates endothelial phenotype.
.
Nat Commun.
2015;
;
6
:
:8671.
.
3.
Sowinski
S
,
Jolly
C
,
Berninghausen
O
,
et al.
Membrane nanotubes physically connect T cells over long distances presenting a novel route for HIV-1 transmission.
.
Nat Cell Biol.
2008;
;
10
:
:211.
–
219
.
4.
Gousset
K
,
Schiff
E
,
Langevin
C
,
et al.
Prions hijack tunnelling nanotubes for intercellular spread.
.
Nat Cell Biol.
2009;
;
11
:
:328.
–
326
.
5.
Osswald
M
,
Jung
E
,
Sahm
F
,
et al.
Brain tumour cells interconnect to a functional and resistant network.
.
Nature.
2015;
;
528
:
:93.
–
98
.
6.
Saha
T
,
Dash
C
,
Jayabalan
R
,
et al.
Intercellular nanotubes mediate mitochondrial trafficking between cancer and immune cells.
.
Nat Nanotechnol.
2022;
;
17
:
:98.
–
106
.
7.
Huang
L-S
,
Cobessi
D
,
Tung
EY
,
et al.
Binding of the respiratory chain inhibitor antimycin to the mitochondrial bc1 complex: a new crystal structure reveals an altered intramolecular hydrogen-bonding pattern.
.
J Mol Biol.
2005;
;
351
:
:573.
–
597
.
8.
Huang
C-W
,
Lin
K-M
,
Hung
T-Y
,
et al.
Multiple Actions of Rotenone, an Inhibitor of Mitochondrial Respiratory Chain, on Ionic Currents and Miniature End-Plate Potential in Mouse Hippocampal (mHippoE-14) Neurons.
.
Cell Physiol Biochem Int J Exp Cell Physiol Biochem Pharmacol.
2018;
;
47
:
:330.
–
343
.
9.
Hase
K
,
Kimura
S
,
Takatsu
H
,
et al.
M-Sec promotes membrane nanotube formation by interacting with Ral and the exocyst complex.
.
Nat Cell Biol.
2009;
;
11
:
:1427.
–
1432
.
10.
Langevin
J
,
Morgan
MJ
,
Sibarita
J-B
,
et al.
Drosophila exocyst components Sec5, Sec6, and Sec15 regulate DE-Cadherin trafficking from recycling endosomes to the plasma membrane.
.
Dev Cell.
2005;
;
9
:
:365.
–
376
.
11.
Arkwright
PD
,
Luchetti
F
,
Tour
J
,
et al.
Fas stimulation of T lymphocytes promotes rapid intercellular exchange of death signals via membrane nanotubes.
.
Cell Res.
2010;
;
20
:
:72.
–
88
.
|