| |
| Med Sci (Paris). 38(11): 888–895. doi: 10.1051/medsci/2022149.Les organoïdes dérivés de tumeurs (ou tumoroïdes), des outils de choix pour la médecine de précision en oncologie Marion Perréard,1,2* Romane Florent,1,2,3* Lucie Thorel,1,2* Audrey Vincent,4 Louis-Bastien Weiswald,1,2,3**b and Laurent Poulain1,2,3**a 1Normandie université, UNICAEN, Inserm U.1086 ANTICIPE, Unité de recherche interdisciplinaire pour la prévention et le traitement des cancers
,
Caen
,
France
.
2UNICANCER, Centre de lutte contre le cancer F. Baclesse
,
Caen
,
France
.
3Normandie université, UNICAEN, Structure fédérative Normandie oncologie, Unité de services PLATON, Plateforme ORGAPRED
,
Caen
,
France
.
4Université de Lille, CHU Lille, CNRS, Inserm, UMR9020-U1277 – CANTHER (Cancer Heterogeneity Plasticity and Resistance to Therapies)
,
Lille
,
France
.
|
Vignette : Test RECAP sur tumoroïdes ovariens (© Romane Florent, plateforme ORGAPRED - Caen).
La cancérologie de demain s’oriente vers une médecine de précision qui nécessite, outre la disponibilité de traitements alternatifs efficaces, l’identification de biomarqueurs permettant la sélection des patients susceptibles de bénéficier de ces nouvelles stratégies thérapeutiques. Actuellement, l’évaluation de l’expression de cibles clés ou la présence d’anomalies génétiques associées à la réponse à différents traitements permettent d’orienter la prise en charge thérapeutique de certains patients [
1
-
3
]. Ces informations présentent un intérêt en termes diagnostiques, pronostiques et prédictifs, mais ont également de nombreuses limites, telles que le manque de sélectivité de certaines signatures moléculaires [
4
] ou les difficultés d’interprétation (signatures mutationnelles complexes, variants de signification inconnue, etc.) (voir [
5
] pour revue). Ce constat souligne l’intérêt du développement de tests fonctionnels susceptibles de fournir des informations additionnelles de haute valeur pour la prédiction de la réponse aux traitements conventionnels comme innovants.
La mise en place progressive de tests fonctionnels en oncologie repose sur l’hypothèse que l’exposition aux traitements de cellules primaires issues de la tumeur du patient à traiter, isolées ou non des cellules stromales dans des systèmes de culture
ex vivo
à court terme, pourrait permettre la prédiction de la réponse du patient aux traitements considérés. Ces tests pourraient également permettre de révéler une corrélation entre la réponse au traitement observée
ex vivo
et l’existence de biomarqueurs de différentes natures (ADN, ARNm, ARN non codants, protéines, etc.) et de différentes origines (tumoraux, sanguins, urinaires, etc.), prédictifs de cette réponse. Ils permettent ainsi de préciser le phénotype de la tumeur par des approches fonctionnelles qui appréhendent de façon intégrée les différents paramètres de la réponse aux traitements, et peuvent conduire à l’identification de signatures moléculaires prédictives, elles-mêmes susceptibles d’accompagner le développement des nouvelles thérapies.
De nouveaux modèles pertinents de cancers ont été développés au cours du temps afin d’améliorer nos connaissances sur la pathogénie, de pouvoir identifier de nouvelles cibles thérapeutiques, de tester de nouvelles molécules, voire de prédire la réponse d’une tumeur à différents traitements [
6
]. À mi-chemin entre les modèles
in vitro
et les modèles
in vivo
, les modèles
ex vivo
ont l’avantage d’être très proches de la tumeur d’origine tout en étant aisément manipulables. Parmi les modèles décrits citons les lignées cellulaires primaires [
7
], les tumorosphères et les sphéroïdes de tissus [
8
], ou encore les tranches de tissus [
9
-
11
].
L’émergence des cultures d’organoïdes dérivés de tumeurs, également appelés tumoroïdes, a récemment élargi le répertoire des modèles précliniques disponibles [
12
]. Ces tumoroïdes sont obtenus après inclusion de cellules issues de la tumeur dans une matrice extracellulaire et mise en culture en présence de facteurs de croissance essentiels aux cellules souches (Wnt3a, R-spondine-1, EGF [
epidermal growth factor
] et noggine
1
). Ces conditions de culture ont été à l’origine optimisées pour générer des organoïdes « normaux ». Elles permettent ainsi aux cellules souches adultes de reproduire
in vitro
la micro-anatomie de leur organe d’origine grâce à leurs propriétés d’auto-renouvellement et de différenciation. Ces principes ont été adaptés à de nombreux organes humains normaux ou pathologiques, y compris aux tumeurs. Les tumoroïdes peuvent être relativement rapidement obtenus et amplifiés après la résection de la tumeur, avec un taux d’établissement allant de moins de 20 à plus de 90 % selon le type de tumeur considéré, et sont proches de la tumeur dont ils dérivent en termes morphologiques et génétiques [
13
]. Les tumoroïdes peuvent être exposés à tout type de traitement (chimiothérapie, radiothérapie, thérapies ciblées), et leur réponse aux traitements peut être évaluée par des méthodes classiques (tests de viabilité de diverses natures, imagerie en temps réel, histologie/immunohistochimie, etc.) permettant de classer les organoïdes dérivés de tumeurs en sensibles, résistants ou intermédiaires. Cette classification peut être utilisée à visée prédictive et orienter ainsi la décision thérapeutique pour le patient dont ils sont issus, ou encore permettre
a posteriori
(une fois qu’une collection suffisamment importante de tumoroïdes est obtenue) la recherche de signatures moléculaires (génomiques, transcriptomiques, protéomiques, etc.) prédictives de la réponse aux traitements.
|
Prédiction de la réponse au traitement et orientation de la décision thérapeutique
Un nombre croissant d’études indique que les organoïdes tumoraux pourraient prédire la réponse aux traitements anticancéreux de la tumeur dont ils dérivent [
14
]. Les études se multiplient afin d’évaluer l’existence d’une corrélation entre la réponse aux traitements des tumoroïdes obtenus et la réponse clinique des patients, une première étape cruciale et indispensable à une éventuelle utilisation des tumoroïdes en clinique dans le futur. Une revue regroupant 17 de ces études a ainsi mis en évidence une sensibilité de 81 % et une spécificité de 74 % pour prédire la réponse des patients aux traitements à l’aide de tests fonctionnels réalisés sur des tumoroïdes [
15
]. Ces chiffres sont difficiles à comparer avec d’autres tests actuellement utilisés en médecine personnalisée, en particulier les recherches de mutations génétiques ou d’expression de marqueurs tumoraux dont les résultats sont utilisés pour administrer certains traitements. En effet, ces derniers nécessitent un test diagnostic, évalué par une sensibilité et une spécificité qui doivent s’approcher le plus possible de 100 %, permettant de conclure à un statut « muté » ou « surexprimé » du gène ou du marqueur chez le patient. Une fois ce statut déterminé, le traitement est administré au patient, mais tous les patients sélectionnés ne bénéficieront pas pour autant de l’efficacité du traitement contre leur tumeur. C’est précisément pour remédier à cette lacune que des tests fonctionnels réalisés sur les organoïdes dérivés de tumeurs sont développés, afin de déterminer directement l’efficacité du traitement sur la tumeur du patient sans recourir à un marqueur intermédiaire (une approche qui intègre en elle-même tous les paramètres - ou une grande partie d’entre eux - de la réponse aux traitements).
Des résultats encourageants
Une étude princeps a ainsi montré l’intérêt de l’utilisation des tumoroïdes dérivés de tumeurs gastro-intestinales métastatiques pour prédire la réponse de 21 patients à différentes chimiothérapies (avec 100 % de sensibilité, 93 % de spécificité, 88 % de valeur prédictive positive et 100 % de valeur prédictive négative) [
16
]. Une autre étude réalisée à partir des tumoroïdes dérivés de 11 tumeurs chimionaïves, a également permis de prédire à 91 % pour la première ligne de traitement et 80 % pour la deuxième ligne, la réponse à la chimiothérapie de patients présentant un cancer du pancréas ; cependant, les tumoroïdes issus de cinq autres tumeurs qui avaient été prétraitées n’ont prédit la réponse au traitement que dans 40 % des cas [
17
].
La corrélation entre la réponse à la radiothérapie des patients et celle des tumoroïdes a été analysée dans les cancers colorectaux chez 19 patients, aboutissant à l’établissement d’un modèle de prédiction d’une précision de 82 % pour les patients sensibles et de 92 % pour les patients résistants [
18
]. Il a aussi été montré, dans un groupe de sept patients, que les lignées d’organoïdes dérivées de carcinomes épidermoïdes de la tête et du cou les moins sensibles à la radiothérapie, correspondaient aux patients ayant rechuté après traitement [
19
]. Enfin, une étude a montré une précision de 84 % (78 % de sensibilité, 92 % de spécificité) pour prédire la réponse à l’aide de tumoroïdes colorectaux à une combinaison de chimiothérapie et de radiothérapie [
20
], un résultat particulièrement intéressant du fait de l’utilisation fréquente de traitements multimodaux en pratique clinique.
Concernant la réponse à l’immunothérapie, certaines équipes utilisant des modèles de tumoroïdes de mélanome [
21
] ou de cancers appendiculaires [
22
] enrichis en cellules immunitaires, ont montré des niveaux de corrélation avec la réponse clinique prometteurs, respectivement de 85 % (sept patients) et de 100 % (deux patients).
La possibilité de prédire la réponse de cancers de l’ovaire aux inhibiteurs des protéines PARP (poly(ADP-ribose) polymérase), impliquées dans la réparation des cassures simple brin de l’ADN, a par ailleurs été évaluée. L’utilisation de ces molécules est pertinente dans un contexte de tumeurs présentant une déficience des mécanismes de réparation par recombinaison homologue (RH) de l’ADN, l’inhibition de la réparation des cassures simples brin générant une accumulation de cassures double brin, elles-mêmes non réparées dans ce contexte. Un test fonctionnel, le test RECAP (
repair capacity test
), permet une appréciation globale de l’état du mécanisme de recombinaison homologue. Ce test quantifie, avant et après l’induction de dommages de l’ADN par irradiation, l’organisation des foyers de réparation par recombinaison homologue,
via
l’observation de la localisation de la recombinase RAD51 (une protéine clé de la RH) dans les cellules proliférantes. En appliquant ce test à des organoïdes issus de tumeurs ovariennes, il a été possible d’identifier les patientes susceptibles de bénéficier d’un traitement par les inhibiteurs de PARP [
23
,
24
].
Des essais en clinique
De nombreux essais cliniques sont en cours afin de déterminer si les tumoroïdes peuvent prédire la réponse aux traitements des patients [
3
] : aux Pays-Bas, à partir de cancers mammaires, pulmonaires et colorectaux (SENSOR, NL50400.031.14 ; TUMOROID, NL49002.031.14) ; en France, par notre équipe, dans les cancers de l’ovaire (protocole OVAREX, NCT03831230), les cancers des voies aérodigestives supérieures (protocole ORGAVADS, NCT04261192), les cancers du sein triple-négatifs (protocole TRIPLEX, NCT05404321) et les cancers de la jonction œsogastrique (protocole GASPAR, NCT04736485).
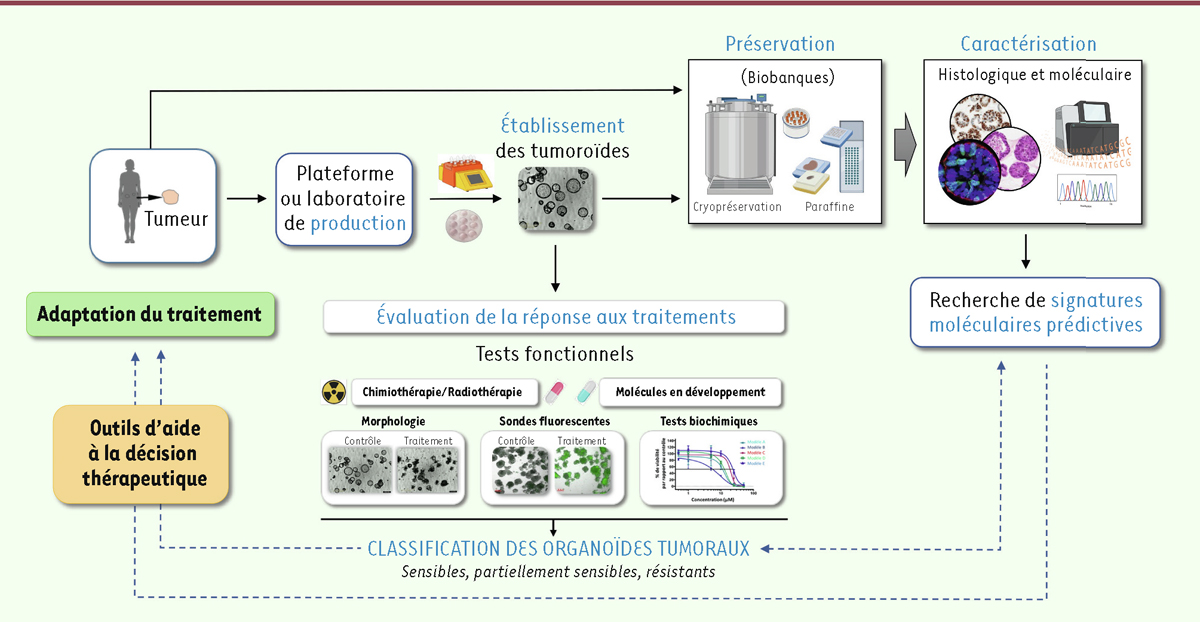
Certaines équipes proposent déjà d’utiliser la réponse des organoïdes tumoraux pour guider la décision thérapeutique (
Figure 1
). Ainsi, Mauri
et al.
ont utilisé des organoïdes tumoraux issus d’un patient présentant un cancer colorectal récidivant pour déterminer quelle molécule devait être administrée après métastasectomie
2
. La molécule à laquelle les organoïdes tumoraux étaient les plus sensibles a ensuite été administrée au patient. Traité, celui-ci était toujours en rémission plus de six mois après la métastasectomie [
25
]. D’autres études cliniques proposent d’intégrer la réponse des organoïdes dérivés de tumeurs comme outil de décision thérapeutique pour les patients présentant des cancers en phase métastatique, non répondeurs aux traitements de premières lignes dans des cancers du sein ou gastrointestinaux (NCT04279509 ; NCT04450706 ; NCT04611035), voire au traitement adjuvant pour le cancer du pancréas (NCT04931394). L’utilisation d’organoïdes tumoraux a même été proposée pour décider de la molécule à instiller directement dans des tumeurs vésicales (cancers de la vessie) lors de la prise en charge initiale (NCT05024734).
 | Figure 1.
Les différentes étapes liées à l’utilisation des tumoroïdes dans un contexte clinique de prédiction de la réponse aux traitements, en vue de l’orientation de la décision thérapeutique.
|
Si la recherche permet d’espérer une introduction rapide de l’utilisation des tumoroïdes dans le cadre de la prise en charge clinique, leur utilisation à des fins prédictives présente encore certaines limites. Le caractère prédictif des tumoroïdes pourrait en effet dépendre des agents anticancéreux utilisés, ou des doses et des ratios des combinaisons de chimiothérapies qui leur sont appliqués. En effet, une absence de corrélation a été observée entre la réponse clinique de patients présentant un cancer colorectal métastatique traités avec la combinaison 5-FU/oxaliplatine et la réponse de tumoroïdes dérivés de biopsies. En revanche, un taux de prédiction de réponse supérieur à 80 % a été observé chez les patients traités avec l’irinotecan et la combinaison irinotecan/5-FU [
26
]. Une étude clinique a proposé aux patients porteurs d’un cancer colorectal métastatique, en progression malgré les premières lignes de traitements, d’adapter la ligne thérapeutique suivante sur la base de la réponse des tumoroïdes dérivés de leur tumeur [
27
]. Aucune amélioration de la réponse clinique n’a pu être constatée mais le nombre de données exploitables était limité dans cette étude du fait du faible taux de réussite pour l’établissement des tumoroïdes (57 %), ou de l’état général des patients, trop altéré pour permettre de poursuivre un traitement global.
|
Identifier des biomarqueurs et des signatures moléculaires prédictives
Dans le cadre de la mise en place d’une oncologie de précision, les collections d’organoïdes tumoraux peuvent être utilisées pour définir des signatures moléculaires (génomiques, transcriptomiques, protéiques, etc.) prédictives de la réponse aux traitements (
Figure 1
).
Dans le cadre des traitements conventionnels, ce type d’approches est réalisé directement sur la tumeur du patient. Pour les molécules en développement, ces analyses pourront être réalisées sur des tumoroïdes grâce auxquels il sera possible de définir un niveau de sensibilité à ces molécules, et de rechercher des signatures différentielles sur des groupes de tumoroïdes, sensibles ou résistants. Cette approche
ex vivo
pourrait permettre le développement très précoce de tests compagnons susceptibles d’accompagner et d’accélérer le développement de nouveaux médicaments. Diverses études ont pu établir un lien entre la réponse aux traitements conventionnels des patients et des signatures prédictives observées avec des tumoroïdes, ouvrant des perspectives pour le développement de thérapies innovantes.
Les banques de tumoroïdes pour définir des biomarqueurs prédictifs
Dans les cancers du pancréas, des biomarqueurs liés à la récidive ont ainsi pu être identifiés à l’aide d’une banque de tumoroïdes dont le profil métabolique a été examiné. Plusieurs oncométabolites, issus du cycle de Krebs, ont en effet été retrouvés plus abondamment dans les tumoroïdes issus de patients ayant récidivé de façon précoce. Cette caractéristique pourrait non seulement permettre d’identifier les tumeurs les plus agressives, mais également constituer une vulnérabilité de la tumeur qui pourrait alors faire l’objet d’un ciblage thérapeutique spécifique [
28
]. Des biomarqueurs, qui prédisent la réponse aux chimiothérapies de tumoroïdes dérivés de cancers colorectaux et de cancers de la vessie d’une banque de tumoroïdes, ont été par ailleurs identifiés par des analyses utilisant l’intelligence artificielle et l’apprentissage automatique («
machine-learning
»), à partir de données de pharmacogénomique [
29
].
L’étude approfondie des caractéristiques moléculaires de collections étendues d’organoïdes dérivés de différentes tumeurs pourrait permettre l’identification de biomarqueurs prédictifs (ou de signatures prédictives incluant plusieurs de ces biomarqueurs, y compris de natures différentes) (
Figure 1
). L’intérêt de cette démarche, qui pourra inclure des approches d’intelligence artificielle, devra bien entendu être confirmé par des études de corrélation avec la réponse clinique de molécules en développement, mais les perspectives dans le domaine du développement de nouveaux médicaments candidats sont immenses, et de telles approches pourraient permettre à la fois une accélération de leur validation et une bien meilleure définition des sous-populations de patients susceptibles de bénéficier de ces nouvelles thérapies.
|
Défis et enjeux futurs pour l’utilisation des tumoroïdes dans une démarche de médecine de précision
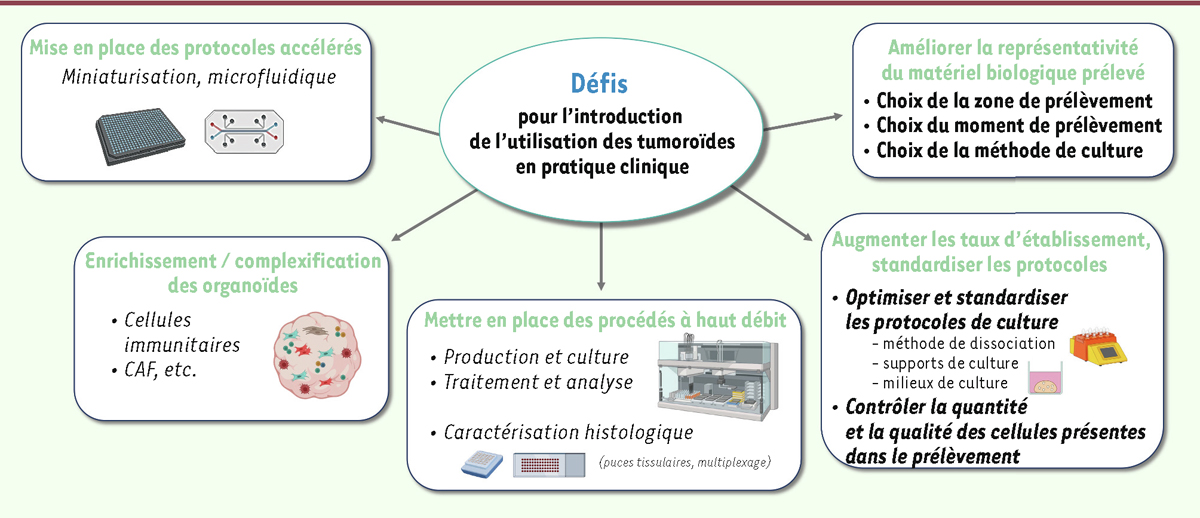
Si l’utilisation des tumoroïdes en pratique clinique courante devient envisageable, certains défis nécessitent d’être relevés (
Figure 2
). Outre la complexité des protocoles expérimentaux à mettre en œuvre (difficilement envisageables dans un laboratoire de biologie conventionnel) et la relative lourdeur des circuits de prélèvements et des aspects règlementaires associés à cette démarche, d’importantes limites nécessitent d’être résolues pour que les résultats obtenus avec les tumoroïdes soient fiables et puissent être transmis aux cliniciens dans un délai compatible avec une prise en charge clinique.
 | Figure 2.
L’introduction de l’utilisation des tumoroïdes en routine clinique nécessite encore la résolution de diverses difficultés.
Ces défis font l’objet de nombreux développements de la part de la communauté scientifique et médicale, dans un contexte multidisciplinaire. CAF :
Cancer-Associated Fibroblast
.
|
Parmi les problèmes à résoudre, citons notamment la représentativité du prélèvement utilisé vis-à-vis de la tumeur initiale, la quantité de matériel nécessaire, le succès et le délai d’établissement des tumoroïdes, le temps nécessaire à l’évaluation de leur réponse aux traitements, la nécessité de complexifier ces tumoroïdes, ou de les enrichir en cellules stromales (fibroblastes, cellules immunitaires, etc.), afin de mieux prédire la réponse à certaines molécules, ou encore la mise en place de procédés de culture à haut débit susceptibles de permettre la prise en charge d’un grand nombre d’échantillons tumoraux. Toutes ces questions font l’objet d’actives recherches, l’enjeu étant majeur pour un transfert réussi vers la clinique. Représentativité du prélèvement utilisé pour la production des tumoroïdes
L’un des enjeux de la médecine personnalisée en oncologie est de s’assurer que le matériel tumoral utilisé pour les tests correspond bien à la tumeur qui va recevoir le traitement, et cela tout au long de la prise en charge. Ainsi, les tumoroïdes hépatiques dérivés de différentes régions des tumeurs d’origine présentent une réponse similaire à différentes thérapies [
30
]. En revanche, les tumoroïdes ovariens dérivés de différents nodules intra-péritonéaux affichent des réponses aux traitements qui peuvent différer [
31
]. Il semble donc nécessaire de multiplier les zones de prélèvements de matériel tumoral lorsque les tumeurs sont disséminées, comme dans le cas des cancers ovariens, afin de s’assurer de la représentativité des lignées obtenues. Cette nécessité alourdira cependant de façon importante la procédure de prélèvement mais également la procédure de culture des tumoroïdes. L’importance de ces observations devra donc être évaluée sur des cohortes de patients de grande envergure.
La sensibilité d’organoïdes dérivés de prélèvements de tumeurs de l’ovaire [
31
] ou du pancréas [
32
] à différents moments de la prise en charge est susceptible d’évoluer. En effet, la maladie cancéreuse peut évoluer au cours du temps, et être influencée par les traitements auxquels elle a été exposée. Il pourrait donc s’avérer nécessaire de répéter les prélèvements de tissu tumoral au cours de l’évolution de la maladie, après un traitement, ainsi qu’en cas de rechute ou d’apparition de métastases. Notons toutefois que, paradoxalement, des organoïdes tumoraux pancréatiques dérivés de biopsies de tumeurs en récidive ou en progression, issues de patients déjà traités, ont prédit la réponse thérapeutique de la tumeur à seulement 40 % alors que les tumoroïdes issus de prélèvement de patients chimionaïfs ont prédit avec efficacité, non seulement la réponse à la première ligne de traitement (91 %) mais également à la deuxième ligne (80 %) [
17
].
Un taux d’établissement variable
Ooft
et al.
ont montré qu’un faible taux d’établissement des organoïdes pouvait être un frein majeur à leur utilisation en clinique [
27
]. Or, le taux d’établissement des tumoroïdes varie en fonction du type ou même du sous-type tumoral considéré. Certaines équipes ont ainsi réussi à obtenir d’excellents taux d’établissement, approchant les 80 à 90 %, pour des organoïdes dérivés de cancers colorectaux ou pancréatiques [
13
]. Pour d’autres tumoroïdes, comme les organoïdes tumoraux de prostate, les taux d’établissement restent faibles, avoisinant les 20 %. La proportion de cellules tumorales présentes dans le prélèvement initial peut influencer le succès d’établissement [
33
], pouvant expliquer la plus grande difficulté à obtenir un taux d’établissement satisfaisant avec des biopsies de petite taille ou des prélèvements provenant de récidives. La contamination par des organoïdes normaux, issus des tissus avoisinant la tumeur et contaminant le prélèvement, constitue dans certains cas un problème important [
34
]. Enfin, pour certains types de tumeurs tels que certains sarcomes, il semble beaucoup plus difficile d’établir des lignées de tumoroïdes [
35
].
L’amélioration du taux d’établissement des tumoroïdes repose sur l’optimisation des conditions de préparation et de culture (méthodes de dissociation, supports de culture, milieux enrichis ou adaptés pour la sélection des cellules tumorales, etc.). Cette amélioration permettrait de faire bénéficier un maximum de patients de cet outil de prédiction, prérequis indispensable avant toute mise en œuvre de tests fonctionnels en pratique clinique.
La mise en place de méthodes d’établissement de tumoroïdes contrôlées et standardisées est donc la première étape indispensable à l’optimisation [
36
]. Une plateforme s’appuyant sur plus de 1 000 organoïdes tumoraux de différents types histologiques a été établie afin d’optimiser les conditions de culture et d’analyse de la réponse aux traitements [
37
]. Ces organoïdes tumoraux peuvent être établis dans des milieux simples mais également enrichis (à l’exception des tumeurs pancréatiques). Cependant, des variations, parfois subtiles, de composition du milieu peuvent présenter un impact important sur le taux d’établissement de sous-types tumoraux. Il sera donc probablement nécessaire de définir, pour chaque type ou sous-type tumoral, le milieu le plus adéquat, c’est-à-dire permettant l’obtention du meilleur taux d’établissement dans un délai aussi court que possible.
Optimiser le délai de réponse aux oncologues Au-delà du taux d’établissement des tumoroïdes pour un patient, le délai d’obtention de leur réponse aux traitements exploitable par le clinicien nécessite également d’être optimisé. Une réponse rapide permettrait en effet une utilisation des organoïdes tumoraux à grande échelle (nécessaire à la fois dans le cadre de la pratique clinique comme pour le développement préclinique de nouvelles molécules par exemple), mais, surtout, serait compatible avec le délai de prise en charge clinique des patients. Dans certains cas, les quelques semaines nécessaires à l’obtention des tumoroïdes et à la réalisation des tests fonctionnels ne sont pas des obstacles. Cependant, notamment dans le cadre de la prise en charge de la récidive, une réponse rapide aux oncologues est requise pour adapter le traitement.
Les méthodes de traitement des tumoroïdes et d’analyse de leur réponse sont des points cruciaux sur lesquels il est possible d’agir pour réduire les délais de réponse. De nombreuses équipes travaillent notamment sur les procédés de miniaturisation et de micro‑fluidique, qui permettraient de tester un plus grand nombre de molécules sur un plus petit nombre de tumoroïdes, voire même de travailler sur des modèles enrichis ou des modèles de co-culture particulièrement intéressants pour l’évaluation de la réponse aux immunothérapies, par exemple. Un système de micro-puits permettant l’analyse d’une centaine d’organoïdes tumoraux (quantité qui peut être obtenue dès le premier passage), a récemment permis d’évaluer la réponse aux traitements d’organoïdes tumoraux pulmonaires en une semaine [
38
]. L’utilisation de méthodes d’analyse de la réponse au traitement par imagerie qui accélère le traitement des informations, a également été proposée [
39
]. Associée à l’utilisation de l’intelligence artificielle, de telles méthodes sont susceptibles de permettre une évaluation rapide et moins coûteuse de la réponse aux traitements, réduisant encore le délai de réponse.
Vers une nécessaire automatisation pour une culture à haut débit
La volonté d’évoluer vers un outil applicable en clinique pour prédire de façon individualisée la réponse d’un patient aux différents traitements nécessite la mise en place d’une procédure applicable à haut débit pour pouvoir prendre en charge un nombre suffisant de patients et tester un nombre important de molécules. Différentes possibilités d’automatisation ont été mises en œuvre par différentes plateformes : la plateforme EIPM à New-York
3,
ou celle que nous avons mise en place
4
. Si les différentes étapes (ensemencements, repiquage, changements de milieux, traitement et analyse de la réponse par tests biochimiques ou imagerie cellulaire en 3D) sont ainsi bien maitrisées et standardisées, il deviendra envisageable d’implémenter de tels tests fonctionnels en clinique et de procéder à l’établissement de « chimiogrammes », véritable graal pour les oncologues.
Enrichir et complexifier les modèles pour étendre le nombre de traitements évaluables Un certain nombre de limites, que nous avons évoquées, entrave l’utilisation des tumoroïdes pour prédire la réponse à des stratégies thérapeutiques fondées sur l’interaction des cellules cancéreuses avec les cellules de leur micro-environnement, tels que les fibroblastes associés au cancer (CAF), les cellules endothéliales ou encore les cellules immunitaires. Les stratégies anti-angiogéniques et les immunothérapies font partie des thérapies pour lesquelles il reste encore difficile d’utiliser les tumoroïdes à des fins prédictives.
Des développements sont actuellement en cours dans le but d’enrichir ou de complexifier les modèles de tumoroïdes existants, en les cultivant avec des cellules présentes dans le micro-environnement tumoral, soit directement sous forme de co-cultures, soit par l’utilisation de dispositifs plus ou moins complexes de micro-fluidique. Les tumoroïdes peuvent ainsi être cultivés en présence de lymphocytes T [
40
,
41
], notamment dans le but d’étudier l’efficacité d’immunothérapies utilisant des inhibiteurs de points de contrôle immunitaire comme les inhibiteurs de PD-1 (
programmed cell death 1
)/PD-L1
(programmed cell death-ligand 1
) ou de CTLA-4 (
cytotoxic T-lymphocyte-associated protein 4
) [
21
,
22
]. Ils peuvent également être cultivés avec des cellules endothéliales afin d’étudier leur capacité à induire une angiogenèse et ainsi analyser l’efficacité de molécules anti‑angiogéniques, telles que le bévacizumab ou le sorafenib [
42
].
Tous ces développements fondés sur l’utilisation de dispositifs de co-culture (ex :
organoid-on-chip
) pourraient ainsi permettre à terme l’évaluation de la réponse des tumoroïdes à un très large éventail de molécules utilisées dans différents traitements, y compris de ceux ciblant le micro-environnement tumoral.
|
Il est donc possible d’établir des tumoroïdes à partir de presque tout type de tumeur. Bien qu’il soit encore nécessaire d’optimiser les conditions de culture pour favoriser et accélérer l’établissement des tumoroïdes, ou de complexifier leur micro-environnement, de nombreuses applications sont désormais envisageables dans le domaine de la prédiction de la réponse aux traitements et de l’orientation de la décision thérapeutique. Les procédés de culture et d’analyse à haut débit, la standardisation des protocoles, la définition de la nature du prélèvement à utiliser pour obtenir une réponse fiable, sont autant de défis qui sont à relever. Par l’introduction de leur utilisation en routine clinique, l’oncologie de précision pourrait bien entrer dans une nouvelle ère au cours de la prochaine décennie. C’est tout l’enjeu des recherches menées à travers le monde et des essais cliniques en cours de réalisation pour valider l’intérêt de cette approche. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les projets ORGAPRED, POLARIS et ORGATHEREX sont cofinancés par l’Union européenne, la Région Normandie dans le cadre du programme opérationnel FEDER/ FSE 2014-2020 et par l’État français dans le cadre du Contrat de plan État-Région Bas-Normand 2015-2020. Nous remercions la Ligue contre le cancer (Comité du Calvados), la fondation ARC pour la recherche sur le cancer, le Groupement des entreprises françaises dans la lutte contre le cancer (GEFLUC), le Fonds de dotation Patrick de Brou de Laurière, la Fondation de l’avenir, la Rochambelle, l’association Vaincrabe, les Lions clubs de Normandie, l’association Solidarité don d’espoir pour leur soutien aux projets menés par nos équipes sur les organoïdes dérivés de tumeurs. Nous remercions nos tutelles, l’Inserm, l’Université de Caen Normandie et le Centre de lutte contre le cancer F. Baclesse, qui nous soutiennent dans la mise en place de ces activités. Nous remercions le Cancéropôle Nord-Ouest pour son soutien à la mise en place des plateformes ORGAPRED (sous la responsabilité de Laurent Poulain et Louis-Bastien Weiswald) et ORGARES (sous la responsabilité d’Audrey Vincent) dans le cadre du réseau inter-régional OrgaNO. Nous remercions le GIS IBISA qui accompagne nos plateformes, labélisées depuis janvier 2022, ainsi que le GDR CNRS « Organoïdes » auquel participent nos plateformes dans le cadre du réseau National des plateformes Organoïdes. Enfin, nous remercions tou(te)s les patient(e)s qui acceptent que leurs échantillons biologiques soient utilisés à des fins de recherche, permettant ainsi l’avancée de nos travaux vers une médecine de précision en oncologie.
|
Footnotes |
1.
Ancevski Hunter
K
,
Socinski
MA
,
Villaruz
LC
.
PD-L1 Testing in Guiding Patient Selection for PD-1/PD-L1 Inhibitor Therapy in Lung Cancer.
.
Mol Diagn Ther.
2018;
;
22
:
:1.
-
10
.
2.
Bailey
MH
,
Tokheim
C
,
Porta-Pardo
E
,
et al.
Comprehensive Characterization of Cancer Driver Genes and Mutations.
.
Cell.
2018;
;
174
:
:1034.
-
5
.
3.
Letai
A
,
Bhola
P
,
Welm
AL
.
Functional precision oncology: Testing tumors with drugs to identify vulnerabilities and novel combinations.
.
Cancer Cell.
2022;
;
40
:
:26.
-
35
.
4.
Mirza
MR
,
Monk
BJ
,
Herrstedt
J
,
et al.
Niraparib Maintenance Therapy in Platinum-Sensitive, Recurrent Ovarian Cancer.
.
N Engl J Med.
2016;
;
375
:
:2154.
-
64
.
5.
Federici
G
,
Soddu
S
.
Variants of uncertain significance in the era of high-throughput genome sequencing: a lesson from breast and ovary cancers.
.
J Exp Clin Cancer Res.
2020;
;
39
:
:46.
.
6.
Alkema
NG
,
Wisman
GB
,
van der Zee
AG
,
et al.
Studying platinum sensitivity and resistance in high-grade serous ovarian cancer: Different models for different questions.
.
Drug Resist Updat.
2016;
;
24
:
:55.
-
69
.
7.
Ugurel
S
,
Schadendorf
D
,
Pfohler
C
,
et al.
In vitro drug sensitivity predicts response and survival after individualized sensitivity-directed chemotherapy in metastatic melanoma: a multicenter phase II trial of the Dermatologic Cooperative Oncology Group.
.
Clin Cancer Res.
2006;
;
12
:
:5454.
-
63
.
8.
Weiswald
LB
,
Bellet
D
,
Dangles-Marie
V
.
Spherical cancer models in tumor biology.
.
Neoplasia.
2015;
;
17
:
:1.
-
15
.
9.
Lheureux
S
,
N’Diaye
M
,
Blanc-Fournier
C
,
et al.
Identification of predictive factors of response to the BH3-mimetic molecule ABT-737: an ex vivo experiment in human serous ovarian carcinoma.
.
Int J Cancer.
2015;
;
136
:
:E340.
-
50
.
10.
Majumder
B
,
Baraneedharan
U
,
Thiyagarajan
S
,
et al.
Predicting clinical response to anticancer drugs using an ex vivo platform that captures tumour heterogeneity.
.
Nat Commun.
2015;
;
6
:
:6169.
.
11.
Vaira
V
,
Fedele
G
,
Pyne
S
,
et al.
Preclinical model of organotypic culture for pharmacodynamic profiling of human tumors.
.
Proc Natl Acad Sci U S A.
2010;
;
107
:
:8352.
-
6
.
12.
Sachs
N
,
Clevers
H
.
Organoid cultures for the analysis of cancer phenotypes.
.
Curr Opin Genet Dev.
2014;
;
24
:
:68.
-
73
.
13.
Weeber
F
,
Ooft
SN
,
Dijkstra
KK
,
Voest
EE
.
Tumor Organoids as a Pre-clinical Cancer Model for Drug Discovery.
.
Cell Chem Biol.
2017;
;
24
:
:1092.
-
100
.
14.
Verduin
M
,
Hoeben
A
,
De Ruysscher
D
,
Vooijs
M
.
Patient-Derived Cancer Organoids as Predictors of Treatment Response.
.
Front Oncol.
2021;
;
11
:
:641980.
.
15.
Wensink
GE
,
Elias
SG
,
Mullenders
J
,
et al.
Patient-derived organoids as a predictive biomarker for treatment response in cancer patients.
.
NPJ Precis Oncol.
2021;
;
5
:
:30.
.
16.
Vlachogiannis
G
,
Hedayat
S
,
Vatsiou
A
,
et al.
Patient-derived organoids model treatment response of metastatic gastrointestinal cancers.
.
Science.
2018;
;
359
:
:920.
-
6
.
17.
Beutel
AK
,
Schutte
L
,
Scheible
J
,
et al.
A Prospective Feasibility Trial to Challenge Patient-Derived Pancreatic Cancer Organoids in Predicting Treatment Response.
.
Cancers (Basel).
2021;
;
13
.
18.
Park
M
,
Kwon
J
,
Kong
J
,
et al.
A Patient-Derived Organoid-Based Radiosensitivity Model for the Prediction of Radiation Responses in Patients with Rectal Cancer.
.
Cancers (Basel).
2021;
;
13
.
19.
Driehuis
E
,
Kolders
S
,
Spelier
S
,
et al.
Oral Mucosal Organoids as a Potential Platform for Personalized Cancer Therapy.
.
Cancer Discov.
2019;
;
9
:
:852.
-
71
.
20.
Yao
Y
,
Xu
X
,
Yang
L
,
et al.
Patient-Derived Organoids Predict Chemoradiation Responses of Locally Advanced Rectal Cancer.
.
Cell Stem Cell.
2020;
;
26
:
:17.
-
26 e6
.
21.
Votanopoulos
KI
,
Forsythe
S
,
Sivakumar
H
,
et al.
Model of Patient-Specific Immune-Enhanced Organoids for Immunotherapy Screening: Feasibility Study.
.
Ann Surg Oncol.
2020;
;
27
:
:1956.
-
67
.
22.
Forsythe
SD
,
Erali
RA
,
Sasikumar
S
,
et al.
Organoid Platform in Preclinical Investigation of Personalized Immunotherapy Efficacy in Appendiceal Cancer: Feasibility Study.
.
Clin Cancer Res.
2021;
;
27
:
:5141.
-
50
.
23.
Hill
SJ
,
Decker
B
,
Roberts
EA
,
et al.
Prediction of DNA Repair Inhibitor Response in Short-Term Patient-Derived Ovarian Cancer Organoids.
.
Cancer Discov.
2018;
;
8
:
:1404.
-
21
.
24.
Kopper
O
,
de Witte
CJ
,
Lohmussaar
K
,
et al.
An organoid platform for ovarian cancer captures intra- and interpatient heterogeneity.
.
Nat Med.
2019;
;
25
:
:838.
-
49
.
25.
Mauri
G
,
Durinikova
E
,
Amatu
A
,
et al.
Empowering Clinical Decision Making in Oligometastatic Colorectal Cancer: The Potential Role of Drug Screening of Patient-Derived Organoids.
.
JCO Precis Oncol.
2021;
;
5
.
26.
Ooft
SN
,
Weeber
F
,
Dijkstra
KK
,
et al.
Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients.
.
Sci Transl Med.
2019;
;
11
.
27.
Ooft
SN
,
Weeber
F
,
Schipper
L
,
et al.
Prospective experimental treatment of colorectal cancer patients based on organoid drug responses.
.
ESMO Open.
2021;
;
6
:
:100103.
.
28.
Braun
LM
,
Lagies
S
,
Klar
RFU
,
et al.
Metabolic Profiling of Early and Late Recurrent Pancreatic Ductal Adenocarcinoma Using Patient-Derived Organoid Cultures.
.
Cancers (Basel).
2020;
;
12
.
29.
Kong
J
,
Lee
H
,
Kim
D
,
et al.
Network-based machine learning in colorectal and bladder organoid models predicts anti-cancer drug efficacy in patients.
.
Nat Commun.
2020;
;
11
:
:5485.
.
30.
Li
L
,
Knutsdottir
H
,
Hui
K
,
et al.
Human primary liver cancer organoids reveal intratumor and interpatient drug response heterogeneity.
.
JCI Insight.
2019;
;
4
.
31.
de Witte
CJ
,
Espejo Valle-Inclan
J
,
Hami
N
,
et al.
Patient-Derived Ovarian Cancer Organoids Mimic Clinical Response and Exhibit Heterogeneous Inter- and Intrapatient Drug Responses.
.
Cell Rep.
2020;
;
31
:
:107762.
.
32.
Tiriac
H
,
Belleau
P
,
Engle
DD
,
et al.
Organoid Profiling Identifies Common Responders to Chemotherapy in Pancreatic Cancer.
.
Cancer Discov.
2018;
;
8
:
:1112.
-
29
.
33.
Kim
M
,
Mun
H
,
Sung
CO
,
et al.
Patient-derived lung cancer organoids as in vitro cancer models for therapeutic screening.
.
Nat Commun.
2019;
;
10
:
:3991.
.
34.
Dijkstra
KK
,
Monkhorst
K
,
Schipper
LJ
,
et al.
Challenges in Establishing Pure Lung Cancer Organoids Limit Their Utility for Personalized Medicine.
.
Cell Rep.
2020;
;
31
:
:107588.
.
35.
Colella
G
,
Fazioli
F
,
Gallo
M
,
et al.
Sarcoma Spheroids and Organoids-Promising Tools in the Era of Personalized Medicine.
.
Int J Mol Sci.
2018;
;
19
.
36.
Driehuis
E
,
Kretzschmar
K
,
Clevers
H
.
Establishment of patient-derived cancer organoids for drug-screening applications.
.
Nat Protoc.
2020;
;
15
:
:3380.
-
409
.
37.
Larsen
BM
,
Kannan
M
,
Langer
LF
,
et al.
A pan-cancer organoid platform for precision medicine.
.
Cell Rep.
2021;
;
36
:
:109429.
.
38.
Hu
Y
,
Sui
X
,
Song
F
,
et al.
Lung cancer organoids analyzed on microwell arrays predict drug responses of patients within a week.
.
Nat Commun.
2021;
;
12
:
:2581.
.
39.
Larsen
BM
,
Cancino
A
,
Shaxted
JM
,
Salahudeen
AA
.
Protocol for drug screening of patient-derived tumor organoids using high-content fluorescent imaging.
.
STAR Protoc.
2022;
;
3
:
:101407.
.
40.
Cattaneo
CM
,
Dijkstra
KK
,
Fanchi
LF
,
et al.
Tumor organoid-T-cell coculture systems.
.
Nat Protoc.
2020;
;
15
:
:15.
-
39
.
41.
Tsai
S
,
McOlash
L
,
Palen
K
,
et al.
Development of primary human pancreatic cancer organoids, matched stromal and immune cells and 3D tumor microenvironment models.
.
BMC Cancer.
2018;
;
18
:
:335.
.
42.
Truelsen
SLB
,
Mousavi
N
,
Wei
H
,
et al.
The cancer angiogenesis co-culture assay: In vitro quantification of the angiogenic potential of tumoroids.
.
PLoS One.
2021;
;
16
:
:e0253258.
.
|