| |
| Med Sci (Paris). 38(11): 877–879. doi: 10.1051/medsci/2022139.Le système nerveux est-il à côté de la plaque ? Gregory Franck1* and Antonino Nicoletti1 1Université Paris Cité et université Sorbonne Paris Nord, Inserm UMRS1148, Laboratory for vascular translational science (LVTS)
,
Paris
,
France MeSH keywords: Humains, Plaque d'athérosclérose, Système nerveux |
Les grands systèmes physiologiques, tels que le système immunitaire, le système vasculaire, ou encore le système nerveux, ont longtemps été étudiés de façon cloisonnée. De nombreux travaux de recherche ont désormais pour objectif de comprendre comment ces systèmes interagissent. Des études ont notamment permis de montrer l’existence de communications bidirectionnelles entre système nerveux et système immunitaire : les cellules immunitaires peuvent détecter des signaux neuronaux spécifiques et les réseaux axonaux peuvent répondre à des stimulus inflammatoires ou cytokiniques. Ainsi est née une nouvelle discipline scientifique : la neuro-immunologie. Quant à l’interaction du système nerveux avec le système vasculaire, elle est à la fois développementale et physiologique.
Dans l’article de Mohanta
et al
., publié dans la revue
Nature
[
1
], les auteurs ont étudié les structures neuronales dans l’adventice des artères, la structure histologique la plus externe de la paroi de ces vaisseaux (
Figure 1
). Différentes équipes de recherche avaient préalablement rapporté que cette couche héberge des infiltrats lymphoïdes dans des artères athéromateuses [
2
–
9
]. Ces amas lymphoïdes, organisés comme les follicules lymphoïdes des ganglions lymphatiques, sont des centres germinatifs ectopiques. On les désigne sous le terme d’organe lymphoïde tertiaire des artères (en anglais,
artery tertiary lymphoid organ
, ATLO) et ils sont le siège de réponses immunitaires spécifiques. Mohanta
et al.
ont détecté une augmentation du nombre d’axones présents dans l’adventice en regard des plaques d’athérome qui se forment spontanément chez la souris hypercholestérolémique
Apoe
-/-
au cours du vieillissement. De plus, ils ont montré que cette densité axonale était encore plus forte lorsque des ATLO étaient présents, du fait de l’existence d’une néogenèse axonale. Ils ont alors émis l’hypothèse qu’une interface immuno-neuro-vasculaire pouvait permettre au système nerveux périphérique de percevoir des informations locales et d’interagir avec les cellules immunitaires de l’adventice des artères.
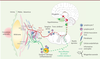 | Figure 1.
Schéma du bras sensoriel et du bras effecteur du circuit neuronal « artère-cerveau » impliqué dans l’interface immuno-neurovasculaire. ATLO : Artery Tertiary Lymphoid Organ.
|
|
Interface immuno-neurovasculaire et athérosclérose
Les auteurs ont alors caractérisé les axones présents dans l’adventice d’aortes athéromateuses, et ont montré la présence d’afférences sensorielles mais aussi de fibres efférentes du système orthosympathique. Les synapses formées par ces fibres étaient situées à quelques nanomètres seulement des cellules immunitaires présentes dans les ATLO ainsi que des cellules musculaires lisses de la partie la plus externe de la média. Ils ont confirmé que les axones ne pénètrent pas dans la média et n’atteignent en aucun cas la plaque d’athérome formée dans l’intima (
Figure 1
). Il semble donc exister un système de communication « tripartite », dans lequel des informations en provenance de l’intima atteindraient l’adventice, siège d’un dialogue neuro-immunitaire. Les auteurs précisent d’ailleurs que les lymphocytes présents dans les ATLO expriment davantage le gène codant le récepteur β2 adrénergique, en faveur d’un possible dialogue entre les efférences du système nerveux sympathique et les cellules immunitaires. Ces résultats ont pu être confirmés sur des artères coronaires humaines.
Par ailleurs, les auteurs sont parvenus à montrer que les axones présents dans l’adventice pénètrent à l’intérieur des ATLO et qu’ils dérivent des ganglions cœliaques et de la chaîne ganglionnaire orthosympathique. En analysant des nerfs plus distants et de plus gros calibre, ils ont montré que chez les souris athéromateuses, les ganglions nerveux périvasculaires et les ganglions somatosensoriels de la racine dorsale étaient en contact étroit avec des amas lymphoïdes (
tertiary lymphoid clusters
) moins complexes que les ATLO, ce qui indique qu’une inflammation neuronale systémique se développe concomitamment à la maladie athéromateuse.
|
Circuit « artère-cerveau »
Les auteurs ont ensuite cherché à savoir s’il existe un lien entre l’innervation adventitielle, le système nerveux périphérique et le système nerveux central (circuit « artère-cerveau »). Pour cela, ils ont utilisé un variant atténué du virus de la pseudo-rage (souche Bartha), dont le neurotropisme et la migration rétrograde permettent de mettre en évidence, par immunomarquage des protéines virales, l’afférence nerveuse du site d’injection. Ils ont pu ainsi tracer le câblage neuronal liant l’adventice athéromateuse, la moelle épinière et le cerveau : deux à quatre jours après injection du virus dans l’adventice, il est détecté dans les ganglions périvasculaires, les ganglions cœliaques, puis dans la chaîne ganglionnaire orthosympathique au bout de quatre jours. C’est aussi après quatre jours qu’il est détecté dans le système nerveux central, dans les noyaux intermédio-latéraux de la substance grise de la moelle épinière, ainsi que dans certains noyaux du cerveau (
Figure 1
). Plus tardivement, le virus est détecté dans un réseau neuronal encore plus grand. Enfin, les auteurs précisent que l’aorte de la souris ne possède pas d’innervation parasympathique (vagale) directe.
|
Système nerveux central, ATLO et athérosclérose
Une augmentation de l’activité électrique des ganglions cœliaques avec l’âge a été mise en évidence chez des souris
Apoe
-/-
, suggérant l’existence d’un couplage entre l’étendue de la plaque d’athérosclérose et l’activité neuronale. En supprimant chirurgicalement les ganglions cœliaques chez des souris
Apoe
-/-
adultes, les auteurs confirment que les niveaux de noradrénaline diminuent fortement dans l’aorte et dans la rate. Surtout, ils notent que cette sympathectomie locale conduit à une diminution rapide de la taille, du nombre et de la cellularité des ATLO, ainsi qu’à une réduction de près de 40 % de la taille des plaques d’athérome dans la crosse aortique et dans l’aorte abdominale au bout de huit mois, sans modifier significativement l’hémodynamique (pression artérielle, fréquence cardiaque) ou la cholestérolémie.
|
Ces travaux mettent en lumière un nouveau scénario, auparavant insoupçonné, dans la couche adventitielle des vaisseaux athéromateux, où 1) un bras sensoriel du système nerveux périphérique est relié au système nerveux central, et 2) un bras sympathique effecteur, qui se projette depuis l’hypothalamus et la moelle épinière vers l’adventice de l’aorte abdominale (et sans doute d’autres artères), peut délivrer localement des médiateurs tels que l’adrénaline, ce qui favoriserait la formation d’amas lymphoïdes organisés (
Figure 1
). Ainsi, les systèmes nerveux central et périphérique pourraient contribuer à la croissance de la lésion athéromateuse. Cette découverte ouvre de nouvelles pistes thérapeutiques ciblant spécifiquement ces dialogues cellulaires et moléculaires afin de contrôler la progression de la maladie athéromateuse. De futurs travaux de recherche devraient permettre de cartographier ces circuits neuronaux autour des principales artères, de caractériser plus précisément le type des fibres nerveuses, et d’évaluer les risques associés à une intervention thérapeutique sur ce dialogue neuro-vasculaire. Pour ne pas risquer d’être « à côté de la plaque », il importe également de clarifier le lien fonctionnel entre le système sympathique et le système somatosensoriel, comme cela a été fait récemment dans le tissu adipeux, où les neurones sensoriels innervant la graisse beige moduleraient le fonctionnement des adipocytes en agissant comme un frein sur le système sympathique [
10
].
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Mohanta
SK
,
Peng
L
,
Li
Y
,
et al.
Neuroimmune cardiovascular interfaces control atherosclerosis.
.
Nature.
2022;
;
605
:
:152.
–
9
.
2.
Grabner
R
,
Lotzer
K
,
Dopping
S
,
et al.
Lymphotoxin β receptor signaling promotes tertiary lymphoid organogenesis in the aorta adventitia of aged ApoE
-/-
mice
.
.
J Exp Med.
2009;
;
206
:
:233.
–
248
.
3.
Mohanta
SK
,
Yin
C
,
Peng
L
,
et al.
Artery tertiary lymphoid organs contribute to innate and adaptive immune responses in advanced mouse atherosclerosis.
.
Circ Res.
2014;
;
114
:
:1772.
–
1787
.
4.
Saphir
O
,
Gore
I
.
Evidence for an inflammatory basis of coronary arteriosclerosis in the young.
.
Arch Pathol.
1950;
;
49
:
:418.
–
426
.
5.
Houtkamp
MA
,
de Boer
OJ
,
van der Loos
CM
,
et al.
Adventitial infiltrates associated with advanced atherosclerotic plaques: structural organization suggests generation of local humoral immune responses.
.
J Pathol.
2001;
;
193
:
:263.
–
269
.
6.
Thaunat
O
,
Graff-Dubois
S
,
Brouard
S
,
et al.
Immune responses elicited in tertiary lymphoid tissues display distinctive features.
.
PLoS One.
2010;
;
5
:
:e11398.
.
7.
Dutertre
CA
,
Clement
M
,
Morvan
M
,
et al.
Deciphering the stromal and hematopoietic cell network of the adventitia from non-aneurysmal and aneurysmal human aorta.
.
PLoS One.
2014;
;
9
:
:e89983.
.
8.
Guedj
K
,
Khallou-Laschet
J
,
Clement
M
,
et al.
M1 macrophages act as LTβR-independent lymphoid tissue inducer cells during atherosclerosis-related lymphoid neogenesis.
.
Cardiovasc Res.
2014;
;
101
:
:434.
–
443
.
9.
Clement
M
,
Guedj
K
,
Andreata
F
,
et al.
Control of the T follicular helper-germinal center B-cell axis by CD8
+
regulatory T cells limits atherosclerosis and tertiary lymphoid organ development
.
.
Circulation.
2015;
;
131
:
:560.
–
570
.
10.
Wang
Y
,
Leung
VH
,
Zhang
Y
,
et al.
The role of somatosensory innervation of adipose tissues.
.
Nature.
2022;
;
609
:
:569.
–
74
.
|