L’immunothérapie recouvre un ensemble de traitements destinés à augmenter ou inhiber la réponse immunitaire pour lutter contre des maladies infectieuses ou auto-immunes et inflammatoires, contre des maladies neurodégénératives, ou contre différents cancers. D’importants efforts de recherche au cours des dernières décennies ont abouti à la production de molécules thérapeutiques, telles que les anticorps monoclonaux (AcM) et les fragments d’anticorps monoclonaux ( Tableau I ) [ 11 ] ( → ) et à celle de cellules armées avec des fragments d’anticorps fusionnés à des molécules d’activation, les lymphocytes CAR ( chimeric antigen receptor )-T [ 12 ] ( → ) capables de reconnaître des cellules pathogéniques et de conduire à leur élimination. Cette élimination s’effectue par différents mécanismes, soit par cytotoxicité directe grâce au recrutement de cellules tueuses (cellules NK [ natural killer ], lymphocytes T cytotoxiques, granulocytes neutrophiles) ou phagocytaires (macrophages, cellules dendritiques), soit de manière indirecte dans le cas d’anticorps ou de fragments d’anticorps conjugués à un élément radioactif ou à une toxine [ 1 ], soit également en favorisant le déploiement d’une réponse immunitaire plus efficace à leur encontre [ 2 ]. L’un des exemples les plus marquants de succès de la thérapie par AcM est l’utilisation clinique du rituximab, qui a révolutionné le traitement d’hémopathies malignes (certains lymphomes et certaines leucémies) au cours des vingt-cinq dernières années [ 3 ], ainsi que celui de certaines formes de la sclérose en plaques plus récemment [ 4 ]. Le rituximab est un AcM chimérique murin/humain (c’est-à-dire ayant des domaines variables V H et V L ( Tableau I ) dérivés d’un anticorps de souris dirigé contre la molécule CD20 humaine ( human cluster of differentiation 20 , huCD20) et fusionnés respectivement aux domaines constants des chaines lourdes et légères d’une immunoglobuline (Ig) G1, κ humaine. Les domaines variables murins sont responsables de la liaison du rituximab à huCD20 spécifiquement exprimé par un vaste éventail de sous-populations de lymphocytes B, tandis que la partie constante Fc (fragment cristallisable) de l’anticorps se lie au composant C1q du système du complément ainsi qu’aux récepteurs pour la région Fc des IgG (RFcγ) présents à la surface de nombreux leucocytes (cellules NK, macrophages, granulocytes neutrophiles, cellules dendritiques, etc.). L’activation de la voie classique du complément (dépendante des anticorps) qui fait suite à la fixation de C1q par l’anticorps conduit à la formation du complexe d’attaque membranaire qui va lyser la cellule ciblée [ 5 ], alors que l’engagement des RFcγ activateurs (RFcγI, IIa, IIc, IIIa, IIIb) déclenche des cascades d’évènements moléculaires conduisant à l’activation de mécanismes de clairance cellulaire, tels que la cytotoxicité cellulaire et la phagocytose dépendantes des anticorps [ 6 ].
(→) Voir la Synthèse de S. Joubert et al ., m/s n° 12, décembre 2019, page 1153
(→) Voir la Synthèse de V. Catros, m/s n° 4, avril 2019, page 316
Tableau I.
Principales caractéristiques des anticorps et fragments d’anticorps utilisés en thérapie.
IgG : immunoglobuline de type G ; kDa : kilodalton ; Fab : fragment
antigen-binding
(fragment se liant à l’antigène) ; scFv :
single-chain variable fragment
(fragment variable à chaîne unique) ; CDC : cytotoxicité dépendante du complément ; CCDA : cytotoxicité cellulaire dépendante des anticorps ; PDA : phagocytose dépendante des anticorps. Les images illustratives utilisées dans ce Tableau proviennent du site
Servier Medical Art
(
https://smart.servier.com/
),
Creative Commons Attribution 3.0 Unported License
.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Si le potentiel thérapeutique des AcM s’est confirmé au fil des années, leur conception nécessite l’emploi de procédés d’ingénierie ardus pour améliorer et optimiser leur activité biologique et leurs propriétés pharmacocinétiques. Souvent dotés de multiples modifications cruciales pour optimiser la fonctionnalité de leur région Fcγ (mutations ponctuelles et modification de leur glycosylation), les AcM sont des molécules complexes, et leur production à grande échelle s’effectue dans des systèmes d’expression eucaryotes sophistiqués, principalement dans des cellules de mammifères (les plus couramment utilisées dans l’industrie pharmaceutique étant des cellules d’ovaire de hamster chinois, les cellules CHO). De plus, les traitements indiqués sont le plus souvent itératifs et nécessitent d’importantes quantités d’anticorps (ainsi, le rituximab est utilisé par injection, à la dose de 375 mg/m 2 de surface corporelle, dans divers schémas thérapeutiques incluant plusieurs cycles d’injection). Il en résulte de forts coûts de production pour les industriels, avec de conséquentes répercussions sur le prix des traitements, donc sur la possibilité d’un accès équitable des patients aux thérapies par AcM à travers le monde. Afin de surmonter certaines de ces limitations, nous avons imaginé la conception de protéines de fusion bimodulaires ( bimodular fusion protein , BMFP) qui pourraient être produites à moindre coût par un système procaryote (bactéries) et qui auraient pour but, une fois injectées chez un patient, de rediriger une réponse anticorps polyclonale préexistante contre le virus d’Epstein-Barr (EBV) vers une cellule cible donnée.
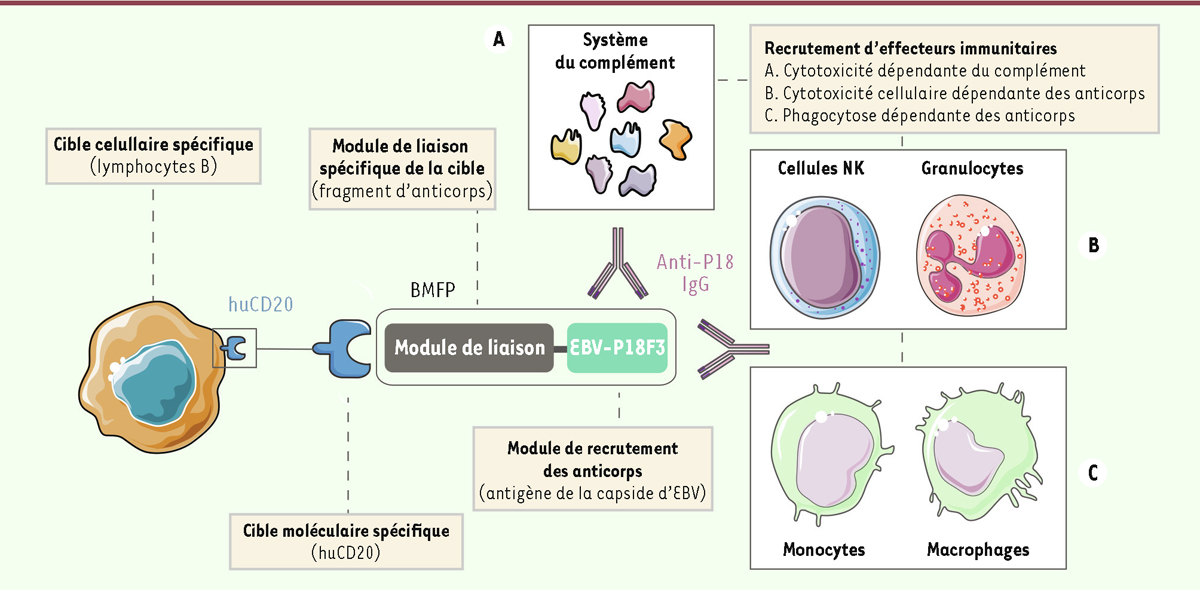
Le virus EBV, qui fait partie de la famille des Herpèsvirus, est omniprésent dans la population humaine : plus de 95 % des adultes sont infectés par ce virus de manière chronique. La persistance du virus à vie est due à sa capacité à établir une phase de latence dans les lymphocytes B mémoires, où il devient invisible pour le système immunitaire [ 7 ]. Cependant, pour assurer sa survie et sa dissémination à un autre hôte par la salive, le virus réactive périodiquement, mais à bas niveau, son cycle lytique pour produire des virions. Par conséquent, les personnes infectées ont, tout au long de leur vie, des anticorps circulants dirigés contre diverses protéines virales, notamment contre la protéine de la capside du virion P18. Des études ont montré que cette protéine, conservée au sein des souches d’EBV, est principalement reconnue par des IgG de la sous-classe 1 (IgG1) [ 8 ], dont la région Fcγ est très couramment utilisée pour la conception d’AcM thérapeutiques du fait de sa capacité à se lier efficacement à C1q et aux RFcγ et à induire l’activation d’effecteurs immunitaires de clairance cellulaire ( Tableau I ). La conception de BMFP pouvant, d’un côté, se lier spécifiquement à une cellule cible indésirable grâce à un fragment d’anticorps (scFv, VHH) ( Tableau I ) et, de l’autre, recruter à la surface de cette cellule cible des IgG1 polyclonales endogènes capables d’activer le complément et d’engager les RFcγ ( Figure 1 ), pourrait s’avérer très utile pour contourner le besoin actuel d’études complexes d’ingénierie visant à améliorer des fonctions effectrices d’un AcM [ 9 ]. Dans une étude récemment publiée dans la revue Science Advances [ 10 ], nous avons établi la preuve de concept de la pertinence d’une telle approche, en démontrant notamment la capacité d’une protéine recombinante bimodulaire de type BMFP ciblant huCD20 et contenant un polypeptide dérivé de P18 ( Figure 1 ) à recruter des IgG anti-EBV capables d’induire des mécanismes immunitaires conduisant à la destruction de lymphocytes B cancéreux in vitro , et à limiter la progression d’une tumeur hématopoïétique dans un modèle tumoral murin.
| Figure 1.
Mode d’action des protéines de fusion bimodulaires (BMFP).
Des molécules bimodulaires, composées d’un fragment (F3) de l’antigène de la capside virale (P18) du virus d’Epstein-Barr (EBV) et d’une unité de liaison ciblant spécifiquement la molécule humaine CD20 (huCD20), exprimée spécifiquement par une grande partie des lymphocytes B, sont produites sous forme de protéines recombinantes (BMFP). Un scFv anti-huCD20 permet de diriger les BMFP vers la surface des lymphocytes B que l’on souhaite éliminer. Le module EBV-P18F3 permet, quant à lui, de recruter les anticorps (IgG) anti-P18 circulants, conduisant ainsi à l’opsonisation de la cellule cible. Le déclenchement consécutif de mécanismes immunitaires effecteurs dépendants des anticorps, comme l’activation du complément
via
la liaison de la partie Fcγ des anticorps avec le composant C1q du complément (
A
) et l’engagement de cellules immunitaires exprimant des récepteurs Fcγ, va conduire à l’élimination des lymphocytes B ciblés (
B-C
). Figure adaptée de [
10
].
|
Dans un premier temps, nous avons optimisé la taille de l’antigène P18 à utiliser pour construire les BMFP afin de 1) rendre la construction de ces dernières la plus versatile possible et assurer la compatibilité du module de recrutement des anticorps anti-EBV avec différents types de modules de liaison à la cellule cible, et 2) rendre leur production en système bactérien possible et efficace. Nous avons pour cela écourté la séquence de P18 du côté N-terminal pour notamment éliminer une cystéine isolée ainsi qu’une succession d’acides aminés hydrophobes qui compromettaient la solubilité des protéines recombinantes obtenues. Un fragment de P18 de 6 500 daltons, appelé P18F3, a ainsi été identifié comme étant optimal pour assurer à la fois l’intégrité biochimique et fonctionnelle des BMFP ainsi que le bon recrutement des IgG anti-EBV. La fusion de P18F3 à un fragment d’anticorps de type scFv ( Tableau I ), issu de l’AcM murin 2H7 et interagissant spécifiquement avec la molécule huCD20, nous a ensuite permis d’obtenir un BMFP (scFv-P18F3) ciblant les lymphocytes B CD20 + utilisés dans notre étude comme cibles expérimentales. Étant donné que les scFv n’ont généralement pas de N-glycosylation, scFv-P18F3 a pu être exprimé avec succès par la bactérie, en quantités suffisantes pour assurer une évaluation expérimentale de l’efficacité de cette molécule in vitro and in vivo chez le petit animal.
Après avoir vérifié que scFv-P18F3 interagissait avec la molécule huCD20 exprimée à la surface de lymphocytes B, nous avons utilisé les cellules de la lignée Raji (cellules lymphoblastiques CD20 + d’un enfant présentant un lymphome de Burkitt, isolées en 1963) comme cible dans des modèles in vitro d’activation du complément et de cytotoxicité cellulaire dépendante des anticorps. Nous avons montré que le traitement de cellules Raji par scFv-P18F3, en présence de plasma provenant d’individus chroniquement infectés par l’EBV, conduisait, d’une part, à l’opsonisation de ces cellules par des IgG anti-P18 présentes dans ces plasmas, suivie de la formation du complexe d’attaque membranaire (C5b-9) à la surface des cellules, et d’autre part, à l’engagement des RFcγ exprimés à la surface de cellules immunitaires effectrices.
Nous avons ensuite évalué l’efficacité de scFv-P18F3 dans le traitement de cellules tumorales in vivo. L’infectivité de l’EBV étant restreinte aux cellules humaines, l’utilisation de modèles tumoraux murins couramment utilisés pour évaluer l’efficacité des AcM anti-huCD20 a nécessité une adaptation. Des souris ont d’abord été immunisées avec l’antigène viral P18 pour produire des anticorps polyclonaux endogènes anti-P18. Ces souris ont ensuite été injectées avec des thymocytes tumoraux murins génétiquement modifiés pour exprimer la molécule huCD20 à leur surface. Dans une première série d’expériences, 40 % des souris traitées par scFv-P18F3 ont eu une survie nettement prolongée, tandis que les souris non traitées ont toutes succombé dans un délai de 35 à 60 jours. Dans une seconde série d’expériences, la médiane de survie des animaux du groupe non traité était de 35 jours contre 51 jours pour le groupe traité, une souris sur cinq traitées avec scFv-P18F3 présentant une rémission totale du cancer.
Ces résultats ont établi la preuve de concept que « l’approche BMFP » permettait de réorienter in vitro des anticorps polyclonaux endogènes dirigés contre EBV vers une cible donnée, et que ce recrutement induisait l’activation d’effecteurs immunitaires impliqués dans la clairance cellulaire. Ils apportent aussi les premiers éléments en faveur de l’efficacité de cette thérapie in vivo , même si le modèle murin que nous avons utilisé ne reproduit notamment pas l’infection chronique des personnes par l’EBV.
Si l’efficacité thérapeutique reste l’objectif principal des traitements par les BMFP, la réduction des coûts de production des traitements, notamment par rapport à ceux de nombreux AcM, est aussi un aspect essentiel à considérer. Les BMFP, qui sont des protéines de plus petite taille que les AcM et qui ne nécessitent pas de modifications post-traductionnelles importantes pour leur fonctionnalité, peuvent être produites en grandes quantités dans un système bactérien suivant des procédés de fabrication moins complexes, et donc moins coûteux, que ceux utilisés pour produire des anticorps entiers. La capacité des BMFP à recruter des anticorps endogènes polyclonaux, dont la biodisponibilité est continue, pourrait aussi s’avérer être un avantage conséquent par rapport aux AcM, qui doivent être injectés à de fortes doses et de façon itérative pour présenter une efficacité thérapeutique. Enfin, du fait de son adaptabilité (changement facile du module de liaison et donc de l’antigène ciblé), la technique BMFP pourrait constituer une plateforme thérapeutique universelle et polyvalente pour développer de nouvelles molécules à usage thérapeutique contre un large éventail de maladies.