En dépit d’un vaccin préventif très efficace, l’infection chronique par le virus de l’hépatite B (VHB) affecte environ 250 millions de personnes dans le monde, et reste la première cause de carcinome hépatocellulaire [ 1 ]. La co-infection par le virus de l’hépatite D (VHD) aggrave et accélère le développement de la maladie hépatique, et est ainsi responsable de la forme la plus sévère d’hépatite virale chronique [ 2 ]. Malgré de nouvelles stratégies thérapeutiques prometteuses, notamment contre le VHD [ 2 ], aucun traitement ne permet actuellement l’élimination de ces virus de manière efficace et rapide chez les personnes affectées. Les deux virus, qui varient en structure, organisation génomique et stratégie de réplication, ont un tropisme hépatique strict, conféré par leur enveloppe commune. Le VHD est en effet un virus satellite du VHB : il détourne les protéines d’enveloppe du VHB pour l’assemblage de ses particules infectieuses [ 2 , 3 ] ( → ).
(→) Voir la Nouvelle de D. Alfaiate et D. Durantel, m/s n° 6-7, juin-juillet 2017, page 570
Ces virus sont tous deux difficiles à cibler directement, et la caractérisation de nouvelles cibles thérapeutiques indirectes, notamment parmi les facteurs cellulaires impliqués dans les cycles viraux, est un enjeu de recherche majeur. Dans ce contexte, nécessitant une connaissance très fine des interactions moléculaires entre le virus et sa cellule hôte, la recherche a longtemps été freinée par l’absence de modèle d’étude simple de ces virus, en particulier parce que les lignées cellulaires dérivées d’hépatocarcinome utilisées au laboratoire ne sont pas sensibles à l’infection par les deux virus, qui ont les mêmes protéines d’enveloppe et le même mécanisme d’entrée dans les cellules, via un récepteur longtemps resté inconnu [ 2 ]. Entre 2012 et 2014, deux équipes de recherche indépendantes ont découvert que ce récepteur cellulaire était le transporteur d’acides biliaires NTCP ( sodium taurocholate co-transporting polypeptide ), codé par le gène SLC10A1 ( solute carrier 10A 1) [ 4 , 5 ]. NTCP est une protéine transmembranaire de 38 KDa, presque exclusivement exprimée à la surface basolatérale des hépatocytes. Le VHD et le VHB interagissent directement avec NTCP par la région preS1 de la grande protéine d’enveloppe du VHB, dont l’extrémité N-terminale est myristoylée 1 [ 6 ]. Des études fonctionnelles ont montré l’importance de deux régions du NTCP humain dans l’interaction avec le VHB et le VHD, l’une de neuf résidus (en position 157-165) et l’autre de quatre résidus (en position 84-87), expliquant le tropisme d’espèce des virus [ 6 ]. Par ailleurs, l’inhibition de l’entrée virale par les acides biliaires d’une part, et de l’import des acides biliaires par les peptides preS1 myristoylés synthétiques d’autre part, suggèrent que cette interaction interfère avec la fonction du transporteur [ 6 ]. Cependant, une caractérisation plus fine de l’interaction entre l’enveloppe du VHB et NTCP était difficile en l’absence de connaissance de la structure de ce transporteur.
Dans un récent numéro de la revue Nature , trois articles publiés simultanément et indépendamment décrivent la structure tridimensionnelle du transporteur NTCP en utilisant la cryo-microscopie électronique (cryo-EM) [ 7 – 10 ]( → ).
(→) Voir la Synthèse de D. Lévy et al., m/s n° 4, avril 2021, page 379
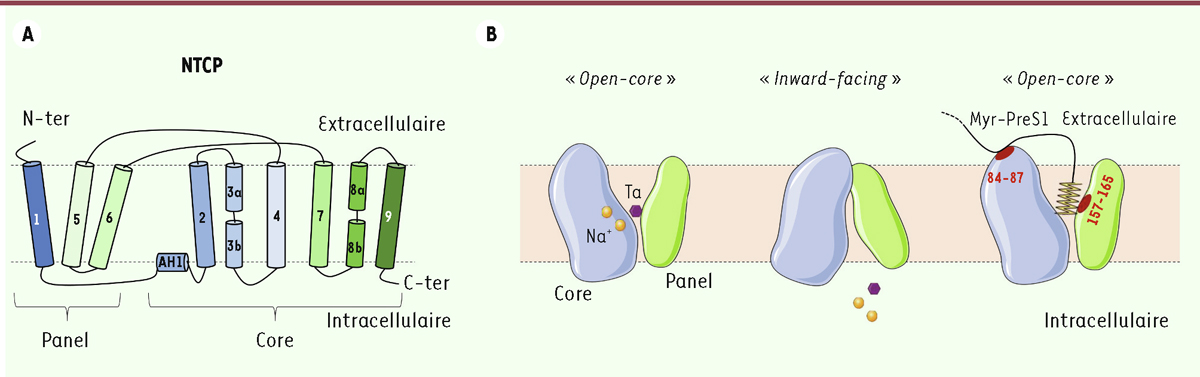
La principale difficulté de l’étude de la structure de NTCP provient de la taille de la protéine, trop petite pour être analysée directement par cryo-EM. Pour surmonter cette difficulté, les chercheurs ont employé des stratégies différentes. Asami et al . [ 8 ], et Park et al . [ 7 ] ont produit des anticorps (Ac) anti-NTCP et ont purifié des complexes NTCP-Ac pour construire une carte de ces complexes à des résolutions de 3,3 Å (pour l’étude d’Asami et al .) et 3,4 Å (pour le NTCP humain dans l’étude de Park et al. ). Goutam et al . [ 9 ], quant à eux, ont modifié quelques acides aminés, puis ont sélectionné des VHH (ou, en anglais, nanobody , Nb), des domaines variables de chaînes lourdes d’anticorps de camélidés (environ 11[-120] acides aminés selon les cas), ainsi qu’un megabody [ 11 ] pour stabiliser la conformation de la protéine. Il convient de noter que les deux VHH utilisés, Nb87 et Nb91, ont été sélectionnés pour leur capacité à inhiber le transport des acides biliaires dépendant de NTCP. Les deux cartes de cryo-EM ainsi déterminées ont une résolution respective de 3,3 et 3,7 Å. Quelle que soit la stratégie choisie, les trois études décrivent une structure similaire de la protéine, qui contient neufs hélices α transmembranaires divisées en deux grands domaines structuraux ( Figure 1 ) : le domaine « panel », qui contient les domaines 1, 5, et 6, et le domaine « core » constitué des domaines 2, 3, 4, 7, 8 et 9 [ 7 – 9 ]. L’étude des complexes avec les nanocorps permet d’identifier deux conformations différentes de NTCP [ 9 ] : l’une, appelée « open-core », est caractérisée par une séparation physique entre les domaines « panel » et « core », formant un tunnel ouvert au sein de la membrane, exposant notamment les deux sites de liaisons aux ions Na + . La seconde, appelée « inward-facing » (tournée vers l’intérieur), est marquée par la liaison entre les domaines « core » et « panel » du côté extracellulaire, et présente une large poche amphiphile du côté du cytoplasme, compatible avec le transport de molécules amphiphiles, telles que les acides biliaires, de l’espace de Disse (l’espace compris entre un vaisseau sanguin et un hépatocyte) vers l’intérieur de l’hépatocyte ( Figure 1 ). Ainsi, le changement de conformation exposerait le transporteur à son substrat (« open core ») avant de permettre son import via la conformation « inward facing », selon un modèle qui rappelle celui de l’homologue bactérien du transporteur d’acides biliaires ASBT ( apical sodium-dependent bile-acid transporter , codé par SLC10A2 dans l’espèce humaine), dont la structure a été caractérisée il y a plus de dix ans [ 12 ]. Park et al . [ 7 ] précisent que le changement de conformation permet l’établissement d’une poche à acides biliaires dans la configuration « open », ce qui permettrait ensuite le contrôle dynamique de leur import par le gradient d’ions Na + .
| Figure 1.
Modèles de structure et de fonction de NTCP. A.
Organisation structurale de NTCP, selon Park
et al
. [
7
] et Asami
et al
. [
8
]. Les neuf hélices alpha transmembranaires sont représentées. AH1 :
amphipathic linker helix
.
B..
Modèles des conformations adoptées par NTCP lors de l’import des acides biliaires et la liaison à l’enveloppe de VHB. Les régions d’interaction avec preS1 sont indiquées en rouge. Le modèle d’interaction avec le peptide preS1 myristoylé (Myr-PreS1) est proposé par Asimi
et al
. [
8
]. Ta : taurocholate (acide biliaire).
|
En plus de la caractérisation de la fonction du transporteur, les trois études décrivent en détail l’interaction entre NTCP et le domaine preS1 de l’antigène d’enveloppe du VHB. En accord avec les études précédentes, toutes trois confirment l’interférence entre cette interaction et le transport d’acides biliaires, notamment l’inhibition de leur import par les peptides preS1. Ils valident également l’importance des 48 premiers résidus de preS1 dans la liaison à NTCP et identifient des domaines d’interaction potentiels. Goutam et al . [ 9 ] montrent ainsi que preS1 interagit avec le domaine transmembranaire 5 (appartenant au domaine « panel »), qui contient les résidus 157-165 précédemment identifiés comme cruciaux pour l’infection par le VHB. Ils montrent que cette interaction est plus efficace lors de la conformation « open core », qui expose les résidus 157-165 à l’espace extracellulaire ( Figure 1 ). Ils identifient d’autres résidus (262, 267, 294) interagissant avec preS1. Park et al . [ 7 ] proposent également une organisation de la poche de liaison aux acides biliaires, à laquelle se lierait preS1 myristoylé, impliquant les résidus 158 et 267 de NTCP, déjà connus pour jouer un rôle clé dans l’infection par le VHB. Cette hypothèse est corroborée par Asami et al . [ 8 ], qui analysent par cryo-EM des complexes NTCP-Ac-preS1. Enfin, Park et al . suggèrent que les résidus 9-18 de preS1 interagissent avec la région 84-87 de NTCP, également indispensable à l’infection par le VHB [ 7 ]. Les trois études permettent de proposer un modèle d’interaction complexe entre l’enveloppe virale et le récepteur NTCP, impliquant des domaines potentiels de liaison aux acides biliaires ( Figure 1 ). Il convient de noter qu’il n’a pas été possible de déterminer le rôle du groupement myristoylé dans la liaison des virus à NTCP. Un modèle alternatif à celui présenté dans la Figure 1 , proposé par Asami et al . [ 8 ], implique l’enchâssement du groupe myristoylé dans la membrane et la liaison à la poche des acides biliaires via les résidus de preS1.
En plus de leur intérêt fondamental pour la caractérisation du fonctionnement des transporteurs, ces travaux sont d’une grande importance dans la perspective de nouvelles solutions thérapeutiques contre les virus VHB et VHD. NTCP est une cible de choix pour le traitement de l’infection par ces virus. Les formes synthétiques des peptides preS1 (résidus 2-48) myristoylés sont très efficaces in vitro et in vivo , et la forme commerciale bulévirtide est actuellement utilisée pour traiter l’hépatite D chronique [ 13 ]. S’il montre l’intérêt d’inhiber l’entrée virale dans la lutte contre ces virus, notamment le VHD, ce traitement souffre aujourd’hui de plusieurs inconvénients : nécessité d’une injection quotidienne pendant une longue durée (la durée totale du traitement n’est pas fixée, en France), et interférence avec l’import des acides biliaires, détectable chez les patients traités, et dont on ignore les effets à long terme. La caractérisation de la structure du récepteur, notamment la description plus fine des interactions entre l’enveloppe du VHB et NTCP, offre des perspectives pour l’identification de molécules inhibant la liaison à preS1 sans affecter le transport des acides biliaires, en ciblant la région 84-87 du transporteur [ 7 – 9 ]. Il est en effet peu probable, étant donné la stringence de la poche de liaison aux acides biliaires décrite par ces études, qu’une inhibition chimique de cette région s’accompagne d’une absence d’effet sur le transport des acides biliaires.