| |
| Med Sci (Paris). 38(11): 861–863. doi: 10.1051/medsci/2022138.Les cellules, « Petits Poucets » des tissus vivants Joseph d’Alessandro,1* Alex Barbier-Chebbah,2 Raphaël Voituriez,2 and Benoît Ladoux1 1Université Paris Cité, CNRS, Institut Jacques Monod
,
F-75013Paris
,
France 2Laboratoire de physique théorique de la matière condensée (LPTMC) et Laboratoire Jean Perrin, CNRS, Sorbonne université
,
Paris
,
France MeSH keywords: |
La migration cellulaire est impliquée dans de nombreux processus physiologiques, comme le développement embryonnaire, la morphogenèse, l’homéostasie et la réparation tissulaires, mais aussi pathologiques, comme l’invasion tumorale [
1
]. Les cellules sont notamment propulsées par le remodelage de leur cytosquelette, un assemblage interne de biopolymères très dynamique, qui permet les changements de forme cellulaire et produit des forces mécaniques en interagissant avec la matrice extracellulaire. Ces interactions se font
via
des complexes d’adhérence et des protéines transmembranaires qui établissent le lien entre l’intérieur et l’extérieur de la cellule [
2
]. Ainsi, la constante réorganisation du cytosquelette permet aux cellules d’adhérer, de se polariser et de se mouvoir dans une certaine direction. Les trajectoires cellulaires dépendent donc à la fois de l’organisation interne du cytosquelette et de son couplage mécanique avec l’environnement : elles sont, entre autres, déterminées par les inhomogénéités locales des propriétés d’adhérence ou de rigidité du substrat.
Dans le même temps, les cellules sont capables de modifier leur environnement extérieur, en déposant, réorganisant ou dégradant les composants de la matrice extracellulaire (
Figure 1
). Le système composé d’une cellule et de son milieu environnant présente donc des possibilités de rétroaction, entre déplacements cellulaires et modification de l’environnement. Cependant, ces rétroactions ont été peu étudiées, notamment en raison de la complexité de l’analyse des trajectoires cellulaires, qui présentent une importante composante stochastique [
3
,
4
].
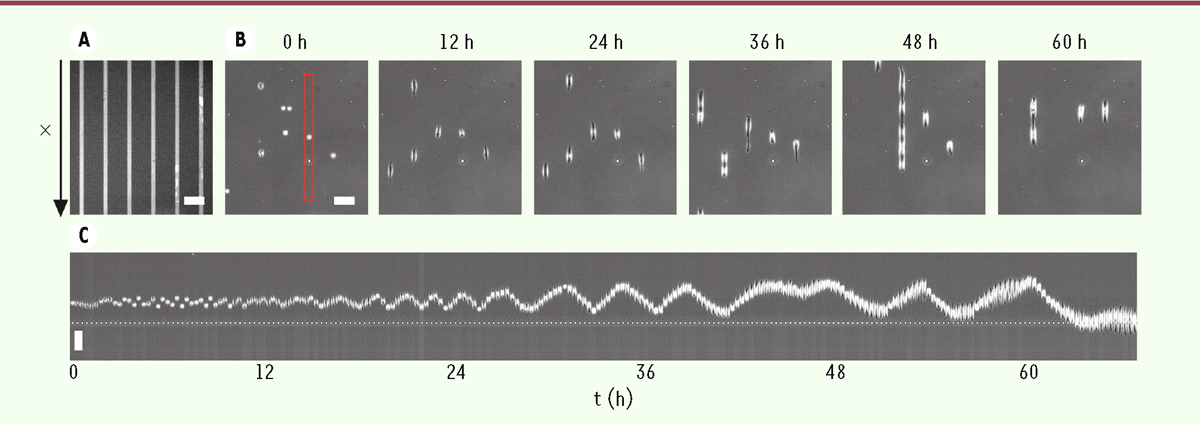
 | Figure 1.
Oscillations spontanées de cellules dont le déplacement est restreint à une dimension. A.
Image de fluorescence de la fibronectine marquée avec la molécule fluorescente Cy3, déposée en lignes pour confiner le mouvement des cellules dans l’axe indiqué par la flèche.
B.
Images instantanées, en contraste de phase, de cellules MDCK (
Madin-Darby canine kidney
) isolées sur les lignes de fibronectine, prises à différents temps après leur dépôt.
C.
« Kymographe » : concaténation d’images d’une même cellule au cours du temps, montrant ses positions successives (barres d’échelle : 20 µm).
|
Différentes approches expérimentales ont été utilisées pour surmonter ces difficultés. Parmi elles, le confinement des cellules sur des rails tient une place particulière, car il permet de diminuer considérablement la variabilité des mouvements [
5
]. Nous avons combiné cette approche expérimentale avec l’analyse statistique d’un grand nombre de trajectoires et leur modélisation mathématique pour mettre en évidence une conséquence importante de la rétroaction entre migration cellulaire et modifications de l’environnement [
6
].
|
Les cellules en mouvement oscillent sur place
Nous avons d’abord préparé des substrats pour la migration cellulaire en déposant, sur un support en plastique, des micro-rails de fibronectine (une protéine sur laquelle les cellules adhèrent et migrent) d’une largeur comparable à celle d’une cellule (
Figure 1A
). Puis nous y avons déposé des cellules, en faible densité, isolées les unes des autres. Nous les avons observées par vidéo-microscopie sur des durées allant jusqu’à quatre jours, puis nous avons reconstitué leurs trajectoires (
Figure 1B
,
C
).
Si la moitié des cellules environ restent statiques, les autres se déplacent sur des distances importantes, de façon active. Étonnamment, au lieu de changer de direction de façon aléatoire comme on l’attendrait, elles présentent des mouvements réguliers d’oscillation autour de leur position initiale (
Figure 1C
). Plus surprenant encore, l’amplitude et la période de ces oscillations croissent lentement au cours du temps, proportionnellement l’une à l’autre, par des incréments relativement constants et, pour ce qui concerne l’amplitude, inférieurs à la longueur atteinte par la cellule au bout de sa course. Cela suggère que les cellules modifient la surface du support sur leur passage, et laissent ainsi une empreinte sur laquelle elles peuvent facilement revenir. Ce comportement de « Petit Poucet » expliquerait les mouvements d’oscillation observés. De plus, à chaque excursion, les cellules débordent un peu de leur empreinte, ce qui permet d’étendre leur domaine de déplacement au cours du temps (
Figure 2
). L’hypothèse alternative serait que ces mouvements oscillants sont une propriété intrinsèque des cellules, et dépendent donc d’une horloge interne : une hypothèse cependant moins probable, car elle supposerait une croissance lente de la période de cette horloge interne, étonnamment synchronisée avec les mouvements eux-mêmes.
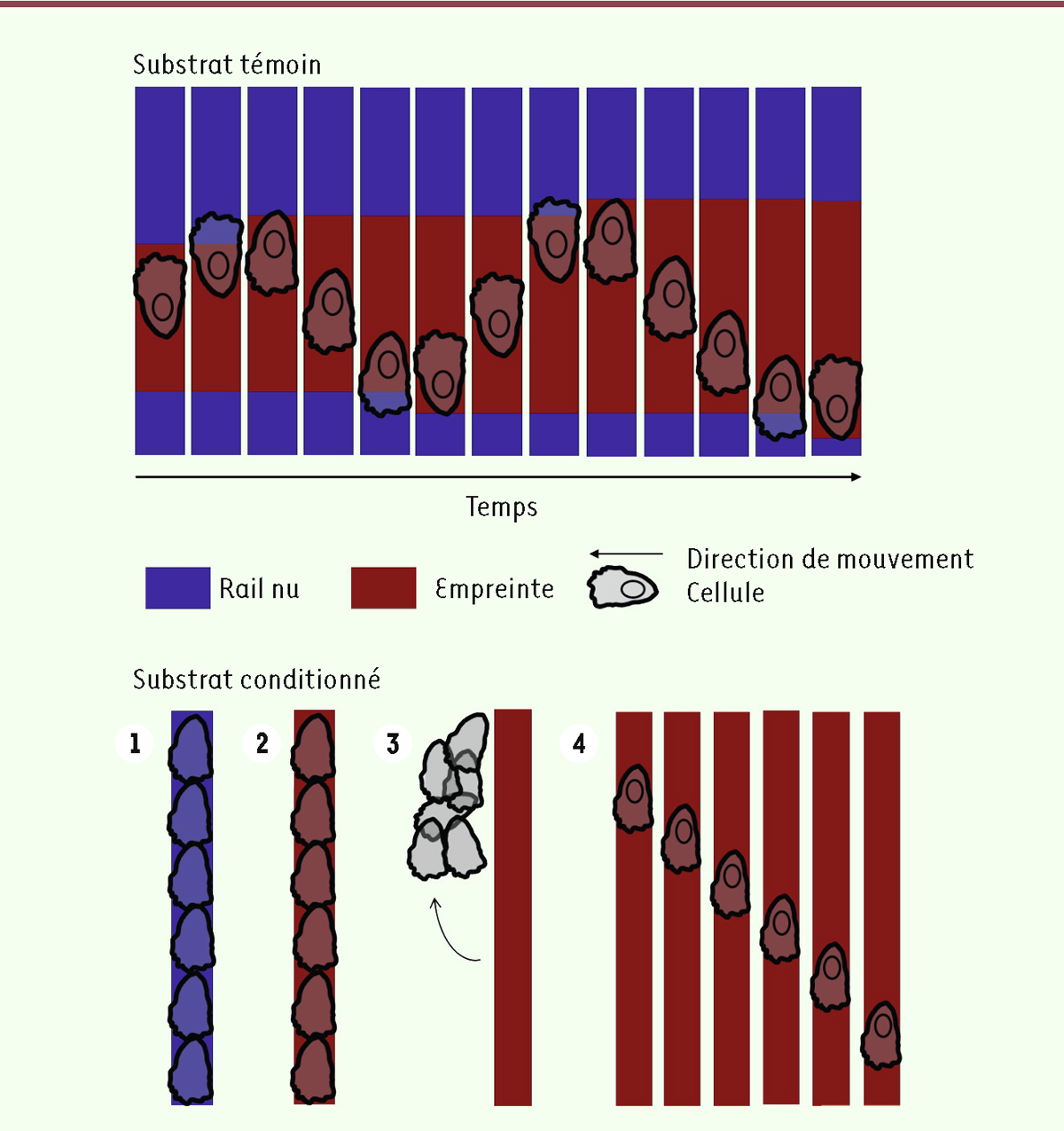
 | Figure 2.
Schéma des « dynamiques réciproques » de la migration et de l’empreinte cellulaires. En haut :
sur un substrat témoin (en bleu : fibronectine imprimée initialement), la cellule dépose une empreinte (en rouge) sur son passage. Elle repart en sens inverse lorsqu’elle atteint le bord de son empreinte, en débordant légèrement.
En bas :
le substrat (en bleu) est conditionné en déposant d’abord des cellules sur toute la longueur de la ligne (1) et (2). Ces cellules sont ensuite détachées (3), laissant leur empreinte (en rouge) à la surface du substrat. Quand on dépose une cellule isolée sur ce substrat conditionné (4), la cellule avance sans changer de sens de déplacement puisqu’elle ne rencontre jamais le bord de l’empreinte.
|
|
Les cellules qui migrent déposent une empreinte sur leur passage
Pour tester ces hypothèses, nous avons eu recours à des expériences de « conditionnement » du substrat de migration. Nous avons déposé des cellules à forte densité sur les rails de fibronectine, puis nous les avons détachées après quelques heures. Nous avons ensuite utilisé ces substrats pour réaliser les mêmes expériences de migration que précédemment. Si les oscillations ne sont régies que par une horloge interne, cette étape supplémentaire ne devrait pas affecter le mouvement des cellules (
Figure 2
). En revanche, si l’hypothèse de l’empreinte cellulaire est correcte, les rails sont maintenant entièrement recouverts d’empreinte dès le début de l’expérience et devraient donc permettre des mouvements sans restriction spatiale. De fait, sur ces substrats conditionnés, les cellules ne changent de sens de déplacement que rarement. Ainsi, elles s’éloignent rapidement de leur position initiale et parcourent de grandes distances. Nous avons montré, par immunomarquage, que les cellules déposent effectivement de la fibronectine et de la laminine, deux protéines de la matrice extracellulaire, sur leur passage : ces dépôts confirment l’existence d’une empreinte cellulaire, dont la composition moléculaire complète reste à élucider. En supposant que les cellules déposent leur empreinte sur tout leur parcours, puis en mesurant leur accélération, nous avons montré qu’elles se déplacent de façon persistante, sauf lorsqu’elles rencontrent le bord de leur empreinte, où elles repartent rapidement en sens inverse.
Pour mieux comprendre les conséquences de cet effet de rétroaction entre migration cellulaire et dynamique du substrat, nous avons élaboré un modèle, adapté de la marche aléatoire auto-attractive, pour rendre compte de nos observations expérimentales. Le modèle considère une particule qui se déplace par sauts successifs sur un réseau : sa trajectoire est « persistante » car la particule a tendance à continuer dans la direction du saut précédent, et « auto-attractive » car lorsque le choix se présente, la particule « préfère » revenir à une position déjà visitée que de poursuivre son mouvement vers un site inconnu. Les trajectoires obtenues par les simulations numériques reproduisent bien des oscillations régulières dont l’amplitude croît progressivement avec le temps. |
Conséquences pour l’exploration de l’espace environnant par les cellules en migration La modélisation permet de mettre en évidence les effets dominants dans le comportement migratoire observé : l’auto-attraction, c’est-à-dire la rétroaction entre migration cellulaire et dynamique du substrat, apparaît comme l’élément essentiel. Le modèle explique notamment que l’auto-attraction produit un « vieillissement » des trajectoires. Cela signifie que les propriétés du mouvement dépendent du moment où elles sont mesurées. Par exemple, plus on observe les cellules tardivement, plus elles semblent mobiles car l’amplitude de leur mouvement augmente. Paradoxalement, la relative « inefficacité », à court terme, du déplacement des cellules, qui s’auto-confinent autour de leur position d’origine, permet une meilleure exploration de leur environnement dans la durée : plutôt que de s’éloigner rapidement dans une seule direction, elles explorent tout l’espace qui les entoure, ce qui augmente la probabilité de rencontrer une cible. Nous avons également pu vérifier la validité de cette propriété « d’exploration compacte » dans le cas d’un déplacement bidimensionnel des cellules sur une surface recouverte d’un substrat. Dans ces conditions, la théorie prédit que les cellules n’oscillent plus, mais conservent leur tendance à explorer l’espace plan autour de leur position initiale. Ainsi, le domaine parcouru par les cellules croît lentement dans le temps mais ne comporte aucun lieu inexploré (à quelque distance qu’elles s’éloignent de leur position initiale, elles ont visité toutes les positions possibles), tandis qu’en l’absence d’auto-attraction, une cellule étendrait rapidement son domaine d’exploration, mais y laisserait un nombre considérable de « trous » inexplorés, et autant de possibilités de manquer des cibles pourtant proches. Notre analyse des trajectoires de cellules libres de se déplacer en deux dimensions, sur un substrat « témoin » ou sur un substrat « conditionné », a confirmé les lois d’échelle prédites par le modèle. |
Nos expériences ont donc permis de montrer que les cellules vivantes, loin de se déplacer dans un environnement constant et uniforme, sont capables de le modifier simultanément à leur mouvement, par un effet d’auto-attraction, ou stigmergie, qui n’est pas sans rappeler le comportement des fourmis formant des rails de phéromones sur leur passage.
In vivo
, on peut supposer que les cellules utilisent cet effet, soit individuellement pour mieux explorer leur environnement, soit collectivement pour définir des trajets préférentiels de migration, voire assurer la cohésion de déplacements cellulaires collectifs [
7
].
Il convient de noter que malgré le nombre des travaux qui ont analysé en détail les trajectoires de cellules en deux voire en trois dimensions,
in vivo
comme
in vitro
, cette rétroaction était passée inaperçue jusqu’à présent. En effet, alors qu’elle est facilement identifiable en cas de déplacement unidimensionnel (sur des rails), ses conséquences sur la trajectoire, quoique importantes, sont plus difficiles à mettre en évidence dans le cas d’un déplacement en deux dimensions (sur une surface), si ce n’est par une comparaison fine avec un comportement théorique issu d’une modélisation. Les approches expérimentales associées à la modélisation, fondées sur un dialogue entre physiciens et biologistes, expérimentateurs et théoriciens, restent donc porteuses de l’espoir d’importantes découvertes en biologie cellulaire.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Friedl
P
,
Gilmour
D
.
Collective cell migration in morphogenesis, regeneration and cancer.
.
Nat Rev Mol Cell Biol.
2009;
;
10
:
:445.
–
457
.
2.
Trepat
X
,
Chen
Z
,
Jacobson
K
.
Compr Physiol.
2012;
;
2
:
:2369.
–
2392
.
3.
d’Alessandro
J
,
Solon
A
,
Hayakawa
Y
, et al.
Contact enhancement of locomotion in spreading cell colonies.
.
Nat Phys.
2017;
;
13
:
:999.
–
1006
.
4.
Bruckner
DB
,
Fink
A
,
Schreiber
C
,
et al.
Stochastic non-linear migration of confined cell migration in two-states systems.
.
Nat Phys.
2019;
;
15
:
:595.
–
601
.
5.
Maiuri
P
,
Terriac
E
,
Paul-Gilloteaux
P
,
et al.
The first world cell race.
.
Curr Biol.
2012;
;
22
:
:R674.
.
6.
d’Alessandro
J
,
Barbier-Chebbah
A
,
Cellerin
V
,
et al.
Cell migration guided by long-lived spatial memory.
.
Nat Commun.
2021;
;
12
:
:4118.
.
7.
Ladoux
B
,
Mège
RM
.
Mechanobiology of collective cell behaviours.
.
Nat Rev Mol Cell Biol.
2017;
;
18
:
:743.
–
757
.
|