| |
| Med Sci (Paris). 38(10): 786–794. doi: 10.1051/medsci/2022104.Astrocytes réactifs et maladies cérébrales Biomarqueurs et cibles thérapeutiques Yiannis Poulot-Becq-Giraudon,* Maria-Angeles Carrillo-de Sauvage,* and Carole Escartin** Université Paris-Saclay, CEA, CNRS, MIRCen, Laboratoire des maladies neurodégénératives
,
Fontenay-aux-Roses
,
France |
Vignette (© O. Guillemaud et A.C. Boulay).
Dès les premières études réalisées à la fin du
xix
e
et au début du
xx
e
siècle comparant sujets sains et sujets malades, il est apparu que les neurones n’étaient pas seuls dans le cerveau et que d’autres cellules (collectivement appelées cellules gliales) et plus particulièrement les astrocytes, changeaient d’apparence en conditions pathologiques
(
Figure 1
)
. Ces observations suggéraient que les maladies du cerveau pouvaient aussi affecter les partenaires des neurones et que les astrocytes dits « réactifs » pouvaient aussi influencer l’évolution des maladies, de façon bénéfique ou délétère.
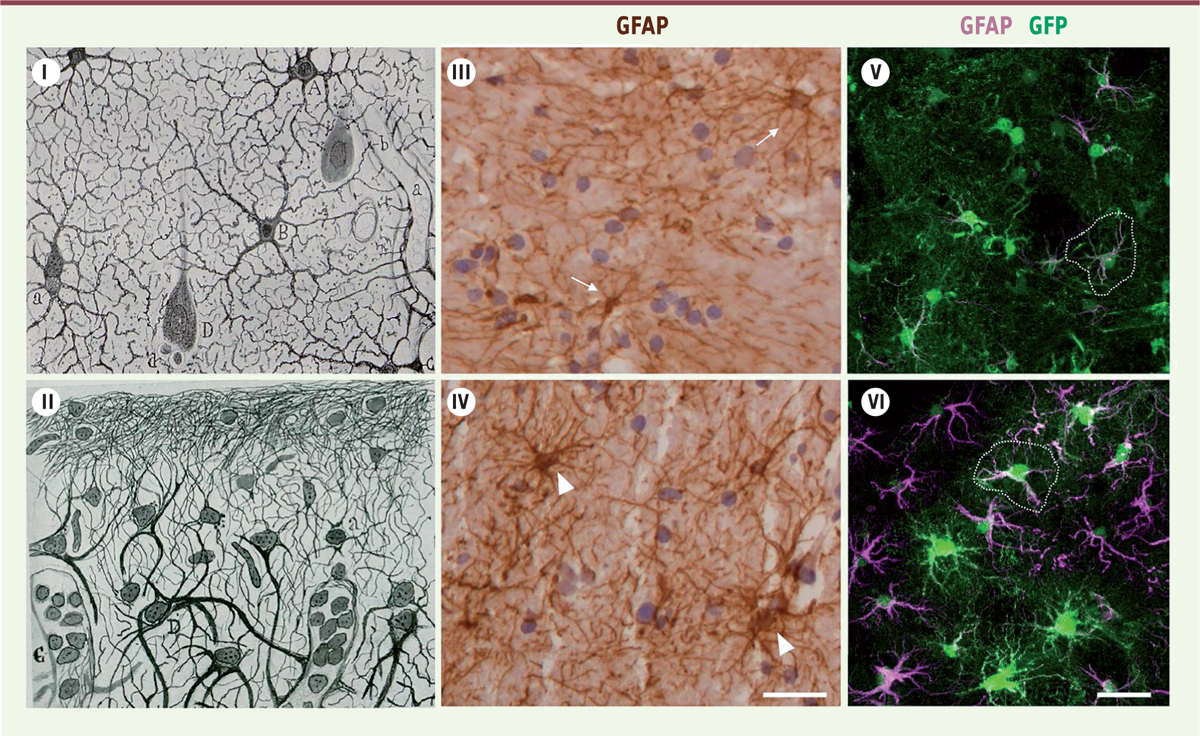
 | Figure 1.
Les astrocytes réactifs sous le microscope, du début du
xxe
siècle jusqu’à nos jours. I.
Dessin de S. Ramon y Cajal représentant des astrocytes (
A, B
) de la substance grise du cortex cérébral d’un sujet sain adulte, après coloration par la méthode au chlorure d’or. Un capillaire sanguin (
a
) est représenté, contacté par des pieds astrocytaires (
C, b
), ainsi qu’un neurone pyramidal (
D
) [
56
].
II.
Dessin de S. Ramon y Cajal représentant des astrocytes réactifs hypertrophiques (
D
) dans la substance grise du cortex cérébral d’un patient adulte souffrant de paralysie générale. L’accumulation de matériel fibreux appelé
fibres de Weigert,
correspondant à l’accumulation de protéines du cytosquelette, est aussi représentée (haut du dessin). Un capillaire sanguin (
C
) est visible [
57
].
III et IV.
Astrocytes dans le putamen d’un individu sain (
III
) et d’un individu atteint de la maladie de Huntington (
IV
), après immunomarquage de la GFAP (en brun) et contre-coloration des noyaux cellulaires par l’hématoxyline (en mauve). Les astrocytes réactifs (têtes de flèche,
IV
) apparaissent plus gros et plus ramifiés que les astrocytes contrôles (flèches,
III
) [
24
]. Échantillons cérébraux obtenus auprès de la Netherlands Brain Bank, Netherlands Institute for Neuroscience, Amsterdam.
V et VI.
Marquage en immunofluorescence de la GFAP (magenta), sur des coupes de cerveaux de souris modèles de la maladie de Huntington après infection par un lentivirus astrocyte-spécifique codant la GFP (
green fluorescent protein
) (
V
) ou un mélange de ce même virus avec un deuxième lentivirus astrocyte-spécifique codant une forme constitutivement active de JAK2. A ce stade précoce de la maladie, les astrocytes expriment très faiblement la GFAP (
V
), JAK2 rend les astrocytes réactifs et induit fortement leur expression de GFAP (
VI
) [
24
]. La GFP présente dans le cytoplasme des astrocytes permet de révéler leur morphologie finement ramifiée. Les astrocytes réactifs ont un corps cellulaire hypertrophique, mais leur domaine n’est pas fortement augmenté (délimité avec des pointillés blancs). L’analyse de la morphologie des astrocytes en marquant la GFAP de leur cytosquelette avec un anticorps, tend à surestimer les changements morphologiques. Notez que chaque astrocyte couvre un domaine tridimensionnel ou territoire unique qui ne chevauche quasiment pas ceux des astrocytes voisins (barres d’échelle 20 µm).
|
Après un siècle de relatif désintérêt pour les astrocytes, il y a un renouveau de la recherche sur ces cellules dans de nombreuses situations pathologiques affectant le système nerveux central (SNC), allant des infections aux trauma en passant par l’épilepsie, les tumeurs cérébrales et les maladies neurodégénératives. Un nombre grandissant d’équipes de recherche étudient désormais ces cellules, en tirant profit d’une palette variée d’outils performants
(
Figure 2
)
[
1
,
2
] (
→
).
(→) Voir la Synthèse de A.L. Hemonnot-Girard
et al., m/s
n° 1, janvier 2021, page 59
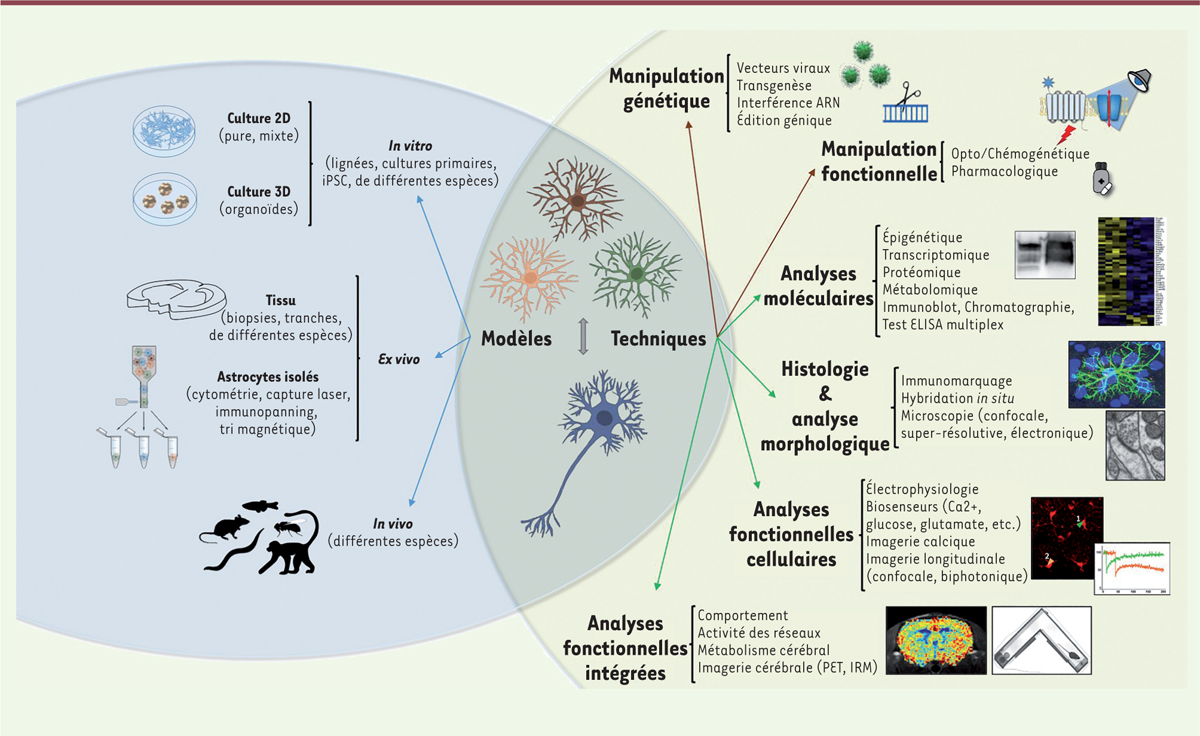
 | Figure 2.
Comment étudier les astrocytes réactifs et leurs interactions avec les neurones ? Sphère bleue, à gauche
: Les astrocytes réactifs peuvent être étudiés dans différents modèles expérimentaux
in vitro, ex vivo
et
in vivo
.
Sphère verte, à droite, flèches marrons
: les astrocytes peuvent être manipulés par des approches génétiques qui offrent une sélectivité cellulaire et temporelle, et par des approches pharmacologiques, qui ont souvent une sélectivité cellulaire réduite.
Flèches vertes.
: l’impact de ces manipulations peut être évalué à de multiples niveaux, de la molécule jusqu’au comportement de l’individu, à l’aide d’une large palette de techniques qui ne cessent de s’améliorer.
|
Une enquête récemment réalisée auprès de chercheurs spécialistes révèle néanmoins une vision parfois divergente de la réactivité astrocytaire et l’utilisation ambiguë de termes pour définir celle-ci [
3
]. C’est dans ce contexte qu’un article de consensus, publié en 2021, a été rédigé par plus de 80 chercheurs issus de 22 pays [
4
]. Les objectifs de cet article collectif étaient de s’accorder sur la nomenclature
(Encadré 1)
, sur les critères utilisés pour caractériser les astrocytes réactifs et clarifier certaines idées erronées
(Encadré 2)
, ainsi que de définir de futurs axes de recherche pour mieux comprendre ces cellules fascinantes.
Les astrocytes réactifs sont en effet davantage que des témoins passifs et insignifiants de maladies affectant les neurones. Ils peuvent être des cibles thérapeutiques alternatives pour des maladies incurables et être utilisés comme biomarqueurs. |
Les astrocytes : des partenaires indispensables aux neurones
Dans le SNC, les astrocytes sont des partenaires essentiels des neurones avec lesquels ils sont en étroite interaction. Ces cellules assurent en effet de nombreuses fonctions indispensables aux neurones, comme le recyclage des neurotransmetteurs, l’homéostasie ionique, la détoxification des espèces réactives de l’oxygène, ou l’apport métabolique [
5
]. Les astrocytes forment un réseau de cellules connectées par des jonctions communicantes, où chacun couvre un domaine tridimensionnel unique qui ne chevauche quasiment pas ceux des astrocytes voisins
(
Figure 1
)
. Leurs nombreuses ramifications leur permettent d’établir directement des contacts avec les synapses et avec la vascularisation cérébrale. Ces zones de contacts, appelées respectivement « prolongement astrocytaire périsynaptique » [
6
] et « prolongement périvasculaire » ou « pied astrocytaire » [
7
], sont des domaines fonctionnels, grâce auxquels les astrocytes régulent activement l’activité synaptique et les réponses vasculaires [
8
,
9
]. Ils influencent ainsi le fonctionnement cérébral et le comportement de l’individu.
|
Les astrocytes en conditions pathologiques Qu’est-ce qu’un astrocyte réactif ?
En conditions pathologiques, les astrocytes deviennent réactifs en subissant des modifications morphologiques, moléculaires, biochimiques et fonctionnelles. Ces changements ont été observés pour la première fois il y a plus de cent ans dans le cerveau de patients souffrant d’épilepsie ou d’infection : les astrocytes présentaient en effet une morphologie anormale (hypertrophiée, polarisée), ainsi qu’une accumulation de matériel fibreux
(
Figure 1
)
[
3
]. Dans le cas de lésions focales du parenchyme cérébral (lésion de la moelle épinière ou accident vasculaire cérébral), les astrocytes peuvent même former une « cicatrice gliale » : ils perdent leur forme ramifiée et s’allongent le long de la lésion, ce qui permet de démarquer la zone saine du parenchyme lésé et, notamment, de limiter l’infiltration de cellules immunitaires dans le SNC [
10
].
Une étape importante dans l’étude des astrocytes réactifs a été l’identification de la forte augmentation des protéines constitutives du cytosquelette astrocytaire dans de nombreuses conditions pathologiques [
11
]. En particulier, la GFAP (
glial fibrillary acidic protein
) constitue un marqueur quasi-universel de la réactivité astrocytaire et permet de détecter les prolongements principaux des astrocytes et leur structure étoilée
(
Figure 1
)
. Ce marqueur n’est cependant pas parfait et ne constitue pas la preuve unique des changements réactifs des astrocytes (voir plus loin).
Les protéines du cytosquelette ne sont en effet pas les seules protéines dont l’expression est augmentée dans les astrocytes réactifs. Les analyses transcriptomiques (puce à ADN puis séquençage d’ARN, ou RNAseq) appliquées à des astrocytes préalablement isolés du SNC
(
Figure 2
)
ont permis de révéler l’étendue des changements transcriptionnels se produisant dans les astrocytes en conditions pathologiques [
12
]. Dans des modèles de maladies cérébrales établis dans différentes espèces, mais aussi chez les patients, des centaines de gènes sont en effet induits ou réprimés dans les astrocytes de différentes régions cérébrales, à différents stades de la maladie. Ces changements majeurs de répertoire moléculaire, qui commencent à peine à être dévoilés, s’accompagnent de changements fonctionnels qui peuvent toucher les nombreuses fonctions des astrocytes.
Les astrocytes réactifs sont donc des astrocytes présentant des modifications à plusieurs niveaux en réponse à un environnement ou un stimulus pathologique, qui peuvent affecter ensuite les différentes cellules du SNC [
3
].
Comment les astrocytes deviennent-ils réactifs ?
Tout stimulus pathologique lié à un changement physiologique est susceptible d’être détecté par les astrocytes et d’induire une réponse de réactivité. Il peut s’agir de mort neuronale, de stress oxydant, de lésion des axones, d’ischémie, d’hyperactivité neuronale, de stimulus mécaniques ou de la présence de « corps étrangers » (acide nucléique, molécules issues de la circulation sanguine, agrégats protéiques, virus, bactéries, etc.). Tous ces événements sont à l’origine de signaux moléculaires qui seront détectés par une large palette de récepteurs membranaires et intracellulaires exprimés par les astrocytes, activant des cascades de signalisation comme, par exemple, les voies JAK (
Janus kinases
)/STAT (
signal transducers and activators of transcription
) ou NF-kB (
nuclear factor-kappa B
), qui contrôlent l’expression de transcrits à l’origine de changements morphologiques et fonctionnels spécifiques [
4
,
13
].
|
1 Quels mots utiliser ?
Il existe beaucoup de termes, utilisés de façon non systématique, pour qualifier les différentes réponses astrocytaires lors d’événements pathologiques dans le SNC. Parmi ceux-ci, on trouve (en anglais/français) «
astrocytosis
/astrocytose », «
astrogliosis
/astrogliose », «
reactive gliosis
/gliose réactionnelle », «
astrocyte reactivity
/réactivité astrocytaire » ou «
astrocyte activation
/activation astrocytaire ». Il est maintenant recommandé d’utiliser « astrocytes réactifs » pour les cellules et « astrogliose réactionnelle » ou « réactivité astrocytaire » (
reactive astrocytes/reactive astrogliosis/astrocyte reactivity
) pour le processus. Le terme « d’activation » doit être réservé aux conditions physiologiques (par exemple, l’activation par une libération physiologique de neurotransmetteurs qui induit une signalisation calcique normale dans les astrocytes, une plasticité morphologique mineure, de courte durée en réponse à un stimulus physiologique). Les notions de changements majeurs, affectant différents aspects de l’astrocyte (morphologie, répertoire moléculaire, fonctions) de façon durable tant que le stimulus pathologique est présent, sont cruciales. Les « astrocytes malades » (
diseased astrocytes
) sont des astrocytes qui expriment de façon intrinsèque une protéine mutée responsable de la maladie (
huntingtine
dans la maladie de Huntington,
GFAP
dans la maladie d’Alexander, par exemple). Ces astrocytes présentent une perte de fonction ou des dysfonctions primaires. Au cours de la maladie et en réponse à d’autres stimulus pathologiques, ils peuvent ensuite devenir réactifs (c’est-à-dire induire des programmes transcriptionnels de réactivité et des changements morphologiques et fonctionnels spécifiques).
Cette terminologie simplifiée a pour but d’améliorer la compréhension entre scientifiques [
4
].
|
Comment identifier et caractériser les astrocytes réactifs ? Changements morphologiques et augmentation de GFAP
L’augmentation de la quantité de GFAP dans les astrocytes reste l’indicateur de réactivité le plus couramment utilisé. Cet indicateur très sensible, qui permet de visualiser le cytosquelette des astrocytes in situ, est détecté dans des situations pathologiques variées. Cependant, il est important de rappeler que les concentrations de GFAP sont variables d’une région cérébrale à l’autre. De plus, l’expression de la GFAP n’est pas uniquement régulée par des stimulus pathologiques mais aussi par des facteurs physiologiques (les hormones, les rythmes circadiens). Dans certains cas, il est possible de ne pas observer d’augmentation de la GFAP alors que d’autres indicateurs de réactivité sont détectés ou que la situation est clairement pathologique (par exemple dans le cas de microtraumatismes répétés [
14
]). La GFAP peut en effet être clivée et elle n’est alors plus reconnue par les anticorps utilisés pour la détecter.
Le marquage du cytosquelette par des anticorps anti-GFAP tend à surestimer l’hypertrophie des astrocytes, qui présentent un cytosquelette « épaissi », mais aussi une réorganisation subtile de leurs fines terminaisons dépourvues de GFAP, terminaisons qui sont rarement étudiées [
15
]. L’expression de protéines fluorescentes ou l’infusion de molécules fluorescentes dans les astrocytes
(
Figure 1
)
permettent en revanche de visualiser l’intégralité de la morphologie astrocytaire, y compris ces fines terminaisons. Ces approches montrent par ailleurs qu’en dehors de cas extrêmes (cicatrice gliale), les astrocytes réactifs conservent leur domaine tridimensionnel (ou territoire). Ils peuvent également présenter des changements de ramifications, des polarisations vers un site focal de lésion, sans hypertrophie massive
(
Figure 1
)
[
16
].
L’augmentation de la quantité d’ARN messagers (ARNm) spécifiques de la GFAP, ou de la protéine elle-même, et les changements morphologiques des cellules sont de très bons indicateurs de réactivité astrocytaire. Ils nécessitent cependant d’être associés à d’autres marqueurs moléculaires ou complétés par des analyses fonctionnelles qui permettent conjointement d’établir la carte d’identité des astrocytes analysés [
4
].
Marqueurs moléculaires associés aux astrocytes réactifs
Au-delà de l’induction de protéines du cytosquelette, de nombreuses modifications moléculaires témoignent de changements réactifs dans les astrocytes. Ces changements peuvent être détectés au niveau des ARNm et/ou des protéines, mais aussi de modifications post-traductionnelles, telles que des phosphorylations, notamment de certains facteurs de transcription, comme STAT3 [
17
]. Parmi les protéines astrocytaires modifiées dans différentes situations pathologiques, on note les transporteurs de neurotransmetteurs, qui sont indispensables à une transmission synaptique rapide et précise, des cytokines et des chimiokines, qui assurent la communication avec les autres cellules du cerveau et les cellules immunitaires périphériques [
18
], des molécules du système du complément, qui permettent l’opsonisation et l’élimination de certaines cellules ou synapses [
19
] et, enfin, des protéines chaperonnes qui préviennent l’agrégation de protéines toxiques (voir [
4
] pour plus de détails).
|
2 Quelques idées erronées
-
Les astrocytes ne prolifèrent pas massivement
comme peut le laisser entendre le suffixe –ose dans « astrogliose » [
4
,
50
]. Seule une sous-population d’astrocytes réactifs prolifère, ceux qui ont leur corps cellulaire en contact avec les vaisseaux, ou ceux qui entrent en contact avec des molécules d’origine périphérique, dans des lésions cérébrales ouvertes par exemple [
4
].
-
Les astrocytes ne migrent pas
dans le cerveau pathologique adulte. Les astrocytes se déplacent au cours du développement cérébral et en culture, mais, dans le cerveau adulte, ils conservent leur position au sein de leur domaine tridimensionnel. Une exception est la formation de la cicatrice gliale au cours de laquelle les astrocytes se réorganisent, perdent leur domaine, et prolifèrent localement.
-
Les astrocytes ne peuvent pas être classés en deux catégories binaires immuables.
Une étude de 2017 a proposé la classification des astrocytes réactifs en type A1 et A2 [
26
], en analogie avec la classification M1/M2 des macrophages et des cellules microgliales, pourtant déjà critiquée [
51
]. Les astrocytes réactifs de « type A1 » étaient observés dans le cerveau de souris injectées avec du lipopolysaccharide, une molécule bactérienne mimant un choc septique, alors que les astrocytes réactifs de « type A2 » étaient observés en condition d’ischémie chez la souris [
12
].
In vitro
, l’exposition d’astrocytes de rongeurs isolés [
26
] ou d’astrocytes humains dérivés d’iPSC [
52
] à un cocktail de cytokines permettait de reproduire un profil moléculaire de type A1 et montrait que ces cellules étaient défectueuses pour plusieurs fonctions homéostatiques et devenaient même neurotoxiques. Cette classification binaire a été perçue par de nombreux chercheurs comme applicable aux astrocytes réactifs quelle que soit la maladie du SNC. Pourtant, cette classification, qui repose sur une signature d’une dizaine de gènes dont les critères de sélection ne sont pas connus, n’est pas confirmée par de nombreuses études transcriptomiques d’astrocytes dans des modèles animaux de différentes maladies cérébrales et chez les patients, où les astrocytes ne se polarisent pas selon ces deux catégories [
4
,
29
,
31
,
32
]. Il est maintenant admis que les astrocytes réactifs peuvent adopter une multitude de profils moléculaires et de changements fonctionnels, bien au-delà de ces deux classes
(
Figure 3
)
. Il est donc recommandé d’abandonner ce concept réducteur d’astrocytes réactifs A1/A2 [
4
].
-
L’expression de quelques transcrits ne permet pas d’inférer un effet bénéfique ou délétère des astrocytes réactifs dans une maladie.
La généralisation des méthodes dites « -omiques » conduit les chercheurs à parfois émettre des hypothèses fortes sur le rôle fonctionnel des astrocytes uniquement sur la base de l’expression de leurs transcrits. Il est important de se rappeler que de nombreuses étapes posttranscriptionnelles (traduction, modifications post-traductionnelles, localisation, stabilité, interactions avec différents régulateurs) conditionnent
in fine
l’activité de chaque protéine et sa/ses fonctions associées. Il est donc indispensable d’évaluer les fonctions supposées remplies par les transcrits différentiellement exprimés dans les astrocytes réactifs, par des méthodes dédiées, et d’évaluer leur impact global dans un contexte pathologique précis. Par exemple, il est important d’évaluer si l’homéostasie du potassium est perturbée lorsque l’abondance du transporteur Kir4.1 est réduite, ce qui n’est pas systématique [
53
,
54
]. De même, la seule présence d’ARNm codant le composant C3 du complément n’est pas toujours associée à un effet neurotoxique [
55
], alors que ce facteur a été proposé comme marqueur des astrocytes réactifs « de type A1 ».
|
Ces altérations moléculaires variées peuvent avoir des conséquences fonctionnelles multiples qui nécessitent d’être également évaluées précisément pour comprendre le rôle des astrocytes réactifs dans un contexte pathologique particulier
(
Figure 2
)
.
Changements fonctionnels dans les astrocytes réactifs
Chaque fonction des astrocytes est susceptible d’être modifiée lorsqu’ils deviennent réactifs [
20
]. Par exemple, dans les modèles murins de la maladie d’Alzheimer, les astrocytes réactifs présentent des altérations majeures de leur signalisation calcique [
21
], le principal mode de communication des astrocytes [
22
] (
→
).
(→) Voir la Nouvelle de M. Arizono
et al., m/s
n° 2, février 2021, page 127
Un autre changement, observé de façon répétée dans différents modèles de maladies (sclérose latérale amyotrophique, maladie de Huntington, mais aussi microtraumatismes), est la baisse des niveaux d’expression des transporteurs du glutamate, associée à une altération de la recapture de ce neurotransmetteur, ce qui a des conséquences délétères sur la transmission synaptique et peut conduire à la mort des neurones suractivés par le glutamate [
23
].
Les astrocytes réactifs ne présentent pas uniquement des altérations de leurs fonctions habituelles. Ils peuvent également acquérir des fonctions bénéfiques, comme, par exemple, la capacité à éliminer des protéines toxiques dans la maladie de Huntington [
24
] ou celle de limiter l’infiltration de cellules immunitaires, en formant une cicatrice gliale après une lésion mécanique [
10
]. À l’inverse, l’exposition des astrocytes à certains stimulus pathologiques peut induire l’acquisition de fonctions délétères, comme la libération de molécules neurotoxiques [
25
,
26
]
(Encadré 2)
.
Les astrocytes réactifs ont des réponses spécifiques et des effets sur la maladie dépendants du contexte
En conditions physiologiques, les astrocytes présentent une hétérogénéité morphologique, moléculaire et fonctionnelle selon les régions et les circuits cérébraux dans lesquels sont impliqués les neurones avec lesquels ils interagissent
(
Figure 3
)
[
27
]. L’âge, le sexe, l’espèce sont également des sources de variations du profil des astrocytes. Ainsi, en fonction de la pathologie cérébrale, de sa région de déclenchement, du type d’anomalie impliquée, mais aussi de son stade, et des caractéristiques propres du sujet concerné, les astrocytes développent une réponse spécifique qui se traduit par des effets sur les neurones voisins, qui pourront être globalement bénéfiques, délétères ou même neutres
(
Figure 3
)
. Ainsi, des astrocytes rendus réactifs par l’activation de STAT3 ont des effets bénéfiques dans des modèles de la maladie de Huntington [
24
] ou à la suite d’une lésion de la moelle épinière [
28
]. Au contraire, ils ont des effets délétères dans des modèles de la maladie d’Alzheimer [
29
,
30
].
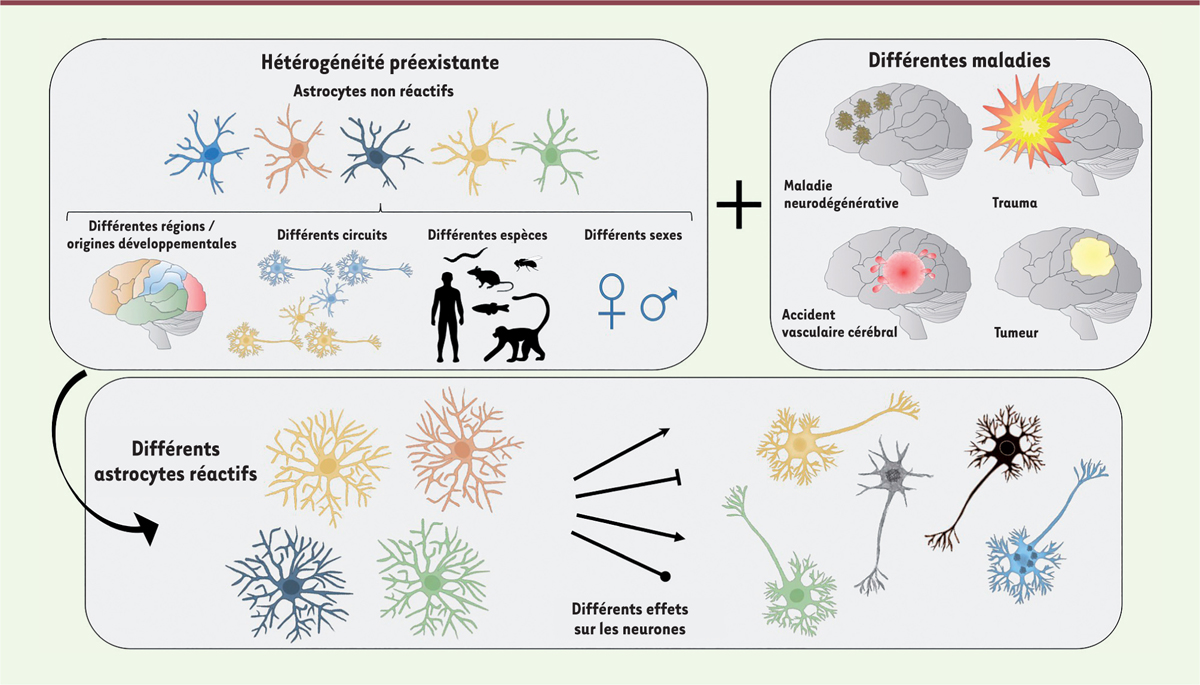
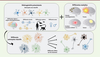 | Figure 3.
Les astrocytes réactifs sont hétérogènes et impactent les neurones de façon variée.
Les astrocytes présentent des différences morphologiques, moléculaires et fonctionnelles selon leur région cérébrale d’appartenance, les circuits neuronaux dans lesquels ils sont impliqués, l’espèce, le sexe, etc. À cette hétérogénéité préexistante s’ajoute le contexte pathologique propre à chaque maladie (type de stimulus pathologique, de dysfonction neuronale, etc.). Ainsi, chaque astrocyte met en place une réponse spécifique à cette situation pathologique et a des effets variables sur les neurones environnants.
|
Ces observations soulignent la complexité de la réactivité astrocytaire. Il est donc problématique de généraliser les observations réalisées pour une maladie à une autre, ou même d’un modèle à l’autre, d’autant qu’un modèle expérimental ne reproduit que certains aspects de chaque maladie. C’est pourquoi il est indispensable de bien caractériser les astrocytes réactifs dans chaque situation pathologique et de préciser les conditions expérimentales (le stade de la maladie, l’espèce, la région cérébrale, le sexe, les marqueurs utilisés pour identifier les astrocytes réactifs). Différentes sources d’hétérogénéité peuvent être étudiées et intégrées dans des analyses multimodales comparatives pour établir les différentes « cartes d’identité » des astrocytes sains et réactifs en fonction des conditions. |
De nouvelles approches au service des astrocytes réactifs
Des techniques performantes sont maintenant disponibles pour disséquer finement les changements morphologiques et moléculaires qui se produisent dans les astrocytes réactifs en conditions pathologiques, et pour étudier leurs conséquences fonctionnelles dans des systèmes expérimentaux pertinents (
Figure 2
)
[
1
,
2
].
Les approches génétiques
Les analyses transcriptomiques permettent d’établir les changements transcriptionnels ou épigénétiques caractéristiques des astrocytes réactifs, au niveau du génome entier, dans une situation pathologique donnée, en particulier dans le cerveau de patients [
31
–
33
]. Ces approches peuvent être utilisées au niveau de la cellule ou du noyau unique. Elles montrent que l’hétérogénéité moléculaire observée entre astrocytes concerne également les astrocytes réactifs [
20
]. Les approches génétiques permettent non seulement d’établir le profil moléculaire des astrocytes réactifs mais aussi de les manipuler expérimentalement. Par transgenèse ou transfert de gènes par des vecteurs viraux sélectifs des astrocytes, il est ainsi possible d’invalider ou de surexprimer des gènes candidats pour en déterminer leur rôle
(
Figure 1V
, 1VI)
[
4
]. Il est aussi possible d’exprimer des récepteurs modifiés qui permettent la stimulation des courants ioniques, après activation optogénétique, ou l’induction de signaux calciques par manipulation chémogénétique à l’aide d’un ligand synthétique exogène
(
Figure 2
)
[
1
,
2
].
Des évaluations fonctionnelles plus précises
L’arsenal des méthodes d’exploration fonctionnelle des astrocytes s’est fortement développé, avec le souci de prendre en compte les spécificités de ces cellules : propriétés électrophysiologiques distinctes des neurones, importance de la signalisation calcique, morphologie complexe associée à des sous-domaines fonctionnels. Il est maintenant possible d’utiliser des biosenseurs pour mesurer les signaux calciques, les courants ioniques ou la quantité de certains métabolites, avec une excellente résolution spatiale, et au cours du temps
(
Figure 2
)
. Ces analyses peuvent être réalisées
in vitro
sur différents types de cultures d’astrocytes, mais aussi
ex vivo
, sur des coupes de cerveaux d’organismes modèles ou sur des biopsies de patients, ou encore avec des animaux modèles anesthésiés ou vigiles, grâce à des techniques d’imagerie
in situ
qui ne cessent de progresser
(
Figure 2
)
. Ces observations fonctionnelles peuvent être couplées à des analyses en temps réel du comportement de l’animal modèle, par exemple le poisson zèbre [
34
] ou la souris [
35
], ce qui permet de montrer l’importance des astrocytes dans le contrôle de comportements complexes, qui sont parfois altérés dans les maladies du SNC [
36
]. Ces méthodes d’imagerie fonctionnelle ont ainsi permis de mettre en évidence un excès de libération de calcium mitochondrial astrocytaire dans un modèle de sclérose latérale amyotrophique [
37
].
Des nouveaux modèles d’étude
Les cultures primaires d’astrocytes ont permis de faire de nombreuses découvertes, en particulier leur signalisation calcique [
38
]. Cependant, il est important de noter qu’en l’absence de neurones (ou de signaux qui peuvent compenser leur absence), les astrocytes cultivés ont un phénotype différent de celui des astrocytes
in situ
, et qu’ils peuvent être dans un état réactif [
12
,
39
]. L’accès aux astrocytes humains dérivés de cellules souches pluripotentes induites humaines (hiPSC) a ouvert un nouveau champ de recherche. Différents protocoles, qui ne cessent d’être raffinés ou simplifiés, permettent de différencier les iPSC en astrocytes (alors appelés iAstrocytes) [
40
]. Les iAstrocytes issus d’iPSC provenant de patients présentent souvent des altérations morphologiques et moléculaires. Ils présentent également des altérations fonctionnelles : par exemple, des changements du métabolisme lipidique dans les iAstrocytes porteurs de l’allèle 4 du gène
APOE
codant l’apolipoprotéine E (
APOE4
), un facteur de risque majeur pour la maladie d’Alzheimer [
41
], ou une réduction de la sécrétion de molécules neurotrophiques dans des iAstrocytes dérivés de patients atteints de sclérose latérale amyotrophique [
42
], ou encore une altération de l’autophagie dans des iAstrocytes dérivés de patients atteints de la maladie de Parkinson [
43
], autant de pistes pour comprendre l’étiologie de ces maladies [
40
,
44
]. Des cultures en deux dimensions, des organoïdes ou des assembloïdes, qui intègrent différents types cellulaires et présentent une activité neuronale, peuvent également être générés
(
Figure 2
)
. Néanmoins, ces modèles d’études prometteurs posent des questions éthiques et une meilleure caractérisation reste nécessaire pour les exploiter comme modèles d’astrocytes humains [
44
,
45
] (
→
).
(→) Voir l’Éditorial de H. Chneiweiss,
m/s
n° 2, février 2020, page 100
|
Les astrocytes réactifs en clinique De nouvelles stratégies thérapeutiques ciblant les astrocytes réactifs
L’étude des astrocytes réactifs peut apporter de nouvelles solutions thérapeutiques pour de nombreuses maladies cérébrales. Comme les astrocytes peuvent avoir des répercussions négatives, positives ou neutres sur différents aspects pathologiques
(
Figure 3
)
, il est nécessaire de caractériser les phénotypes que ces cellules adoptent et leur impact dans chaque contexte pathologique. Il s’agit de comprendre ce qui rend un astrocyte réactif délétère ou même toxique dans une situation pathologique donnée, et les mécanismes qui contrôlent cet état, pour pouvoir les cibler à des fins thérapeutiques. La stratégie peut, au contraire, être de promouvoir une forme bénéfique d’astrocytes réactifs, en activant les voies de signalisation qui la contrôlent.
Les analyses bio-informatiques et statistiques avancées sont nécessaires pour identifier des «
master-régulateurs
»
1,
de voies de signalisation ou épigénétiques qui régulent certains phénotypes astrocytaires d’intérêt, mais aussi pour établir des signatures moléculaires à valeur diagnostique ou prédictive [
4
]. Ces approches computationnelles fondées sur l’intelligence artificielle ou la biologie des systèmes deviennent indispensables pour intégrer la masse de données multiparamétriques disponibles ou générées au cours des expériences [
46
,
47
] (
→
).
(→) Voir le Repère de J. Haiech,
m/s
n° 10, octobre 2020, page 919
L’objectif est d’exploiter de façon approfondie ces données riches et précieuses, car acquises à partir des patients. La validation sur des échantillons humains est en effet une étape cruciale dans la mise en place d’une stratégie thérapeutique visant les astrocytes. « Humaniser » la recherche
Même si de nombreuses caractéristiques astrocytaires sont conservées entre les rongeurs et l’homme, des comparaisons morphologiques, transcriptomiques et fonctionnelles ont mis en évidence des différences significatives entre les astrocytes de différentes espèces [
48
]. Les iAstrocytes permettent d’explorer, dans un environnement contrôlé et facilement manipulable, des hypothèses fonctionnelles ou de caractériser des déficits dans les cellules issues de patients.
Une alternative à l’utilisation de ces cellules consiste en l’obtention de tissus de patients sous forme de biopsies réalisées lors de chirurgie cérébrale (résection de foyers épileptiques ou de tumeurs), ou de tissus fixés ou congelés prélevés chez des patients décédés. Dans ce cas, l’observation de processus pathologiques reste cependant limitée, et l’analyse des phases précoces n’est possible que dans les cas de patients atteints de maladies génétiques diagnostiquées
(
Figure 1
)
.
L’accès à de nouveaux modèles de cellules humaines et à des échantillons de patients bien caractérisés permettra de valider les résultats les plus prometteurs sur des astrocytes humains, et de confirmer leur intérêt thérapeutique clinique. Les astrocytes réactifs comme biomarqueurs
Un biomarqueur est un paramètre biologique mesurable qui peut prédire ou influencer l’incidence ou l’évolution d’une maladie. Dans le cas des maladies cérébrales, la présence de ces biomarqueurs peut être déterminée en clinique à partir de prélèvements de liquides biologiques (sang, liquide céphalo-rachidien). Ils peuvent également être identifiés
in situ
par des techniques d’imagerie cérébrale (imagerie par résonance magnétique, tomographie par émission de positons)
(
Figure 2
)
[
2
].
Les astrocytes réactifs sont finalement eux-mêmes des biomarqueurs puisque leur état réactif est un indicateur d’un processus pathologique. La présence des protéines astrocytaires YKL40 (ou
chitinase 3-like 1
) et GFAP (ou ses fragments) peut être détectée dans le liquide céphalo-rachidien ou le plasma de patients atteints de pathologie amyloïde ou de démence fronto-temporale [
49
]. Mais ces protéines biomarqueurs sont rarement spécifiques d’une maladie ou d’un stade. Les biomarqueurs sont donc toujours interprétés à la lueur d’autres analyses biologiques et cliniques. Un objectif à moyen terme est de développer et raffiner la palette de biomarqueurs astrocytaires en identifiant des biomarqueurs caractéristiques de sous-types d’astrocytes réactifs. Cela permettra sans doute d’établir des diagnostics plus précis et des pronostics d’évolution de la maladie, selon le type d’astrocytes observés.
|
Grâce à la mise en évidence de leurs rôles importants et variés, les astrocytes ont pris une place grandissante dans la recherche en neuropathologie. Ils présentent des modifications nombreuses et spécifiques dans diverses conditions pathologiques et peuvent significativement influencer le décours ou la résolution de certaines maladies. La combinaison de nouvelles approches fonctionnelles sélectives des astrocytes permettra de caractériser ces cellules complexes de manière plus fine et approfondie, en particulier chez les patients. L’enjeu est de développer des thérapies alternatives et d’identifier des biomarqueurs performants pour de nombreuses maladies cérébrales, en tirant profit du partenariat naturel existant entre les astrocytes et les neurones. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions Tom Lakomy et Lucile Ben Haim pour leurs commentaires sur ce manuscrit. Y.P. est financé par un contrat doctoral de l’école doctorale BioSIGNE (université Paris Saclay). La recherche de l’équipe est financée par l’ANR, la fondation France Alzheimer, NeurATRIS, le CEA et le CNRS
.
Nous remercions O. Guillemaud et A.C. Boulay pour l’image de la vignette
.
|
Footnotes |
1.
Hemonnot-Girard
AL
,
Ben Haim
L
,
Escartin
C
,
et al.
De nouvelles techniques pour dévoiler le rôle des cellules gliales du cerveau.
.
Med Sci (Paris).
2021;
;
37
:
:59.
–
67
.
2.
Hirbec
H
,
Déglon
N
,
Foo
LC
,
et al.
Emerging technologies to study glial cells.
.
Glia.
2020;
;
68
:
:1692.
–
728
.
3.
Escartin
C
,
Guillemaud
O
.
Carrillo-de Sauvage MA. Questions and (some) answers on reactive astrocytes.
.
Glia.
2019;
;
67
:
:2221.
–
2247
.
4.
Escartin
C
,
Galea
E
,
Lakatos
A
,
et al.
Reactive astrocyte nomenclature, definitions, and future directions.
.
Nat Neurosci.
2021;
;
24
:
:312.
–
25
.
5.
Verkhratsky
A
,
Nedergaard
M
.
Physiology of Astroglia.
.
Physiol Rev.
2018;
;
98
:
:239.
–
389
.
6.
Ghézali
G
,
Dallérac
G
,
Rouach
N
.
Perisynaptic astroglial processes: dynamic processors of neuronal information.
.
Brain Struct Funct.
2016;
;
221
:
:2427.
–
2442
.
7.
Cohen-Salmon
M
,
Slaoui
L
,
Mazaré
N
,
et al.
Astrocytes in the regulation of cerebrovascular functions.
.
Glia.
2021;
;
69
:
:817.
–
41
.
8.
Semyanov
A
,
Verkhratsky
A
.
Astrocytic processes: from tripartite synapses to the active milieu.
.
Trends Neurosci.
2021;
;
44
:
:781.
–
92
.
9.
Mazare
N
,
Oudart
M
,
Cohen-Salmon
M
.
Local translation in perisynaptic and perivascular astrocytic processes - a means to ensure astrocyte molecular and functional polarity?
J Cell Sci.
2021
;
:134.
.
10.
Adams
KL
,
Gallo
V
.
The diversity and disparity of the glial scar.
.
Nat Neurosci.
2018;
;
21
:
:9.
–
15
.
11.
Hol
EM
,
Pekny
M
.
Glial fibrillary acidic protein (GFAP) and the astrocyte intermediate filament system in diseases of the central nervous system.
.
Curr Opin Cell Biol.
2015;
;
32
:
:121.
–
130
.
12.
Zamanian
JL
,
Xu
L
,
Foo
LC
et al.
Genomic analysis of reactive astrogliosis.
.
J Neurosci.
2012;
;
32
:
:6391.
–
6410
.
13.
Ben Haim
L
,
Carrillo-de Sauvage
MA
,
Ceyzériat
K
,
et al.
Elusive roles for reactive astrocytes in neurodegenerative diseases.
.
Front Cell Neurosci.
2015;
;
9
:
:278.
.
14.
Shandra
O
,
Winemiller
AR
,
Heithoff
BP
et al.
Repetitive Diffuse Mild Traumatic Brain Injury Causes an Atypical Astrocyte Response and Spontaneous Recurrent Seizures.
.
J Neurosci.
2019;
;
39
:
:1944.
–
1963
.
15.
Khakh
BS
,
Deneen
B
.
The Emerging Nature of Astrocyte Diversity.
.
Annu Rev Neurosci.
2019;
;
42
:
:187.
–
207
.
16.
Wilhelmsson
U
,
Bushong
EA
,
Price
DL
et al.
Redefining the concept of reactive astrocytes as cells that remain within their unique domains upon reaction to injury.
.
Proc Natl Acad Sci U S A.
2006;
;
103
:
:17513.
–
17518
.
17.
Ceyzériat
K
,
Abjean
L
,
Carrillo-de Sauvage
MA
et al.
The complex STATes of astrocyte reactivity: How are they controlled by the JAK-STAT3 pathway?
.
Neuroscience.
2016;
;
330
:
:205.
–
218
.
18.
Salvador
AF
,
Lima
KA de
,
Kipnis
J
.
Neuromodulation by the immune system: a focus on cytokines.
.
Nat Rev Immunol.
2021;
;
21
:
:526.
–
41
.
19.
Hammond
TR
,
Marsh
SE
,
Stevens
B
.
Immune Signaling in Neurodegeneration.
.
Immunity.
2019;
;
50
:
:955.
–
974
.
20.
Lee
HG
,
Wheeler
MA
,
Quintana
FJ
.
Function and therapeutic value of astrocytes in neurological diseases.
.
Nat Rev Drug Discov 2022.
2022
;
:1.
–
20
.
21.
Kuchibhotla
K v.
,
Lattarulo
CR
,
Hyman
BT
,
et al.
Synchronous hyperactivity and intercellular calcium waves in astrocytes in Alzheimer mice.
.
Science.
2009;
;
323
:
:1211.
–
5
.
22.
Arizono
M
,
Idziak
A
,
Nägerl
UV
.
Il faut être trois pour danser le tango - Illuminer les signaux Ca2+ des synapses tripartites.
.
Med Sci (Paris).
2021;
;
37
:
:127.
–
9
.
23.
Todd
AC
,
Hardingham
GE
.
The Regulation of Astrocytic Glutamate Transporters in Health and Neurodegenerative Diseases.
.
Int J Mol Sci.
2020;
;
21
:
:1.
–
32
.
24.
Abjean
L
,
Ben Haim
L
,
Riquelme-Perez
M
,
et al.
Reactive astrocytes promote proteostasis in Huntington’s disease through the JAK2-STAT3 pathway.
.
Brain.
2022
.
https://doi.org/10.1093/brain/awac068
.
25.
Colombo
E
,
Cordiglieri
C
,
Melli
G
et al.
Stimulation of the neurotrophin receptor TrkB on astrocytes drives nitric oxide production and neurodegeneration.
.
J Exp Med.
2012;
;
209
:
:521.
–
535
.
26.
Liddelow
SA
,
Guttenplan
KA
,
Clarke
LE
et al.
Neurotoxic reactive astrocytes are induced by activated microglia.
.
Nature.
2017;
;
541
:
:481.
–
487
.
27.
Ben Haim
L
,
Rowitch
DH
.
Functional diversity of astrocytes in neural circuit regulation.
.
Nat Rev Neurosci.
2017;
;
18
:
:31.
–
41
.
28.
Anderson
MA
,
Burda
JE
,
Ren
Y
et al.
Astrocyte scar formation aids central nervous system axon regeneration.
.
Nature.
2016;
;
532
:
:195.
–
200
.
29.
Ceyzériat
K
,
Ben Haim
L
,
Denizot
A
et al.
Modulation of astrocyte reactivity improves functional deficits in mouse models of Alzheimer’s disease.
.
Acta Neuropathol Commun.
2018;
;
6
:
:104.
.
30.
Guillemaud
O
,
Ceyzériat
K
,
Saint-Georges
T
,
et al.
Complex roles for reactive astrocytes in the triple transgenic mouse model of Alzheimer disease.
.
Neurobiol Aging.
2020;
;
90
:
:135.
–
46
.
31.
Mathys
H
,
Davila-Velderrain
J
,
Peng
Z
et al.
Single-cell transcriptomic analysis of Alzheimer’s disease.
.
Nature.
2019;
;
570
:
:332.
–
337
.
32.
Al-Dalahmah
O
,
Sosunov
AA
,
Shaik
A
,
et al.
Single-nucleus RNA-seq identifies Huntington disease astrocyte states.
.
Acta Neuropathol Commun.
2020
;
:8.
.
33.
Hasel
P
,
Rose
IVL
,
Sadick
JS
,
et al.
Neuroinflammatory astrocyte subtypes in the mouse brain.
.
Nat Neurosci.
2021;
;
24
:
:1475.
–
87
.
34.
Mu
Y
,
Bennett
D v.
,
Rubinov
M
,
et al.
Glia Accumulate Evidence that Actions Are Futile and Suppress Unsuccessful Behavior.
.
Cell.
2019;
;
178
:
:27.
–
43.e19
.
35.
Paukert
M
,
Agarwal
A
,
Cha
J
et al.
Norepinephrine controls astroglial responsiveness to local circuit activity.
.
Neuron.
2014;
;
82
:
:1263.
–
1270
.
36.
Ben Haim
L
,
Escartin
C
.
Astrocytes and neuropsychiatric symptoms in neurodegenerative diseases: Exploring the missing links.
.
Curr Opin Neurobiol.
2022;
;
72
:
:63.
–
71
.
37.
Agarwal
A
,
Wu
PH
,
Hughes
EG
et al.
Transient Opening of the Mitochondrial Permeability Transition Pore Induces Microdomain Calcium Transients in Astrocyte Processes.
.
Neuron.
2017;
;
93
:
:587.
–
605.e7
.
38.
Cornell-Bell
AH
,
Thomas
PG
,
Caffrey
JM
.
Ca2+ and filopodial responses to glutamate in cultured astrocytes and neurons.
.
Can J Physiol Pharmacol.
1992;
;
70
:
:206.
–
218
.
39.
Perriot
S
,
Mathias
A
,
Perriard
G
et al.
Human Induced Pluripotent Stem Cell-Derived Astrocytes Are Differentially Activated by Multiple Sclerosis-Associated Cytokines.
.
Stem Cell Rep.
2018;
;
11
:
:1199.
–
1210
.
40.
Franklin
H
,
Clarke
BE
,
Patani
R
.
Astrocytes and microglia in neurodegenerative diseases: Lessons from human in vitro models.
.
Prog Neurobiol.
2021;
;
200
:
:101973.
.
41.
Sienski
G
,
Narayan
P
,
Bonner
JM
,
et al.
APOE4 disrupts intracellular lipid homeostasis in human iPSC-derived glia.
.
Sci Transl Med.
2021;
;
13
:
:eaaz4564.
.
42.
Varcianna
A
,
Myszczynska
MA
,
Castelli
LM
et al.
Micro-RNAs secreted through astrocyte-derived extracellular vesicles cause neuronal network degeneration in C9orf72 ALS.
.
EBioMedicine.
2019;
;
40
:
:626.
–
635
.
43.
di Domenico
A
,
Carola
G
,
Calatayud
C
et al.
Patient-Specific iPSC-Derived Astrocytes Contribute to Non-Cell-Autonomous Neurodegeneration in Parkinson’s Disease.
.
Stem Cell Rep.
2019;
;
12
:
:213.
–
229
.
44.
Kelley
KW
,
Pasca
SP
.
Human brain organogenesis: Toward a cellular understanding of development and disease.
.
Cell.
2022;
;
185
:
:42.
–
61
.
45.
Chneiweiss
H
.
Organoïdes : nouvelles perspectives et nouvelles questions éthiques.
.
Med Sci (Paris).
2020;
;
36
:
:99.
–
100
.
46.
Haiech
J
.
Parcourir l’histoire de l’intelligence artificielle, pour mieux la définir et la comprendre.
.
Med Sci (Paris).
2020;
;
36
:
:919.
–
23
.
47.
Kastanenka
K v.
,
Moreno-Bote
R
,
Pittà
M de
,
et al.
A roadmap to integrate astrocytes into Systems Neuroscience.
.
Glia.
2020;
;
68
:
:5.
–
26
.
48.
Zhang
Y
,
Sloan
SA
,
Clarke
LE
et al.
Purification and Characterization of Progenitor and Mature Human Astrocytes Reveals Transcriptional and Functional Differences with Mouse.
.
Neuron.
2016;
;
89
:
:37.
–
53
.
49.
Hansson
O
.
Biomarkers for neurodegenerative diseases.
.
Nat Med.
2021;
;
27
:
:954.
–
63
.
50.
Bardehle
S
,
Krüger
M
,
Buggenthin
F
et al.
Live imaging of astrocyte responses to acute injury reveals selective juxtavascular proliferation.
.
Nat Neurosci.
2013;
;
16
:
:580.
–
586
.
51.
Ransohoff
RM
.
A polarizing question: do M1 and M2 microglia exist?
.
Nat Neurosci.
2016;
;
19
:
:987.
–
991
.
52.
Barbar
L
,
Jain
T
,
Zimmer
M
,
et al.
CD49f Is a Novel Marker of Functional and Reactive Human iPSC-Derived Astrocytes.
.
Neuron.
2020;
;
107
:
:436.
–
53
.e12.
53.
Tong
X
,
Ao
Y
,
Faas
GC
et al.
Astrocyte Kir4.1 ion channel deficits contribute to neuronal dysfunction in Huntington’s disease model mice.
.
Nat Neurosci.
2014;
;
17
:
:694.
–
703
.
54.
Huffels
CFM
,
Osborn
LM
,
Hulshof
LA
,
et al.
Amyloid-β plaques affect astrocyte Kir4.1 protein expression but not function in the dentate gyrus of APP/PS1 mice.
.
Glia.
2022;
;
70
:
:748.
–
67
.
55.
Hartmann
K
,
Sepulveda-Falla
D
,
Rose
IVL
et al.
Complement 3 +-astrocytes are highly abundant in prion diseases, but their abolishment led to an accelerated disease course and early dysregulation of microglia.
.
Acta Neuropathol Commun.
2019;
;
7
:
:83.
.
56.
DeFelipe
J.
.
Cajal y sus dibujos: ciencia y arte.
.
Arte y neurologia.
2005
;
:213.
–
230
.
57.
Ramón y Cajal
S
.
Contribution à la connaissance de la névroglie cérébrale et cérébelleuse dans la paralysie générale progressive.
.
Trab Lab Invest biol.
1925;
;
23
:
:157.
–
216
.
|