| |
| Med Sci (Paris). 38(10): 763–765. doi: 10.1051/medsci/2022118.Cancérogenèse et variants faux sens pathogènes du domaine exonucléasique des ADN polymérases ε et δ Les risques de l’infidélité Albain Chansavang,1,2 Benoit Rousseau,3 Nicolas Leulliot,4 Julien Masliah-Planchon,5 Ivan Bièche,2,5 Éric Pasmant,1,2* and Nadim Hamzaoui1,2 1Fédération de génétique et médecine génomique, hôpital Cochin, AP-HP, Centre-Université Paris Cité
,
Paris
,
France 2Institut Cochin, Inserm U1016, CNRS UMR8104, université Paris Cité, CARPEM
,
Paris
,
France 3Department of medicine, Division of solid tumor oncology, Memorial Sloan Kettering Cancer Center
,
New York
,
États-Unis 4CiTCoM, CNRS UMR8038, université Paris Cité
,
France 5Service de génétique, Institut Curie
,
Paris
,
France MeSH keywords: Réplication de l'ADN, Exonucleases, Humains, Tumeurs, Saccharomyces cerevisiae, épidémiologie, génétique |
L’importance du domaine exonucléase 3’-5’ des ADN polymérases ε et δ pour la fidélité de la réplication de l’ADN
Les ADN polymérases δ (POLD1) et ε (POLE) sont les principales réplicases de l’ADN des eucaryotes, après amorçage par la polymérase α (POLA) [
1
] (
→
).
(→) Voir la Nouvelle de S.M. de Procé, m/s n° 10, octobre 2015, page821
Dans l’espèce humaine, les holoenzymes POLD et POLE comprennent chacune quatre sous-unités, dont les polymérases sont codées respectivement par les gènes
POLE
(
DNA polymerase epsilon, catalytic subunit
) et
POLD1
(
DNA polymerase delta 1, catalytic subunit
) [
2
]. Ces ADN polymérases présentent, en sus de leur domaine polymérase, un domaine exonucléase 3’-5’ qui est le domaine d’édition à l’origine de la fidélité de la réplication de l’ADN [
3
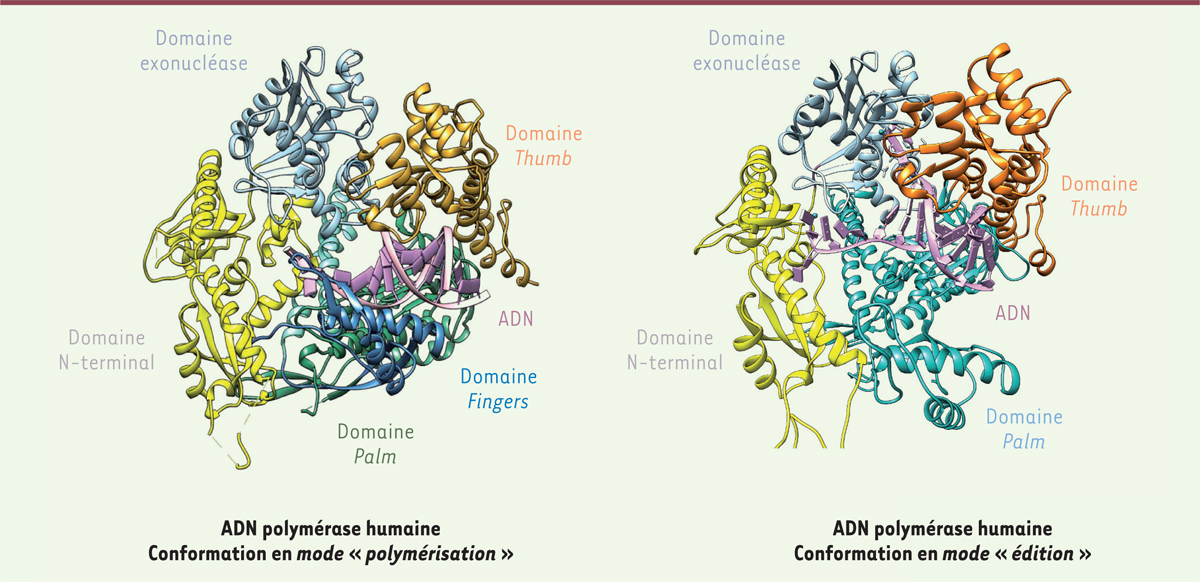
]. Lorsque l’ADN polymérase commet une erreur d’appariement et insère un nucléotide incorrect en face du nucléotide du brin « mère » de l’ADN, la synthèse s’interrompt, le brin en cours de synthèse se détache du brin mère et s’engage dans la poche du domaine exonucléase 3’-5’. Celui-ci élimine le dernier nucléotide incorrectement inséré, et le brin d’ADN retourne dans le domaine polymérase où la synthèse de l’ADN peut reprendre
(
Figure 1
)
.
 | Figure 1.
Modélisation de l’ADN polymérase ε (POLE) en mode « polymérisation » et en mode « édition ».
Le domaine polymérase est composé de trois parties reproduisant la configuration d’une main droite ouverte : la paume (palm, couleur verte) qui contient le site catalytique, les doigts (
fingers
, couleur bleu foncé) qui positionnent correctement le brin mère de l’ADN, et le pouce (
thumb
, couleur or) qui lie l’ADN à la sortie du site catalytique et est impliqué dans la processivité de l’enzyme. S’y ajoutent un domaine exonucléase (en bleu pâle), qui contient son propre site catalytique et un domaine N-terminal (en jaune). En mode « polymérisation », l’ADN (violet) est positionné dans le site polymérase. En cas de mésappariement d’un nucléotide, la synthèse s’interrompt et le brin nouvellement synthétisé entre dans la poche exonucléase pour excision du dernier nucléotide incorporé (mode « édition »).
|
|
Des variants pathogènes du domaine exonucléase de POLE identifiés dans des cancers « ultra-mutés »
L’implication du déficit de ce mécanisme de correction des mésappariements par altération du domaine exonucléase dans la tumorigenèse a été révélée par les analyses d’exomes et de génomes tumoraux grâce aux techniques de séquençage de l’ADN de nouvelle génération. En 2012, le séquençage de l’exome de 224 cancers colorectaux dans le cadre du projet TCGA (
The Cancer Genome Atlas
) a révélé un sous-ensemble de tumeurs (environ 3 %) caractérisées, sur le plan moléculaire, par une accumulation de mutations dans le génome tumoral [
4
]. Ces tumeurs présentaient des mutations faux sens pathogènes récurrentes du gène
POLE
à l’état hétérozygote, qui laissaient intact le domaine polymérase, mais affectaient le domaine exonucléase de l’enzyme. Par exemple, les mutations p.Pro286Arg ou p.Val411Leu étaient associées à un nombre élevé de variations du génome des cellules tumorales, souvent supérieur à 100 variations par mégabase (Mb) d’ADN. La forte charge mutationnelle
1
de ces tumeurs leur a valu le qualificatif « ultra-mutées » [
5
].
L’analyse de la signature mutationnelle trinucléotidique selon les sous-types de substitutions et leur environnement nucléotidique immédiat a mis en évidence des profils mutationnels spécifiques des tumeurs montrant un variant pathogène de
POLE
[
6
,
7
]
2
. En effet, ces variations du génome tumoral ne sont pas distribuées aléatoirement entre les différents types de substitutions. Si l’on considère les six types de substitutions possibles dans leur contexte génomique immédiat (les deux nucléotides situés de part et d’autre de la mutation, soit 96 triplets possibles), il apparaît que les tumeurs avec variant pathogène du domaine exonucléase de POLE sont caractérisées par une augmentation d’un facteur 100 des transversions C>A dans un contexte de triplet TCT, et par une augmentation d’un facteur 30 des transitions C>T dans un contexte de triplet TCG. Par la suite, plusieurs études ont détecté des mutations faux sens pathogènes du domaine exonucléase de POLE dans environ 8 % des cancers de l’endomètre [
8
] et dans d’autres types de tumeurs où ils définissent un phénotype ultra-muté associé à cette signature mutationnelle spécifique, dénommée SBS10 (
single-base substitution 10
) [
5
].
|
Des variants faux sens pathogènes « constitutionnels » du domaine exonucléase de
POLE
à l’origine d’un syndrome de prédisposition à certains cancers
Indépendamment de l’identification de variants pathogènes « somatiques » (
i.e.
, présents uniquement dans les cellules tumorales) de
POLE
, d’autres études ont montré que des variants faux sens pathogènes « constitutionnels » (
i.e.
, présents dans toutes les cellules de l’individu, à l’état hétérozygote) affectant la fonction relecture-correction de POLD1 et POLE prédisposent à une polypose et au cancer colorectal, et à d’autres types de cancers [
9
]. Ce syndrome héréditaire de prédisposition génétique à ces cancers, transmis selon le mode autosomique dominant, est connu sous le nom de polypose adénomateuse associée aux ADN polymérases (
polymerase proofreading-associated polyposis
, PPAP
;
MIM : 615083 et MIM : 612591). Il est associé à un risque cumulé de cancer colorectal de près de 50 % avant l’âge de 50 ans et de 74 % avant l’âge de 70 ans [
10
]. Ces variants pathogènes constitutionnels de
POLE
et
POLD1
peuvent également être impliqués dans la survenue d’autres cancers touchant divers organes comme le duodénum, l’endomètre ou le cerveau (glioblastome à cellules géantes, principalement). Les tumeurs survenues dans le cadre du syndrome PPAP présentent la même signature mutationnelle trinucléotidique SBS10 que les tumeurs avec variant pathogène somatique de
POLE
.
|
Des variants pathogènes de
POLE
corrélés avec l’efficacité de l’immunothérapie
Les variants faux sens pathogènes tumoraux du domaine de relecture-correction de POLE sont de très bon pronostic dans les cancers de l’endomètre. Les tumeurs possédant ces variants présentent généralement un infiltrat lymphocytaire important en relation avec la forte charge mutationnelle des cellules tumorales, possiblement corrélée avec l’expression de nombreux néo-antigènes par ces cellules. Ainsi, les variants pathogènes de
POLE
pourraient être un biomarqueur de la réponse aux immunothérapies. C’est ce que montre la récente publication des résultats d’un premier essai clinique prospectif utilisant une immunothérapie anti-PD1 chez des patients ayant des tumeurs avec mutation de
POLE
, à un stade avancé [
11
]. Un bénéfice thérapeutique a été constaté chez les patients porteurs d’un variant pathogène du domaine exonucléase de POLE, mais pas chez ceux qui avaient d’autres types de variants (variants du domaine exonucléase n’affectant pas l’activité correctrice de l’enzyme ou variants localisés hors de ce domaine protéique).
|
L’interprétation des variants faux sens de
POLE
: un enjeu médical
L’avènement des nouvelles techniques de séquençage de l’ADN a augmenté considérablement les capacités d’analyse du génome, avec pour conséquence l’identification d’un nombre croissant de variants génétiques. L’interprétation de ces variants est le nouvel enjeu de la médecine génomique, notamment ceux des gènes dits « actionnables », pour lesquels l’identification d’un variant pathogène peut modifier la prise en charge des patients. À ce jour, plus de 200 variants faux sens du domaine exonucléase de POLE et POLD1 ont été décrits en oncologie (TCGA,
https://www.cbioportal.org/
), dont une dizaine entraînant une augmentation du risque de cancer lorsqu’ils sont présents constitutionnellement. Cependant, l’incertitude quant à la pathogénicité de ces variants est un frein à leur utilisation pour le conseil génétique ou la prise en charge thérapeutique des patients.
POLE
est un gène de grande taille susceptible de subir, dans les cellules tumorales, des mutations somatiques non pathogènes. En effet, le remplacement d’un acide aminé par un autre peut n’entraîner aucune conséquence fonctionnelle, même dans un domaine catalytique de la protéine. Une solution possible à ce problème consiste à tester dans des lignées cellulaires ou des organismes modèles comme la levure, l’activité des nouveaux variants identifiés.
Ainsi, nous avons récemment introduit, dans l’orthologue du gène
POLE
de la levure
S. cerevisiae
, des variants du domaine exonucléase qui avaient été identifiés chez des personnes atteintes du syndrome PPAP. Nous avons montré qu’ils étaient associés à un phénotype « hypermutateur » [
10
]. Étonnamment, ces analyses fonctionnelles ont révélé que certains variants, en particulier les variants somatiques les plus fréquents tels que p.Pro286Arg ou p.Val411Leu, déstabilisent le génome bien plus que ne le supposerait la simple abolition de l’activité exonucléase [
12
]. Des études structurales fines des protéines porteuses de ces mutations récurrentes ont d’ailleurs permis de proposer une explication à ce constat [
13
,
14
].
La découverte de variants pathogènes affectant la capacité du domaine exonucléase de l’ADN polymérase POLE à corriger les erreurs de réplication de l’ADN a donc permis d’identifier, d’une part, un nouveau syndrome rare de prédisposition héréditaire à certains cancers, et, d’autre part, un sous-ensemble de tumeurs sporadiques, principalement du côlon et de l’endomètre, caractérisées par une charge mutationnelle très élevée et une bonne réponse de la tumeur à l’immunothérapie. Le développement de tests fonctionnels et des analyses structurales devrait permettre de mieux comprendre les effets pathogènes des diverses mutations de
POLE
identifiées chez les patients.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
de Procé
Marion S.
Des fragments d’ADN synthétisés par l’ADN polymérase α modifient notre génome.
.
Med Sci (Paris).
2015;
;
31
:
:821.
–
823
.
2.
Lujan
SA
,
Williams
JS
,
Kunkel
TA
.
DNA polymerases divide the labor of genome replication.
.
Trends Cell Biol.
2016;
;
26
:
:640.
–
654
.
3.
Shevelev
IV
,
Hübscher
U
.
The 3’ 5’ exonucleases.
.
Nat Rev Mol Cell Biol.
2002;
;
3
:
:364.
–
376
.
4.
Cancer Genome Atlas Network.
.
Comprehensive molecular characterization of human colon and rectal cancer.
.
Nature.
2012;
;
487
:
:330.
–
337
.
5.
Rayner
E
,
van Gool
IC
,
Palles
C
,
et al.
A panoply of errors: polymerase proofreading domain mutations in cancer.
.
Nat Rev Cancer.
2016;
;
16
:
:71.
–
81
.
6.
Alexandrov
LB
,
Nik-Zainal
S
,
Wedge
DC
,
et al.
Signatures of mutational processes in human cancer.
.
Nature.
2013;
;
500
:
:415.
–
421
.
7.
Alexandrov
LB
,
Kim
J
,
Haradhvala
NJ
,
et al.
The repertoire of mutational signatures in human cancer.
.
Nature.
2020;
;
578
:
:94.
–
101
.
8.
Church
DN
,
Briggs
SEW
,
Palles
C
,
et al.
DNA polymerase ε and δ exonuclease domain mutations in endometrial cancer.
.
Hum Mol Genet.
2013;
;
22
:
:2820.
–
2828
.
9.
Palles
C
,
Cazier
J-B
,
Howarth
KM
,
et al.
Germline mutations affecting the proofreading domains of POLE and POLD1 predispose to colorectal adenomas and carcinomas.
.
Nat Genet.
2013;
;
45
:
:136.
–
144
.
10.
Hamzaoui
N
,
Alarcon
F
,
Leulliot
N
,
et al.
Genetic, structural, and functional characterization of POLE polymerase proofreading variants allows cancer risk prediction.
.
Genet Med.
2020;
;
22
:
:1533.
–
41
.
11.
Rousseau
B
,
Bieche
I
,
Pasmant
E
,
et al.
PD-1 blockade in solid tumors with defects in polymerase epsilon.
.
Cancer Discov.
2022;
;
12
:
:1435.
–
48
.
12.
Barbari
SR
,
Kane
DP
,
Moore
EA
,
Shcherbakova
PV
.
Functional Analysis of Cancer-Associated DNA Polymerase ε Variants in Saccharomyces cerevisiae.
.
G3 Bethesda Md.
2018;
;
8
:
:1019.
–
29
.
13.
Xing
X
,
Kane
DP
,
Bulock
CR
,
et al.
A recurrent cancer-associated substitution in DNA polymerase ε produces a hyperactive enzyme.
.
Nat Commun.
2019;
;
10
:
:374.
.
14.
Parkash
V
,
Kulkarni
Y
,
Ter Beek
J
,
et al.
Structural consequence of the most frequently recurring cancer-associated substitution in DNA polymerase ε.
.
Nat Commun.
2019;
;
10
:
:373.
.
|