| |
| Med Sci (Paris). 38(8-9): 749–751. doi: 10.1051/medsci/2022117.Arthrose et obésité Rôle central du tissu adipeux Merve Guler,1* Sarah Ali,1** and Claire Jacques1*** 1M1 Biologie intégrative et physiologie, Sorbonne Université
,
75005Paris
,
France 2Inserm UMRS_938, CDR St-Antoine, Sorbonne Université
,
75005Paris
,
France MeSH keywords: Tissu adipeux, Humains, Obésité, Arthrose, complications, étiologie, génétique |
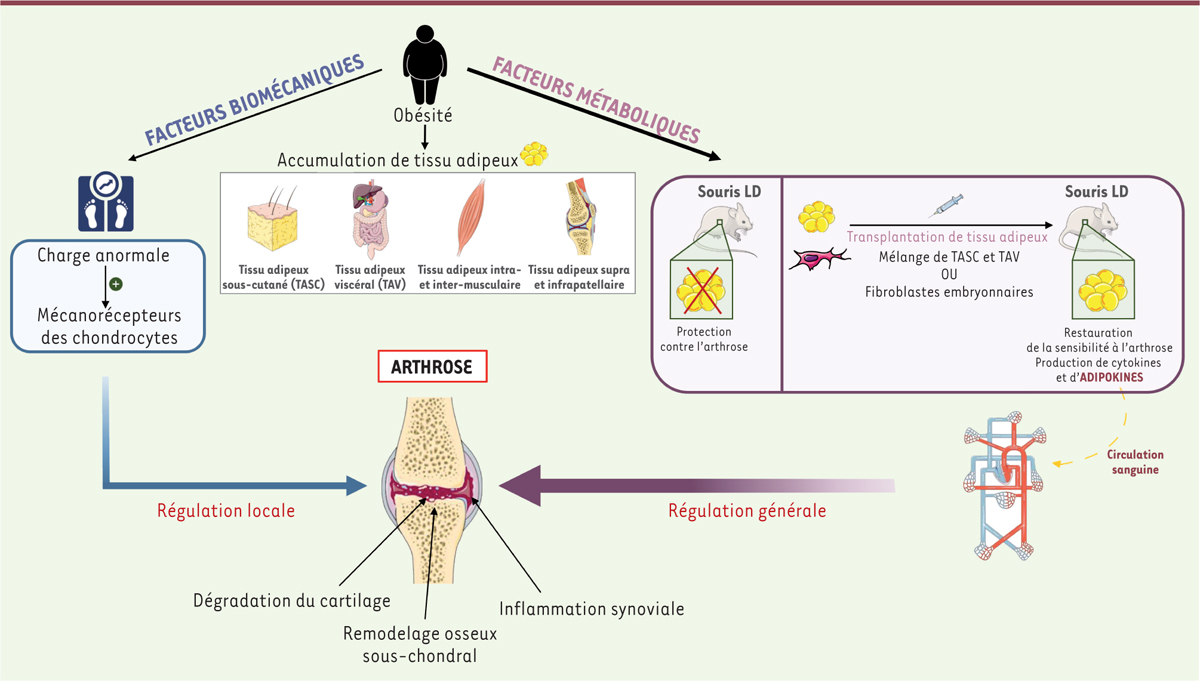
L’arthrose, la plus fréquente des maladies ostéo-articulaires
L’arthrose est la maladie articulaire la plus fréquente touchant 10 millions de français dont 65 % ont plus de 65 ans
1
. Il s’agit de la première cause de handicap au monde selon l’Organisation mondiale de la santé (OMS) et cette maladie douloureuse peut être considérée aujourd’hui comme mortelle, en raison des risques cardiovasculaires liés à la sédentarité provoquée par la maladie [
1
]. L’arthrose est caractérisée par une dégradation du cartilage, une inflammation de la membrane synoviale (synovite) et un remodelage osseux sous-chondral [
2
]. Actuellement, il n’existe pas de traitements curatifs mais uniquement des traitements symptomatiques, tels que des analgésiques et des anti-inflammatoires. Outre le vieillissement ou un traumatisme, l’obésité constitue également l’un des principaux facteurs de risque de l’arthrose [
3
]. Cependant, les mécanismes par lesquels l’obésité conduit à l’apparition et à la progression de l’arthrose restent à définir. Le lien entre l’obésité et l’arthrose a longtemps été expliqué uniquement par la surcharge mécanique appliquée aux articulations en raison de l’excès de poids corporel chez les patients obèses [
4
]. Pour l’arthrose du genou, il a ainsi été montré que ce stress mécanique, détecté par des mécanorécepteurs présents à la surface des chondrocytes, peut aboutir à une inflammation locale et à une dégradation du cartilage [
5
]. Toutefois, l’arthrose touche de nombreuses articulations parmi lesquelles on différencie les articulations portantes, où le facteur mécanique va jouer un rôle, mais également les articulations non portantes (l’arthrose des mains, par exemple) pour lesquelles d’autres facteurs entrent en jeu.
|
Le tissu adipeux, un acteur central dans l’arthrose
Le tissu adipeux (TA) est un organe multifonctionnel ayant un rôle de stockage des graisses, mais également un rôle endocrine, lié à la sécrétion de molécules, appelées adipokines, qui sont biologiquement actives. Le TA se localise sous la peau (tissu adipeux sous-cutané, TASC), autour des organes internes (tissu adipeux viscéral, TAV) et dans le système musculaire (tissu adipeux intra et inter-musculaire) [
5
]. Il existe un TA, bien qu’en plus plus faible quantité, qui est situé dans les articulations, comme dans le genou où on distingue les TA supra- et infra-patellaire
2
. Chez les personnes obèses, une accumulation de graisses s’accompagne d’une hypertrophie et d’une hyperplasie des adipocytes. Plusieurs études ont suggéré l’implication du TA dans la pathogenèse de l’arthrose. Hormis les facteurs biomécaniques, liés à la surcharge pondérale, des facteurs métaboliques et inflammatoires sont également responsables de cette dégénérescence articulaire. Concernant les facteurs métaboliques, l’existence d’une potentielle association entre l’arthrose et le syndrome métabolique (MetS) a été démontrée. Le MetS est caractérisé par un tour de taille important (en raison d’un excès de graisse abdominale) associé à certains dérèglements métaboliques comme le diabète, la dyslipidémie ou encore l’hypertension artérielle [
6
,
7
]. Ce type de dérégulation métabolique peut conduire à une pathogenèse de l’arthrose, notamment avec la mise en place d’une inflammation de bas grade au niveau général. Le TA contribue également à l’exacerbation de l’inflammation par la sécrétion de cytokines pro-inflammatoires (IL[interleukine]-1β, TNF[
tumor necrosis factor
]-α et IL-6) et d’adipokines. Ces adipokines ont des propriétés majoritairement pro-inflammatoires sur l’arthrose et vont avoir un rôle dans la dégradation du cartilage, l’inflammation synoviale et le remodelage osseux [
4
,
5
]. La sévérité de l’arthrose est corrélée aux concentrations d’adipokines [
8
]. Parmi ces adipokines, la leptine, l’adiponectine, la résistine, la chimérine et la lipocaline-2 ont été identifiées. La leptine, qui est la plus étudiée, est connue pour son contrôle sur la prise alimentaire. Elle a également été décrite comme un régulateur de l’inflammation, de l’activité catabolique du cartilage et du remodelage du cartilage et des os [
6
].
Bien que le lien entre l’augmentation de la masse du tissu adipeux et la pathogenèse de l’arthrose ait été étudié, l’effet direct de la contribution du TA dans le processus arthrosique n’est pas encore totalement élucidé. Cela s’explique par le fait qu’il existe des interactions complexes entre les facteurs métaboliques, biomécaniques et inflammatoires liés à l’obésité. Dans un article publié dans PNAS [
9
] en janvier 2021, l’équipe de F. Guilak (Saint Louis, Missouri, États-Unis) s’est intéressée au rôle clé du tissu adipeux dans le développement de l’arthrose en étudiant la communication entre le tissu adipeux et le cartilage articulaire.
|
Rôle direct du TA dans la pathogénèse de l’arthrose : un modèle murin lipodystrophique comme modèle d’étude Dans cette étude, les auteurs ont utilisé un modèle de souris transgéniques lipodystrophiques (LD) entièrement dépourvues de TA mais possédant un poids similaire aux souris contrôles (WT). Ce modèle permet ainsi d’analyser uniquement le rôle du tissu adipeux dans le développement de l’arthrose en éliminant le facteur de charge mécanique sur les articulations dû à la masse corporelle. Dans un premier temps, les chercheurs ont étudié l’impact de l’absence de TA sur le développement de l’arthrose en comparant le phénotype arthrosique de souris âgées témoins ou LD. |
L’absence de tissu adipeux confère une protection contre l’arthrose
Dans cet article, les auteurs ont évalué la sévérité de l’arthrose au niveau de l’articulation du genou des souris à 28 semaines, grâce à des analyses histologiques et en utilisant le score de Mankin
3,
. Remarquablement, alors que les souris LD présentent plusieurs caractéristiques prédisposant à l’arthrose telles qu’une sclérose osseuse (sous-chondrale), une faiblesse musculaire, un dysfonctionnement métabolique et une inflammation générale, elles présentent moins de lésions cartilagineuses spontanées que les souris témoins. Dans une autre série d’expériences, les chercheurs ont réalisé par chirurgie une déstabilisation du ménisque médial (DMM)
4,
d’un des deux genoux de souris âgées de 16 semaines afin d’induire une arthrose chez les deux groupes de souris. Les analyses réalisées à 12 semaines post-DMM (soit 28 semaines au total), révèlent que les souris LD sont protégées contre les lésions cartilagineuses du genou induites par DMM contrairement aux souris témoins. Étant donné que la douleur est le symptôme majeur de l’arthrose, celle-ci a également été évaluée. Pour ce faire, l’allodynie
5,
tactile a été déterminée par un test électronique démontrant un seuil de retrait de patte plus élevé pour les souris LD. De plus, les souris LD maintiennent des seuils de pression-douleur similaires entre leurs genoux DMM et non DMM à l’inverse des souris témoins qui présentent une hyperalgésie
6
du genou DMM. Ainsi, les souris LD sont moins sensibles à la douleur que les souris témoins, ce qui est cohérent avec l’absence de lésions cartilagineuses. Ces données montrent une protection des souris LD vis-à-vis de la dégradation articulaire et de la douleur.
Dans un second temps, des transplantations de TA ont été effectuées sur les souris LD pour tester directement les effets du TA et des facteurs sécrétés par celui-ci. |
La transplantation de TA restaure la susceptibilité à l’arthrose
Afin d’établir le rôle central du tissu adipeux dans l’arthrose, les auteurs ont cherché à étudier l’effet de sa transplantation chez les souris LD. Deux sources différentes de TA ont été utilisées. D’une part, un mélange de TASC et de TAV provenant de souris témoins (groupe “
WT-fat rescue
”, WF-R) et, d’autre part, des fibroblastes embryonnaires capables de se différencier en adipocytes, 21 jours après leur injection (groupe “
MEF-rescue
”, MEF-R). Les deux groupes de souris transplantées ont présenté des lésions articulaires après un DMM, ce qui témoigne d’un rétablissement de la sensibilité à l’arthrose suite à l’implantation de graisses. De même, après transplantation de TA, les souris LD présentent une hyperalgésie en réponse au DMM comme les souris témoins. Chez les souris LD, initialement dépourvues de leptine, la transplantation conduit à remonter la concentration circulante de cette adipokine jusqu’à 20 à 30 % du niveau normalement trouvé chez les souris témoins. De même, le profil inflammatoire des souris LD transplantées [concentrations circulantes de médiateurs anti-inflammatoires (IL-10 et TIMP-1) et pro-inflammatoires (IL-1α, IL-6 et TNF-α)] est globalement similaire à celui des souris témoins. Ces expériences ont permis de démontrer que la transplantation d’une petite quantité de tissu adipeux contribue à restaurer la susceptibilité à l’arthrose en modifiant les différents facteurs associés à cette maladie (inflammation de bas niveau, os sclérotique, faiblesse musculaire).
|
Conclusions et perspectives
Ces résultats utilisant des souris LD nous révèlent qu’une absence de TA confère une protection contre l’arthrose spontanée ou induite par DMM. Au contraire, une transplantation de TA sain chez ces animaux inverse la situation et restaure la sensibilité à l’arthrose. Ces résultats soutiennent l’hypothèse que l’arthrose peut être influencée et contrôlée par le TA. Ainsi, pour la première fois, l’existence d’une communication directe, de nature globale, a pu être démontrée entre le TA et l’articulation de genou chez la souris. Cette étude importante a fait l’objet d’un «
Research highlights
» dans
Nature Reviews Rheumatology
en mars 2021 [
10
]. Suite à cette étude, il est donc important d’identifier les facteurs endocriniens libérés par le TA. Les adipokines semblent être de bonnes candidates car elles sont capables de provoquer une inflammation générale se manifestant localement dans l’articulation. Ainsi, certaines études s’articulent principalement autour de la leptine. En effet, l’augmentation de la concentration sérique de leptine induite par l’obésité pourrait être à l’origine de l’inflammation articulaire et contribuer au développement de l’arthrose (
→
). Cela est cohérent avec le phénotype des souris LD n’ayant pas de leptine, qui sont protégées du développement de l’arthrose, et avec la transplantation de TA qui restaure une certaine quantité de leptine ainsi que la sensibilité à l’arthrose. Ainsi, de nouvelles thérapeutiques pour les patients présentant une arthrose pourraient cibler le tissu adipeux et notamment certaines adipokines qui restent cependant à identifier.
 | Figure 1. Implication du tissu adipeux dans la pathogenèse de l’arthrose. L’accumulation de tissu adipeux tels que les tissus adipeux sous-cutané, viscéral, musculaire et supra/infrapatellaire chez les patients obèses contribue à la dégradation articulaire conduisant à l’arthrose via deux types de facteurs : biomécaniques et métaboliques. Les facteurs biomécaniques sont associés à une charge excessive provoquant un stress mécanique. Ce stress est détecté par des mécanorécepteurs présents à la surface des chondrocytes, agissant de manière locale sur les articulations portantes. Cependant, les articulations non portantes étant aussi touchées par l’arthrose, cela suggère l’action de facteurs métaboliques. Récemment, l’équipe de F. Guilak a démontré le rôle direct du tissu adipeux dans le développement de l’arthrose. Des souris lipodystrophiques dépourvues de tissu adipeux acquièrent une protection contre l’arthrose. La transplantation de tissu adipeux issu d’un mélange de TASC et TAV de souris témoins ou de fibroblastes embryonnaires de souris restaure la sensibilité à l’arthrose. Le tissu adipeux sécrète des cytokines et des adipokines qui empruntent la circulation sanguine et agissent par voie générale sur les articulations. L’activation de l’ensemble de ces voies se traduit par une dégradation du cartilage, une inflammation synoviale et un remodelage osseux sous-chondral caractéristiques de l’arthrose. TASC : tissu adipeux sous-cutané ; TAV : tissu adipeux viscéral ; LD : souris lipodystrophiques. |
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Berenbaum
F
,
Walker
C
.
Osteoarthritis and inflammation: a serious disease with overlapping phenotypic patterns.
.
Postgraduate Medicine.
2020;
;
132
:
:377.
–
84
.
2.
Xie
C
,
Chen
Q
.
Adipokines: New Therapeutic Target for Osteoarthritis?
.
Curr Rheumatol Rep.
2019;
;
21
:
:71.
.
3.
Raud
B
,
Gay
C
,
Guiguet-Auclair
C
,
et al.
Level of obesity is directly associated with the clinical and functional consequences of knee osteoarthritis.
.
Sci Rep.
2020;
;
10
:
:3601.
.
4.
Zapata-Linares
N
,
Eymard
F
,
Berenbaum
F
,
et al.
Role of adipose tissues in osteoarthritis.
.
Curr Opin Rheumatol.
2021;
;
33
:
:84.
–
93
.
5.
Chang
J
,
Liao
Z
,
Lu
M
,
et al.
Systemic and local adipose tissue in knee osteoarthritis.
.
Osteoarthritis Cartilage.
2018;
;
26
:
:864.
–
871
.
6.
Francisco
V
,
Ruiz-Fernández
C
,
Pino
J
,
et al.
Adipokines: Linking metabolic syndrome, the immune system, and arthritic diseases.
.
Biochem Pharmacol.
2019;
;
165
:
:196.
–
206
.
7.
Gao
Y-H
,
Zhao
C-W
,
Liu
B
,
et al.
An update on the association between metabolic syndrome and osteoarthritis and on the potential role of leptin in osteoarthritis.
.
Cytokine.
2020;
;
129
:
:155043.
.
8.
Berenbaum
F.
.
Osteoarthritis as an inflammatory disease (osteoarthritis is not osteoarthrosis!).
.
Osteoarthritis and Cartilage.
2013;
;
21
:
:16.
–
21
.
9.
Collins
KH
,
Lenz
KL
,
Pollitt
EN
,
et al.
Adipose tissue is a critical regulator of osteoarthritis.
.
Proc Natl Acad Sci U S A.
2021;
;
118
:
:e2021096118.
.
10.
Clarke
J
.
Adipose tissue triggers OA.
.
Nat Rev Rheumatol.
2021;
;
17
:
:130.
.
|