| |
| Med Sci (Paris). 38(8-9): 746–478. doi: 10.1051/medsci/2022116.Obésité et résistance centrale à la leptine Impact sur la maladie d’Alzheimer Sylvie Heng,1* Melody Betin,1** and Isabelle Limon2*** 1M1 Biologie intégrative et physiologie (BIP), Parcours Nutrition, qualité et santé, Sorbonne Université
,
Campus Pierre et Marie Curie75005Paris
,
France 2Équipe Dynamique des signaux intracellulaires et cibles thérapeutiques, UMR 8256 Adaptation biologique et vieillissement, Institut de biologie Paris-Seine (IBPS)
,
Paris
,
France MeSH keywords: Maladie d'Alzheimer, Humains, Leptine, Obésité, Récepteurs à la leptine, épidémiologie, étiologie, complications |
La maladie d’Alzheimer (MA), première cause mondiale de démence pour les sujets de plus de 65 ans, est une maladie neuro-dégénérative entraînant une atrophie hippocampique ainsi qu’une perte progressive de la mémoire et des fonctions cognitives. Sur le plan neuroanatomique, la MA est définie par la présence anormale de plaques, dites « séniles », formées de dépôts extracellulaires de peptides β-amyloïdes
1
(Aβ)[
1
], et d’enchevêtrements neurofibrillaires composés de filaments de protéine Tau hyperphosphorylée
2
[
2
]. Le diagnostic de la MA peut reposer sur l’imagerie médicale. Une ponction lombaire peut également être pratiquée afin d’effectuer un dosage des protéines Aβ et Tau, qui sont deux marqueurs de la maladie, dont la concentration est anormalement élevée dans le liquide céphalo-rachidien des patients souffrant de MA [
3
].
Les mécanismes de développement de la MA sont complexes et en partie inconnus. Cependant, des pistes intéressantes ont été mises à jour, notamment un lien entre obésité et MA. En effet, de nombreuses études mettent en évidence une corrélation positive entre l’obésité sévère
3
[
4
,
5
], ses conséquences (résistance à l’insuline, diabète de type II, etc.), et le risque de développer une MA [
5
]. Nous discuterons en particulier, dans cette nouvelle, le lien entre résistance centrale à la leptine, qui est l’une des manifestations de l’obésité, et maladie d’Alzheimer.
|
Obésité, leptine et régulation de la cognition
La leptine est une hormone produite par le tissu adipeux blanc, qui a pour rôle de réguler le métabolisme énergétique en diminuant l’appétit, donc la prise alimentaire, et en augmentant la dépense énergétique. Cet effet anorexigène s’exerce principalement
via
l’isoforme Ob-Rb du récepteur de la leptine (Ob-R), exprimé par les neurones du noyau arqué de l’hypothalamus. La majorité des patients obèses présentent une hyperleptinémie
4
[
6
], et également une résistance à la leptine. Cet état résulte principalement d’une diminution de l’expression du récepteur Ob-Rb et d’un défaut d’activation des voies de signalisation activées en réponse à la leptine. L’efficacité du transport de la leptine à travers la barrière hémato-encéphalique (BHE) est également diminuée chez ces patients [
7
].
Outre ses fonctions dans le métabolisme, la leptine a probablement un rôle important dans la régulation de la cognition, comme le montrent plusieurs études. Elle aurait, tout d’abord, un effet neuroprotecteur. En effet, l’injection par voie intra-péritonéale ou intra-cutanée de leptine prévient l’effet toxique de l’hyperactivation des récepteurs neuronaux N-méthyl-D-aspartate (NMDA), en favorisant notamment la production de protéines anti-apoptotiques comme Bcl-xL [
1
]. La leptine peut également avoir une action plus directe sur la mémoire. En interagissant avec ses récepteurs hippocampiques Ob-Rb, elle module l’activation des récepteurs glutamatergiques de l’α-amino-3-hydroxy-5-méthylisoxasol-4-propionate (AMPA) et NMDA. Elle a ainsi des effets pro-cognitifs et intervient dans la préservation de la mémoire et la plasticité synaptique [
1
,
5
].
Ex vivo,
l’incubation de coupes de cerveaux de rongeurs en présence de leptine permet l’augmentation de la potentialisation à long terme (PLT), un mécanisme associé à l’apprentissage et à la mémoire. À l’inverse, les rongeurs leptino-résistants présentent une PLT diminuée et une neurogenèse altérée. Une altération de la mémoire à long terme est aussi retrouvée chez les rats n’exprimant pas d’Ob-Rb fonctionnels [
8
]. Finalement, la leptine aurait également un effet négatif sur l’accumulation des protéines Aβ et Tau, considérées comme marqueurs de la MA : l’administration chronique de leptine dans le cerveau de souris utilisées comme modèles de la MA diminue la charge cérébrale en peptides Aβ et protéine Tau phosphorylée
in vivo
[
1
].
|
La leptino-résistance : un facteur de risque de la maladie d’Alzheimer ?
Chez les patients présentant une maladie d’Alzheimer, les résultats sont contradictoires quant aux concentrations de leptine mesurées dans le liquide céphalo-rachidien et l’hippocampe. En revanche, les résultats obtenus à partir de modèles murins de la maladie d’Alzheimer montrent une diminution des concentrations de leptine circulante au cours du vieillissement et de l’évolution de la maladie d’Alzheimer. L’expression des récepteurs Ob-R ou la quantité de leur ARNm sont, de plus, significativement diminués dans l’hippocampe et le néocortex de souris utilisées comme modèles de la maladie d’Alzheimer [
9
]. Ces données sont ainsi cohérentes avec l’hypothèse d’une association entre résistance neuronale à la leptine et déclin cognitif lié à la maladie d’Alzheimer.
Les données obtenues avec des souris obèses et leptino-résistantes, du fait de mutations dans les gènes codant les récepteurs de la leptine rendant ceux-ci non fonctionnels (Leprdb/db), étayent cette hypothèse. En effet, lorsque ces souris sont croisées avec des souris db/AD (utilisées comme modèle murin de la maladie d’Alzheimer), des niveaux significativement accrus de phosphorylation de la protéine Tau sont observés [
10
]. De plus, à l’âge de 10-14 mois, les souris de la lignée db/AD (obèses, leptino-resistantes et atteintes d’une pathologie amyloïde) présentent un trouble de l’apprentissage et/ou de la mémoire spatiale, à la différence des lignées parentales [
11
]. Enfin, l’administration chronique de leptine dans le cerveau de souris modèles de la maladie d’Alzheimer, diminue la charge cérébrale en peptides Aβ et protéine Tau phosphorylée et améliore leurs performances d’apprentissage et de mémoire [
1
].
|
La maladie d’Alzheimer renforce la leptino-résistance
Le traitement
in vitro
de neurones de rats par des peptides Aβ1-42 (qui correspondent à la forme toxique des Aβ fortement présente dans le cerveaux des individus présentant une MA) engendre une cascade de signalisation aboutissant notamment à l’augmentation du niveau de Cdk5-p35, qui est un activateur de SOCS3. Cette dernière protéine étant un inhibiteur de la signalisation induite par la leptine, son activité va contribuer à la leptino-résistance. Ces données suggèrent donc que la MA contribue à la leptino-résistance [
5
,
12
]. Par ailleurs, chez des patients non obèses présentant une MA, les caractéristiques d’une résistance à la leptine ont été retrouvées. En effet, l’accumulation de peptides Aβ dans le plexus choroïde inhibe le transporteur de leptine de cette région du cerveau, la mégaline, diminuant ainsi l’entrée de leptine dans le cerveau [
13
]. Enfin, les récepteurs hippocampiques Ob-Rb des patients présentant une maladie d’Alzheimer, localisés à proximité des enchevêtrements neurofibrillaires, sont majoritairement inactivés [
9
]. Ces éléments suggèrent que la MA, indépendamment d’une situation d’obésité, pourrait induire une leptino-résistance et confirment bien l’interrelation entre les deux pathologies.
|
La leptine, sécrétée par le tissu adipeux, est importante pour le bon fonctionnement du cerveau, de la mémoire et des processus d’apprentissage. Elle est neuroprotectrice et augmente la PLT, potentialisant l’activité des récepteurs synaptiques NMDA du glutamate. La leptino-résistance accompagnant l’obésité peut donc avoir des impacts négatifs sur certaines capacités cognitives, les mêmes que celles affectées chez les patients souffrant de la MA. On retrouve également dans des modèles de la MA et chez des patients souffrant de la MA des signes de leptino-résistance, même si ces patients ne présentent pas d’obésité. Il existe donc une véritable boucle d’amplification dans laquelle la résistance à la leptine va aggraver les symptômes de la MA, et où la MA elle-même va accentuer cette résistance à la leptine. Remédier à cette leptino-résistance constitue donc un nouvel axe d’intérêt dans la recherche de traitement contre la MA. La re-sensibilisation des individus à la leptine pourrait être une première approche. Dans le cas où la leptino-résistance est due à une hyperleptinémie chronique, cette re-sensibilisation passe en général par la normalisation des concentrations de cette hormone. Pour les individus obèses, cette re-sensibilisation peut se faire notamment par une alimentation faible en graisses, mais aussi de façon pharmacologique [
14
]. Dans le cas où la leptino-résistance est dépendante du mécanisme des Ob-Rb, l’utilisation d’agonistes de la leptine pourrait être une autre approche intéressante. En effet, l’agoniste synthétique OB3 de la leptine, exerçant ses effets par un mécanisme d’action central différent de celui de la leptine, est capable de réduire l’apport alimentaire et le gain de poids dans des modèles de souris obèses déficientes en Ob-Rb [
7
,
15
]. Compte tenu de la prévalence de l’obésité dans le monde et de l’implication de la résistance à la leptine dans le développement de la MA, poursuivre les recherches sur la résistance à la leptine et comment la traiter représente un réel intérêt pour la santé publique, aussi bien en ce qui concerne le traitement de l’obésité que celui de la MA.
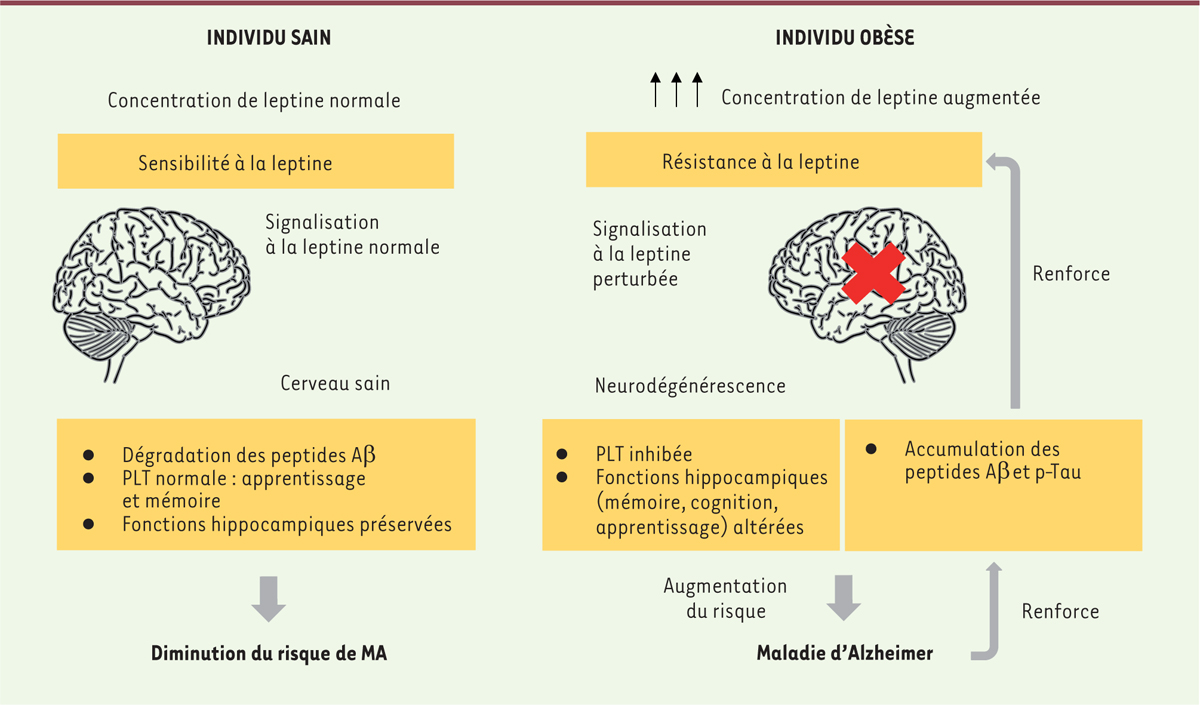
 | Figure 1. Représentation schématique de l’impact de la résistance à la leptine dans la maladie d’Alzheimer. Un individu sain présente une concentration de leptine circulante et une sensibilité à la leptine toutes les deux normales. Les activités neuronales liées à l’apprentissage et les fonctions hippocampiques sont préservées. Accompagnées par une dégradation normale des peptides Aβ, le risque de développer la maladie d’Alzheimer s’en retrouve diminué. Cependant, chez les individus obèses, nous pouvons retrouver une concentration de leptine circulante anormalement élevée qui va entraîner une résistance à la leptine. Les fonctions précédemment citées, normales chez l’individu sain, sont perturbées chez l’individu obèse. Cela va donc engendrer une augmentation du risque de développer la maladie d’Alzheimer, qui va elle-même renforcer la résistance à la leptine en provoquant une accumulation plus importante de peptides Aβ et de p-Tau. Aβ : peptide β-amyloïde ; PLT : potentialisation à long terme ; p-Tau : protéine Tau phosphorylée. Flèches noires : augmentation. |
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
McGuire
MJ
,
Ishii
M
.
Leptin dysfunction and Alzheimer’s disease: evidence from cellular, animal, and human studies.
.
Cell Mol Neurobiol.
2016;
;
36
:
:203.
–
217
.
2.
Chakrabarti
S
,
Khemka
VK
,
Banerjee
A
,
et al.
Metabolic Risk Factors of Sporadic Alzheimer’s Disease: Implications in the Pathology.
.
Pathogenesis and Treatment. Aging Dis.
2015;
;
6
:
:282.
–
299
.
3.
Khan
S
,
Barve
KH
,
Kumar
MS
.
Recent Advancements in Pathogenesis, Diagnostics and Treatment of Alzheimer’s Disease.
.
Curr Neuropharmacol.
2020;
;
18
:
:1106.
–
25
.
4.
Lin
X
,
Li
H
.
Obesity: Epidemiology, Pathophysiology, and Therapeutics.
.
Front Endocrinol.
2021;
;
12
:
:706978.
.
5.
Lloret
A
,
Monllor
P
,
Esteve
D
,
et al.
Obesity as a Risk Factor for Alzheimer’s Disease: Implication of Leptin and Glutamate.
.
Front Neurosci.
2019;
;
13
:
:508.
.
6.
Zhao
S
,
Kusminski
CM
,
Elmquist
JK
,
et al.
Leptin: Less Is More.
.
Diabetes.
2020;
;
69
:
:823.
–
9
.
7.
Izquierdo
AG
,
Crujeiras
AB
,
Casanueva
FF
,
et al.
Leptin, Obesity, and Leptin Resistance: Where Are We 25 Years Later?
.
Nutrients.
2019;
;
11
:
:2704.
.
8.
Van Doorn
C
,
Macht
VA
,
Grillo
CA
,
et al.
Leptin resistance and hippocampal behavioral deficits.
.
Physiology & Behavior.
2017;
;
176
:
:207.
–
213
.
9.
Bonda
DJ
,
Stone
JG
,
Torres
SL
,
et al.
Dysregulation of Leptin Signaling in Alzheimer Disease: Evidence for Neuronal Leptin Resistance.
.
J Neurochem.
2014;
;
128
:
:162.
–
172
.
10.
Flores-Dorantes
MT
,
Díaz-López
YE
,
Gutiérrez-Aguilar
R
.
Environment and Gene Association With Obesity and Their Impact on Neurodegenerative and Neurodevelopmental Diseases.
.
Front Neurosci.
2020;
;
14
:
:863.
.
11.
Niedowicz
DM
,
Reeves
VL
,
Platt
TL
,
et al.
Obesity and diabetes cause cognitive dysfunction in the absence of accelerated β-amyloid deposition in a novel murine model of mixed or vascular dementia.
.
Acta Neuropathol Commun.
2014;
;
2
:
:64.
.
12.
Fuchsberger
T
,
Martínez-Bellver
S
,
Giraldo
E
,
et al.
Aβ Induces Excitotoxicity Mediated by APC/C-Cdh1 Depletion That Can Be Prevented by Glutaminase Inhibition Promoting Neuronal Survival.
.
Sci Rep.
2016;
;
6
:
:31158.
.
13.
Dietrich
MO
,
Spuch
C
,
Antequera
D
,
et al.
Megalin mediates the transport of leptin across the blood-CSF barrier.
.
Neurobiol Aging.
2008;
;
29
:
:902.
–
912
.
14.
Andreoli
MF
,
Donato
J
,
Cakir
I
,
et al.
Leptin resensitisation: a reversion of leptin-resistant states.
.
J Endocrinol.
2019;
;
241
:
:R81.
–
R96
.
15.
Greco
M
,
De Santo
M
,
Comandè
A
,
et al.
Leptin-Activity Modulators and Their Potential Pharmaceutical Applications.
.
Biomolecules.
2021;
;
11
:
:1045.
.
|