| |
| Med Sci (Paris). 38(8-9): 743–745. doi: 10.1051/medsci/2022115.Régulation de la pression artérielle Un rôle majeur de l’apport en potassium Dicken Fardol,1a Aylin Gulmez,1b Zeynep Yoldas,1c and Stéphane Lourdel2d 1Master Biologie intégrative et physiologie, Sorbonne Université
,
Paris
,
France 2Centre de recherche des Cordeliers, Sorbonne Université
,
Paris
,
France |
L’actualité scientifique vue par les étudiants du Master de biologie intégrative et physiologie (BIP) de Sorbonne Université
Série coordonnée par Sophie Sibéril.
L’hypertension est la pathologie cardiovasculaire la plus fréquente : elle touche environ un milliard de personnes dans le monde [
1
]. L’augmentation de la pression s’exerçant sur les vaisseaux sanguins peut avoir des conséquences néfastes, telles que les accidents vasculaires cérébraux ou l’infarctus du myocarde. Au cours de ces dernières années, les habitudes alimentaires ont beaucoup évolué, notamment dans les pays industrialisés. Des travaux ont ainsi démontré une diminution importante de la consommation d’aliments riches en potassium (K
+
), liée en partie à la transformation industrielle des aliments [
1
]. Cette diminution pourrait avoir un impact sur la survenue de dérégulations de la pression artérielle.
|
Les variations de la concentration plasmatique en potassium impactent la pression artérielle
Les reins jouent un rôle crucial dans la régulation de l’homéostasie du milieu intérieur. En particulier, ils régulent de manière très fine les bilans du sodium (Na
+
) et du K
+
par l’intermédiaire de phénomènes de réabsorption et de sécrétion de ces ions le long des différents segments du néphron
1,
. D’après une étude de 2014 réalisée dans 18 pays et incluant plus de 100 000 participants, une élévation de la pression artérielle est observée chez les sujets pour lesquels les apports en Na
+
augmentent [
1
]. Cette étude a par ailleurs révélé que pour ces mêmes apports de sodium, la pression artérielle est augmentée lorsque les apports alimentaires en K
+
diminuent. Ainsi, il apparaît que l’absence des apports en K
+
joue également un rôle important dans l’hypertension artérielle.
L’acteur responsable de la détection des modifications de la kaliémie (ou concentration plasmatique de K
+
) a été identifié très récemment. Il met en jeu le tubule contourné distal (TCD), un segment du néphron. En effet, Cuevas
et al.
ont émis l’hypothèse que des canaux K
+
appartenant à la famille Kir (
Inwardly rectifying K
+
channels,
ou canaux potassium à rectification entrante), exprimés à la surface de la membrane basolatérale des cellules du TCD, jouent ce rôle important de senseur potassique [
2
]
(
Figure 1
)
.
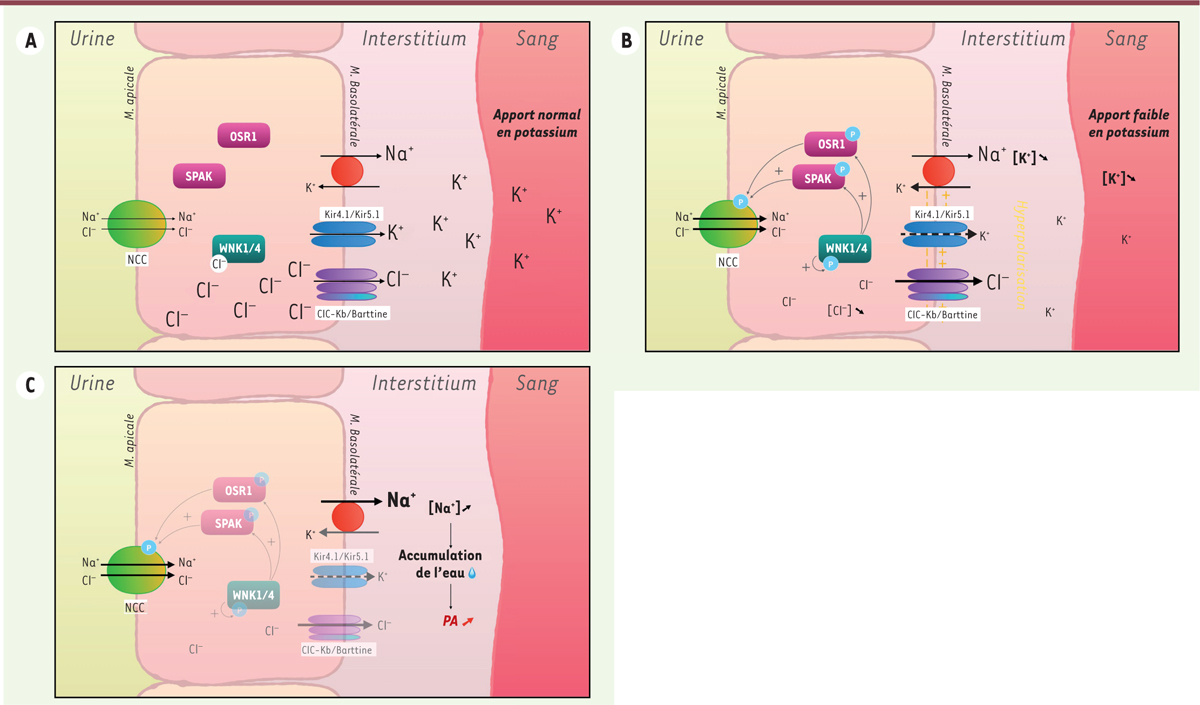
 | Figure 1.
Schéma représentant la modulation de l’activité du cotransporteur Na+Cl- (NCC) dans les cellules du tubule contourné distal (TCD) lors d’une hypokaliémie. (A)
Condition physiologique avec un apport potassique normal.
(B)
Une diminution des apports en K
+
provoque une augmentation du courant K
+
sortant contrôlé par les canaux Kir4.1/Kir5.1. L’hyperpolarisation de la membrane basolatérale qui en résulte favorise la sortie de Cl
-
à travers les canaux ClC-Kb/Barttine. La diminution de concentration intracellulaire de Cl
-
permet l’autophosphorylation des protéines kinases WNK1 et WNK4, qui, à leur tour, phosphorylent les protéines SPAK et OSR1. Ces dernières stimulent ainsi NCC.
(C)
La sur-stimulation des NCC provoque une augmentation de la réabsorption de NaCl, ce qui résulte en une augmentation d’excrétion de Na
+
par les pompes Na
+
/K
+
. L’augmentation de la concentration extracellulaire de Na
+
conduit à une accumulation de l’eau dans le milieu extracellulaire, augementation, ce qui provoque l’augmentation de la pression artérielle (PA).
|
|
Les canaux K
+
Kir4.1/Kir5.1 jouent un rôle crucial dans la détection des variations de la kaliémie
Les canaux Kir4.1 et Kir5.1 sont des canaux K
+
d’une conductance de 40 pS (picosiémens) exprimés à la surface de la membrane basolatérale des cellules TCD sous la forme d’hétérotétramères et codés respectivement par les gènes
KCNJ10
et
KCNJ16
. Pour étudier le rôle de ces canaux, Cuevas
et al.
ont généré des souris chez lesquelles l’expression du canal Kir4.1 a été empêchée de manière ciblée dans les reins [
2
]. Chez ces souris, les analyses de détection des protéines par
western blot
et les mesures de
patch-clamp
ont révélé une forte diminution de l’expression des canaux 40 pS K
+
ainsi qu’une réduction drastique de la conductance basolatérale au K
+
. Ces souris ne sont plus capables de détecter le changement d’apport potassique et elles présentent une diminution importante de leur pression artérielle [
2
]. Ces résultats suggèrent que Kir5.1 ne peut pas former à lui seul un canal K
+
à la membrane basolatérale des cellules du TCD en absence de Kir4.1. Une autre étude, menée chez des souris dont le gène codant Kir5.1 a été invalidé dans le rein (
Kcnj16
-/-
), montre par ailleurs que ces souris présentent une conductance K
+
diminuée par rapport aux souris témoins [
3
]. Ces différentes études soulignent donc l’importance à la fois de Kir4.1 et Kir5.1 dans la régulation des courants K
+
et dans la détection du changement de kaliémie.
|
Les canaux K
+
Kir4.1/Kir5.1 sont responsables de l’activation du co-transporteur Na
+
-Cl
-
De nombreuses études ont révélé que l’activité du co-transporteur Na
+
Cl
-
(ou NCC) exprimé à la surface de la membrane apicale des cellules du TCD dépend des apports en K
+
de l’organisme détectés par les Kir. Étant donné que les canaux K
+
Kir4.1/5.1 sont exprimés à la surface de la membrane basolatérale des cellules du TCD, différentes équipes de chercheurs se sont intéressées à la voie de signalisation qui assure un couplage entre la membrane apicale et la surface de la membrane basolatérale. Cuevas
et al.
ont observé chez les souris pour lesquelles le gène codant Kir4.1 a été invalidé (
KCNJ10
-/-
), une diminution des formes phosphorylées (donc actives) de NCC et des protéines kinases SPAK (
SPS1-related proline/alanine-rich kinase
) [
2
]. Les kinases SPAK sont impliquées dans une cascade de signalisation qui permet l’activation des co-transporteurs NCC. Importantes dans cette cascade, les kinases WNK 1/4 (
with no lysine [K] kinase
) activent les SPAK. Leur activité est régulée par la concentration intracellulaire en Cl
-
. Les travaux de Piala
et al.
ont démontré qu’une concentration intracellulaire élevée de Cl
-
stabilise la forme inactive des WNK, par coordination des ions Cl
-
sur le site catalytique des kinases [
4
]. Un apport faible en K
+
provoque une augmentation de la conductance potassique basolatérale des cellules TCD, ce qui induit alors une hyperpolarisation de la membrane basolatérale. Celle-ci favorise la sortie des ions Cl
-
à travers la membrane basolatérale par les canaux ClC-Kb/Barttine. Il en résulte une diminution de la concentration intracellulaire de Cl
-
et, de ce fait, une activation des WNK qui phosphorylent les SPAK et d’autres kinases (telles que OSR1 [
odd-skipped related 1
]) qui stimulent finalement à leur tour les co-transporteurs NCC.
|
Une suractivation du co-transporteur NCC par l’hypokaliémie altère la pression artérielle
Terker
et al.
ont observé des quantités élevées de NCC, de NCC phosphorylé (pNCC), ainsi qu’une augmentation de la pression artérielle chez des souris soumises pendant sept jours à un régime riche en Na
+
et pauvre en K
+
(régime HS/LK), en comparaison avec des souris soumises à un apport également riche en Na
+
mais normal en K
+
(régime HS/NK) [
5
]. En revanche, chez des souris dont le gène codant le NCC a été invalidé, soumises à un régime HS/LK, aucune augmentation de la pression artérielle n’a été observée, contrairement aux souris témoins non modifiées pour le gène NCC [
5
]. L’expression de pNCC dans des exosomes urinaires est par ailleurs plus importante chez des patients soumis pendant quatre jours à un régime HS/LK, par rapport aux patients soumis à un régime HS/NK.
Cuevas
et al.
ont également évalué les effets de différents régimes en K
+
sur les niveaux de pNCC chez les souris
Kcnj10
-/-
(n’exprimant pas Kir4.1). Suite à un régime faible en K
+
, aucune augmentation de la quantité de pNCC n’a été observée chez ces souris transgéniques, contrairement aux souris témoins. Afin de quantifier ce résultat, les chercheurs ont évalué l’abondance de pNCC en fonction de la kaliémie. Chez les souris témoins, il apparaît que la kaliémie représente un modulateur important de la quantité de pNCC, alors que cela n’est pas le cas chez les souris KS-
Kcnj10
-/-
[
2
]. Ces résultats permettent de conclure que les variations de kaliémie n’ont plus d’effet sur le cotransporteur NCC en absence du canal Kir4.1. Celui-ci est donc strictement nécessaire pour que les variations de kaliémie puissent exercer des effets sur NCC [
2
].
|
Le contrôle de la kaliémie : un élément important à prendre en compte dans le traitement de l’hypertension artérielle
Le transport rénal de solutés est un processus finement régulé et contrôlé, et un dérèglement de cette fonction a des conséquences sur l’ensemble de l’organisme. Le canal K
+
Kir4.1 joue un rôle crucial de senseur potassique, pierre angulaire de la modulation de la pression artérielle
via
l’activation du co-transporteur NCC par les kinases WNK1, WNK4, SPAK et OSR1. Une suractivation de NCC, induite par une hypokaliémie, entraîne en effet une augmentation du transport du Na
+
vers le liquide extracellulaire, ce qui provoque une accumulation d’eau dans ce compartiment afin de maintenir une osmolalité physiologique. L’augmentation de la volémie qui s’ensuit induit alors une élévation de la pression artérielle.
L’ensemble des résultats que nous avons relatés met ainsi en avant des pistes thérapeutiques importantes à explorer, notamment en termes de régime alimentaire. En effet, il a été montré qu’une diminution des apports en K
+
avait des conséquences rénales qui pouvaient s’avérer néfastes chez les sujets hypertendus. Ces résultats suggèrent donc qu’ajuster les niveaux de K
+
dans l’alimentation (par exemple à travers l’utilisation de sels de K
+
) pourrait jouer un rôle crucial dans la diminution des risques liés à une hypertension artérielle.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Mente
A
,
O’Donnell
MJ
,
Rangarajan
S
,
et al.
Association of urinary sodium and potassium excretion with blood pressure.
.
N Engl J Med.
2014;
;
371
:
:601.
–
611
.
2.
Cuevas
CA
,
Su
XT
,
Wang
MX
,
et al.
Potassium sensing by renal distal tubules requires Kir4.1.
.
J Am Soc Nephrol.
2017;
;
28
:
:1814.
–
1825
.
3.
Wu
P
,
Gao
ZX
,
Zhang
DD
,
et al.
Deletion of Kir5.1 impairs renal ability to excrete potassium during increased dietary potassium intake.
.
JASN.
2019;
;
30
:
:1425.
–
1438
.
4.
Piala
AT
,
Moon
TM
,
Akella
R
,
et al.
Chloride Sensing by WNK1 Involves Inhibition of Autophosphorylation.
.
Sci Signal.
2014;
;
7
:
:ra41.
.
5.
Terker
AS
,
Zhang
C
,
McCormick
JA
,
et al.
Potassium modulates electrolyte balance and blood pressure through effects on distal cell voltage and chloride.
.
Cell Metab.
2015;
;
21
:
:39.
–
50
.
|