| |
| Med Sci (Paris). 38(8-9): 733–736. doi: 10.1051/medsci/2022112.Quels traitements pour le mélanome uvéal ? Evangelia Ch Papasotiriou,1a Emilie Chessel,2b Carla Costa,1c Lucie Daniel,1d Isaline Deridder,1e Solène Garyga,1f Coralie Gineste,1g and Sacha Nahon-Estève3h 1
Polytech Nice Sophia, Spécialité Génie biologique 5
e
année, Pharmacologie et Biotechnologies, Université Côte d’Azur
,
France 2Master 2 Cancérologie Recherche Translationnelle, Université Côte d’Azur
,
France 3CHU Nice, Service d’ophtalmologie, hôpital Pasteur 2, Université Côte d’Azur
,
France MeSH keywords: Humains, Mélanome, Tumeurs de l'uvée, thérapie |
Le mélanome uvéal (MU) est le cancer primitif oculaire le plus fréquent chez l’adulte. Au stade métastatique (MUm), il est réfractaire aux thérapies existantes du mélanome cutané métastatique (thérapies ciblées et immunothérapies) [
1
]. L’explication tient dans le fait que ces deux types de tumeurs présentent une étiologie et des altérations génétiques différentes. Contrairement au mélanome cutané (MC) qui présente une charge mutationnelle élevée en lien avec l’exposition au soleil et est caractérisé par des mutations dans la sérine/thréonine kinase BRAF, la petite GTPase NRAS ou le facteur d’échange NF1, le MU présente en général une charge mutationnelle faible et des mutations dans la sous-unité alpha de la protéine G hétérotrimérique GNAQ ou de son homologue GNA11 [
11
] (
→
).
(→) Voir la Nouvelle de E. Papasotiriou
et al
., page 729 de ce numéro
Dans le MU, des mutations secondaires coopèrent avec ces mutations oncogènes pilotes, pour induire la progression tumorale. Ainsi, des mutations dans la voie de la dé-ubiquinitation de BAP1, dans le facteur d’épissage SF3B1 ou dans le facteur d’initiation de la traduction EIF1AX contribuent à la progression du MU. Malgré les progrès réalisés en ce qui concerne la caractérisation moléculaire du MU, aucune étude n’a permis jusqu’à présent d’identifier des cibles thérapeutiques pour prévenir les métastases. Actuellement, la plupart des études cliniques menées sur le MUm demeurent de portée limitée en raison d’effectifs faibles et de la nature rétrospective de ces études. La survie et la qualité de vie de la majorité des patients atteints de MUm restent donc conditionnées au développement de nouvelles thérapies. |
Les traitements du mélanome uvéal primaire L’une des préoccupations majeures dans le traitement des tumeurs oculaires, outre l’efficacité de la thérapie, est la préservation de l’œil et de la vue. Les traitements conservateurs, qui permettent de détruire la tumeur en conservant le globe oculaire, sont essentiellement fondés sur la protonthérapie, une modalité de radiothérapie externe reposant sur l’utilisation de particules lourdes chargées (les protons). Grâce aux propriétés physiques uniques de ces particules par rapport aux photons X, utilisés dans la radiothérapie conventionnelle, la protonthérapie est la principale technique de radiothérapie externe utilisée pour le traitement du MU car elle permet de délivrer la dose curative au niveau de la tumeur avec peu de toxicité pour les tissus sains péritumoraux. Le contrôle local de la tumeur est obtenu dans 95 % des cas. En revanche, lorsque la tumeur est trop volumineuse ou mal placée, ou en cas de récidive ou de complications après la protonthérapie, une énucléation, c’est-à-dire une ablation chirurgicale de l’œil, est réalisée. Quant au traitement par chimiothérapie, il ne peut constituer une thérapie standard car les essais cliniques n’ont pas montré de résultats concluants concernant son efficacité. |
Les traitements du mélanome uvéal métastatique
Malgré la protonthérapie, près de 50 % des patients vont développer des métastases 15 ans après le diagnostic initial de leur tumeur, avec une médiane de survie de 12 mois dès lors que le diagnostic de MUm est établi [
2
]. Parmi ces patients, près de 90 % d’entre eux présenteront des métastases hépatiques, avec une localisation hépatique exclusive pour la moitié d’entre eux. En conséquence, de nombreuses stratégies thérapeutiques ciblant le foie ont été développées depuis ces dernières années, mais avec des résultats limités sur la survie globale. Si les métastases sont localisées à certaines portions du foie et que l’état général du patient le permet, une exérèse chirurgicale peut être proposée et aboutir à une médiane de survie globale de 17 mois [
2
]. D’autres stratégies reposent sur l’administration sélective au foie d’une chimiothérapie (par voie intra-artérielle hépatique, par chimio-embolisation transartérielle ou par perfusion hépatique isolée), ou d’agents radioactifs (microsphères de verre ou de résine marquées à l’Yttrium-90), avec des résultats variables d’efficacité (survie globale médiane entre 10 et 16 mois) [
2
].
|
Le tebentafusp, un traitement prometteur mais présentant certaines limites
Un essai clinique international multicentrique de phase III, mené auprès de 378 patients atteints de MUm hépatiques et extra-hépatiques, a récemment montré que le tebentafusp augmentait la survie globale de ces patients par rapport aux traitements déjà existants [
3
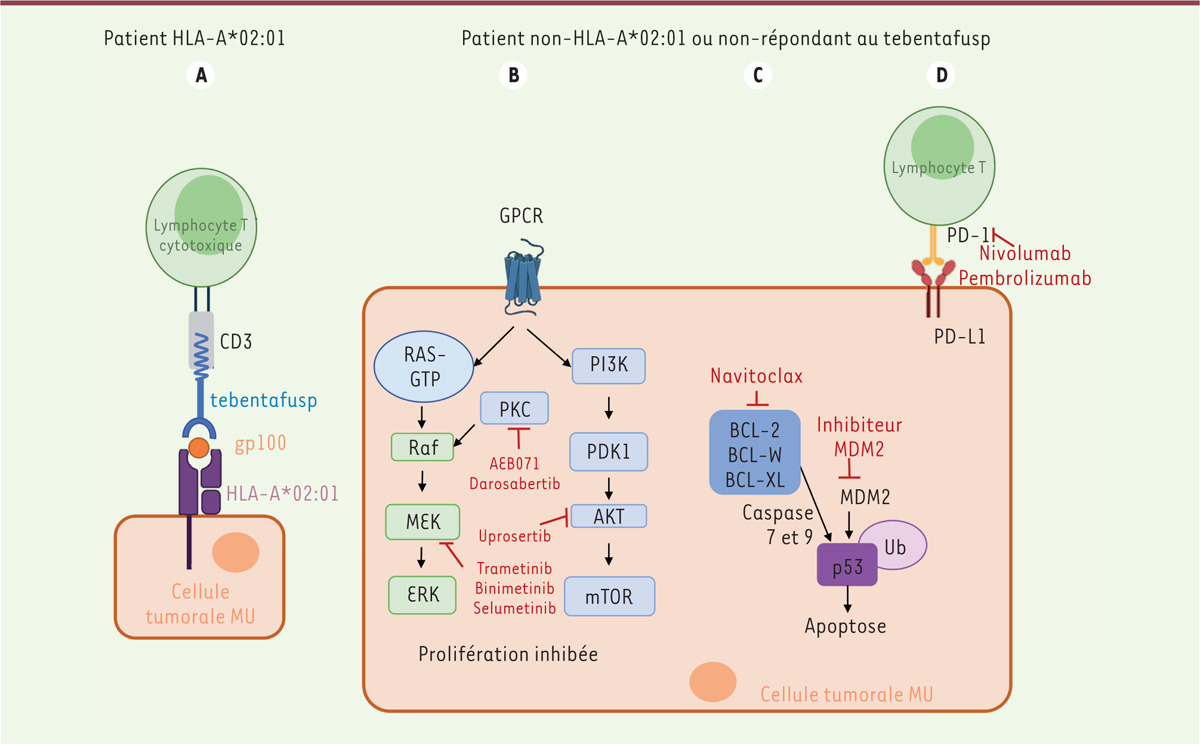
]. Le tebentafusp est une protéine de fusion bispécifique qui reconnaît deux cibles, l’une présente sur les cellules de MU, et la seconde sur les lymphocytes T. Une extrémité du tebentafusp reconnaît une partie de la protéine gp100 exprimée par les cellules de mélanome. Cette reconnaissance se fait grâce au domaine de liaison d’un TCR (récepteur des lymphocytes T) de haute affinité, spécifique d’un peptide dérivé de l’antigène tumoral gp100, présenté par l’allèle HLA-A*02:01 du CMH de classe I. L’autre extrémité du tebentafusp se lie au corécepteur CD3, ce qui active et redirige les lymphocytes T pour qu’ils attaquent les cellules de MU exprimant l’antigène gp100. Le tebentafusp établit ainsi un pont entre la tumeur et les cellules immunitaires, permettant à ces dernières d’attaquer les cellules tumorales
(
Figure 1
)
.
 | Figure 1.
Schéma de l’arsenal thérapeutique contre le mélanome uvéal. (A)
Mécanisme d’action du tebentafusp : l’extrémité du tebentafusp reconnaît l’antigène gp100, exprimé par les cellules de MU et présenté par les molécules HLA-A*02:01.
(B)
Agents évalués pour le traitement du MU et leurs cibles moléculaires.
(C)
Mécanisme d’action du navitoclax associé aux inhibiteurs de MDM2 : MDM2 est une ubiquitine ligase E3 localisée dans le noyau qui régule négativement p53 en la ciblant pour une dégradation protéasomique. Ainsi, des inhibiteurs de MDM2 associés au navitoclax (inhibiteur de protéines anti-apoptotiques BCL-2, BCL-X
L
et BCL-W) activent les fonctions d’apoptose (via les caspases 7/9) et d’arrêt du cycle cellulaire modulées par p53.
(D)
Mécanisme d’action d’un inhibiteur de point de contrôle immunitaire : activation des lymphocytes T par inhibition de l’interaction de PD-L1 avec son ligand. CD3: complexe protéique membranaire (cluster de différenciation 3) ; HLA :
human leukocyte antigen
; HLA-A*02:01 : allèle du locus A du complexe majeur d’histocompatibilité (CMH) de classe I ; GPCR : récepteur couplé aux protéines G ; MDM2 : murine double minute 2 ; PD-1 :
programmed cell death 1
; PD-L1 :
programmed death-ligand 1
; PI3K : phosphoinositide 3-kinase ; PKC : protéine kinase C ; ERK :
extracellular signal-regulated kinases
; mTOR :
mammalian target of rapamycin
.
|
Dans cet essai clinique contrôlé ouvert, les patients HLA-A*02:01 atteints de MUm non traités ont été répartis au hasard pour recevoir le tebentafusp (groupe tebentafusp) ou un traitement à base d’anticorps monoclonaux (pembrolizumab et/ou ipilimumab) ou une chimiothérapie en monothérapie (dacarbazine) (groupes de référence). Après un suivi médian de 14,1 mois, la survie globale (OS) a été analysée dans les différents groupes de patients. Les résultats ont montré que les patients ayant reçu le tebentafusp présentaient un risque de décès presque deux fois moins élevé que les patients traités avec les autres types de thérapies. En outre, le taux estimé de survie à un an était de 73,2 % chez les patients du groupe tebentafusp, contre 58,5 % dans les autres groupes. L’incidence et la sévérité des effets indésirables diminuaient de façon concomitante après les trois ou quatre premières doses de tebentafusp et ont rarement conduit à l’arrêt du traitement. Cette étude démontre ainsi pour la première fois une amélioration de la survie globale de patients atteints de MUm par rapport aux autres traitements systémiques. Néanmoins, deux limites sont à souligner concernant cette étude : (1) l’absence de comparaison de l’efficacité du tebentafusp par rapport aux autres thérapies loco-régionales actuellement proposées et ayant montré un bénéfice en terme de survie globale des patients ; (2) la limitation de l’étude à des patients possédant l’allèle HLA-A*02:01. En sachant que 45 % de la population caucasienne est porteuse de cet allèle et que 20 % des patients traités par tebentafusp répondent au traitement, le tebentafusp ne bénéficierait en théorie qu’à 9 % des patients atteints de MUm. Ces premiers résultats encouragent donc à poursuivre la recherche de nouveaux traitements pour la majorité des patients. |
Quel traitement pour les patients non répondeurs au tebentafusp ? Actuellement, d’autres pistes thérapeutiques sont explorées, en particulier, les inhibiteurs de voie de signalisation et de point de contrôle immunitaire. L’association des inhibiteurs de MDM2 et BCL2
L’expression de MDM2, qui induit la dégradation de la protéine p53
via
le protéasome, et des protéines anti-apoptotiques de la famille BCL-2 (BCL-2/BCL-X
L
/BCL-W) est associée aux résistances aux traitements dans de nombreuses tumeurs. Néanmoins les essais cliniques s’appuyant sur des monothérapies utilisant des inhibiteurs de ces protéines n’ont pas permis d’obtenir de résultats significatifs en termes de survie globale des patients atteints de MU. Il a en effet été montré que la voie du stress du réticulum endoplasmique joue un rôle dans la résistance au navitoclax (inhibiteur de BCL-2/BCL-X
L
/BCL-W) [
4
]. Cependant, des expériences précliniques chez l’animal montrent que la combinaison d’inhibiteurs de MDM2 et de navitoclax tend à diminuer la croissance de xénogreffes de cellules de patients [
5
]. Ainsi, la co-inhibition de BCL-2/BCL-X
L
/BCL-W et de MDM2 permettrait d’induire la mort cellulaire par apoptose
(
Figure 1
)
. Cette combinaison thérapeutique semble donc intéressante dans le traitement du MUm [
5
].
Les inhibiteurs de la voie MAPK/ERK et PI3K/PKB
Les patients atteints de MU montrent fréquemment une mutation des protéines GNAQ/GNA11, qui stimulent en aval les voies de signalisation PKC/MEK/ERK et PI3K/AKT impliquées dans la prolifération, l’invasion et la survie cellulaire. Différents essais cliniques testant l’effet d’inhibiteurs de MEK1/2 (selumetinib, trametinib), de PKC (sotrastaurine, LXS196) et d’AKT (uprosertib) sont en cours dans le MUm
(
Figure 1
)
. Cependant chez l’homme, le MU semble peu sensible à l’inhibition de ces différentes kinases, quels que soient l’agent inhibiteur et le partenaire de combinaison [
6
].
Les inhibiteurs des points de contrôle immunitaire
Bien que les inhibiteurs des points de contrôle immunitaire soient moins prometteurs que le tebentafusp, les patients non éligibles au tebentafusp pourraient tout de même bénéficier de ce type de traitement en monothérapie ou en combinaison avec d’autres thérapies [
7
] (
→
).
(→) Voir la Nouvelle de M. Rodrigues
et al
.,
m/s
n° 11, novembre 2018, page 925
Par exemple, une des altérations les plus fréquentes dans le MU est la perte de fonction de BAP1, une déubiquitinase de l’histone H2A impliquée dans l’organisation de la chromatine. Une combinaison d’inhibiteurs d’histone désacétylase (entinostat) et d’anti-PD1 (pembrolizumab) a montré des résultats encourageants et durables avec un effet synergique de la combinaison thérapeutique [
8
]. Il est intéressant de noter que des études ont montré l’expression d’autres points de contrôle immunitaire tels que LAG3, TIGIT et TIM-3 dans le MU, ouvrant la porte à de nouveaux traitements [
9
].
Les lymphocytes infiltrant les tumeurs
Les lymphocytes infiltrant la tumeur ou TIL sont des lymphocytes capables de pénétrer dans les tumeurs pour tuer les cellules cancéreuses grâce à la reconnaissance d’antigènes tumoraux autologues. Cela peut offrir un réel avantage thérapeutique à la condition que les TIL ne soient pas inactivés par la tumeur. Leur prolifération et leur modification en laboratoire permettent d’améliorer leur réponse, stratégie déjà étudiée en pratique clinique dans le MUm [
10
]. Dans cette étude, un tiers des patients (7/21) ayant reçu des TIL autologues amplifiés et sélectionnés (ayant une forte réactivité antitumorale) ont répondu au traitement. Ce traitement prometteur est cependant limité par le temps nécessaire à l’expansion en laboratoire des TIL prélevés avant leur réinjection chez le patient.
|
Le tebentafusp, molécule la plus prometteuse à l’heure actuelle ne permet le traitement que d’un faible nombre de patients. Produire de nouvelles molécules anti-gp100 ciblant d’autres haplocytes HLA est une piste intéressante pour les patients HLA-A*02:01-négatifs. Enfin, les différentes études cliniques sur le MUm soulignent la pertinence du développement de stratégies d’une médecine personnalisée pour ce type de cancer et de l’utilisation de combinaisons de différentes approches thérapeutiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
|
AKT
|
AKT Sérine/Thréonine Kinase 1 |
|
BAP1
|
BRCA1-associated protein 1
|
|
BCL-2
|
B-cell lymphoma 2
|
|
CTLA-4
|
Cytotoxic T-lymphocyte-associated protein 4
|
|
ERK
|
Extracellular signal-regulated kinase
|
|
GNAQ/GNA11
|
G Protein Subunit Alpha Q/11
|
|
LDH
|
Lactate déshydrogénase |
|
MAPK
|
Mitogen-activated protein kinases
|
|
MBD4
|
Methyl-CpG-Binding Domain 4, DNA Glycosylase
|
|
MDM2
|
murine double minute 2 |
|
PD-1
|
Programmed cell death 1
|
|
PD-L1
|
Programmed death-ligand 1
|
|
PI3K
|
Phosphoinositide 3-kinase |
|
PKC
|
Protéine kinase C |
|
TIL
|
Tumor-infiltrating lymphocytes
|
|
1.
Pandiani
C
,
Béranger
GE
,
Leclerc
J
et al.
Focus on cutaneous and uveal melanoma specificities.
.
Genes Dev.
2017;
;
31
:
:724.
–
743
.
2.
Rantala
ES
,
Hernberg
MM
,
Piperno-Neumann
S
,
et al.
Metastatic uveal melanoma: The final frontier.
.
Prog Retin Eye Res.
2022;
;
6
:
:101041.
.
3.
Nathan
P
,
Hassel
JC
,
Rutkowski
P
,
et al
.
Overall survival benefit with tebentafusp in metastatic uveal melanoma.
.
N Engl J Med.
2021;
;
385
:
:1196.
–
206
.
4.
Bellini
L
,
Strub
T
,
Habel
N
,
et al
.
Endoplasmic reticulum stress mediates resistance to BCL-2 inhibitor in uveal melanoma cells.
.
Cell Death Discov.
2020;
;
6
:
:22.
.
5.
Decaudin
D
,
Frisch Dit Leitz
E
,
et al
.
Preclinical evaluation of drug combinations identifies co-inhibition of Bcl-2/XL/W and MDM2 as a potential therapy in uveal melanoma.
.
Eur J Cancer.
2020;
;
126
:
:93.
–
103
.
6.
Wang
JZ
,
Lin
V
,
Toumi
E
,
et al
.
Development of new therapeutic options for the treatment of uveal melanoma.
.
FEBS J.
2021;
;
288
:
:6226.
–
49
.
7.
Rodrigues
M
,
Mobuchon
L
,
Houy
A
et al.
Rôle du gène MBD4 dans un phénotype hypermutateur et dans la tumorigenèse.
.
Med Sci (Paris).
2018;
;
34
:
:925.
–
927
.
8.
Ny
L
,
Jespersen
H
,
Karlsson
J
,
et al
.
The PEMDAC phase 2 study of pembrolizumab and entinostat in patients with metastatic uveal melanoma.
.
Nat Commun.
2021;
;
12
:
:5155.
.
9.
Durante
MA
,
Rodriguez
DA
,
Kurtenbach
S
,
et al
.
Single-cell analysis reveals new evolutionary complexity in uveal melanoma.
.
Nat Commun.
2020;
;
11
:
:496.
.
10.
Chandran
SS
,
Somerville
RPT
,
Yang
JC
et al.
Treatment of metastatic uveal melanoma with adoptive transfer of tumour-infiltrating lymphocytes: a single-centre, two-stage, single-arm, phase 2 study.
.
Lancet Oncol.
2017;
;
18
:
:792.
–
802
.
11.
Papasotiriou
E
,
Ben Abdeljelil
R
,
Benhammou
I
,
et al
.
Le mélanome uvéal est-il identique au mélanome cutané ?
Med Sci (Paris).
2022;
;
38
:
:729.
–
32
.
|