| |
| Med Sci (Paris). 38(8-9): 729–732. doi: 10.1051/medsci/2022111.Le mélanome uvéal est-il identique au mélanome cutané ? Evangelia Ch Papasotiriou,1a Raihane Ben Abdeljelil,1b Imane Benhammou,1c Léa Bertin,1d Emmanuel Chadeuf,1e Grégoire Colve,1f and Nicole Arrighi1g 1
Polytech Nice Sophia, Spécialité génie biologique 5
e
année, Pharmacologie et Biotechnologies, Université Côte d’Azur
,
France |
L’actualité scientifique vue par les étudiants de l’école d’ingénieurs d’Université Côte d’Azur - Polytech Nice Sophia
Série coordonnée par Sophie Sibéril. Les cancers diffèrent par les types cellulaires impliqués et leur localisation dans l’organisme. Les cancers issus de mélanocytes sont appelés mélanomes. Les mélanocytes synthétisent les pigments mélaniques, qui jouent un rôle clé dans la protection face aux rayonnements solaires. Ils sont retrouvés notamment dans la peau (dans l’épiderme précisément) et dans l’œil (dans la conjonctive et dans l’uvée). Ainsi, on distingue les mélanomes cutanés (MC) et les mélanomes oculaires. Les mélanomes oculaires sont eux-mêmes constitués des mélanomes uvéaux (MU) (95 %) et des mélanomes conjonctivaux (5 %). L’uvée étant une tunique vasculaire composée par l’iris, le corps ciliaire et la choroïde, on parle de MU lorsque l’une de ces structures est le siège d’une prolifération tumorale mélanocytaire. Dans cette série de nouvelles, nous aborderons les points communs et les différences entre MU et MC avant de discuter des traitements actuels et des perspectives thérapeutiques pour le MU, puis de l’existence d’une hétérogénéité intratumorale et enfin du rôle du facteur de transcription HES6 dans le MU. Dans ce premier volet, nous tenterons de répondre à la question : quelles sont les similarités et les différences entre le MU et le MC ? Dans un premier temps, nous nous intéresserons à la comparaison entre MC et MU en termes d’incidence, de facteurs de risques et de diagnostic. Puis, nous expliquerons les modifications génétiques et les aberrations chromosomiques spécifiques à chacune de ces pathologies. Enfin, nous nous intéresserons aux traitements existants actuellement contre chacun des mélanomes et leurs limites. |
Mélanome cutané et mélanome uvéal : des tableaux cliniques différents
Les MC et MU sont issus des mêmes cellules, les mélanocytes. Néanmoins, chacune de ces tumeurs présente des caractéristiques cliniques qui leur sont propres. Bien qu’il soit le plus minoritaire des cancers de la peau, le MC est le plus mortel. Le Centre international de recherche sur le cancer (CIRC) rapporte 325 000 nouveaux cas de MC avec 57 000 décès en 2020 dans le monde. Le MU qui est la tumeur intraoculaire primitive la plus fréquente chez l’adulte est plus rare que le MC avec environ 500 nouveaux cas diagnostiqués chaque année en France. Si l’on compare les taux standardisés de survie dans ces deux pathologies, le MU est bien plus létal que le MC avec un taux de survie d’environ 70 % à 5 ans pour le MU contre 91 % à 5 ans pour le MC [
1
].
L’incidence de ces cancers est liée à des facteurs de risque génétiques et environnementaux qui peuvent différer selon le type de mélanome. L’exposition aux rayons UV solaires est le principal facteur de risque environnemental du MC, alors qu’elle ne semble jouer aucun rôle dans la cancérogenèse du MU.
Le diagnostic de chacune de ces pathologies nécessite des examens spécifiques. La détection du MC débute dès l’observation d’une lésion pigmentée nouvelle de la peau ou la modification d’un nævus jusqu’alors stable. Le pronostic dépend alors du stade de la maladie au moment du diagnostic. La prise en charge du patient sera guidée par la classification du MC selon l’AJCC (
American Joint Committee on Cancer
) fondée sur des facteurs comme la mesure de l’épaisseur de la tumeur (indice de Breslow), la présence d’ulcération, l’invasion métastatique des ganglions régionaux, etc. [
2
].
La détection du MU est, quant à elle, plus difficile. En effet, les symptômes visuels rapportés (lorsqu’ils existent) ne sont pas spécifiques et vont dépendre de la position de la tumeur et des signes d’exsudation (œdème maculaire, décollement de rétine) qu’ils provoquent. Ainsi, un patient pourra rapporter une baisse d’acuité visuelle en cas de tumeur proche de la macula alors qu’une tumeur plus éloignée pourra ne provoquer aucun symptôme. Les tumeurs asymptomatiques ne peuvent être diagnostiquées que lors d’une visite de routine. La prise en charge du patient sera guidée essentiellement par les dimensions de la tumeur et la présence éventuelle de métastases. Une surveillance à vie sera nécessaire pour ces patients car une dissémination hématogène a souvent lieu avant le diagnostic et peut conduire à l’apparition de métastases principalement hépatiques [
3
].
|
Les altérations génétiques et les aberrations chromosomiques
Certains facteurs de risque génétiques sont communs au MC et MU, tels que les antécédents familiaux, le nombre de nævus ou le phototype clair [
3
,
4
]. D’autres facteurs génétiques sont, quant à eux, spécifiques du MC, telles que des mutations germinales dans certains gènes de susceptibilité incluant des régulateurs du cycle cellulaire comme
CDKN2A
,
CDK4
,
RB1
et
MITF
[
3
]. Concernant le MU, les gènes de susceptibilité sont notamment ceux impliqués dans la couleur claire des yeux ainsi que
BAP1 et MDB4
[
4
]. Le gène
BAP1
code une enzyme de dé-ubiquitination se liant à BRCA1 (protéine suppresseur de tumeur), tandis que le gène
MBD4
(
methyl-CpG binding domain 4
) code une ADN glycosylase impliquée dans le mécanisme de réparation des dommages à l’ADN. Celle-ci interagit avec l’ADN méthylé pour réparer les mésappariements G/T. Les mutations germinales de
BAP1 et MDB4
sont responsables d’une prédisposition au développement de tumeurs [
5
].
Au-delà des prédispositions génétiques des MC et MU, des mutations somatiques sont également à relever dans chacune de ces tumeurs. Dans le MC, elles concernent principalement la voie MAPK/ERK, incluant notamment des mutations de
BRAF
,
NRAS
et
NF1
retrouvées dans respectivement 50 %, 30 % et 15 % des MC, et la voie PI3K/AKT
(
Figure 1
)
[
6
]. La perturbation de la voie de signalisation PI3K/AKT conduit à une prolifération accrue, une survie cellulaire exacerbée et un développement du MC.
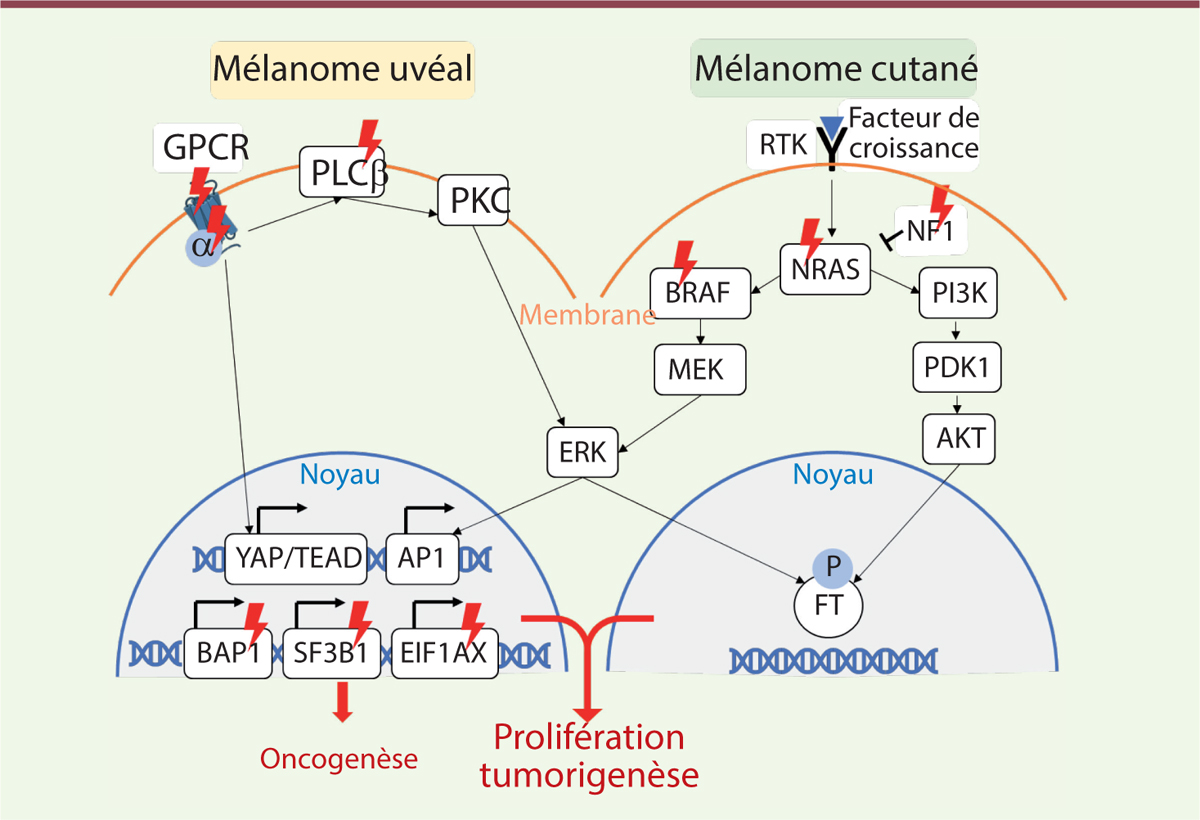
 | Figure 1.
Schéma des voies de signalisation impliquées dans les mélanomes uvéal et cutané.
Les protéines dont les gènes sont susceptibles d’être porteurs de mutations et d’être liés au développement d’un mélanome sont marquées d’un éclair rouge. Facteurs du MU : GPCR : récepteur couplé aux protéines G ; PLCβ : phospholipase C β ; PKC : protéine kinase C ; ERK :
extracellular signal-regulated kinases
; YAP/TEAD : équivalent de YAP/TAZ ; AP1 :
activator protein 1
; SF3B1 :
splicing factor 3b subunit 1
; EIF1AX :
eukaryotic translation initiation factor 1A X-linked
. Facteurs du MC : RTK : récepteur à activité tyrosine kinase ; NF1 : neurofibromine 1 ; PDK1 : pyruvate déshydrogénase kinase ; FT : facteur de transcription ; P : phosphorylation.
|
Dans le MU, des mutations somatiques ont été identifiées dans la sous-unité alpha de la protéine G hétérotrimérique GNAQ ou de son paralogue GNA11 [
7
]. Quatre-vingt pour cent des MU portent une mutation dans un de ces deux gènes conduisant à l’activation de l’axe phospholipase C-protéine kinase C, à la libération de calcium intracellulaire (Ca
2+
) et à des réponses cellulaires variées. GNAQ/11 induit également l’activation de la voie de signalisation Hippo-YAP/TAZ qui joue un rôle crucial lors de l’angiogenèse et de la prolifération tumorale. D’autres mutations dans les gènes
BAP1
,
EIF1AX
et
SF3B1
ont également été identifiées avec un impact sur le risque métastatique du MU [
8
].
Le MU primaire est également caractérisé par des anomalies chromosomiques, dont les plus importantes sont la monosomie du chromosome 3 et un gain du chromosome 8q, et qui peuvent être utilisées pour le pronostic en complément de la classification AJCC [
9
].
Ces deux mélanomes présentent donc des spécificités quant aux voies de signalisation mises en cause dans leur développement
(
Tableau I
)
. Des recherches sont en cours pour une meilleure compréhension des mécanismes moléculaires impliqués dans chaque type de mélanome et le développement de thérapies adaptées. Il n’y pas de facteurs environnementaux décrits pour le MU, mais il existe des facteurs phénotypiques liés au phototype clair. Les différentes couleurs de peaux, cheveux et yeux dépendent du rapport eumélanine/phéomélanine, significativement plus important dans la peau foncée et les yeux brun que dans la peau pâle et les yeux avec un iris de couleur claire [
10
]. La mélanine (eumélanine ou phéomélanine) est produite par les mélanocytes. Elle constitue un polymère absorbant la lumière qui protège contre l’effet nocif des rayonnements ultraviolets (UV) A et UVB du soleil. Jusqu’à présent, le mécanisme de la transformation des mélanocytes de l’œil en MU et le rôle que pourrait jouer la mélanine dans le MU n’ont pas été élucidés.
Tableau 1
|
|
Mélanome uvéal |
Mélanome cutané |
| Représentation |
|
95 % des mélanomes oculaires |
10 % des cancers cutanés |
| Incidence dans le monde |
|
0,7 cas pour 100 000 habitants |
10 cas pour 100 000 habitants |
| Potentiel métastatique |
|
50 % des cas |
60 à 80 % des cas |
| Symptômes |
|
Suivant la localisation de la tumeur dans l’oeil |
Lésion cutanée |
|
Environnementaux |
Pas connus |
Exposition solaire |
| Facteurs de risque |
Phénotypiques |
Yeux clairs, phototype clair, naevus |
Phototype clair, phénotype naevus |
|
Génétiques |
Mutations germinales
BAP1
et
MBD4
|
Mutations germinales
CDKN2A, CDK4
|
| Mutations somatiques initiatrices |
|
GNAQ/GNA11
|
BRAF, NRAS
et
NF1
|
| Traitement |
Tumeur primaire |
Protonthérapie Énucléation |
Excision chirurgicale |
|
Métastases |
Immunothérapie (IMCgp100) |
Immunothérapies (anti-PD-1, anti-CTLA-4) Thérapies ciblées (anti-BRAF, anti-MEK) |
Tableau récapitulatif et comparatif des mélanomes cutané et uvéal.
|
|
Des traitements envisageables pour ces deux pathologies
Les thérapies proposées pour ces pathologies dépendent, comme pour beaucoup d’autres, du stade auquel le mélanome est diagnostiqué. Dans le cas du MC de stade localisé, le traitement de référence est la chirurgie avec une exérèse et une marge de sécurité clinique déterminée selon l’indice de Breslow. En cas de MC avancé (envahissement ganglionnaire, métastase(s) à distance), des thérapies ciblées ou des immunothérapies sont actuellement proposées, ciblant la voie MAPK/ERK avec les inhibiteurs des kinases BRAF et/ou MEK, ou les inhibiteurs des points de contrôle immunitaire (PD-1 ou CTLA-4) [
12
] (
→
).
(→) Voir la Nouvelle de E. Papasotiriou
et al
., page 733 de ce numéro
En ce qui concerne le traitement du MU, la préoccupation principale est de traiter le cancer en essayant de conserver l’œil et, si possible, la vision. Le traitement choisi dépendra de la taille du mélanome, de son étendue et de sa localisation mais également du pays et de l’accessibilité aux techniques employées pour le traitement. Il n’existe à ce jour aucune différence en termes de survie entre un traitement conservant l’œil (radiothérapie) et un traitement ne le conservant pas (énucléation) [
11
]. Ainsi, en France, lorsque la conservation de l’œil est possible, le traitement de prédilection repose sur la protonthérapie, une technique de radiothérapie externe utilisant un faisceau de protons. Les MU de grande taille ou circonférentiels sont quant à eux majoritairement traités par énucléation, l’œil ne pouvant supporter un trop grand volume d’irradiation.
En cas d’existence de métastases, le MU ne peut pas être traité par les mêmes thérapies ciblées ou immunothérapies que celles utilisées dans le MC puisque les altérations génétiques et les facteurs étiologiques de ces deux tumeurs sont distincts. Toutefois, une nouvelle molécule d’immunothérapie, le tebentafusp, a montré des résultats prometteurs [
12
]. De plus, l’étude de l’hétérogénéité intra-tumorale, afin de découvrir de nouveaux marqueurs pronostics, pourrait offrir de nouvelles perspectives dans le traitement personnalisé des tumeurs, notamment grâce au séquençage de l’ARN sur cellule unique et l’identification de sous-populations cellulaires [
13
] (
→
).
(→) Voir la Nouvelle de E. Grandjean-Closson
et al
., page 737 de ce numéro
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
|
AJCC
|
American Joint Committee on Cancer
|
|
BAP1
|
BRCA1-associated protein 1
|
|
BRAF
|
B-Raf proto-oncogene serine/threonine kinase
|
|
CDK4
|
Cyclin-dependent kinase 4
|
|
CDKN2A
|
Cyclin-dependent kinase inhibitor 2A
|
|
CTLA-4
|
Cytotoxic T lymphocyte antigen 4
|
|
GNAQ
|
G Protein Subunit Alpha q
|
|
HES6
|
Hairy/Enhancer of Split (Hes) 6
|
|
MAPK/ERK
|
Mitogen-activated protein kinase/extracellular signal-regulated kinase
|
|
MEK
|
MAP kinase kinase
|
|
MITF
|
Microphthalmia-associated transcription factor
|
|
NF1
|
Neurofibromatosis factor 1 (NF1)
|
|
NRAS
|
Neuroblastoma RAS viral oncogene homolog
|
|
PD-1
|
Programmed cell death protein 1
|
|
PI3K
|
Phosphoinositide 3-kinase
|
|
RB1
|
RB transcriptional corepressor 1
|
|
TCGA
|
The cancer genome atlas
|
|
YAP/TAZ
|
Yes
-
associated protein/ transcriptional coactivator with PDZ-binding motif
|
|
1.
Kujala
E
,
Mäkitie
T
,
Kivelä
T
.
Very long-term prognosis of patients with malignant uveal melanoma.
.
Invest Ophthalmol Vis Sci.
2003;
;
44
:
:4651.
–
4659
.
2.
Eggermont
AMM
,
Spatz
A
,
Robert
C
.
Cutaneous melanoma.
.
Lancet.
2014;
;
383
:
:816.
–
827
.
3.
Eide
N
,
Hoifødt
HK
,
Nesland
JM
,
et al.
Disseminated tumour cells in bone marrow of patients with uveal melanoma.
.
Acta Ophthalmol (Copenh).
2013;
;
91
:
:343.
–
348
.
4.
Jager
MJ
,
Shields
CL
,
Cebulla
CM
,
et al.
Uveal melanoma.
.
Nat Rev Dis Primer.
2020;
;
6
:
:24.
.
5.
Palles
C
,
West
HD
,
Chew
E
,
et al.
Germline MBD4 deficiency causes a multi-tumor predisposition syndrome.
.
Am J hum Genet.
2022;
;
109
:
:953.
–
960
.
6.
Network
Cancer Genome Atlas
.
Genomic Classification of Cutaneous Melanoma.
.
Cell.
2015;
;
161
:
:1681.
–
1696
.
7.
Smit
KN
,
Jager
MJ
,
de Klein
A
,
et al.
Uveal melanoma: Towards a molecular understanding.
.
Prog Retin Eye Res.
2020;
;
75
:
:100800.
.
8.
Robertson
AG
,
Shih
J
,
Yau
C
,
et al.
Integrative analysis identifies four molecular and clinical subsets in uveal melanoma.
.
Cancer Cell.
2017;
;
32
:
:204.
–
220.e15
.
9.
Cassoux
N
,
Rodrigues
MJ
,
Plancher
C
,
et al.
Genome-wide profiling is a clinically relevant and affordable prognostic test in posterior uveal melanoma.
.
Br J Ophthalmol.
2014;
;
98
:
:769.
–
774
.
10.
Wakamatsu
K
,
Hu
DN
,
McCormick
SA
,
Ito
S
.
Characterization of melanin in human iridal and choroidal melanocytes from eyes with various colored irides.
.
Pigment Cell Melanoma Res.
2008;
;
21
:
:97.
–
105
.
11.
Papakostas
TD
,
Lane
AM
,
Morrison
M
,
et al.
Long-term outcomes after proton beam irradiation in patients with large choroidal melanomas.
.
JAMA Ophthalmol.
2017;
;
135
:
:1191.
–
1196
.
12.
Papasotiriou
E
,
Chessel
E
,
Costa
C
,
et al.
Quels traitements pour le mélanome uvéal ?
Med Sci (Paris).
2022;
;
38
:
:733.
–
6
.
13.
Grandjean-Closson
E
,
Heckmann
C
,
Le Coz
C
,
et al.
L’analyse des mélanomes uvéaux primaires à l’aide de la technique de séquençage d’ARN en cellules uniques.
.
Med Sci (Paris).
2022;
;
38
:
:737.
–
9
.
|