Vignette (© DR).
La pandémie de la COVID-19 ( coronavirus disease 2019 ) reste un objet de recherche en biologie-santé, mais également dans de nombreuses autres disciplines, sociologie, psychologie, philosophie des sciences, sciences politiques, pour n’en citer que quelques-unes. C’est aussi un perturbateur de nos sociétés et, de ce fait, un riche objet d’étude. La COVID-19 a ainsi joué le rôle d’un « stress-test » pour nos systèmes de protection sanitaire et pour nos mécanismes décisionnels en santé.
Les actions des gouvernants, et plus particulièrement des responsables de la santé, en cette période de pandémie peut s’analyser selon trois critères :
1) La modélisation de l’évolution de l’épidémie, pour aider la décision politique de sécurisation sanitaire de la population ; rappelons à cet égard la définition de la santé selon l’Organisation mondiale de la santé (OMS), qui prend en compte non seulement le bien-être physique, mais aussi le bien-être moral et le bien-être social ;
2) L’accompagnement de l’épidémie : prise en charge et soins des personnes malades ;
3) La prévention de l’épidémie par une thérapie prophylactique ou en éliminant autant que faire se peut la circulation du virus.
Ces actions et leur analyse ont évolué avec le corpus de connaissances sur la pandémie et sur le virus, qui s’est construit progressivement. Dans les faits, ce corpus s’est construit très rapidement grâce aux nombreuses actions menées internationalement. Cette construction a cependant été largement « polluée » par son utilisation par des communautés non académiques aux convictions contradictoires, ce qui a rendu difficile la production de « connaissances certifiées », validées par les agences sanitaires pour être utilisables par les décideurs.
Dans cet article, nous essayons de discuter comment le choix du modèle des modes de contamination du virus SARS-CoV-2 ( severe acute respiratory syndrome-coronavirus-2 ) a effectivement contribué à l’édification d’une décision politique.
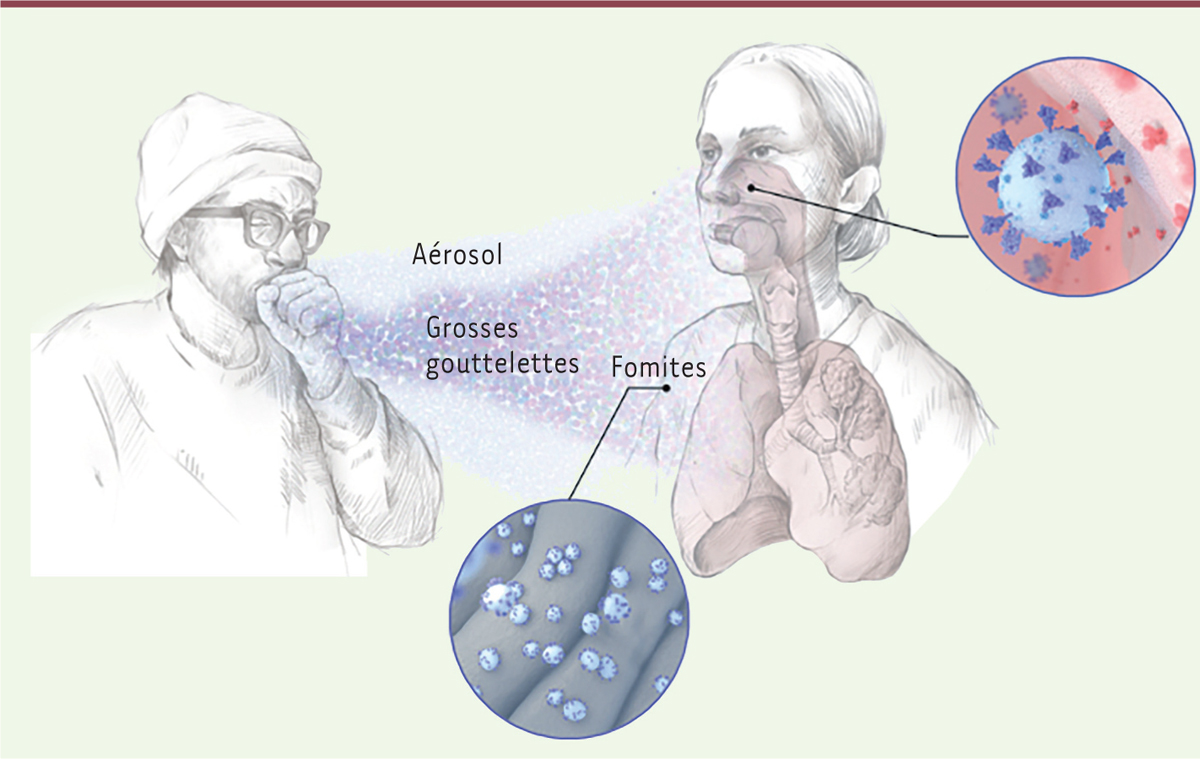
La transmission des virus peut se faire de trois manières ( Figure 1 ) :
1) Par contact direct (voie manuportée), par l’intermédiaire de fomites 1 ;
2) Par de grosses gouttelettes, que l’on nomme gouttelettes balistiques, car leurs mouvements sont guidés principalement par la pesanteur ; celles-ci sont projetées lorsque l’on tousse, éternue ou postillonne ; ces gouttelettes parcourent des distances en moyenne inférieures à deux mètres, et participent à la contamination lorsqu’elles se déposent et forment des fomites ;
3) Par aérosol, aéroportée, par une brume de fines gouttelettes, qui restent en suspension dans l’air et voyagent dans un espace clos, selon les mouvements de l’air.
Les gouttelettes voient leurs tailles se modifier en fonction de phénomènes d’évaporation, qui dépendent des conditions de température et d’humidité, mais aussi selon leur composition. Elles sont issues de la salive ou du mucus nasal ou bronchique. On peut concevoir la transformation, par évaporation, des grosses gouttelettes balistiques en brumes aéroportées.
À chaque mode de transmission correspondent des mesures pour en restreindre la portée. Pour prévenir une contamination par des fomites, une bonne hygiène des mains, le nettoyage de son environnement et de tous les éléments que l’on introduit dans son espace de vie sont nécessaires. En revanche, dans ce cas, les masques ne sont pas utiles, sauf pour les personnels soignants impliqués dans des gestes pouvant générer une aérolisation ou être confrontés à des patients toussant et éternuant.
Pour prévenir une contamination par les gouttelettes balistiques, il faut ajouter aux mesures d’hygiène, la distanciation physique et des masques capables de les bloquer et de s’en protéger. Dans ce cas, les masques chirurgicaux et les masques FFP2 ( filtering facepiece , ou en français, pièce faciale filtrante de classe 2) ne sont pas beaucoup plus utiles que des masques en tissus. On réserve donc ces masques FFP2 aux centres hospitaliers, pour protéger les soignants des éventuels aérosols formés.
Si la contamination se fait par aérosols, les masques FFP2 permettent la meilleure protection, les masques chirurgicaux offrant une protection moins efficace [ 1 ]. Pour cette raison, les masques FFP2 sont indispensables dans les centres hospitaliers et pour l’ensemble des soignants. Le renouvellement d’air des endroits clos permet également de diluer la concentration de cette brume virale et, ainsi, d’éviter la contamination à longue distance.
On voit donc bien que les décisions de politique de santé sont étroitement liées aux connaissances scientifiques sur les modes de contaminations, considérées comme validées par les agences sanitaires et les conseillers scientifiques et médicaux, à un moment donné. Il existe également une hiérarchie entre les différentes mesures de protection : il est en effet plus simple et moins coûteux pour la société de se protéger quand on est face à une contamination majoritairement manuportée, plutôt que face à une contamination aéroportée.