| |
| Med Sci (Paris). 38(8-9): 679–685. doi: 10.1051/medsci/2022108.La stimulation magnétique répétée pour le traitement des traumas spinaux Pauline Michel-Flutot1* and Stéphane Vinit1** 1Université Paris-Saclay, UVSQ, Inserm U1179, END-ICAP
,
78000Versailles
,
France |
Vignette (© DR).
Les traumas spinaux sont à l’origine de paralysies motrices permanentes dues à l’atteinte des voies nerveuses provenant de la moelle épinière et responsables de l’innervation des différents muscles. Selon l’Organisation mondiale de la santé (OMS), entre 250 0000 et 500 000 nouveaux cas de traumas spinaux sont recensés chaque année dans le monde [
1
]. Ils sont généralement liés à des accidents de la circulation, des chutes, des violences, ou sont en lien avec la pratique d’un sport. Lorsqu’ils touchent la moelle cervicale, ces traumas conduisent, en plus des paralysies motrices des membres supérieurs et inférieurs, à une insuffisance respiratoire due à une paralysie du diaphragme, le principal muscle inspiratoire. Une assistance respiratoire est alors requise pour permettre à ces patients de survivre. La recherche et le développement de nouvelles thérapies, de préférence non invasives, représentent donc un défi pour espérer obtenir, un jour, une récupération complète des capacités perdues.
|
La stimulation magnétique
La stimulation magnétique transcrânienne répétée est couramment utilisée dans le traitement de diverses maladies neurologiques ou psychiatriques, telles que le trouble bipolaire ou le trouble de stress post-traumatique, afin de moduler l’activité neuronale du cerveau [
2
,
3
]. Cette stimulation est délivrée par une bobine de cuivre qui transforme le courant électrique la traversant en un champ magnétique de haute intensité
(
Figure 1
)
. Celui-ci induit localement un champ électrique cortical qui provoque des déplacements de charges ioniques à travers la membrane plasmique des neurones. Ces flux ioniques peuvent dépolariser ces neurones, voire induire des trains de potentiels d’action permettant de stimuler les neurones qui leur sont connectés, jusqu’à produire la contraction des muscles innervés par les motoneurones correspondants. Ces contractions musculaires peuvent alors être enregistrées à l’aide d’électrodes placées sur la main ou la jambe, sous la forme de potentiels évoqués moteurs, qui reflètent l’excitabilité générale et la conductivité du système nerveux central. En cas de lésion de la moelle épinière, la stimulation magnétique transcrânienne ou trans-spinale appliquée de façon répétée pourrait constituer une alternative non invasive à la stimulation électrique épidurale, dont les effets bénéfiques sur la récupération fonctionnelle ont déjà été montrés [
4
].
 | Figure 1.
La stimulation magnétique
. Appareil de stimulation magnétique (
A
) connecté à une bobine en forme de huit (
B
).
|
|
Effets moléculaires et cellulaires de la stimulation magnétique répétée sur la modulation de l’activité neuronale
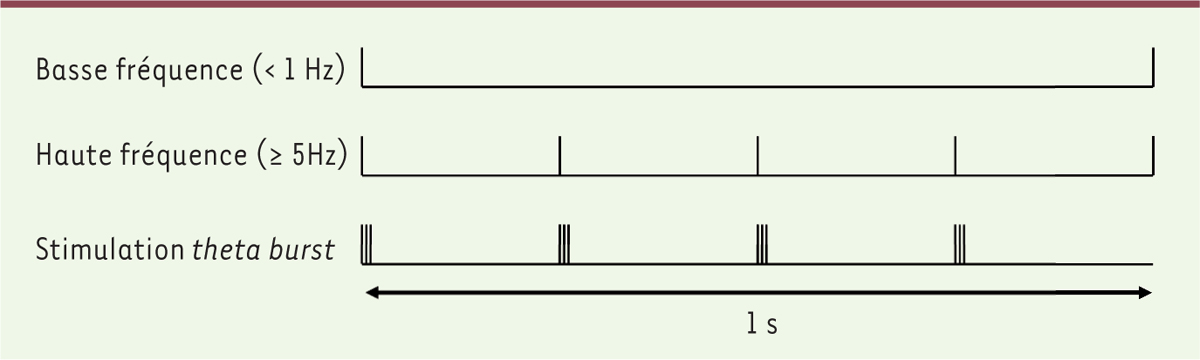
La SMr peut modifier l’excitabilité corticale ou spinale, selon le site où elle est appliquée, soit en l’augmentant, soit en la diminuant. Les effets de cette neuromodulation peuvent être observés dès la fin de la période de stimulation. L’augmentation de l’excitabilité neuronale est généralement obtenue par des protocoles de SMr « de haute fréquence ». Elle est due à un mécanisme similaire à celui de la potentialisation à long terme
1
(obtenue après une stimulation par des trains de potentiels d’action dont la fréquence est supérieure à 5 Hz) [
5
–
7
]. La réduction de l’excitabilité, quant à elle, est associée aux protocoles de SMr « de basse fréquence » (≤ 1 Hz), et son mécanisme est semblable à celui de la dépression à long terme
2
[
6
,
8
]
(
Figure 2
)
. Un autre type de stimulation magnétique répétée, appelée stimulation «
thêta burst
» (STB), qui consiste généralement en l’application de trois stimulation à 50 Hz répétées à une fréquence de 5 Hz (fréquence comprise dans l’intervalle de fréquences des ondes thêta de l’électroencéphalogramme, d’où le nom donné à ce type de stimulation), peut induire, comme c’est le cas des autres protocoles de SMr, soit un effet excitateur, si le protocole est appliqué de façon intermittente, soit un effet inhibiteur, s’il est appliqué de façon continue [
9
,
10
]
(
Figure 2
)
.
 | Figure 2.
Exemples de protocoles de stimulation magnétique répétée, utilisés en clinique, dans les modèles in vitro et dans les modèles précliniques.
Chaque trait vertical représente une stimulation. Les protocoles de stimulation magnétique répétée à basse fréquence (≤ 1 Hz) induisent une réduction d’excitabilité des neurones, alors que les protocoles à haute fréquence (≥ 5 Hz) induisent une augmentation d’excitabilité. Quant aux protocoles de stimulation magnétique du type
thêta burst
, ils sont connus pour induire une réduction d’excitabilité des neurones lorsque la stimulation est appliquée de façon continue, et une augmentation d’excitabilité lorsqu’elle l’est de façon intermittente.
|
Effets de la stimulation magnétique répétée sur les systèmes nerveux excitateur et inhibiteur
L’intérêt des chercheurs s’est porté sur la capacité des protocoles de SMr à modifier l’excitabilité des systèmes neuronaux et à induire des phénomènes plastiques, en particulier pour la neurotransmission excitatrice glutamatergique et la neurotransmission inhibitrice GABA (acide γ-aminobutyrique) ergique [
8
]. En ce qui concerne la neurotransmission glutamatergique,
in vitro
, dans un modèle de culture de neurones, l’étude de la modulation des synapses excitatrices des neurones matures du cortex CA1 de l’hippocampe
3,
par SMr à une fréquence de 10 Hz a montré que ce protocole conduit à une augmentation du « poids synaptique »
4,
des synapses glutamatergiques. Cette augmentation s’accompagne globalement d’un remodelage des épines dendritiques de ces neurones, ainsi que d’une augmentation du nombre de récepteurs post-synaptiques du glutamate de type AMPA (α-amino-3-hydroxy-5-méthylisoxazol-4-propionate) contenant la sous-unité GluA1 (ou
AMPA receptor 1
). Le remodelage dendritique reposerait sur l’activation de canaux sodiques et de canaux calciques (de type L) dépendant du voltage, et des récepteurs du glutamate de type NMDA (N-méthyl-D-aspartate) [
5
,
7
]. En ce qui concerne la neurotransmission GABAergique, ce protocole induit une réduction du poids synaptique des synapses GABAergiques. Cette réduction dépendrait du calcium et impliquerait un remodelage post-synaptique, avec une réduction de l’expression des protéines d’échafaudage, les géphyrines [
11
]. Ces résultats, obtenus
ex vivo,
révèlent des mécanismes qui participent à l’augmentation de l’excitabilité neuronale induite par la SMr à haute fréquence.
In vivo
, chez le rat, les protocoles de STB continue et de STB intermittente ont des effets différents sur les systèmes corticaux inhibiteurs. La STB intermittente permet une augmentation de l’amplitude des réponses évoquées sensorielles, associée à une réduction de l’expression de la parvalbumine, une protéine associée à la signalisation calcique, dans les interneurones inhibiteurs GABAergiques qui l’expriment, modifiant ainsi leur activité [
12
,
13
]. Administrée de façon aiguë
5
, la STB (stimulation
thêta burst
) intermittente provoque, en plus de la réduction du nombre d’interneurones GABAergiques exprimant la parvalbumine, une augmentation de l’expression du neuropeptide Y dans le cortex, qui serait impliqué dans la réduction de la transmission glutamatergique. En effet, une réduction concomitante de l’expression du transporteur du glutamate vGluT1 présynaptique a été rapportée dans les neurones corticaux [
14
]. Ces deux effets inverses de la STB intermittente sur la transmission glutamatergique peuvent s’expliquer par une tentative du système de prévenir toute modification de l’équilibre entre excitation et inhibition, tout en permettant une forme de plasticité [
14
]. Les effets de potentialisation à long terme associés aux protocoles de STB impliqueraient donc une modulation des systèmes corticaux excitateurs et inhibiteurs [
12
].
Les protocoles de STB effectuée en continu, de même que les protocoles de SMr effectués à basse fréquence, permettent une modulation de l’expression, dans les interneurones inhibiteurs corticaux, d’autres molécules, telles que les enzymes GAD65 (acide glutamique décarboxylase de 65 KDa) et GAD67 ou le transporteur GAT-1 (
GABA transporter 1
). Un renforcement des synapses GABAergiques inhibitrices est observé suite à l’administration de ce type de protocole (STB continu ou SMr à basse fréquence) [
15
], conduisant de fait à une diminution de l’excitabilité neuronale.
Effets de la stimulation magnétique répétée sur l’activité cellulaire
Les traitements par SMr ont également des effets à l’échelle cellulaire. Les effets bénéfiques de la SMr à haute fréquence reposeraient sur une augmentation de la neurogenèse dans le gyrus denté de l’hippocampe. Chez le rat, elle peut être évaluée en dénombrant les cellules en cours de division (marquées avec la bromodéoxyuridine [BrdU]) chez les animaux soumis à un protocole de SMr chronique
5
à une fréquence de 25 Hz par comparaison avec des animaux témoins [
16
]. Ce processus pourrait être responsable de l’effet anti-dépresseur des protocoles de SMr à haute fréquence [
16
]. Chez le rat, l’application de protocoles aigus de SMr à haute ou à basse fréquence provoque une augmentation de l’expression neuronale de c-Fos (activation d’une voie de signalisation cellulaire) et de Zif268 (impliqué dans des processus de plasticité synaptique et de formation de la mémoire), montrant l’accroissement d’activité de transcription génique des cellules activées par les protocoles de SMr [
17
].
Dans les cellules gliales, le traitement par SMr conduit à une augmentation de la quantité d’ARN messager codant la GFAP (
glial fibrillary acidic protein
), une protéine du cytosquelette principalement exprimée par les astrocytes, ce qui indique que les protocoles de SMr pourraient également moduler l’activité astrogliale [
18
]. Néanmoins, une étude récente utilisant un protocole de SMr à 100 Hz durant trois jours chez le rat n’a montré aucun impact de la SMr sur les cellules astrogliales et microgliales [
19
]. Le nombre de cellules microgliales ne serait pas affecté par l’application d’un protocole de SMr délivrée à basse fréquence chez le rat sain [
20
]. Concernant les oligodendrocytes, l’application de protocoles de SMr
in vitro
, sur des cellules en culture, induit une augmentation de leur sécrétion de facteurs neurotrophiques, et,
in vivo
chez le rat, induit une augmentation de leur activité de myélinisation des axones des neurones de l’hippocampe [
21
–
23
]. La SMr permettrait par ailleurs une différenciation plus rapide des cellules progénitrices des oligodendrocytes en oligodendrocytes matures [
21
,
23
]. Il sera donc nécessaire de porter une attention particulière au choix des protocoles de SMr utilisés pour le développement de futures applications cliniques.
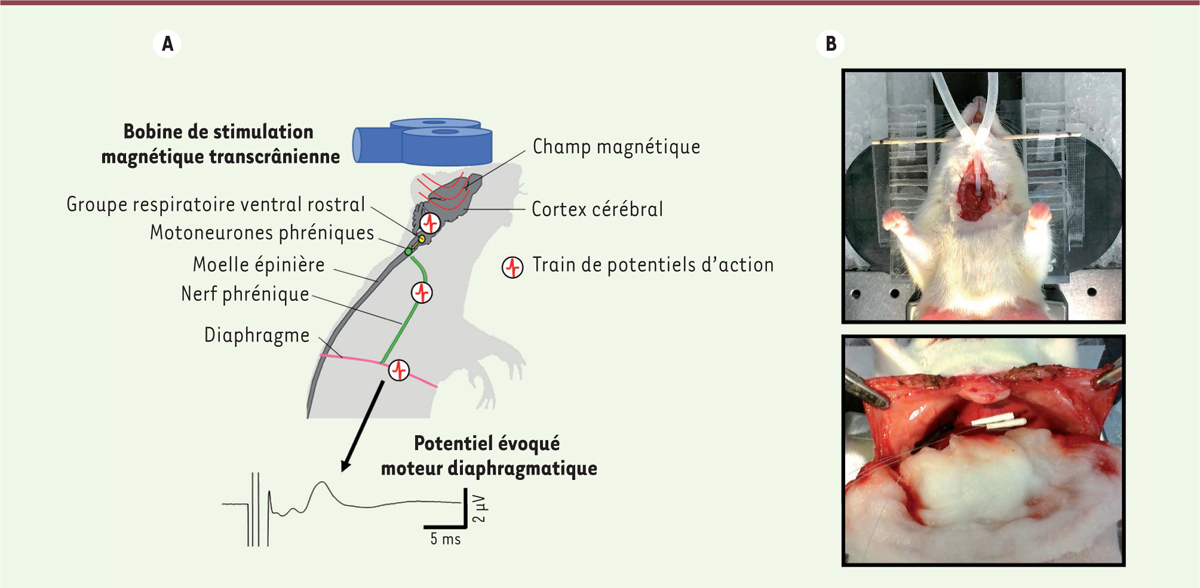
Récemment, nous avons observé que l’application aiguë d’un protocole de SMr délivrée à 10 Hz chez le rat sain anesthésié conduit à une augmentation durable de l’excitabilité du réseau neuronal phrénique qui innerve le muscle diaphragmatique [
24
]. Cette augmentation d’excitabilité neuronale, révélée par l’enregistrement des potentiels évoqués moteurs diaphragmatiques [
25
–
27
]
(
Figure 3
)
, serait induite par une levée de l’inhibition GABAergique dans le réseau neuronal phrénique [
24
]. Ces résultats confirment l’existence d’une neuromodulation de l’activité neuronale qui est permise par une modulation de la balance excitation/inhibition induite par les protocoles de SMr. Cet effet facilitateur ou excitateur de la SMr pourrait être utilisé de façon bénéfique en renforçant, par exemple, les voies motrices intraspinales dans le cas de déficits locomoteurs ou respiratoires, comme cela est souvent le cas à la suite d’un trauma de la moelle cervicale.
 | Figure 3.
Enregistrement de potentiels évoqués moteurs diaphragmatiques. A.
Schéma de l’application du champ magnétique sur le crâne d’un rat et de la propagation du stimulus jusqu’au diaphragme. L’enregistrement du potentiel évoqué moteur diaphragmatique est indiqué. L’étude de l’amplitude des potentiels évoqués moteurs diaphragmatiques permet d’évaluer l’effet de protocoles de stimulation magnétique répétée sur l’excitabilité du réseau neuronal phrénique (figure adaptée de [
27
]).
B.
Photographies montrant le positionnement du rat sur la bobine de stimulation magnétique (en haut) et celui des électrodes d’enregistrement implantées dans le diaphragme de l’animal (en bas).
|
|
La stimulation magnétique répétée appliquée à des modèles précliniques de trauma spinal
La SMr induit divers effets selon la fréquence et la puissance ou le type de stimulation utilisés. L’utilisation de modèles animaux est nécessaire afin de mieux comprendre les mécanismes impliqués dans la modulation de l’excitabilité et la plasticité synaptique observées. Cela est d’autant plus important que des protocoles de SMr transcrânienne (le plus souvent entre 1 Hz et 10 Hz) sont déjà utilisés chez l’homme après un trauma spinal [
28
–
31
].
Les potentiels effets bénéfiques de ces traitements par SMr ont été étudiés dans plusieurs modèles précliniques mimant diverses maladies, en particulier chez le rat. Ces études visent à élucider les mécanismes moléculaires et cellulaires à l’origine des effets bénéfiques induits par la SMr sur ces maladies dans le but de les potentialiser en clinique [
6
]. Dans le cadre des traumas spinaux, la stimulation électrique épidurale, qui agit sur l’excitabilité des réseaux neuronaux de manière invasive
6,
, a montré des effets fonctionnels bénéfiques chez l’homme [
4
]. L’utilisation de la SMr serait donc d’un grand intérêt pour les patients [
32
], car elle a la même finalité tout en étant beaucoup moins invasive. Dans les modèles précliniques de trauma spinal, les effets des protocoles de SMr peuvent être évalués par l’enregistrement de potentiels évoqués musculaires [
24
-
26
,
33
-
35
], ou par des analyses à l’échelle cellulaire et moléculaire [
14
,
35
,
36
].
Le devenir de populations de cellules gliales après traitement par SMr à haute fréquence a également été étudié, en particulier dans un modèle de compression thoracique chez le rat. Dans ce modèle, un protocole chronique de SMr à 25 Hz provoque une réduction de la surface occupée par les cellules maquées par la GFAP et la Iba1 (
ionized calcium-binding adapter molecule 1
), astrocytes et microglies/macrophages respectivement, dans les cornes ventrales et dorsales de la moelle épinière lombaire, dans les segments métamériques L4 et L5. Chez l’animal sain, la GFAP et la Iba1 sont exprimées respectivement par les astrocytes et les cellules microgliales. Elles deviennent réactives
7
et leurs quantités augmentent en cas d’inflammation. Le traitement chronique par SMr pourrait ainsi réduire certains phénomènes inflammatoires dans la moelle épinière après trauma, ainsi que la douleur neuropathique associée. En effet, l’activation des cellules neurales de la corne dorsale par les astrocytes réactifs ainsi que la microglie activée seraient responsables de ces douleurs [
37
].
D’autres études ont concerné les effets fonctionnels de la SMr, parfois couplée à d’autres thérapies [
38
]. Ses effets sur la spasticité, sur les douleurs neuropathiques, et, plus particulièrement, sur la récupération et la réhabilitation locomotrice, ont été évalués. Chez le rat, un traitement par SMr à 20 Hz dix minutes après une contusion thoracique (une lésion de la moelle thoracique) induit une amélioration du score BBB (Basso, Beattie et Bresnahan)
8
dans les semaines qui suivent, par rapport à des animaux non traités, ainsi qu’une augmentation de l’amplitude des potentiels évoqués moteurs enregistrés sur les pattes avant de l’animal [
39
]. L’application d’un protocole de STB intermittente en chronique après une compression de la moelle épinière thoracique, permet également d’agir sur plusieurs paramètres de la motricité. En effet, une amélioration du score BBB pour des compressions de la moelle épinière thoracique légères et modérées (mais pas sévères) est observée, et s’accompagne d’une augmentation de l’expression spinale de GAP-43 (
growth-associated protein 43
), une protéine marqueur des cônes de croissance des axones, ce qui reflète une augmentation du remodelage neuronal. Une forme de plasticité neuronale intraspinale pourrait donc être à l’origine de la récupération de la fonction locomotrice que l’on observe à la suite d’un traitement par SMr [
40
]. L’application d’un protocole chronique de SMr délivrée à 10 Hz chez le rat après une hémisection de la moelle au niveau du segment métamérique cervical C2 conduit également à un renforcement de l’activité de l’hémidiaphragme non affecté par la lésion, une forme de compensation visant à pallier la perte d’activité de l’hémidiaphragme affecté. Un renforcement de voies intraspinales croisées, qui étaient « silencieuses » avant la lésion (ces voies existent mais ne sont pas utilisées en conditions physiologiques. Elles peuvent ainsi être recrutées en cas de trauma spinal), est aussi observé, ainsi qu’une modulation des processus inflammatoires au site lésionnel. Ces résultats laissent donc entrevoir de nouvelles perspectives thérapeutiques associées à la SMr afin d’induire une récupération de la fonction respiratoire après un trauma spinal cervical [
35
].
Plusieurs approches thérapeutiques ont été associées à la SMr afin d’en potentialiser les effets. Ainsi, chez la souris, après hémisection de la moelle épinière thoracique, l’application chronique d’un traitement par SMr à 20 Hz, combinée à l’administration d’un anticorps neutralisant dirigé contre la molécule répulsive de guidage axonal A (
repulsive guidance molecule a,
RGMa), majore l’amélioration locomotrice induite par l’administration de l’anticorps seul [
41
]. De même, après contusion thoracique chez le rat, un protocole de SMr à 0,5 Hz ou 10 Hz combiné à une transplantation de cellules souches mésenchymateuses isolées de cordon ombilical humain a conduit à une amélioration du score BBB comparativement aux animaux témoins, ainsi qu’à une augmentation de l’amplitude des potentiels évoqués moteurs et à une réduction de l’apoptose neuronale post-traumatique [
42
]. De même, l’association d’un traitement chronique par SMr à 10 Hz à un entraînement passif sur pédalier a conduit à une augmentation significative du score BBB par rapport à l’effet bénéfique de chacun de ces traitements administrés séparément [
43
].
Une alternative à la SMr transcrânienne du cortex cérébral est la SMr de la moelle épinière par voie trans-spinale, appliquée en particulier au-dessus du site lésionnel. Chez la souris, après contusion thoracique, un protocole chronique de SMr à 15 Hz au niveau de la lésion, prolongé (une fois par jour pendant trois semaines) durant les trois semaines suivant le traumatisme, a conduit à une augmentation du score BBB chez les animaux traités [
44
]. De même, après transsection de la moelle épinière thoracique ou transsection du funicule
9
dorsal, un protocole de SMr à 10 Hz, appliqué pendant dix minutes par jour durant deux semaines, a conduit à une amélioration de la fonction locomotrice des animaux.
L’analyse protéomique de la moelle épinière au niveau de la zone lésée, après l’application du protocole de SMr, met en évidence la modulation de l’expression de 160 protéines, avec, plus particulièrement, une diminution de l’expression des protéines impliquées dans l’apoptose et la mort neuronale. En revanche, les molécules participant au développement ou à la prolifération des neurones et à la genèse ou à la croissance des axones sont surexprimées. Une réduction de la démyélinisation axonale est par ailleurs observée [
45
]. Ce protocole, appliqué chez le rat durant deux semaines après une contusion ou une transsection de la moelle épinière thoracique, induit également une amélioration de la fonction locomotrice, et une réduction de la formation de syrinx
10
au site lésionnel [
46
]. En revanche, un protocole de SMr à basse fréquence, en continu durant 35 minutes après contusion thoracique, n’entraîne aucune récupération durable de la motricité, et aucune amélioration de la transmission synaptique neuromusculaire, sauf s’il est combiné à un protocole d’exercice physique, ou s’il est concomitant à l’administration de neurotrophine 3 (par transfection avec un adénovirus) [
47
].
|
Conclusion et perspectives
La SMr est une technique non invasive, déjà utilisée pour le traitement de certaines maladies, ce qui rend envisageable son application pour des patients ayant subi une blessure de la moelle épinière. Cependant, il reste fondamental de comprendre les mécanismes cellulaires et moléculaires induits par la SMr participant à la modulation de l’activité des réseaux neuronaux, afin de pouvoir cibler la meilleure fenêtre temporelle pour son application thérapeutique et de déterminer le protocole permettant d’optimiser ses effets bénéfiques fonctionnels. Dans les modèles précliniques de trauma spinal, l’amélioration des fonctions motrices, bien que limitée, diffère selon le protocole de SMr appliqué. Par ailleurs, associer la SMr à d’autres approches thérapeutiques semble potentialiser ses effets bénéfiques. En effet, l’association d’un protocole de SMr visant à moduler l’activité neuronale avec des approches thérapeutiques modifiant l’environnement périneuronal pour le rendre plus permissif aux processus de plasticité neuronale, pourrait potentialiser l’efficacité de ce protocole. Ainsi, l’administration de chondroïtinase ABC (un inhibiteur des protéoglycanes du type chondroïtine sulfate, des molécules périneuronales inhibitrices des processus de plasticité synaptique) ou la transplantation de cellules neurales au site lésionnel induisent une récupération fonctionnelle après un trauma spinal [
48
]. Bien que ces thérapies soient invasives, elles pourraient potentialiser les améliorations fonctionnelles obtenues en utilisant un protocole de SMr adapté, et ouvrir ainsi de nouvelles perspectives thérapeutiques en vue d’une récupération complète des capacités motrices perdues consécutives à un trauma de la moelle épinière.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
World Health Organisation.
.
Spinal cord injury.
.
Geneva:
:
WHO;
,
2013
.
2.
McClintock
SM
,
Reti
IM
,
Carpenter
LL
,
et al.
Consensus recommendations for the clinical application of repetitive transcranial magnetic stimulation (rTMS) in the treatment of depression.
.
J Clin Psychiatry.
2018
;
:79.
.
3.
Kozel
FA
.
Clinical repetitive transcranial magnetic stimulation for posttraumatic stress disorder, generalized anxiety disorder, and bipolar disorder.
.
Psychiatr Clin North Am.
2018;
;
41
:
:433.
–
446
.
4.
Choi
E
,
Gattas
S
,
Brown
N
,
et al.
Epidural electrical stimulation for spinal cord injury.
.
Neural Regen Res.
2021;
;
16
:
:2367.
–
75
.
5.
Vlachos
A
,
Muller-Dahlhaus
F
,
Rosskopp
J
,
et al.
Repetitive magnetic stimulation induces functional and structural plasticity of excitatory postsynapses in mouse organotypic hippocampal slice cultures.
.
J Neurosci.
2012;
;
32
:
:17514.
–
17523
.
6.
Tang
A
,
Thickbroom
G
,
Rodger
J
.
Repetitive transcranial magnetic stimulation of the brain: Mechanisms from animal and experimental Models.
.
Neuroscientist.
2017;
;
23
:
:82.
–
94
.
7.
Lenz
M
,
Platschek
S
,
Priesemann
V
,
et al.
Repetitive magnetic stimulation induces plasticity of excitatory postsynapses on proximal dendrites of cultured mouse CA1 pyramidal neurons.
.
Brain Struct Funct.
2015;
;
220
:
:3323.
–
3337
.
8.
Lenz
M
,
Vlachos
A
.
Releasing the cortical brake by non-invasive electromagnetic stimulation? rTMS Induces LTD of GABAergic neurotransmission.
.
Front Neural Circuits.
2016;
;
10
:
:96.
.
9.
Lefaucheur
JP
.
Transcranial magnetic stimulation.
.
Handb Clin Neurol.
2019;
;
160
:
:559.
–
580
.
10.
Huang
Y-Z
,
Edwards
MJ
,
Rounis
E
,
et al.
Theta burst stimulation of the human motor cortex.
.
Neuron.
2005;
;
45
:
:201.
–
206
.
11.
Lenz
M
,
Galanis
C
,
Muller-Dahlhaus
F
,
et al.
Repetitive magnetic stimulation induces plasticity of inhibitory synapses.
.
Nat Commun.
2016;
;
7
:
:10020.
.
12.
Benali
A
,
Trippe
J
,
Weiler
E
,
et al.
Theta-burst transcranial magnetic stimulation alters cortical inhibition.
.
J Neurosci.
2011;
;
31
:
:1193.
–
1203
.
13.
Labedi
A
,
Benali
A
,
Mix
A
,
et al.
Modulation of inhibitory activity markers by intermittent theta-burst stimulation in rat cortex is NMDA-receptor dependent.
.
Brain Stimul.
2014;
;
7
:
:394.
–
400
.
14.
Jazmati
D
,
Neubacher
U
,
Funke
K
.
Neuropeptide Y as a possible homeostatic element for changes in cortical excitability induced by repetitive transcranial magnetic stimulation.
.
Brain Stimul.
2018;
;
11
:
:797.
–
805
.
15.
Trippe
J
,
Mix
A
,
Aydin-Abidin
S
,
et al.
theta burst and conventional low-frequency rTMS differentially affect GABAergic neurotransmission in the rat cortex.
.
Exp Brain Res.
2009;
;
199
:
:411.
–
421
.
16.
Ueyama
E
,
Ukai
S
,
Ogawa
A
,
et al.
Chronic repetitive transcranial magnetic stimulation increases hippocampal neurogenesis in rats.
.
Psychiatry Clin Neurosci.
2011;
;
65
:
:77.
–
81
.
17.
Aydin-Abidin
S
,
Trippe
J
,
Funke
K
,
et al.
High- and low-frequency repetitive transcranial magnetic stimulation differentially activates c-Fos and zif268 protein expression in the rat brain.
.
Exp Brain Res.
2008;
;
188
:
:249.
–
261
.
18.
Fujiki
M
,
Steward
O
.
High frequency transcranial magnetic stimulation mimics the effects of ECS in upregulating astroglial gene expression in the murine CNS.
.
Brain Res Mol Brain Res.
1997;
;
44
:
:301.
–
308
.
19.
Zorzo
C
,
Higarza
SG
,
Méndez
M
,
et al.
High frequency repetitive transcranial magnetic stimulation improves neuronal activity without affecting astrocytes and microglia density.
.
Brain Res Bull.
2019;
;
150
:
:13.
–
20
.
20.
Liebetanz
D
,
Fauser
S
,
Michaelis
T
,
et al.
Safety aspects of chronic low-frequency transcranial magnetic stimulation based on localized proton magnetic resonance spectroscopy and histology of the rat brain.
.
J Psychiatr Res.
2003;
;
37
:
:277.
–
286
.
21.
Prasad
A
,
Teh
DBL
,
Blasiak
A
,
et al.
Static magnetic field stimulation enhances oligodendrocyte differentiation and secretion of neurotrophic factors.
.
Sci Rep.
2017;
;
7
:
:6743.
.
22.
Dolgova
N
,
Wei
Z
,
Spink
B
,
et al.
Low-field magnetic stimulation accelerates the differentiation of oligodendrocyte precursor cells via non-canonical TGF-β sgnaling pathways.
.
Mol Neurobiol.
2021;
;
58
:
:855.
–
66
.
23.
Cullen
CL
,
Young
KM
.
How does transcranial magnetic stimulation influence glial cells in the central nervous system?
.
Front Neural Circuits.
2016;
;
10
:
:26.
.
24.
Michel-Flutot
P
,
Zholudeva
LV
,
Randelman
ML
,
et al.
High frequency repetitive Transcranial Magnetic Stimulation promotes long lasting phrenic motoneuron excitability via GABAergic networks.
.
Resp Physiol Neurobiol.
2021
:
:103704.
.
25.
Vinit
S
,
Keomani
E
,
Deramaudt
TB
,
et al.
Interdisciplinary approaches of transcranial magnetic stimulation applied to a respiratory neuronal circuitry model.
.
PloS one.
2014;
;
9
:
:e113251.
.
26.
Vinit
S
,
Keomani
E
,
Deramaudt
TB
,
et al.
Reorganization of respiratory descending pathways following cervical spinal partial section investigated by transcranial magnetic stimulation in the rat.
.
PloS one.
2016;
;
11
:
:e0148180.
.
27.
Vinit
S
,
Petitjean
M
.
Novel role for transcranial magnetic stimulation to study post-traumatic respiratory neuroplasticity.
.
Neural Regen Res.
2016;
;
11
:
:1073.
–
1074
.
28.
Belci
M
,
Catley
M
,
Husain
M
,
et al.
Magnetic brain stimulation can improve clinical outcome in incomplete spinal cord injured patients.
.
Spinal Cord.
2004;
;
42
:
:417.
–
419
.
29.
Yılmaz
B
,
Kesikburun
S
.
Yas¸ar
E
,
Tan
AK
.
The effect of repetitive transcranial magnetic stimulation on refractory neuropathic pain in spinal cord injury.
.
J Spinal Cord Med.
2014;
;
37
:
:397.
–
400
.
30.
Wincek
A
,
Huber
J
,
Leszczyn΄ska
K
,
et al.
The long-term effect of treatment using the transcranial magnetic stimulation rTMS in patients after incomplete cervical or thoracic spinal cord injury.
.
J Clin Med.
2021
;
:10.
.
31.
Turi
Z
,
Lenz
M
,
Paulus
W
,
et al.
Selecting stimulation intensity in repetitive transcranial magnetic stimulation studies: A systematic review between 1991 and 2020.
.
Europ J Neurosci.
2021;
;
53
:
:3404.
–
15
.
32.
Tazoe
T
,
Perez
MA
.
Effects of repetitive transcranial magnetic stimulation on recovery of function after spinal cord injury.
.
Arch Phys Med Rehabil.
2015;
;
96
:
:S145.
–
S155
.
33.
Lee
KZ
,
Liou
LM
,
Vinit
S
.
Diaphragm motor-evoked potential induced by cervical magnetic stimulation following cervical spinal cord contusion in the rat.
.
J Neurotrauma.
2021;
;
38
:
:2122.
–
40
.
34.
Lee
KZ
,
Liou
LM
,
Vinit
S
,
Ren
MY
.
Rostral-caudal effect of cervical magnetic stimulation on the diaphragm motor evoked potential after cervical spinal cord contusion in the rat.
.
J Neurotrauma.
2022;
;
39
:
:683.
–
700
.
35.
Michel-Flutot
P
,
Jesus
I
,
Vanhee
V
,
et al.
Effects of chronic high-frequency rTMS protocol on respiratory neuroplasticity following C2 spinal cord hemisection in rats.
.
Biology.
2022;
;
11
:
:473.
.
36.
Gao
W
,
Yu
LG
,
Liu
YL
,
et al.
Effects of high frequency repetitive transcranial magnetic stimulation on KCC2 expression in rats with spasticity following spinal cord injury.
.
J Huazhong Univ Sci Technolog Med Sci.
2017;
;
37
:
:777.
–
781
.
37.
Kim
JY
,
Choi
GS
,
Cho
YW
,
et al.
Attenuation of spinal cord injury-induced astroglial and microglial activation by repetitive transcranial magnetic stimulation in rats.
.
J Korean Med Sci.
2013;
;
28
:
:295.
–
299
.
38.
Delarue
Q
,
Chalfouh
C
,
Guérout
N
.
Spinal cord injury: can we repair spinal cord non-invasively by using magnetic stimulation?
Neural Regen Res.
2021;
;
16
:
:2429.
–
30
.
39.
Krishnan
VS
,
Shin
SS
,
Belegu
V
,
et al.
Multimodal evaluation of TMS-induced somatosensory plasticity and behavioral recovery in rats with contusion spinal cord injury.
.
Front Neurosci.
2019;
;
13
:
:387.
.
40.
Marufa
SA
,
Hsieh
TH
,
Liou
JC
,
et al.
Neuromodulatory effects of repetitive transcranial magnetic stimulation on neural plasticity and motor functions in rats with an incomplete spinal cord injury: A preliminary study.
.
PloS one.
2021;
;
16
:
:e0252965.
.
41.
Nakanishi
T
,
Fujita
Y
,
Tanaka
T
,
Yamashita
T
.
Anti-repulsive guidance molecule-a antibody treatment and repetitive transcranial magnetic stimulation have synergistic effects on motor recovery after spinal cord injury.
.
Neurosci Lett.
2019;
;
709
:
:134329.
.
42.
Guo
M
,
Wu
L
,
Song
Z
,
Yang
B
.
Enhancement of neural stem cell proliferation in rats with spinal cord injury by a combination of repetitive transcranial magnetic stimulation (rTMS) and human umbilical cord blood mesenchymal stem cells (hUCB-MSCs).
.
Med Sci Monit.
2020;
;
26
:
:e924445.
.
43.
Wang
P
,
Yin
R
,
Wang
S
,
et al.
Effects of repetitive transcranial magnetic stimulation (rTMS) and treadmill training on recovery of motor function in a rat model of partial spinal cord injury.
.
Med Sci Monit.
2021;
;
27
:
:e931601.
.
44.
Leydeker
M
,
Delva
S
,
Tserlyuk
I
,
et al.
The effects of 15 Hz trans-spinal magnetic stimulation on locomotor control in mice with chronic contusive spinal cord injury.
.
Electromagn Biol Med.
2013;
;
32
:
:155.
–
164
.
45.
Chalfouh
C
,
Guillou
C
,
Hardouin
J
,
et al.
The regenerative effect of trans-spinal magnetic stimulation after spinal cord injury: Mechanisms and pathways underlying the effect.
.
Neurotherapeutics.
2020;
;
17
:
:2069.
–
88
.
46.
Robac
A
,
Neveu
P
,
Hugede
A
,
et al.
Repetitive trans-spinal magnetic stimulation improves functional recovery and tissue repair in contusive and penetrating spinal c ord injury models in rats.
.
Biomedicines.
2021
;
:9.
.
47.
Petrosyan
HA
,
Alessi
V
,
Hunanyan
AS
,
et al.
Spinal electro-magnetic stimulation combined with transgene delivery of neurotrophin NT-3 and exercise: novel combination therapy for spinal contusion injury.
.
J Neurophysiol.
2015;
;
114
:
:2923.
–
2940
.
48.
Bradbury
EJ
,
Burnside
ER
.
Moving beyond the glial scar for spinal cord repair.
.
Nat Commun.
2019;
;
10
:
:3879.
.
|