| |
| Med Sci (Paris). 38(8-9): 650–653. doi: 10.1051/medsci/2022097.Les CEACAM épithéliales, plateformes d’ancrage des microorganismes pathogènes dans les muqueuses Théo Paris1 and Laure Yatime1* 1Laboratoire des interactions hôte-pathogène, UMR5235, Université de Montpellier, CNRS, Inserm
,
Montpellier
,
France MeSH keywords: Épithélium, Humains, Muqueuse |
Les CEACAM : des molécules d’adhérence présentes dans divers épithéliums
Les molécules d’adhérence cellulaire liées aux antigènes carcino-embryonnaires (CEACAM pour
carcinoembryonic antigen-related cell adhesion molecules
) sont des protéines de surface glycosylées appartenant à la superfamille des immunoglobulines. Elles sont présentes uniquement chez les vertébrés [
1
]. Dans l’espèce humaine, il existe 12 protéines CEACAM distinctes, et pour certaines, plusieurs isoformes. Les CEACAM ont d’abord été identifiées comme des protéines fœtales qui ne réapparaissaient chez l’adulte que dans des tissus cancéreux, ce qui leur a valu leur nom [
1
]. Le prototype de la famille, CEACAM5, a été découvert par Gold et Freeman en 1965 dans des tumeurs du côlon. Depuis, il a été montré que les trois protéines CEACAM présentant le spectre d’expression le plus large (CEACAM 1, 5 et 6) sont surexprimées dans de nombreux cancers, en corrélation avec la progression tumorale et l’apparition de métastases [
1
,
2
] (
→
).
(→) Voir la Nouvelle de M. Draveny
et al
.,
m/s
n° 4, avril 2021, page 403
De ce fait, ces récepteurs constituent d’importants biomarqueurs tumoraux et sont considérés comme de possibles cibles thérapeutiques pour le développement de thérapies anti-cancéreuses [
2
].
La distribution tissulaire des CEACAM est plus ou moins étendue selon la protéine considérée. Plusieurs types cellulaires peuvent exprimer ces protéines, qui sont présentes notamment dans le tube digestif et les voies respiratoires, principalement dans les cellules épithéliales, mais également dans des cellules myéloïdes ou endothéliales [
3
,
4
] (
→
).
(→) Voir la Synthèse de S. Létourneau et N. Beauchemin,
m/s
n° 4, avril 1997, page 483
Dans l’intestin, les CEACAM sont ancrées dans la membrane apicale des cellules de l’épithélium colonnaire, dans les microvillosités lorsqu’elles en possèdent. On les détecte dans les entérocytes, les cellules à mucus (ou cellules caliciformes), les cellules de Paneth et les cellules entéroendocrines
(
Figure 1
)
, ou encore dans les cellules M des plaques de Peyer. Dans des conditions inflammatoires, les CEACAM ont tendance à s’insérer dans des microdomaines membranaires riches en cholestérol et sphingolipides (les radeaux lipidiques). Dans les poumons, les CEACAM sont majoritairement exprimées par les cellules bronchiolaires de Clara et par les cellules alvéolaires de type I et II [
5
].
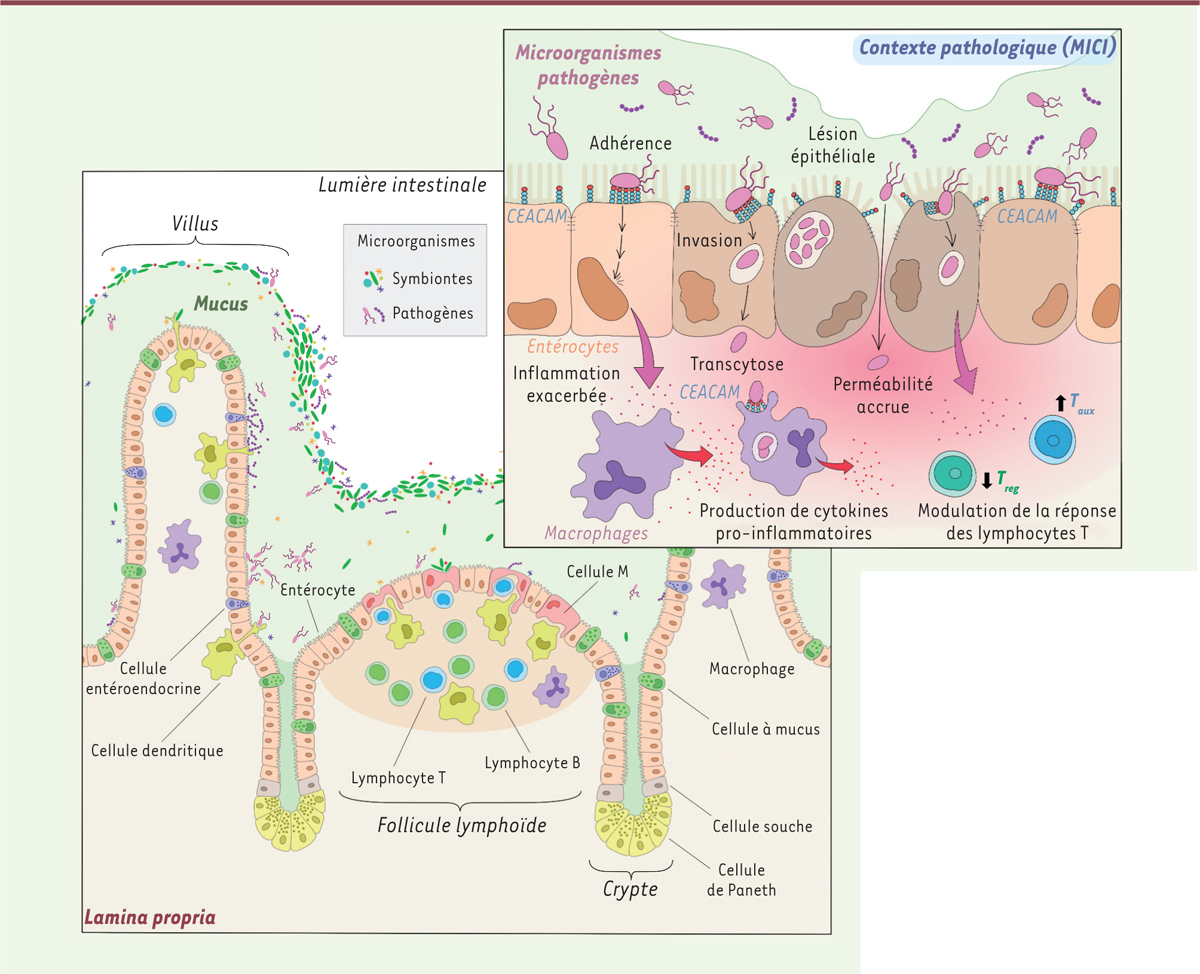
 | Figure 1.
Interactions entre les microorganismes pathogènes et les protéines CEACAM des cellules de l’épithélium intestinal.
Architecture et composition cellulaire de l’épithélium intestinal qui interagit de manière ponctuelle avec la flore microbienne (microorganismes symbiontes et pathogènes). Dans des conditions physiologiques, les microorganismes pathogènes sont maintenus à distance par l’épaisse couche de mucus et par la compétition avec les bactéries commensales. L’encart en haut à droite illustre la situation pathologique d’une maladie inflammatoire chronique de l’intestin (MICI) entraînant une fragilisation de la barrière épithéliale et une dysbiose intestinale. Les microorganismes pathogènes deviennent alors prédominants et interagissent de manière répétée avec les récepteurs CEACAM présents sur la face apicale des cellules épithéliales. Ces interactions promeuvent l’internalisation et la transcytose de ces microorganismes dans les entérocytes et dans les macrophages, leur permettant d’échapper au système immunitaire. Elles modulent également la réponse immunitaire, notamment celle des lymphocytes T : augmentation de la réponse des lymphocytes T auxiliaires (T
aux
) et réduction de celle des lymphocytes T régulateurs (T
reg
). Enfin, elles induisent la production de cytokines pro-inflammatoires. Ces agressions bactériennes, relayées par les CEACAM, favorisent l’apparition de lésions et la persistance de l’état inflammatoire.
|
|
Les CEACAM épithéliales servent de points d’ancrage aux microorganismes pathogènes dans l’intestin et les poumons
On a longtemps pensé que le rôle des CEACAM était restreint à un contexte cancéreux, mais la détection de ces protéines dans des tissus sains a conduit à la découverte de rôles indépendants de la tumorigenèse [
1
]. Ainsi, différentes CEACAM peuvent interagir avec les microorganismes pathogènes présents au sein du microbiote intestinal ou dans les voies respiratoires
(
Figure 1
)
. Elles servent alors de plateforme à ces agents pathogènes, leur permettant d’adhérer, puis de coloniser l’épithélium intestinal ou broncho-pulmonaire, ce qui peut entraîner des réactions inflammatoires intenses et souvent délétères [
6
].
De nombreux microorganismes pathogènes sont connus pour activer les CEACAM épithéliales, notamment les bactéries
Escherichia coli
adhérentes et invasives, les salmonelles, diverses espèces de
Neisseria
, ou encore la levure
Candida albicans
[
6
]. Ces interactions hôte-microbes sont particulièrement néfastes dans un contexte de maladie inflammatoire chronique de l’intestin, où les microorganismes pathogènes prolifèrent anormalement à la faveur d’une dysbiose intestinale et d’une déficience du système immunitaire. Elles maintiennent un état inflammatoire, par la production de cytokines pro-inflammatoires, telles que le TNF-α (
tumor necrosis factor
a), et elles modulent la réponse des lymphocytes T au profit des microorganismes pathogènes [
3
,
6
]. L’ancrage de ces microorganismes aux CEACAM épithéliales, alors surexprimées, facilite également leur internalisation, leur permettant d’échapper à la détection par le système immunitaire. Les agressions répétées de ces agents pathogènes contribuent à la formation de lésions intestinales qui, avec l’inflammation chronique, sont responsables des symptômes invalidants des maladies inflammatoires chroniques de l’intestin
(
Figure 1
)
. Des effets délétères des interactions CEACAM-microbes sont également observés dans les poumons. Ainsi, l’accrochage de l’adhésine UspA1 de la bactérie
Moraxella catarrhalis
au récepteur CEACAM1 induit l’apoptose des cellules bronchiques et alvéolaires, contribuant au développement de la bronchopneumopathie chronique obstructive [
5
].
Plus récemment, on a découvert que les CEACAM servent aussi de points d’entrée cellulaire à divers virus. CEACAM1 peut notamment interagir avec la protéine Spike du virus de l’hépatite murine (MHV), ce qui active la fusion des virions à la membrane des cellules hôtes [
7
]. CEACAM6, quant à elle, serait un récepteur pour la neuraminidase du virus de la grippe A. Cette interaction favorise la production des protéines virales en empêchant la mort des cellules infectées [
8
]. Le rôle pro-viral des CEACAM reste cependant controversé. En effet, CEACAM1 pourrait avoir une action anti-virale contre le cytomégalovirus humain (CMV) ainsi que contre divers virus grippaux, en bloquant l’activité de mTOR (
mammalian target of rapamycin
), ce qui a pour conséquence de diminuer le taux global de synthèse protéique [
9
]. Ces résultats attestent néanmoins du rôle pivot que jouent les CEACAM dans les muqueuses internes, tant comme promoteurs de l’infection par les microorganismes pathogènes présents dans le milieu extérieur que comme activateurs du système immunitaire.
|
CEACAMz1, un orthologue potentiel des CEACAM humaines présent dans l’épiderme du poisson zèbre
L’étude des CEACAM s’est jusqu’à présent focalisée sur celles des mammifères. Pourtant, des analyses phylogénétiques récentes montrent que les gènes codant ces protéines sont en fait présents chez un grand nombre de vertébrés, incluant divers clades de poissons téléostéens. Nous avons récemment identifié un gène orthologue des gènes
CEACAM
humains sur le chromosome 16 du poisson zèbre
Danio rerio
[
10
]. Une analyse de synténie indique que ce gène se trouve dans un environnement génétique très proche de celui des gènes humains. Il code une protéine extracellulaire de 981 acides aminés, composée de onze domaines immunoglobulines (Ig) qui s’agencent selon une architecture tridimensionnelle très similaire à celle des CEACAM humaines, à savoir un domaine de type Ig-V en position N-terminale, suivi de dix domaines de type Ig-C2 reliés à la membrane plasmique grâce à une ancre glycosylphosphatidyl inositol (GPI)
(
Figure 2A
)
. La faible conservation de la séquence des acides aminés de cette protéine par rapport à celle des protéines CEACAM de mammifères ne nous a cependant pas permis d’établir l’orthologie avec un gène
CEACAM
humain particulier, et nous a conduits à adopter une nomenclature distincte pour les gènes
CEACAM
de poisson zèbre en nommant ce gène
CEACAMz1
.
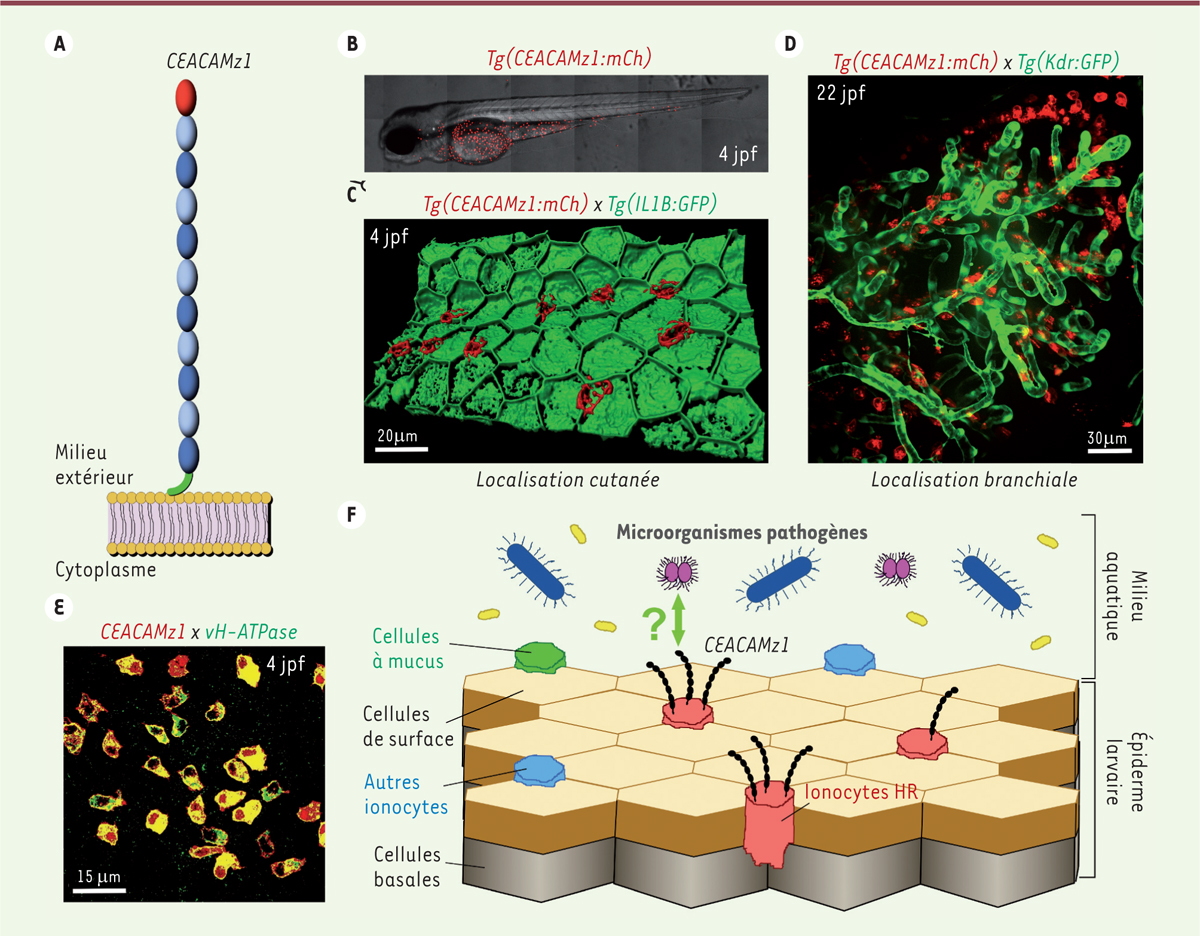
 | Figure 2.
La protéine CEACAMz1 des cellules de l’épiderme du poisson zèbre est à l’interface avec le milieu extérieur. A.
Représentation schématique de l’organisation structurale de la protéine CEACAMz1. Le domaine N-terminal de type Ig-V est représenté en rouge, les domaines Ig-C2 en bleu et l’ancrage GPI à la membrane en vert.
B.
Imagerie, par microscopie confocale à fluorescence, d’une larve de quatre jours post-fertilisation (4 jpf) issue d’une lignée transgénique rapportrice pour le gène codant CEACAMz1 :
Tg(CEACAMz1:mCh)
. Les cellules exprimant CEACAMz1, repérées par leur fluorescence rouge, sont situées dans l’épiderme ventral de la larve.
C.
Reconstitution d’une portion de l’épiderme ventral d’une larve de 4 jpf issue d’un croisement entre la lignée rapportrice pour le gène codant CEACAMz1 et une lignée rapportrice pour le gène codant l’interleukine 1B :
Tg(IL1B:GFP)
. Les cellules exprimant CEACAMz1 (en rouge) s’intercalent entre les cellules de surface de l’épiderme, repérées par leur fluorescence verte.
D.
Imagerie, par microscopie confocale à fluorescence, des branchies d’une larve de 22 jpf issue d’un croisement entre la lignée rapportrice pour le gène codant CEACAMz1 et une lignée rapportrice pour le gène codant le facteur de croissance de l’endothélium vasculaire :
Tg(Kdr:GFP)
. Les vaisseaux sanguins sont ainsi repérés par leur fluorescence verte. Les cellules exprimant CEACAMz1 (en rouge) s’alignent le long des filaments branchiaux afférents.
E.
Immuno-marquage d’une larve de 4 jpf issue de la lignée rapportrice pour le gène codant CEACAMz1 (fluorescence rouge) par un anticorps spécifique de la pompe à protons vacuolaire (vH-ATPase, fluorescence verte). La co-localisation observée (fluorescence rouge + verte = jaune) montre que CEACAMz1 est spécifiquement exprimée par les ionocytes riches en vH-ATPase (ionocytes HR).
F.
Schéma de l’épiderme de la larve du poisson zèbre, montrant sa structure simple en bi-couche. La couche externe est composée d’un pavage régulier de cellules de surface, qui se différencieront en kératinocytes, et entre lesquelles s’intercalent différents types d’ionocytes et des cellules à mucus. La localisation de la protéine CEACAMz1 dans cet épiderme « muqueux », en position privilégiée d’échange avec le milieu extérieur, établit un parallèle fonctionnel avec les récepteurs CEACAM épithéliaux humains.
|
Grâce à la construction d’une lignée de poisson zèbre rapportrice pour la protéine CEACAMz1
(
Figure 2B
)
, nous avons pu suivre sa distribution tissulaire au cours du développement larvaire par microscopie confocale à fluorescence [
10
]. Nous avons ainsi montré que CEACAMz1 est exprimée dans des cellules isolées, présentes d’abord dans la couche supérieure de l’épiderme ventral, aux stades précoces du développement, puis dans l’épithélium de revêtement branchial, s’intercalant entre les kératinocytes
(
Figures 2C
, D)
. Par des immuno-marquages successifs, nous sommes parvenus à identifier ces cellules comme étant des ionocytes riches en pompe à protons (ionocytes HR), un type cellulaire indispensable aux processus d’ionorégulation
(
Figure 2E
)
. Le profil d’expression de CEACAMz1 est étroitement lié au profil de différenciation puis de redistribution de ces ionocytes HR de la peau vers les branchies, concomitamment au passage d’un mode de respiration cutané, chez les larves, à un mode de respiration branchial, chez les poissons adultes. Le gène codant CEACAMz1 peut donc être utilisé comme un nouveau marqueur spécifique des ionocytes de type HR pleinement différenciés.
|
CEACAMz1, un récepteur cellulaire de muqueuses en contact avec le milieu extérieur
La composition cellulaire de l’épiderme du poisson zèbre, du fait de son évolution dans un environnement aquatique, est plus diversifiée que celle de l’épiderme d’un mammifère [
11
]. Au sein du pavage régulier de kératinocytes s’intercalent des ionocytes, proches des cellules rénales de mammifères et responsables des échanges ioniques et gazeux avec l’extérieur, et des cellules à mucus, glandes unicellulaires rappelant les cellules intestinales qui produisent le mucus
(
Figure 2F
)
. De fait, l’épiderme de poisson s’apparente davantage à une muqueuse qu’à un épiderme classique. Cela est également vrai pour l’épithélium de revêtement des branchies du poisson zèbre, dont la composition cellulaire est similaire à celle de l’épiderme de la larve. Dans la peau comme dans les branchies, ces épithéliums agissent comme des barrières contre les agressions extérieures. Ils constituent donc des points d’entrée privilégiés pour les microorganismes pathogènes. La présence d’une protéine de la famille des CEACAM dans ces épithéliums externes du poisson zèbre suggère que, comme chez les mammifères, cette protéine est impliquée dans les échanges avec l’extérieur et dans les interactions avec des microorganismes pathogènes.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Hammarström
S
.
The carcinoembryonic antigen (CEA) family: structures, suggested functions and expression in normal and malignant tissues.
.
Semin Cancer Biol.
1999;
;
9
:
:67.
–
81
.
2.
Létourneau
S
,
Beauchemin
N
.
Rôles des antigènes carcino-embryonnaires dans la cancérisation et la progression tumorale.
.
Med Sci (Paris).
1997;
;
13
:
:483.
–
491
.
3.
Kelleher
M
,
Singh
R
,
O’Driscoll
CM
,
Melgar
S
.
Carcinoembryonic antigen (CEACAM) family members and inflammatory bowel disease.
.
Cytokine Growth Factor Rev.
2019;
;
47
:
:21.
–
31
.
4.
Draveny
M
,
Ghali
A
,
Nüsse
O
.
Contrôle de l’infection des granulocytes neutrophiles par Helicobacter pylori via l’interaction HopQ-CEACAM.
.
Med Sci (Paris).
2021;
;
37
:
:403.
–
5
.
5.
Klaile
E
,
Klassert
TE
,
Scheffrahn
I
,
et al.
Carcinoembryonic antigen (CEA)-related cell adhesion molecules are co-expressed in the human lung and their expression can be modulated in bronchial epithelial cells by non-typable Haemophilus influenzae, Moraxella catarrhalis, TLR3, and type I and II interferons.
.
Respir Res.
2013;
;
14
:
:85.
.
6.
Tchoupa
AK
,
Schuhmacher
T
,
Hauck
CR
.
Signaling by epithelial members of the CEACAM family : mucosal docking sites for pathogenic bacteria.
.
Cell Commun Signal.
2014;
;
12
:
:27.
.
7.
Miura
HS
,
Nakagaki
K
,
Taguchi
F
.
N-terminal domain of the murine coronavirus receptor CEACAM1 is responsible for fusogenic activation and conformational changes of the spike protein.
.
J Virol.
2004;
;
78
:
:216.
–
223
.
8.
Rahman
SK
,
Ansari
MA
,
Gaur
P
,
et al.
The immunomodulatory CEA cell adhesion molecule 6 (CEACAM6/CD66c) is a protein receptor for the Influenza A virus.
.
Viruses.
2021;
;
13
:
:726.
.
9.
Vitenshtein
A
,
Weisblum
Y
,
Hauka
S
,
et al.
CEACAM1-mediated inhibition of virus production.
.
Cell Rep.
2016;
;
15
:
:2331.
–
2339
.
10.
Kowalewski
J
,
Paris
T
,
Gonzalez
C
,
et al.
Characterization of a member of the CEACAM protein family as a novel marker of proton pump-rich ionocytes on the zebrafish epidermis.
.
PLoS One.
2021;
;
16
:
:e0254533.
.
11.
Chang
WJ
,
Hwang
PP
.
Development of zebrafish epidermis.
.
Birth Defects Res C Embryo Today Reviews.
2011;
;
93
:
:205.
–
14
.
|